Выделение и идентификация нетуберкулезных микобактерий у пациентов фтизиатрических учреждений 03. 00. 07 Микробиология
| Вид материала | Автореферат |
- Бактериологическая диагностика туберкулеза внелегочных локализаций с исследованием, 271.98kb.
- Идентификация и внутривидовое типирование возбудителей сапа и мелиоидоза 03. 00., 750.11kb.
- Омелотерапия в онкологии с точки зрения доказательной медицины, 135.77kb.
- Цивилизации древнего востока, 288.82kb.
- Примерная программа дисциплины микробиология, вирусология, микробиология полости рта, 447.35kb.
- «Микробиология», 161.59kb.
- Контрольная работа по дисциплине Микробиология По теме Общая и специальная микробиология, 208.97kb.
- Резолюция второго всероссийского конгресса пациентов город Самара 03 ноября 2011, 206.55kb.
- Вопросы к экзамену по дисциплине «Микробиология, физиология питания, санитария», 45.83kb.
- Рабочей программы учебной дисциплины (модуля) микробиология, 48.16kb.
Установлено (табл. 1), что жидкая питательная среда (7Н9) более эффективна в выделении микобактерий, чем плотные. Из 227 культур микобактерий, выделенных на трех средах, 204 (89,9%) получены в жидкой питательной среде (как только в ней одной, так и в комбинациях с другими средами). На среде 7Н11 выделены 180 (79,3%), а на Л-Й – 166 (73,1%) культур. Что касается НТМ, то больше всего культур также удалось выделить в жидкой питательной среде 7Н9 – 35 (85,4%), меньше на плотной агаровой 7Н11 – 30 (73,2%), и ещё меньше на среде Л-Й – 27 (65,9%) культур.
Чаще НТМ выделяли на трех средах –18 (43,9%), что достоверно выше, чем при других сочетаниях сред ( p < 0,05), и лишь в единичных случаях только на одной среде: Л-Й – 1 (2,4%); 7Н11 – 2 (4,9%) и 7Н9 – 5 (12,2%), соответственно (табл. 2).
Таблица 2.
Частота выделения микобактерий на разных питательных средах
и их комбинациях (абс., %)
| Среда | Число выделенных изолятов микобактерий | ||||
| МАС | M. kansasii | M. xenopi | M. fortuitum | Всего НТМ | |
| Только Л-Й | 1 | - | - | - | 1 (2,4) |
| Только Миддлбрук 7Н11 | 1 | 1 | - | - | 2 (4,9) |
| Только Миддлбрук 7Н9 | 3 | 1 | - | 1 | 5 (12,2) |
| Л-Й + 7Н11 | 2 | - | - | 1 | 3 (7,3) |
| Л-Й + 7Н9 | 2 | - | 1 | 2 | 5 (12,2) |
| 7Н9 + 7Н11 | 3 | 2 | 2 | - | 7 (17,1) |
| На всех средах | 5 | 4 | 3 | 6 | 18 (43,9) |
| ИТОГО | 17 | 8 | 6 | 10 | 41 |
Таблица 3.
Эффективность выделения НТМ на средах Левенштейна-Йенсена
и Миддлбрука 7Н9
| Вид микобактерий | Число НТМ выделенных на среде: | Достоверность различий (р) | |||
| Левенштейна-Йенсена | Миддлбрука 7Н9 (BACTEC MGIT 960) | ||||
| абс. | % | абс. | % | ||
| МАС (106) | 64 | 60,4 | 83 | 78,3 | < 0,02 |
| M. kansasii (51) | 31 | 60,8 | 43 | 84,3 | < 0,01 |
| M. xenopi (42) | 35 | 83,3 | 39 | 92,9 | < 0,05 |
| M. gordonae (16) | 10 | 62,5 | 13 | 81,3 | < 0,02 |
| M. marinum (6) | 4 | 66,7 | 5 | 83,3 | > 0,05 |
| Всего медлен-норастущие (221) | 144 | 65,2 | 183 | 82,8 | < 0,05 |
| M. fortuitum (71) | 48 | 67,6 | 51 | 71,8 | > 0,05 |
| M. chelonae (11) | 7 | 63,6 | 8 | 72,7 | > 0,05 |
| M. flavescens (8) | 6 | 75,0 | 7 | 87,5 | > 0,05 |
| Всего быстро-растущие (90) | 61 | 67,8 | 66 | 73,3 | > 0,05 |
| ВСЕГО НТМ (311) | 205 | 65,9 | 249 | 80,1 | < 0,05 |
Дополнительно на значительно большем количестве материала было проведено сравнение эффективности использования двух сред – Левенштейна-Йенсена и Миддлбрука 7Н9, которые постоянно применяют в микробиологической лаборатории МНПЦБТ (табл. 3). Частота выделения всех видов НТМ оказалась также в 1,2 раза выше в жидкой питательной среде, в наибольшей степени это относилось к МАС, M. kansasii, M. xenopi, M. gordonae.
Таблица 4.
Сроки выделения культур НТМ на разных питательных средах
| Вид микобактерий | Длительность культивирования (дни) на среде: | Различия в длительности культивиро-вания (коэф-фициент) | Досто-верность различий (р) | ||
| Левенштейна-Йенсена (1) | Миддлбру-ка 7Н11 (2) | Миддлбру-ка 7Н9 (3) | |||
| МАС (17) | 38,6 ± 3,2 | 30,1 ± 2,7 | 22,3 ± 3,4 | (1)-(2) – 1,3 (1)-(3) – 1,7 (2)-(3) – 1,4 | p1-2 > 0,05 p1-3 < 0,01 p2-3 < 0,05 |
| M. kansasii (8) | 30,2 ± 8,6 | 26,5 ± 4,6 | 16,1 ± 4,9 | (1)-(2) – 1,1 (1)-(3) – 1,9 (2)-(3) – 1,7 | p1-2 > 0,05 p1-3 < 0,01 p2-3 < 0,01 |
| M. xenopi (6) | 40,4 ± 6,9 | 30,6 ± 5,1 | 22,8 ± 5,1 | (1)-(2) – 1,3 (1)-(3) – 1,8 (2)-(3) – 1,3 | p1-2 > 0,05 p1-3 < 0,01 p2-3 > 0,05 |
| M. fortuitum (10) | 38,4 ± 2,1 | 34,5 ± 4,6 | 16,8 ± 8,6 | (1)-(2) – 1,1 (1)-(3) – 2,3 (2)-(3) – 2,1 | p1-2 > 0,05 p1-3 < 0,01 p2-3 < 0,01 |
| ВСЕГО (41) | 37,2±4,5 | 30,5±3,9 | 19,8±5,2 | (1)-(2) – 1,2 (1)-(3) – 1,9 (2)-(3) – 1,5 | p1-2 > 0,05 p1-3 < 0,01 p2-3 < 0,05 |
Следует отметить, что обнаружение роста микобактерий в системе BACTEC MGIT 960 (в модифицированной жидкой среде Миддлбрука 7Н9) происходило на 10-20 дней раньше (табл. 4), чем на плотных средах. Среднее время детекции роста на этой среде составило 19,8±5,2 дней, по сравнению с 30,5±3,9 днями на среде 7Н11 и 37,2±4,5 днями на среде Левенштейна-Йенсена (т.е. в 1,5 и 1,9 раз быстрее, соответственно).
Эти данные подтверждены и при расширенном исследовании с использованием только сред Левенштейна-Йенсена и Миддлбрука 7Н9 (табл. 5).
Таблица 5.
Длительность культивирования НТМ на средах Левенштейна-Йенсена
и Миддлбрука 7Н9
| Вид микобактерий | Длительность культивирования (дни) на среде: | Различия в длительности культивирования (коэф-фициент) | Достоверность различий (р) | |
| Левенштейна-Йенсена | Миддлбрука 7Н9 | |||
| МАС (106) | 35,9 ± 2,7 | 18,4 ± 3,0 | 2,0 | < 0,01 |
| M. kansasii (51) | 28,4 ± 4,2 | 15,3 ± 3,6 | 1,9 | < 0,01 |
| M. xenopi (42) | 36,2 ± 3,9 | 20,8 ± 3,5 | 1,7 | < 0,01 |
| M. gordonae (16) | 40,1 ± 4,1 | 20,3 ± 2,2 | 2,0 | < 0,01 |
| M. marinum (6) | 33,3 ± 2,6 | 20,2 ± 4,9 | 1,6 | < 0,01 |
| M. fortuitum (71) | 37,8 ± 1,7 | 16,2 ± 5,1 | 2,3 | < 0,01 |
| M. chelonae (11) | 22,2 ± 3,9 | 13,2 ± 0,9 | 1,7 | < 0,01 |
| M. flavescens (8) | 23,4 ± 3,2 | 14,1 ± 0,3 | 1,7 | < 0,01 |
| ВСЕГО (311) | 34,5±3,0 | 17,6±3,5 | 2,0 | < 0,01 |
Самый высокий процент контаминации посевов наблюдался на среде Л-Й (11,2%), а самый низкий на среде 7Н11 (5,3%), 7,2% образцов было контаминировано в среде 7Н9.
В ходе проведенных исследований выявлено, что недостатком метода выделения микобактерий в жидких питательных средах является невозможность наблюдения за морфологией и хромогенностью колоний.
Преимуществом яичных сред (в частности, Л-Й), является устойчивость к высыханию, а следовательно пригодность для инкубации в течение длительного периода. Однако при росте контаминатов происходит разжижение среды, что приводит к прерыванию инкубации и потере клинически значимых штаммов микобактерий.
Следует также отметить, что агаровая среда Миддлбрука 7Н11, благодаря простому химическому составу менее подвергалась контаминации, а наличие в ее составе гидролизата казеина способствовало росту штаммов, наиболее требовательных к условиям культивирования.
Дополнительное (к среде 7Н9) культивирование на среде 7Н11 и/или Л-Й обеспечивало более полное выделение микобактерий (по данным L.Heifets,1997 до 10% НТМ вырастает только на плотных средах), а использование чашек с агаровой средой 7Н11 позволяет провести первичную идентификацию вида микобактерий по морфологии колоний и выбрать наиболее информативные биохимические тесты для окончательной идентификации, получить чистую культуру в случаях обильного роста контаминантов и обнаружить смешанные культуры микобактерий.
Вместе с тем, следует иметь в виду, что недостатком применения чашек с агаровой средой 7Н11 в условиях централизованных микробиологических лабораторий с большим потоком исследований являются неудобства, связанные с серьезными трудозатратами по инкубированию и просмотру большого количества чашек, однако в пробирочном варианте эта среда может успешно применяться в комплексе выделения микобактерий. Исходя из вышеизложенного, целесообразнее агаровые чашки использовать для субкультивирования изолятов, полученных на плотной яичной или в жидкой питательных средах.
Необходимо подчеркнуть, что ни на одной из изученных питательных сред не удалось выделить из клинических образцов культуры микобактерий в 100% случаев,что является важным доводом для применения их комбинаций.
В итоге проведенных исследований разработан оптимальный микробиологический комплекс методов выделения НТМ: культивирование диагностического материала на модифицированной жидкой питательной среде Миддлбрука 7Н9 (в автоматизированной системе BACTEC MGIT 960) в сочетании с одной из плотных сред.
1.2. Частота обнаружения и видовой состав НТМ, выделенных в Централизованной микробиологической лаборатории МНПЦБТ
Анализ частоты обнаружения НТМ в клиническом материале свидетельствует о существенном увеличении их количества в последние 2 года. Если в 2006 г. выделено 102 (3,0%), в 2007 г. – 111 (3,4%), то в 2008 г. – 253 (6,9%) и за 10 месяцев 2009 года – 268 (8,7%) изолятов НТМ (от общего числа микобактерий) (рис.1).
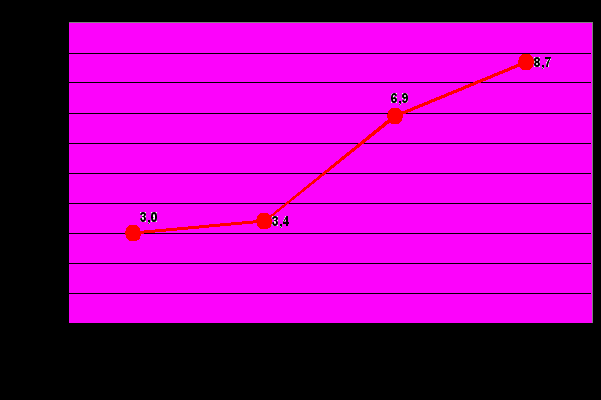
р2008-2007 < 0,01
р2007-2006 > 0,05
р2009-2008 < 0,05
Рис. 1. Частота обнаружения НТМ за период 2006-2009 гг.
Низкий показатель выделения НТМ в 2006-2007 годы связан с отсутствием оптимальных методических возможностей, поскольку организация данного вида исследований только начиналась. В связи с этим, не все выделенные в лаборатории культуры НТМ идентифицировали до вида, часть из них (полученные в жидкой питательной среде) только дифференцировали от микобактерий туберкулезного комплекса, поэтому при подсчете не учитывали. Начиная с 2008 года, выделение и идентификацию НТМ проводили с использованием разработанного алгоритма, с применением вышеописанного набора питательных сред, молекулярно-генетических методов (ПДРФ, биочипы) и ВЭЖХ, что позволило ускорить процесс идентификации микобактерий и повысить его специфичность. Благодаря этому, за последние годы ряду больных был установлен диагноз микобактериоза (некоторым – вместо туберкулеза) и назначена соответствующая терапия; положительная динамика процесса в большинстве случаев подтвердила правильность диагноза.
При изучении видового спектра выделенных в Центре НТМ было установлено (табл. 6), что две трети из них относились к медленнорастущим (по классификации Runyon) и одна треть к быстрорастущим.
Таблица 6.
Частота обнаружения микобактерий при использовании
микробиологических методов
| Группа микобактерий | Виды микобактерий | Количество | % | |
| всего | в т.ч. в ассоциации | |||
| M. tuberculosis complex | M. tuberculosis | 230 | 20* | 27,3 |
| M. bovis | 2 | | 0,2 | |
| ВСЕГО | 232 | 20 | 27,6 | |
| Нетуберкулезные микобактерии | ||||
| Медленнорастущие | MAC | 203 | 16** | 24,1 |
| M. kansassii | 78 | | 9,3 | |
| M. xenopi | 83 | | 9,9 | |
| M. gordonae | 25 | | 3,0 | |
| M. marinum | 6 | | 0,7 | |
| M. scrofulaceum | 5 | | 0,6 | |
| Прочие**** | 6 | | 0,7 | |
| Всего | 406 | 16 | 48,3 | |
| Быстрорастущие | M. fortuitum | 169 | 8*** | 20,1 |
| M. chelonae | 18 | | 2,1 | |
| M. flavescens | 15 | | 1,8 | |
| Прочие**** | 1 | | 0,1 | |
| Всего | 203 | 8 | 24,1 | |
| ВСЕГО НТМ | 609 | 24 | 72,4 | |
| ИТОГО | 841 | 44 | 100,0 | |
