Физическая
| Вид материала | Рабочая программа |
| Поверхностные явления. Адсорбция. Таблица 1 Стандартные электродные потенциалы () |
- Методика подбора средств профессионально-прикладной подготовки. Основные факторы, определяющие, 46.84kb.
- Рабочая программа дисциплины физическая культура Степень выпускника, 873.87kb.
- Основная образовательная программа высшего профессионального образования Направление, 4490.7kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Программа аттестационных испытаний Факультет Физической культуры Бакалавриат по направлению, 289.66kb.
- Лекция 1 Физическая картина природы и ее «изобразительные средства», 164.13kb.
- М. К. Аммосова Институт физической культуры и спорта рабочая программа, 78.29kb.
- Программа дисциплины «Физическая культура» Утверждена умс председатель, 83.66kb.
- Тематический план 1 по дисциплине «Физическая культура», 404.41kb.
- Условия проведения конкурса знатоков по специальности Физическая культура для лиц, 27.28kb.
Поверхностные явления. Адсорбция.
Изучение поверхностных свойств является одной из важных проблем химии.
Запас свободной поверхностной энергии А определяется суммарной поверхностью частиц S и коэффициентом поверхностного натяжения :
А=S (Дж/м2).
При отсутствии стабилизатора свободная поверхностная энергия коллоидной системы понижается за счет уменьшения величины поверхности S (происходит коагуляция).
Чтобы предотвратить агрегирование частиц, добавляют стабилизатор, который при неизменной величине поверхности снижает свободную поверхностную энергию, уменьшая поверхностное натяжение .
Величина поверхностного натяжения численно равна работе, которую необходимо затратить на образование 1м2 новой поверхности в изотермических условиях (Дж/м2 или Н/м). Известно несколько методов определения поверхностного натяжения.
Метод поднятия жидкости в капилляре:
= h r g (Н/м) ,
2
где: r- радиус капилляра (м);
- плотность (кг/м3);
g - ускорение силы тяжести (м/сек2).
Метод Траубе - с помощью сталагмометра подсчитывается какое число капель стандартной жидкости no и исследуемой жидкости nx содержится в определенном объеме жидкостей :
n0x0
 = ,
= , nx0
где : 0 и x - плотности стандартной и исследуемой жидкостей;
0 - поверхностное натяжение стандартной жидкости.
Для измерения поверхностного натяжения растворов можно применять также метод «отрыва кольца». Кольцо из металлической проволоки опускается на поверхность жидкости и уравновешивается рычагом весов. Затем определяется усилие, которое нужно приложить, чтобы преодолеть силу сцепления кольца с жидкостью и оторвать кольцо от поверхности
F = k (Н/м) ,
где : k - обобщающая константа, зависящая от диаметра проволоки, размеров кольца и краевого угла смачивания Θ .
Широко распространен метод наибольшего давления пузырька, предложенный П.А.Ребиндером. К поверхности жидкости подводится вакуумная пробирка с капилляром, на конце которого под действием вакуума образуется воздушный пузырек. Давление, при котором пузырек проскакивает через поверхностную пленку жидкости и прорывает ее, определяется величиной x :
0 рx
 x= (Н/м) ,
x= (Н/м) ,р0
где : 0 - поверхностное натяжение стандартной жидкости (Н/м);
рx и р0 - давления, необходимые для проскакивания пузырька через поверхность исследуемой и стандартной жидкостей (Н/м2).
Поверхностно-активными называются вещества, добавки которых уменьшают поверхностное натяжение растворителя. По отношению к воде - это органические кислоты, спирты, белки, мыла и др. дифильные (т.е. состоящие из полярной и неполярной частей) вещества.
Изменение поверхностного натяжения раствора при введении ПАВ определяют с помощью уравнения Шишковского:
0 - = а ln (1+bС) ,
где : 0 - поверхностное натяжение растворителя (Н/м) ;
- поверхностное натяжение раствора (Н/м) ;
a и b - эмпирические константы, причем величина а мало меняется от вещества к веществу, а b зависит от поверхностной активности вещества;
С - концентрация раствора (кмоль/м3).
Мерой поверхностной активности вещества является константа b в уравнении Шишковского.
Введение ПАВ, понижающих поверхностное натяжение, сопровождается увеличением концентрации растворенного вещества в поверхностном слое или на поверхности раздела фаз - адсорбция.
Для определения адсорбции применяются:
1)уравнение Гиббса :
С d
Г

 = ,
= ,RT dC
где : Г - адсорбция (кмоль/м2);
С - концентрация раствора (кмоль/м3) ;
R - газовая постоянная ;
Т - температура , К ;
d
 - мера поверхностной активности.
- мера поверхностной активности.dC
- уравнение монослойной адсорбции Ленгмюра:
bC
 Г=Г (кмоль/м2) ,
Г=Г (кмоль/м2) ,1+bC
где : Г - предельное количество адсорбирующегося вещества ;
b - константа, характеризующая поверхностную активность вещества;
С - равновесная концентрация растворенного вещества (кмоль/м3).
Константы Г и b можно найти графически, преобразовав уравнение Ленгмюра в уравнение прямой :
1 1 1 1



 = · + .
= · + . Г Гb C Г
Г Гb C Г Используя уравнение Шишковского, можно перейти от уравнения Гиббса к уравнению Ленгмюра :
d аb С d ab C





 = ; Г = =
= ; Г = = dC 1+bC RT dC 1+bC RT
а bC а
и


 ли Г= , очевидно = Г ,тогда
ли Г= , очевидно = Г ,тогдаRT 1+bC RT
bC
 Г = Г ;
Г = Г ;1+bC
- при адсорбции газа или растворимого вещества на твердом адсорбенте используют эмпирическое уравнение Фрейндлиха:
Г =С (для растворов) или Г=р (для газов).
Для вычисления константы и , достаточно прологарифмировать уравнение Фрейндлиха (lgГ=lgβ +αlgC) и построить прямую в координатах lgГ = (lgC), где отрезок, отсекаемый этой прямой от оси ординат будет равен lgβ, а тангенс угла наклона прямой равен α .
4) уравнение для расчета полислойной адсорбции (уравнение Дубинина). Изотерма адсорбции на адсорбентах с мелкими порами
(Гср. 10-9м) - они получили название адсорбентов первого структурного типа - имеет вид:
Г= (/v)*e - k,T lg ( p /p),
а для крупнопористых адсорбентов второго структурного типа
(Гср.10-7-10-6м):
Г= (/v)*e - k T lg ( p /p),
где : Г - адсорбция (кмоль/кг);
- общая пористость (м3/кг);
V - молярный объем адсорбируемого вещества в жидком состоянии
(м3/кмоль);
Т - температура (К) ;
k1 и k2 - константы ;
р - равновесное давление пара при данной температуре (Н/м2) ;
рS - давление насыщенного пара (по справочнику) (Н/м2).
При логарифмировании уравнение легко переходит в линейную форму, откуда графически определяется пористость сорбентов.
Для построения кривых распределения пор сорбентов по радиусам применяют метод капиллярной конденсации : экспериментально определяют величину адсорбции в зависимости от увеличения равновесного давления, а затем определяют величину десорбции при снижении равновесного давления. На графике в координатах Г = (р/рS) кривые адсорбции и десорбции не совпадают- образуется петля гистерезиса. Истинному ходу процесса сорбции отвечает ветвь десорбции; ее и используют для расчета пористости (м3/кг):
= Г V ,
где: Г - экспериментальная величина сорбции (кмоль/кг);
V - молярный объем вещества (по справочнику) (м3/кмоль).
Для определения радиусов пор применяют уравнение Томсона:
2V
 r = --------------- (м),
r = --------------- (м),RT ln(ps /p)
где: - поверхностное натяжение конденсата при данной температуре (Дж/м2) (по справочнику);
V - молярный объем конденсата (по справочнику) (м3/кмоль);
R - газовая постоянная ;
рS - давление насыщенного пара над макроповерхностью (Н/м2) (по справочнику);
р - равновесное давление в капилляре данного радиуса (Н/м2) (по кривой десорбции).
Интегральная кривая строится в координатах =(r), а дифференциальная - в координатах (/r)=ср, где :
м = м+1 - м ; r = rм+1 - rм ; rср - средний радиус, равный
rсрм = (rм+1 + rм)/2. Процессы ионного обмена на твердой поверхности характеризуется уравнением Б.П.Никольского:
Г1(1/Z ) С1(1/Z )

 = К ,
= К , Г2(1/Z ) С2(1/Z2 )
где Г1 и Г2 - количество ионов, поглощенных поверхностью сорбента (кмоль/кг) ;
С1 и С2 - равновесные концентрации ионов в растворе (кмоль/м2);
К - константа обмена, зависящая от способности ионов к адсорбции на данном сорбенте. Графически изображается прямой, тангенс угла наклона которой и представляет величину константы К.
Пример. По экспериментальным данным постройте кривую адсорбции углекислого газа на цеолите при 2930К и с помощью графического метода определить константы уравнения Ленгмюра:
| Равновесное давление Р∙10-2, н/м2 | 1,0 | 5,0 | 10,0 | 30,0 | 75,0 | 100,0 | 200,0 |
| Адсорбция Г∙103, кмоль/кг | 35,0 | 86,0 | 112,0 | 152,0 | 174,0 | 178,0 | 188,0 |
Решение. По данным таблицы строится кривая адсорбции CO2 на цеолите.
Г·103 ,кмоль/кг
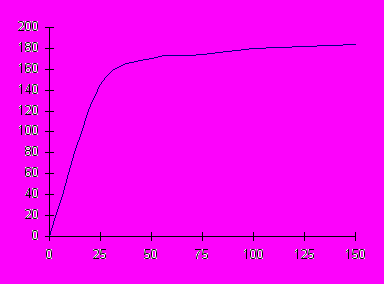 р·10-2,н/м2
р·10-2,н/м2Уравнение монослойной адсорбции Ленгмюра имеет вид: Г=Г∞ ∙
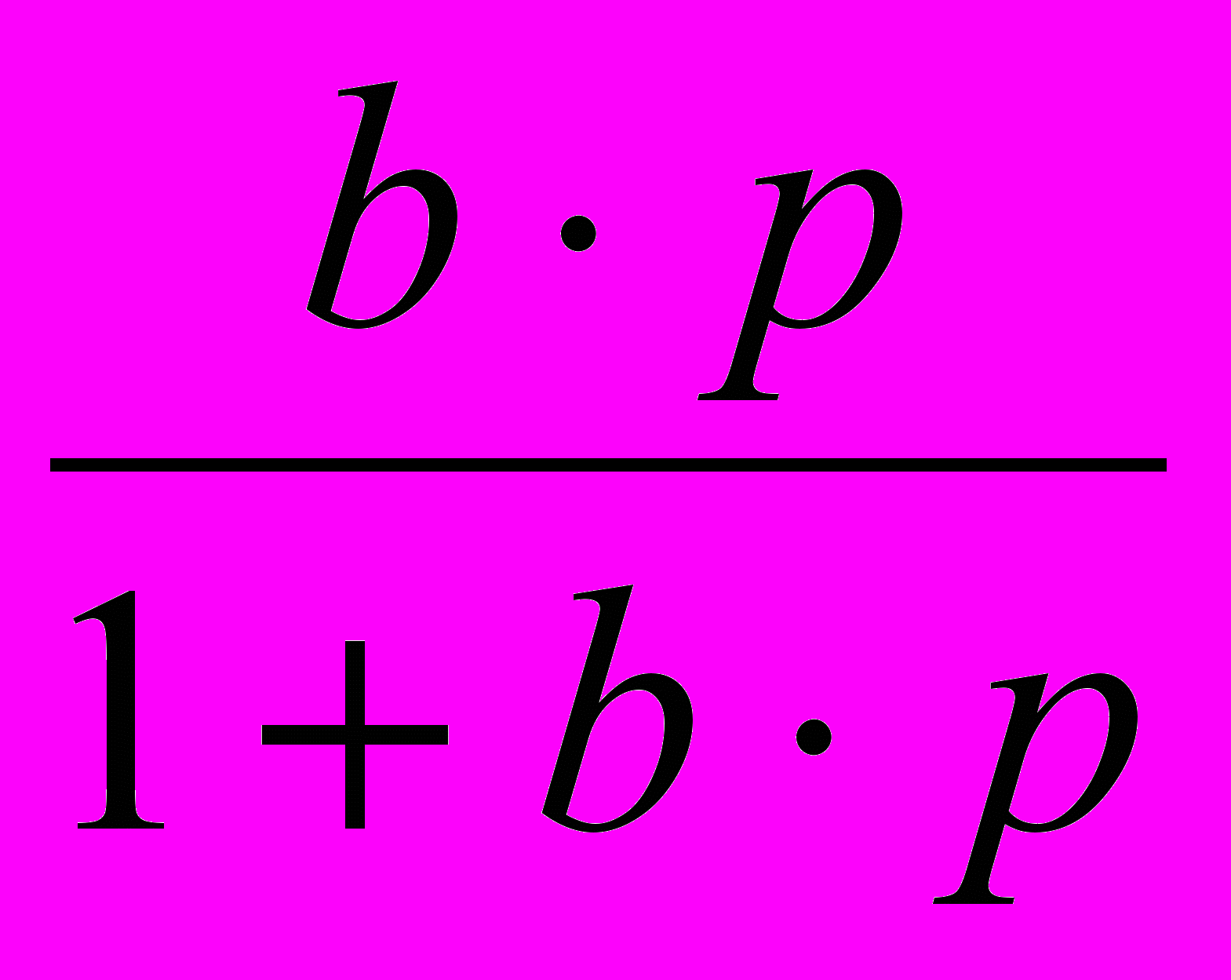 , где
, гдеГ∞ - предельное количество адсорбируемого вещества; b – константа, характеризующая поверхностную активность вещества; р – равновесное давление растворенного вещества.
Константы Г∞ и b находят графически, преобразуя уравнение Ленгмюра в уравнение прямой: делят единицу на обе части этого уравнения, тогда
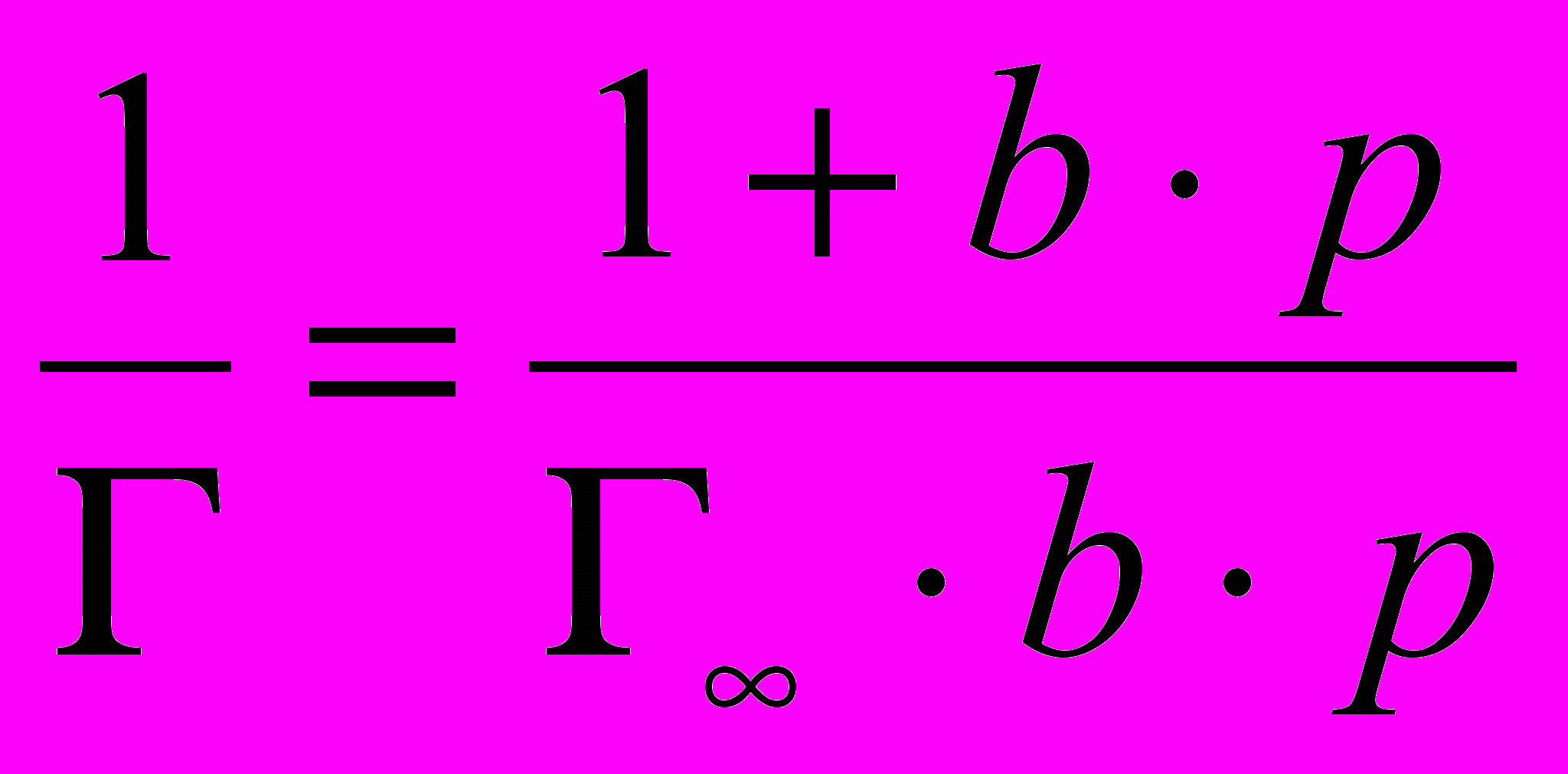 ;
; 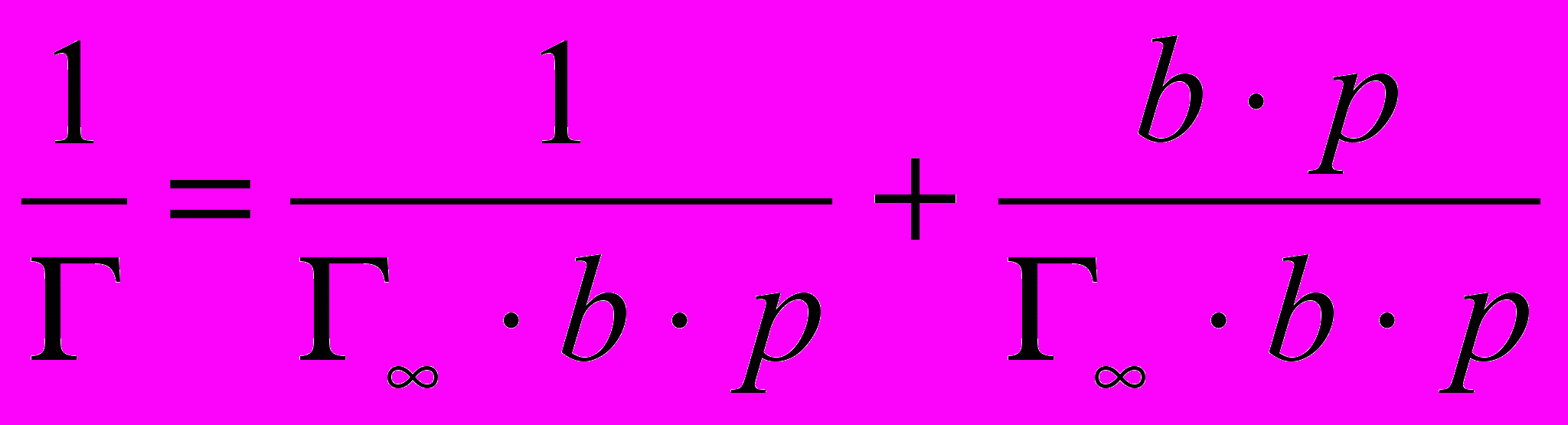 ; при сокращении и преобразовании формулы получается выражение
; при сокращении и преобразовании формулы получается выражение 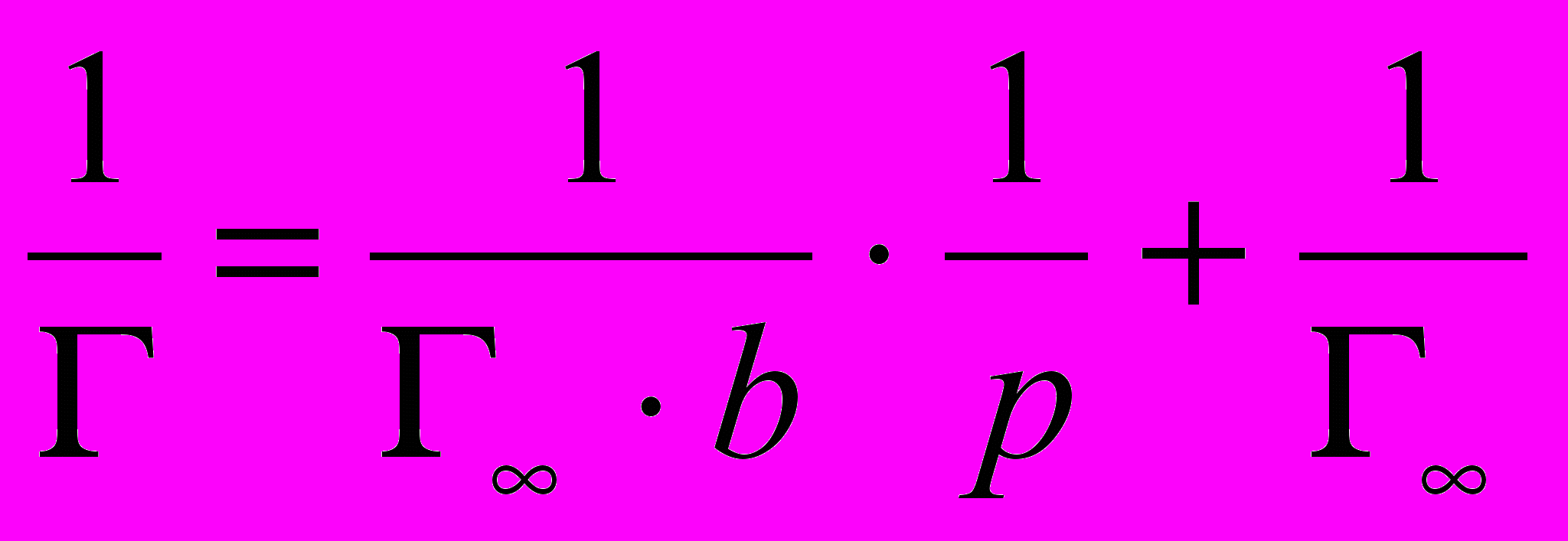 .
. Вычисляют значения
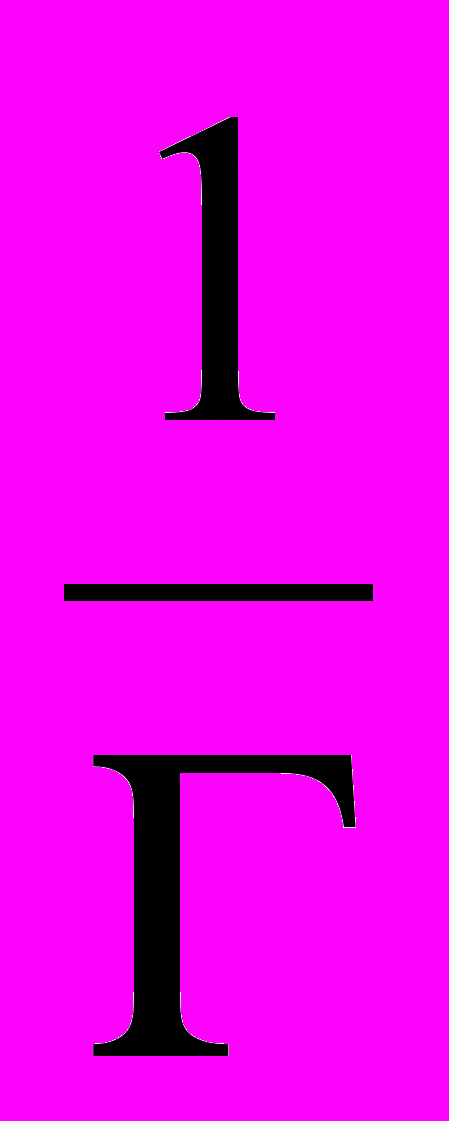 и
и 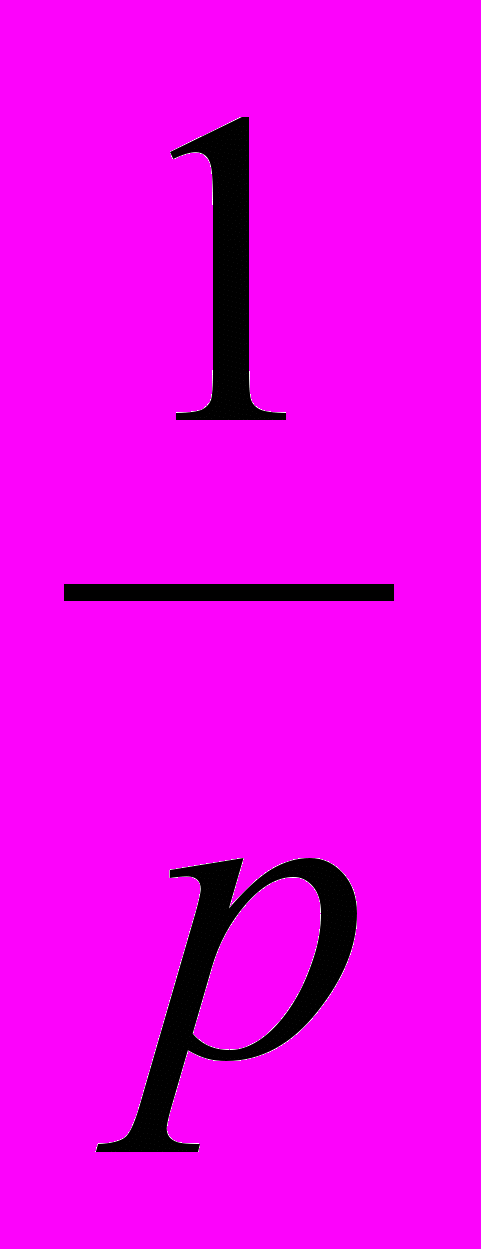 и на основании этих расчетов строят график.
и на основании этих расчетов строят график.| 1/p·102 | 1,0 | 0,2 | 0,1 | 0,03 | 0,013 | 0,010 | 0,005 |
| 1/Г·10-3 | 0,029 | 0,012 | 0,009 | 0,007 | 0,006 | 0,0056 | 0,0053 |
1/Г·10-3
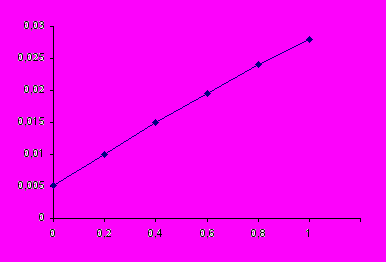 1/p·102
1/p·102Отрезок, отсекаемый прямой на оси ординат равен 1/Г∞ (0,0052·10-3), следовательно Г∞= 192 ·10-3 кмоль/кг. Тангенс угла наклона прямой к оси абсцисс равен 1/(Г∞ ּb).
tgα =
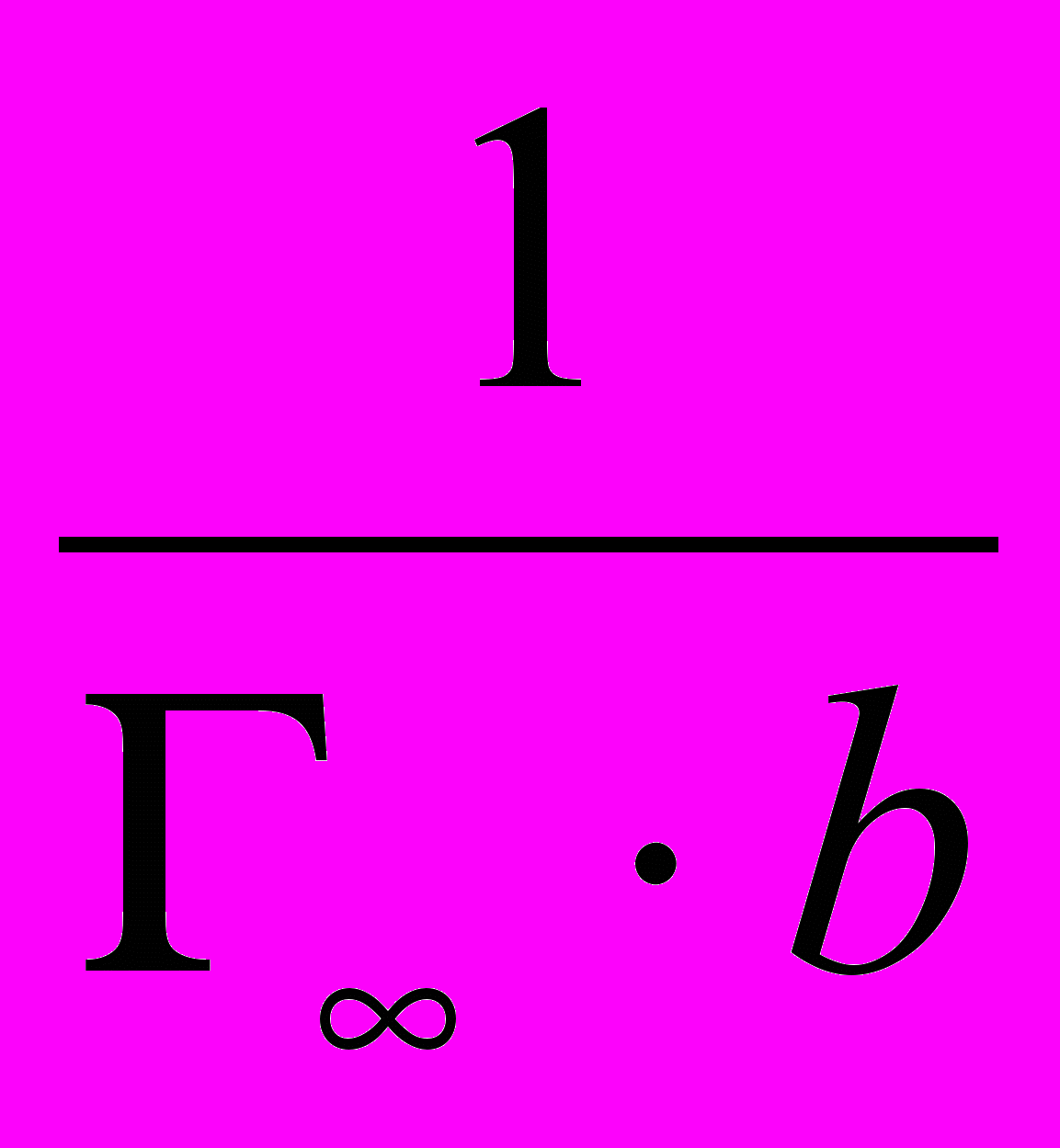 ; tgα = (0,029-0,0052)·103 / 1,0·10-2 = 2,38·103 (отношение противоположного катета к прилежащему катету
; tgα = (0,029-0,0052)·103 / 1,0·10-2 = 2,38·103 (отношение противоположного катета к прилежащему катету по отношению к углу в треугольнике)
по отношению к углу в треугольнике)b =
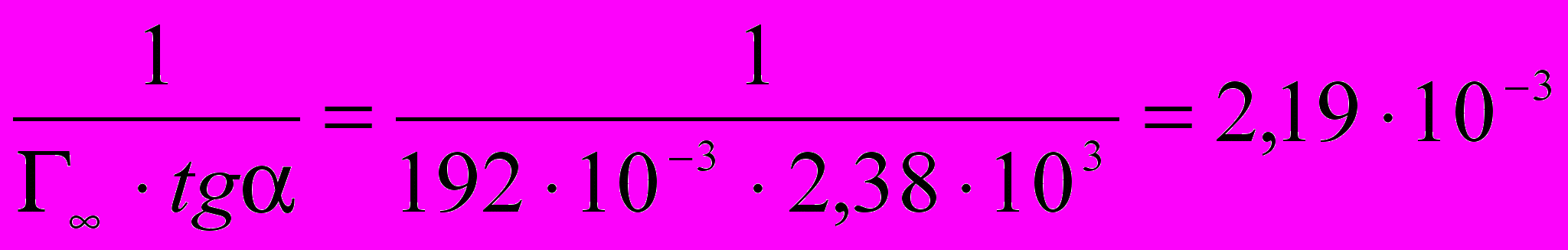 .
. Контрольные вопросы
76.Вычислите поверхностное натяжение глицерина, если в капилляре с радиусом r=0.4*10-3м он поднялся на высоту h=26.8*10-3м. Плотность глицерина =1.26кг/м3.
77.Какова величина поверхностного натяжения ртути, если в стеклянном капилляре с радиусом r=0,6*10-3м столбик ее опустился на 12*10-3м ниже уровня ртути в сосуде?
78.Вычислите поверхностное натяжение анилина на границе с воздухом при 292оК, если методом наибольшего давления пузырьков получены следующие результаты: давление пузырьков при проскакивании его в воду равно 11,82*102Н/м2, а анилин- 711,5 Н/м. Поверхностное натяжение воды о=72,55*10-3Н/м.
79. Найдите поверхностное натяжение анилина, если с помощью сталагмометра Траубе получены данные: число капель анилина – 42, плотность его –1,4кг/м 3, число капель воды-18. Температура опыта +2880К. Поверхностное натяжение воды о=73,26*10-3Н/м.
80.Во сколько раз изменится запас свободной поверхностной энергии водяного тумана, если радиус его капелек увеличится от 1*10-6 до 1,2*10-3м при 2880К?
81.Во сколько раз увеличится свободная поверхностная энергия системы при пептизации геля Fe(OH)3, если при этом радиус частиц геля уменьшается от 1*10-6 до 1*10-9м ?
82.Для водного раствора пропилового спирта найдены следующие значения констант уравнения Шишковского (при 2930К): а=14,4*10-3; в=6,6. Вычислите поверхностное натяжение раствора с концентрацией, равной 1кмоль/м3. Поверхностное натяжение воды о=72,53*10-3Н/м.
83.Константы уравнения Шишковского для водного раствора валериановой кислоты при 2730К равны : а=14,72*10-3; в=10,4. При какой концентрации поверхностное натяжение раствора будет составлять 52,1*10-3Н/м, если поверхностное натяжение воды при 2730К равно 75,49*10-3Н/м ?
84.Используя константы уравнения Шишковского (а=12,6*10-3; в=21,5), рассчитайте поверхностное натяжение для водных растворов масляной кислоты при 2730К для следующих концентраций (кмоль/м3) : 0,007; 0,021; 0,05; 0,104 и постройте кривую в координатах = f ( c ) . Поверхностное натяжение воды о =75,49*10-3Н/м.
85.Пользуясь графическим методом, найти поверхностную активность масляной кислоты на границе водного раствора с воздухом при 2930К по данным :
| Концентрация С , кмоль/м3 | 0,00 | 0,021 | 0,050 | 0,104 | 0,246 |
| Поверхностное натяжение *10-3 Н/м | 72,53 | 68,12 | 63,53 | 58,60 | 50,30 |
86.Вычислите адсорбцию масляной кислоты на поверхности раздела водного раствора с воздухом при 2730К и концентрации С=0,1кмоль/м3, если зависимость поверхностного натяжения от концентрации выражается уравнением :
= 0 -16,7*10-3 ln(1+21,5с).
87.Найдите адсорбцию пропионовой кислоты на поверхности раздела водный раствор-воздух при 2730К и концентрации 0,5кмоль/м3 по константам Шишковского: а=12,5*10-3 и в=7,73.
88.Найдите поверхностную активность валериановой кислоты на границе ее водного раствора с воздухом при 3530К и концентрации 0,01кмоль/м3 по константам Шишковского: а=17,7*10-3 и в=19,72.
89.Вычислите адсорбцию масляной кислоты на поверхности раздела водный раствор-воздух при 2830К и концентрации С=0,104кмоль/м3, используя следующие данные:
| Концентрация С , кмоль/м3 | 0,00 | 0,021 | 0,050 | 0,104 | 0,246 | 0,489 |
| Поверхностное натяжение *10-3 Н/м | 74,01 | 69,51 | 64,30 | 59,85 | 51,09 | 44,00 |
90.Используя уравнение Ленгмюра, вычислите адсорбцию пропионовой кислоты на поверхности раздела водный раствор-воздух при 2930К и концентрации С=0,1кмоль /м3, если известны константы уравнения Шишковского: а=12,8*10-3; в=7,16.
91.Вычислите по формуле Ленгмюра величину адсорбции изоамилового спирта концентрации С=0,1кмоль /м3 на поверхности раздела водный раствор-воздух при 2920К по данным константам: Г8=8,7*10-9 кмоль/м2 ; в=42.
92.Для водного раствора изомасляной кислоты при 2910К константы Шишковского равны: а=13,1*10-3 и в=2,2. Чему равна адсорбция при концентрациях С1=0,01; С2=0,1; С3=1 кмоль/м3 ?
93.По экспериментальным данным постройте кривую адсорбции паров воды на сорбенте при 353К и с помощью графического метода определить константы уравнения Ленгмюра:
-
Равновесное давление
Р*10-2, н/м2
1,33
2,66
5,32
6,65
9,30
13,30
17,30
Адсорбция
Г*103, кмоль/кг
7,0
7,7
8,34
8,63
8,90
9,12
9,33
94.Вычислите величину адсорбции азота на цеолите при концентрации 0,1кмоль /м3, если Г8=38,9*10-3 кг/кг, в=0,156*10-2.
95.Найдите площадь, приходящуюся на одну молекулу в насыщенном адсорбционном слое анилина на поверхности его водного раствора, если Г8=6*10-9 кмоль/м2 ?
96.Какова площадь, приходящаяся на одну молекулу изомасляной кислоты на поверхности раздела водный раствор- воздух, если Г8=5,42*10-9 кмоль/м2 ?
97.По константам Лингмюра Г8=182*10-3 и в=0,1*10-2 рассчитайте и постройте кривую адсорбции углекислого газа на активированном угле в пределах следующих равновесных давлений газа: 10*10-2÷400*102 Н/м2.
98.Используя константы эмпирического уравнения Фрейндлиха =1,6*10-3 и =0,48 , постройте кривую адсорбции СО2 на активированном угле при 2710К в интервале давлений от 2*102 до 30*102 Н/м2.
99.Установите, к какому структурному типу сорбентов можно отнести молекулярные сита. Если при сорбции на них паров воды при 353К получены следующие экспериментальные данные :
| Равновесное давление Р*10-2, н/м2 | 1,33 | 2,66 | 5,32 | 6,65 | 9,30 | 13,30 | 17,30 |
| Адсорбция Г*103, кмоль/кг | 7,0 | 7,7 | 8,34 | 8,63 | 8,90 | 9,12 | 9,33 |
Давление насыщенного пара рs=472*102 .Н/м2
100.Используя данные задачи 91, определите общую пористость молекулярных сит (молекулярный объем воды V=0.018м3/кмоль при 353К).
101.Определите общую пористость цеолита (адсорбент первого структурного типа) при адсорбции этана при Т=298К, р*10-2=50Н/м2, рs=37*105н/м2, молярный объем этана V=0,064м3/кмоль; Г*103=2,0кмоль/кг.
102.При капиллярной конденсации паров воды в порах активированного угля (293К) получены результаты:
| Равновесное давление Р*10-2, н/м2 | 5,32 | 10,0 | 11,3 | 12,5 | 14,7 | 17,3 | 20,0 | 23,3 |
| Величина сорбции Г*103, кмоль/кг | | | | | | | | |
| по кривой адсорбции | 0,5 | 2,3 | 4,0 | 5,0 | 10,0 | 16,0 | 20,0 | 28,5 |
| по кривой десорбции | 0,5 | 2,5 | 5,0 | 7,5 | 15,0 | 23,0 | 27,6 | 28,5 |
Покажите наличие гистерезиса и рассчитайте дифференциальную кривую распределения пор по радиусам. Vводы=0,018м3/кмоль, рs=23.4*102Н/м2; воды=72,5*10-3Дж/м2.
103.Постройте кривую капиллярной конденсации (петлю гистерезиса) паров воды и дифференциальную кривую распределения пор активированного угля по радиусам используя данные :
| Равновесное давление Р*10-2, н/м2 | 4,65 | 9,3 | 14,0 | 18,7 | 20,9 | 23,3 |
| Величина сорбции Г*103, кмоль/кг, по кривой адсорбции | 0,5 | 1,5 | 8,5 | 20,0 | 24,0 | 28,5 |
| по кривой десорбции | 0,5 | 1,5 | 13,0 | 27,0 | 28,0 | 28,5 |
Vводы=0,018м3/кмоль, рs=23.4*102Н/м2; воды=72,5*10-3Дж/м2.
104.Построить интегральную и дифференциальную кривые распределения пор по радиусам для активированного угля при капиллярной конденсации паров бензола (2930К):
| Равновесное давление Р*10-2, н/м2 | 19,8 | 29,9 | 39,8 | 59,6 | 79,7 | 89,4 |
| Величина сорбции Г*103, кмоль/кг, по кривой адсорбции | 24,0 | 28,3 | 31,0 | 36,0 | 46,0 | 55,0 |
| по кривой десорбции | 24,0 | 30,0 | 37,5 | 44,0 | 50,0 | 55,0 |
Vбензола=0,089м3/кмоль, рs=99,3*102Н/м2; =28,9*10-3Дж/м2.
105.Построить кривую капиллярной конденсации паров метилового спирта на активированном угле. Используя ветвь десорбции построить интегральную и дифференциальную кривые распределения пор по радиусам (2930К) :
| Равновесное давление Р*10-2, н/м2 | 12,8 | 25,6 | 38,4 | 51,2 | 64,0 | 76,8 | 90,0 | 102,0 |
| Величина сорбции Г*103, кмоль/кг | | | | | | | | |
| по кривой адсорбции | 7,5 | 8,0 | 8,3 | 8,6 | 9,4 | 10,2 | 11,4 | 13,0 |
| по кривой десорбции | 7,5 | 8,3 | 9,0 | 9,6 | 10,2 | 11,0 | 11,7 | 13,0 |
Vсн3он=0,0406м3/кмоль, рs=128*102Н/м2; =22,6*10-3Дж/м2.
106.Определите, к какому структурному типу сорбентов отнести ионит, если при сорбции на нем паров CCl4 получены данные:
| Равновесное давление Р*10-2, н/м2 | 30,4 | 38,8 | 48,6 | 77,0 | 100,5 |
| Величина сорбции Г*103, кмоль/кг | 0,02 | 0,03 | 0,04 | 0,06 | 0,07 |
рsccl4=121*102Н/м2.
107.Постройте изотермы адсорбции и десорбции водяного пара на пшеничном глиадине в координатах Г=f (р/рs), по максимальной величине сорбции рассчитайте общую пористость сорбентов, пользуясь данными :
| р/рs | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 |
| Величина сорбции Г*103, кмоль/кг, по кривой адсорбции | 1,75 | 3,22 | 3,6 | 4,67 | 5,55 | 6,7 | 6,9 | 9,18 |
| по кривой десорбции | 2,66 | 3,78 | 4,9 | 6,16 | 6,95 | 7,7 | 8,45 | 9,22 |
Vводы=0,018м3/кмоль.
108.По данным задачи 99 рассчитайте и постройте интегральную и дифференциальную кривые распределения пор по радиусам. Vводы=0,018м3/кмоль, рs=23.4*102Н/м2; воды=72,5*10-3Дж/м2; R=8,3*103Дж/(град*моль).
109.Как изменится величина общей пористости аэросила (высокодисперсный кремнезем), если до гидротермальной обработки максимальная величина сорбции на нем паров азота составляла 7,5*10-3кмоль/кг, а после обработки 4,0*10-3кмоль/кг ? V паров азота=0,0224м3/кмоль.
110.Пользуясь данными ионного обмена ионов кальция (Г1, С1) и натрия (Г2, С2) на синтетическом катионите, определите графически константу уравнения Никольского К :
| С11/2 С2 в растворе | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,8 |
| Г11/2 Г2 на сорбенте | 0,75 | 1,0 | 1,5 | 1,8 | 2,4 | 3,1 |
111.При изучении реакции обмена Mg- ионов из чернозема с ионами Са из внесенных минеральных удобрений получены данные:
| Концентрация ионов в растворе С*103, кмоль/м3 | Количество сорбированных катионов Г*105кмоль/кг | ||
| Mg | Ca | Mg | Ca |
| 2,41 | 4,75 | 8,12 | 42,88 |
| 2,25 | 5,00 | 7,70 | 43,30 |
| 2,00 | 5,10 | 6,90 | 44,10 |
| 1,84 | 5,50 | 6,10 | 44,90 |
| 1,53 | 5,87 | 4,54 | 46,46 |
| 1,37 | 5,99 | 4,12 | 46,88 |
Графическим методом определите константу уравнения Никольского К.
112.Определите константу уравнения Никольского К, используя данные реакций обмена ионов Na из раствора натриевой соли на ионы Mg из почвы :
| Концентрация ионов в растворе С*103, кмоль/м3 | Количество сорбированных ионов на почве Г*105кмоль/кг | ||
| Na | Mg | Na | Mg |
| 13.8 | 42.0 | 1.2 | 25.4 |
| 21.2 | 38.3 | 1.9 | 26.1 |
| 38.2 | 31.9 | 3.6 | 27.2 |
| 65.0 | 21.1 | 8.0 | 29.3 |
| 79.2 | 14.8 | 11.7 | 32.84 |
ПРИЛОЖЕНИЕ
Таблица 1
Стандартные электродные потенциалы (0)
некоторых металлов (ряд напряжений)
| Электрод | 0 , В | Электрод | 0 , В |
| Li+/Li | -3.045 | Cd2+/Cd | -0.403 |
| Rb+/Rb | -2.925 | Co2+/Co | -0.277 |
| K+/K | -2.924 | Ni2+/Ni | -0.25 |
| Cs+/Cs | -2.923 | Sn2+/Sn | -0.136 |
| Ba2+/Ba | -2.90 | Pb2+/Pb | -0.127 |
| Ca2+/Ca | -2.87 | Fe3+/Fe | -0.037 |
| Na+/Na | -2.714 | 2H+/H2 | 0.000 |
| Mg2+/Mg | -2.37 | Sb3+/Sb | +0.20 |
| Al3+/Al | -1.70 | Bi3+/Bi | +0.215 |
| Ti2+/Ti | -1.603 | Cu2+/Cu | +0.34 |
| Zr4+/Zr | -1.58 | Cu+/Cu | +0.52 |
| Mn2+/Mn | -1.18 | Hg2+/Hg | +0.79 |
| V2+/V | -1.18 | Ag+/Ag | +0.80 |
| Cr2+/Cr | -0.913 | Hg2+/Hg | +0.85 |
| Zn2+/Zn | -0.763 | Pt2+/Pt | +1.19 |
| Cr3+/Cr | -0.74 | Au3+/Au | +1.50 |
| Fe2+/Fe | -0.44 | Au+/Au | +1.70 |
Таблица 2
