Физическая
| Вид материала | Рабочая программа |
- Методика подбора средств профессионально-прикладной подготовки. Основные факторы, определяющие, 46.84kb.
- Рабочая программа дисциплины физическая культура Степень выпускника, 873.87kb.
- Основная образовательная программа высшего профессионального образования Направление, 4490.7kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Программа аттестационных испытаний Факультет Физической культуры Бакалавриат по направлению, 289.66kb.
- Лекция 1 Физическая картина природы и ее «изобразительные средства», 164.13kb.
- М. К. Аммосова Институт физической культуры и спорта рабочая программа, 78.29kb.
- Программа дисциплины «Физическая культура» Утверждена умс председатель, 83.66kb.
- Тематический план 1 по дисциплине «Физическая культура», 404.41kb.
- Условия проведения конкурса знатоков по специальности Физическая культура для лиц, 27.28kb.
Двухкомпонентные твердые системы в равновесии с расплавом .
Свойства их изучают при помощи диаграмм плавкости. Диаграммы плавкости строят по кривым охлаждения.
1.Оба компонента неограниченно растворимы друг в друге, в твердом состоянии образуют твердые растворы. Такие системы называются изоморфными. Возможно непрерывное изменение состава твердого раствора.
2.Компоненты нерастворимы друг в друге в твердом состоянии, а образуют смесь кристаллов обоих компонентов. В жидком состоянии компоненты неограниченно растворимы друг в друге. Такие системы называют неизоморфными. При охлаждении системы до некоторой температуры она становится насыщенной относительно одного из компонентов. Из расплава выделяются кристаллы этого компонента. Такие системы образуют вещества, значительно отличающиеся по свойствам. Неизоморфные системы можно разделить:
- системы, компоненты которых не образуют химических соединений друг с другом;
- системы, компоненты которых образуют устойчивые химические соединения;
- системы, компоненты которых образуют неустойчивые химические соединения, разлагающиеся при температурах более низких, чем температура плавления этих соединений.
Диаграммы плавкости неизоморфных систем можно использовать для определения теплот плавления: Т=Кm.
3. Компоненты ограниченно растворимы друг в друге, например, системы, составленные из двух взаимно ограниченных растворимых жидкостей. Практическое значение имеет зависимость взаимной растворимости от температуры при постоянном давлении.
Пример 1. При 800С давление пара над бензолом равно 106Па, а над метилбензолом 4·104 Па. Найдите молярную долю метилбензола в паре, равновесном с жидкой смесью бензола и метилбензола, при 800С при условии, что молярная доля метилбензола в жидкой смеси равна 0,60.
Решение: Молярная (мольная) доля бензола в жидкой смеси составляет
NжБ = 1 - NжМ = 1 – 0,60 = 0,40
Давление насыщенного пара над раствором Р равно сумме парциальных давлений РБензол и РМетилбензол: Р = РБ + РМ. По закону Рауля
РБ = Р0Б · NЖБ и PМ = P0М · NЖМ
Соотношение между составом пара и жидкости системе может быть выражено через давление насыщенных паров чистых компонентов и общее давление Робщ. Парциальное давление, согласно закону Дальтона:
РБ=Робщ· NГБ ; РМ=Робщ · NГМ , тогда
Р0Б · NЖБ = Pобщ · NГБ ; Р0М NЖМ = Pобщ · NГМ,
тогда
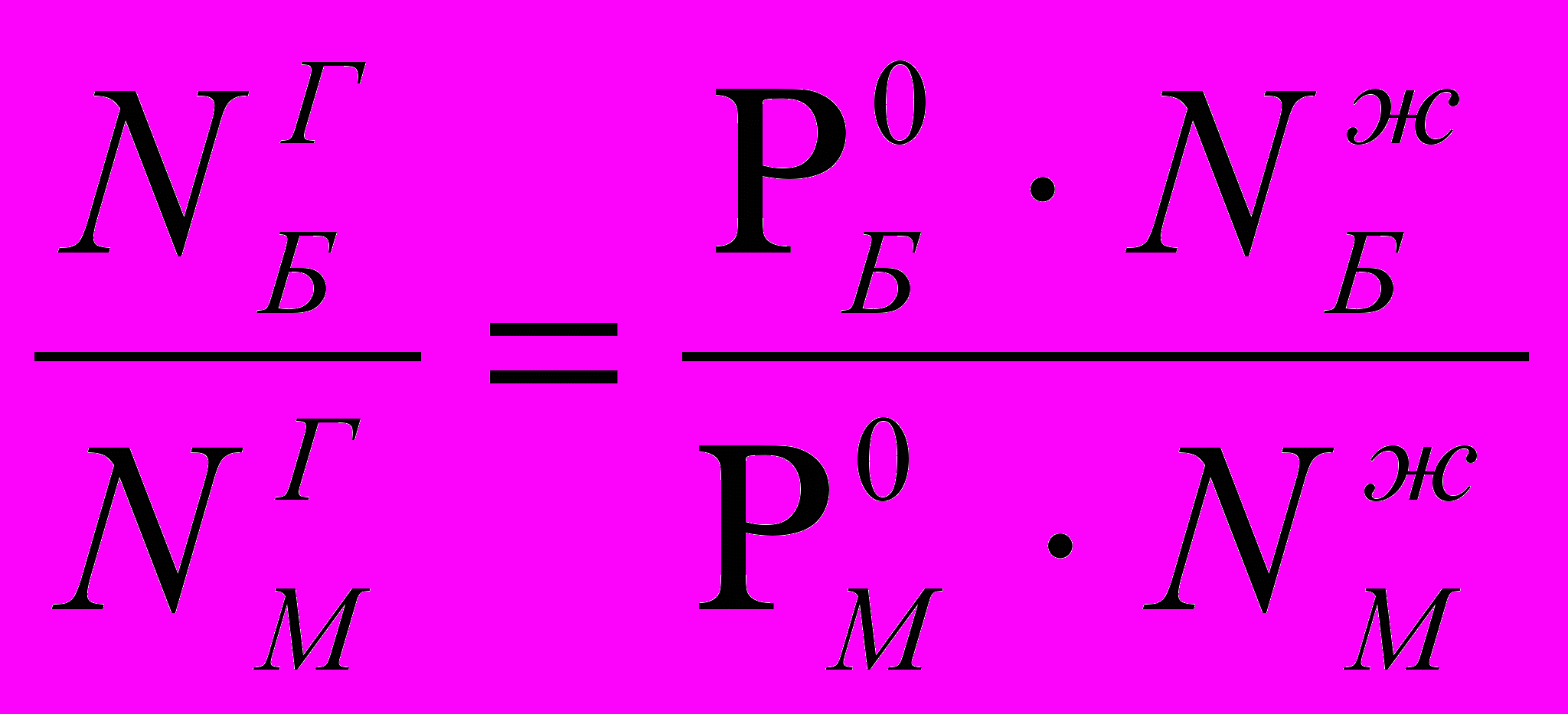 . Молярная доля бензола в паре равна NГБ = 1 – NГМ , следовательно
. Молярная доля бензола в паре равна NГБ = 1 – NГМ , следовательно 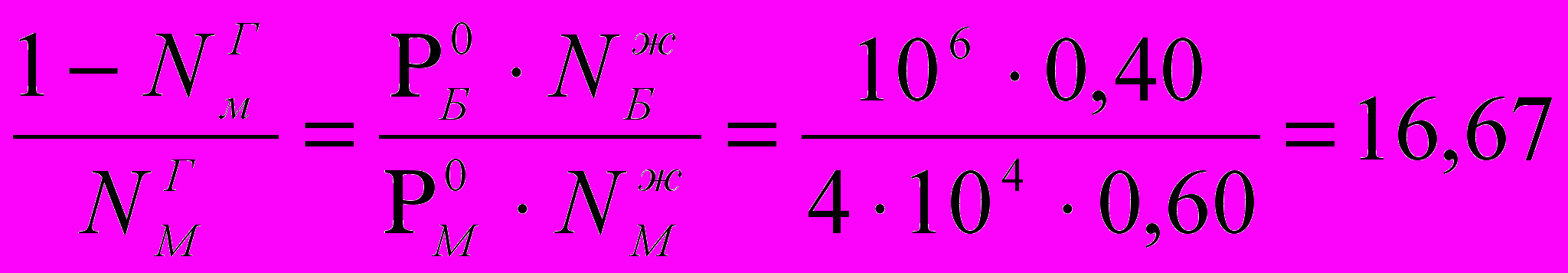 отсюда
отсюда1 – NГМ = 16,67· NГМ
молярная доля метилбензола в паре, равновесном с жидкой смесью бензола и метилбензола составляет NГМ = 1 / 17,67 = 0,057.
Пример 2. При растворении 1,38 г глицерина в 100 г воды температура замерзания понизилась на 0,2790С. Определить молекулярную массу глицерина.
Решение. В первую очередь определяется количество граммов глицерина, которое приходится на 1000 г воды:
На 100г воды----------1,38г глицерина, тогда
На 1000г воды----------x г глицерина X=
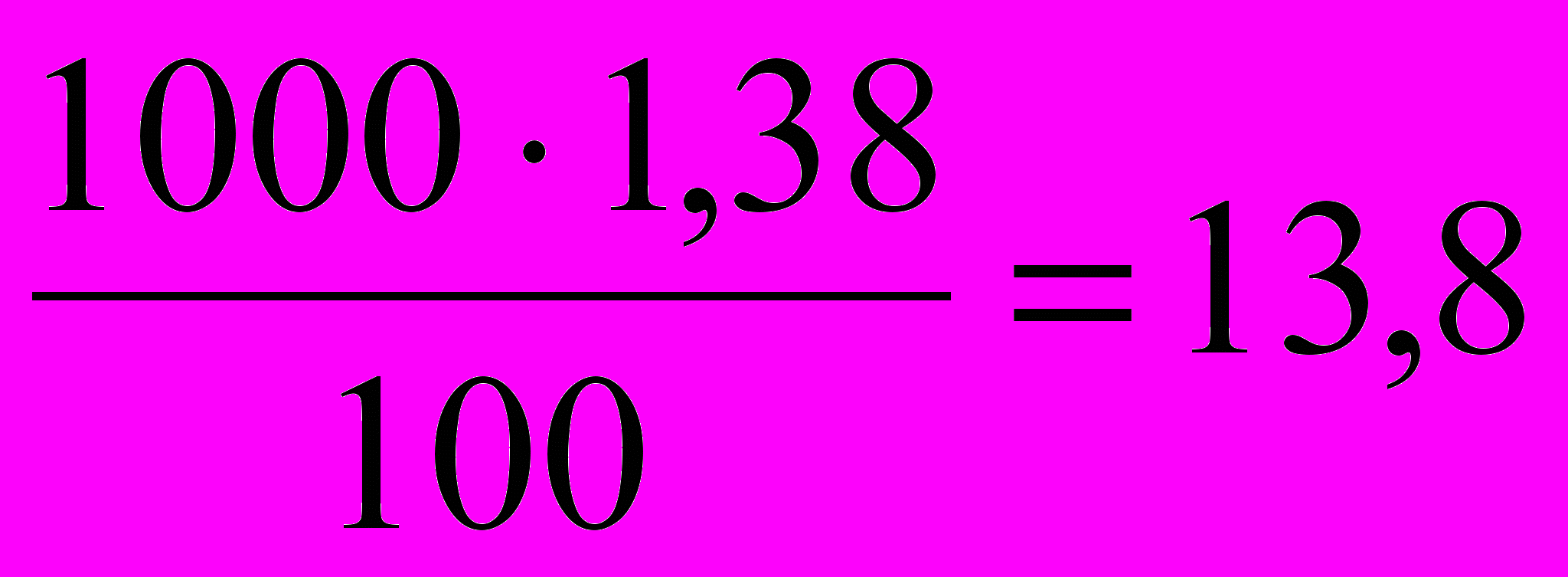 г
гСоответственно, моляльность этого раствора равна b =
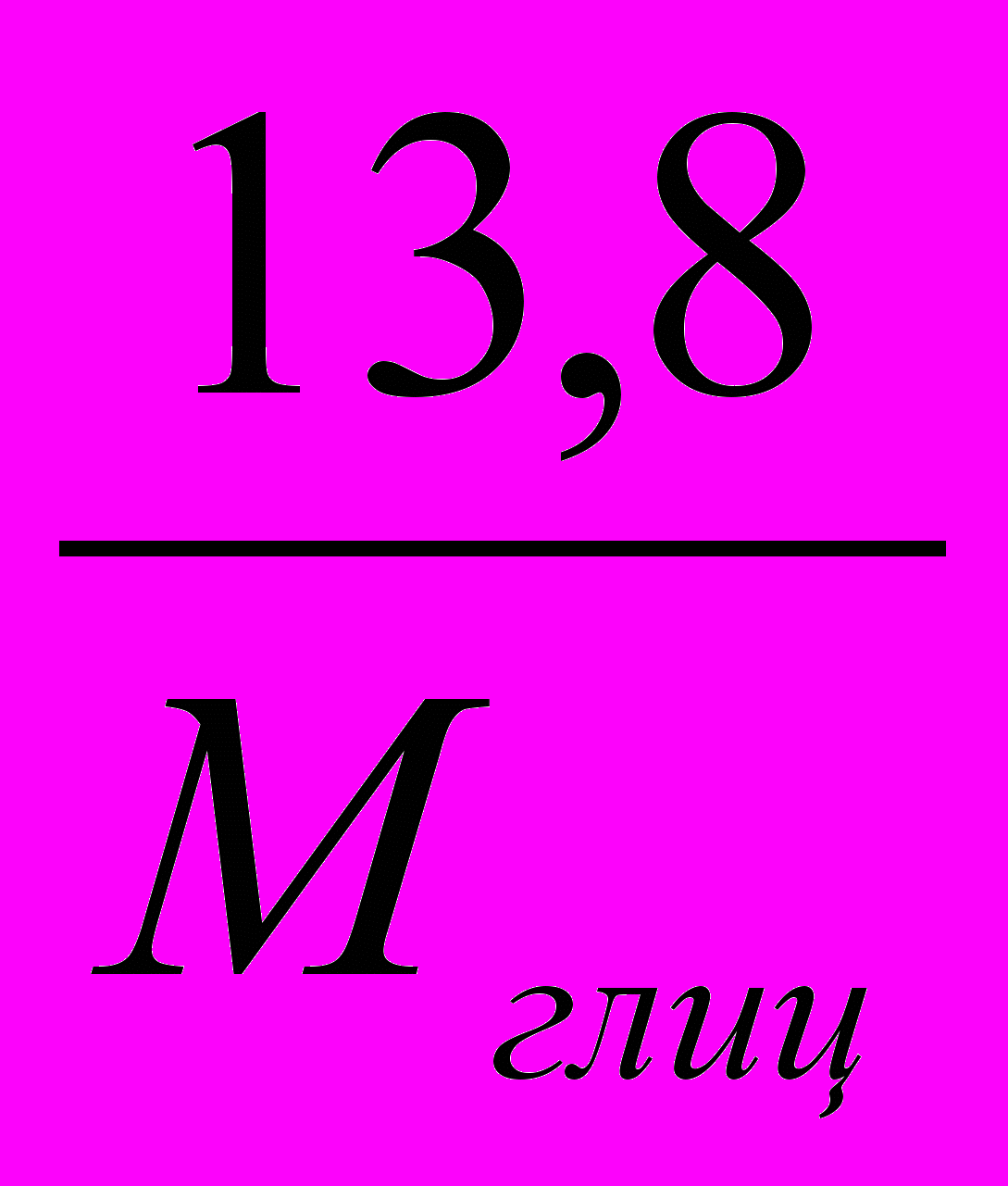 .
.По условию задачи температура замерзания понизилась на ΔТ = К ·b= 0,2790С, где К – криоскопическая постоянная (для воды составляет 1,86 град·кг/моль). Таким образом, молекулярная масса глицерина равна Мглиц=
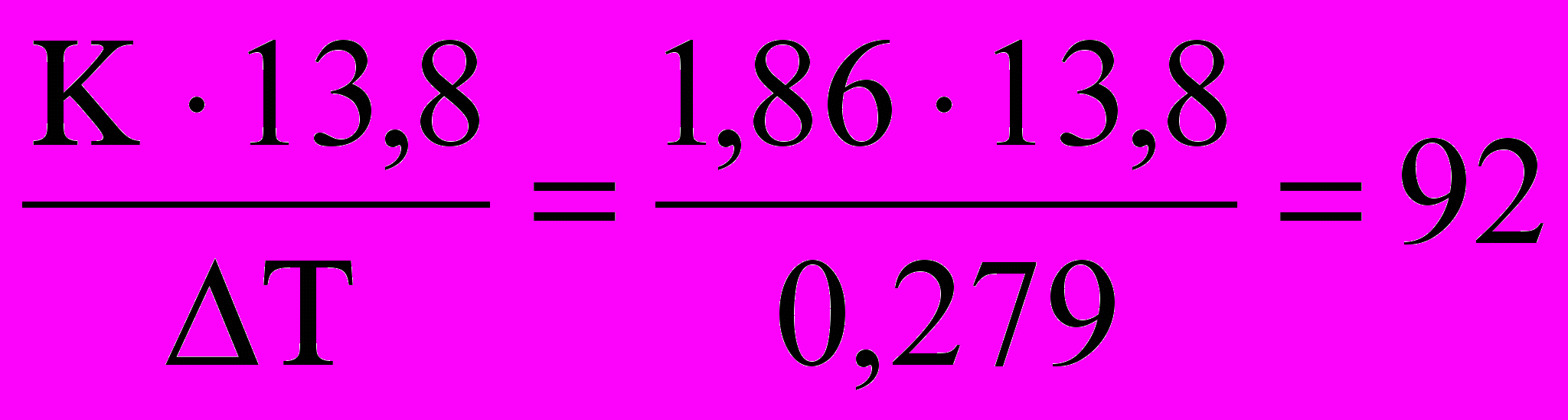 г.
г.Контрольные вопросы
40.Раствор, содержащий 5,00г неэлектролита в 100,0г воды, кипит при 100,420С. Вычислите молярную массу неэлектролита.
41.Чему равна температура кипения 10%-го раствора сахарозы С12H22O11?
42. При температуре 363 К давление паров бензола равно 135775 Па, а толуола – 54107 Па. Какой должна быть молярная доля бензола в смеси, чтобы она закипела при температуре 363 К и нормальном атмосферном давлении?
43.Водный раствор, содержащий 5,18 г растворенного вещества в 155,18 г раствора, замерзает при –1,390С. Вычислите молекулярную массу растворенного вещества.
44.Температура кипения чистого сероуглерода равна 46,20С. Раствор, содержащий 0,217г серы в 19,18г сероуглерода, кипит при 46,30С. Эбулоскопическая константа сероуглерода равна 2,32 град·кг/моль. Сколько атомов содержится в молекуле серы, растворенной в СS2?
45.Рассчитайте эбулоскопическую постоянную для воды, если известно, что при нормальной температуре кипения 373 К ее удельная теплота испарения равна 2,464 кДж/моль.
46.Определите температуру кипения четыреххлористого углерода, если в него добавить 2,5% серы. Чистый ССl4 кипит при 349,7 К. Удельная теплота испарения ССl4 составляет 195,72·103Дж/кг.
47.Водный раствор, содержащий нелетучее растворенное вещество, замерзает при 271,5 К. Определите температуру кипения раствора и давление пара раствора при 298 К. Давление пара чистой воды при 298К равно 3167,21 н/м2.
48. При 313К давления паров дихлорэтана и бензола равны 2,066·104 и 2,433·104 Н/м2 соответственно. Постройте график зависимости общего и парциального давлений пара от состава смеси этих веществ, считая эту смесь идеальным раствором:
-
Nс6н6
Рс2н4сl·10-4н/м2
Рс6н6·10-4н/м2
0,075
1,897
0,176
0,130
1,791
0,292
0,186
1,664
0,443
0,257
1,507
0,648
0,342
1,355
0,832
0,462
1,133
1,113
0,560
0,933
1,347
0,640
0,773
1,527
0,695
0,664
1,663
0,745
0,553
1,800
0,792
0,429
1,933
0,848
0,320
2,056
0,875
0,247
2,140
0,945
0,125
2,287
Какие можно сделать выводы из этих данных ? Определите состав смеси, которая будет кипеть при Робщ=2,267·10-4Н/м2.Определите давление, при котором закипит смесь, содержащая 40 масс. % бензола.
49.При Т=323К для системы этиловый спирт - дихлорэтан получены следующие данные :
-
N c2н5он
Р с2н5он·10-4, н/м2
Р с2н4сl2·10-4,н/м2
0,1
1,349
2,866
0,2
1,773
2,740
0,3
1,953
2,686
0,4
2,025
2,652
0,5
2,085
2,585
0,6
2,155
2,464
0,7
2,260
2,249
0,8
2,417
1,843
0,9
2,672
1,147
Давление пара чистого этилового спирта при этой температуре 2,960·104Н/м2, а чистого дихлорэтана 3,113·104Н/м2. Вычислите общее давление над системой при всех заданных соотношениях, постройте диаграмму зависимости парциальных и общего давления от состава.
50. При изучении равновесия в системе жидкость-пар (хлороформ-диэтиловый эфир) при 298К были получены данные:
| N с2н5ос2н5 | 0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 |
| Рс2н5ос2н5·10-4,н/м2 | 0 | 0,460 | 1,287 | 2,666 | 4,093 | 5,333 |
| Рснсl3·10-4,н/м2 | 1,933 | 1,480 | 0,920 | 0,460 | 0,165 | 0 |
Постройте график парциального и общего давления Р над системой от состава. На график нанесите зависимость Рс2н5ос2н5; Рснсl3 и Р от состава, считая раствор идеальным.
51. Пользуясь данными примера 40, постройте график зависимости состава пара от состава жидкой фазы, для системы бензол-дихлор-этан при 313К.
52. Вычислить, какой объем кислорода из воздуха растворится в 1м3 воды при Т=293К и Р=5*105Н/м2. Коэффициент распределения кислорода в воде при 293К равен 1,365*10-8 Кмоль/Н*м.
53. Экспериментально определены значения парциальных давлений над системой ацетон-хлороформ при 308,2К в зависимости от состава:
| Nснсl3 | 0 | 0,2 | 0,4 | 0,6 | 0,8 | 1,0 |
| Рcнсl3*10-4,н/м2 | 0 | 0,453 | 1,093 | 1,973 | 3,0 | 3,906 |
| Р(сн3)2со*10-4,н/м2 | 4,586 | 3,60 | 2,440 | 1,360 | 0,556 | 0 |
Постройте график зависимости парциальных и общего давлений над системой от состава. Определите при каком давлении начнет кипеть система, содержащая 50 мол. % хлороформа при Т=308,2К.
Ответ: 3,38*104Н/м2
54. Давление паров веществ А и В при 323К соответственно равны 4,666*104 и 10,132*104Н/м2. Вычислите состав пара, равновесного с раствором, считая раствор, полученный при смешении 0,5 кмоль А и 0,7 моль В, идеальным.
Ответ: NгА=0,248.
55. Рассчитайте состав пара над раствором, содержащим по 0,5 кмоль бензола и толуола, по зависимости давления насыщенного пара от температуры для бензола и толуола:
| Т,К | 330 | 350 | 380 | 420 |
| Рос6н6*10-4,н/м2 | 5,2 | 9,3 | 21,3 | 55,5 |
| Рос6н5сн3*10-4,н/м2 | 1,6 | 3,8 | 9,3 | 25,8 |
Дайте заключение, о применимости первого закона Вревского. При расчете раствор считать идеальным.
Ответ: 0,765; 0,710; 0,696; 0,682 мол.%.
56. При данной температуре давление чистых С и Д равно 550 и 250 мм.рт.ст. соответственно. С помощью простого графического построения определите:
а) общее давление пара над раствором, содержащим 25 мол. % Д;
б) парциальное давление РД0 в смеси;
в) состав раствора, давление пара которого равно 500 мл.рт.ст.
Примите, что раствор идеальный.
57. На диаграмме состояния двухкомпонентной системы СаSiO3-BaSiO3 (рис 3) указать, какие соединения образуются при массовом составе:
а) 40% BaSiO3+60% CaSiO3;
б) 80% BaSiO3+20% CaSiO3
при различных температурах. Как на диаграмме состояния определить конгруентно или инконгруентно плавится химическое соединение.
58. Система, состоящая из четыреххлористого углерода (С) и диоксана (Д), имеет две эвтектические точки: при 5,2 мол %Д и температуре -24,7оС и при 49,5 мол. %Д и температуре -20,2оС. Имеется одно бинарное соединение С2Д с конгруентной точкой плавления чистого четыреххлористого углерода
С=-22,7оС. Температура плавления чистого Д = 11,8оС. Постройте фазовую диаграмму «состав-температура» этой системы, приняв, что твердые растворы не образуются.
59. Укажите эвтектические точки на диаграмме CuCl-FeCl3 (рис 4). Какие химические соединения образуются в системе?
60. Разберите на диаграмме двухкомпонентной системы с образованием непрерывного ряда твердых растворов правило рычага для определения относительных количеств жидкой и твердой фаз.
61. Что следует понимать под линией ликвидуса, солидуса и эвтектикой. Приведите пример диаграммы состояния плавления двойной системы с компонентами нерастворимыми один в другом в кристаллическом состоянии.
Жидкие трехкомпонентные системы
Закон распределения.
Для каждой данной температуры отношение концентраций третьего компонента в двух равновесных фазах есть величина постоянная, не зависящая от абсолютного количества всех веществ, участвующих в распределении:
С1
С2 = К - константа распределения;
С1 - равновесная концентрация распределяющегося вещества в первой фазе;
С2 - равновесная концентрация распределяющегося вещества во второй фазе .
В некоторых системах распределяющееся вещество имеет неодинаковые частицы в разных растворителях.
Тогда С1n М11

 = К, где n = ;
= К, где n = ;C2 М1
(М1- средне-молярная масса распределяющегося вещества в первой фазе; М11 - во второй фазе).
Если газ распределяется между газообразной и жидкой фазами, удобно перейти к парциальному давлению:
1
С
 2= P, а при постоянной температуре С2=К1Р,
2= P, а при постоянной температуре С2=К1Р,RT
1 С1
г

 де К1 = и = К,
де К1 = и = К, RT С2
то С1 = КК1Р, т.е. С1 = АР, где С1-концентрация газа в жидкой фазе.
Концентрация газа в жидкой фазе прямо пропорциональна парциальному давлению газа (закон Генри).
При распределении третьего вещества между двумя несмешивающимися жидкостями, возможен случай, когда степень диссоциации распределяющегося вещества в разных растворителях отличается:
oбозначим степень диссоциации распределяющегося вещества в первом растворителе 1 и во втором 2. Тогда:
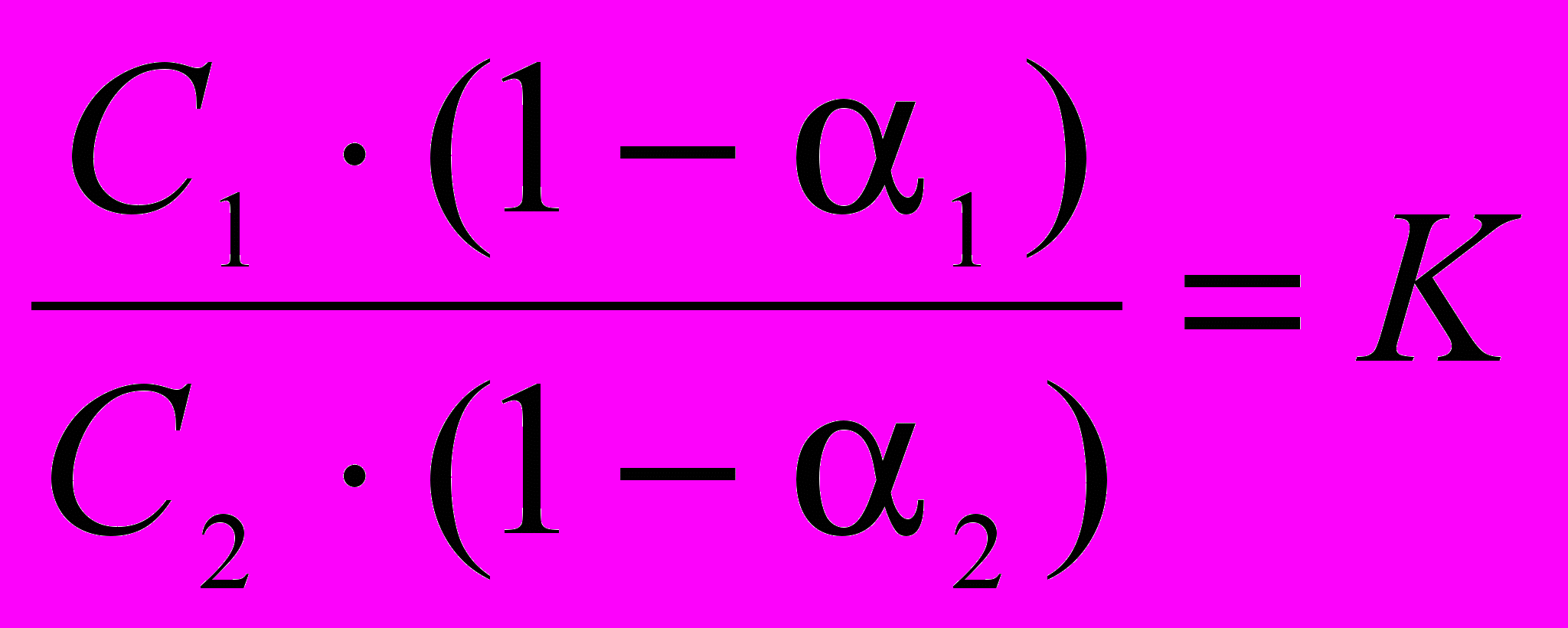
Для концентрированных растворов концентрации следует заменить активностями:
 = К.
= К. Закон распределения широко используется при экстрагировании вещества из раствора:

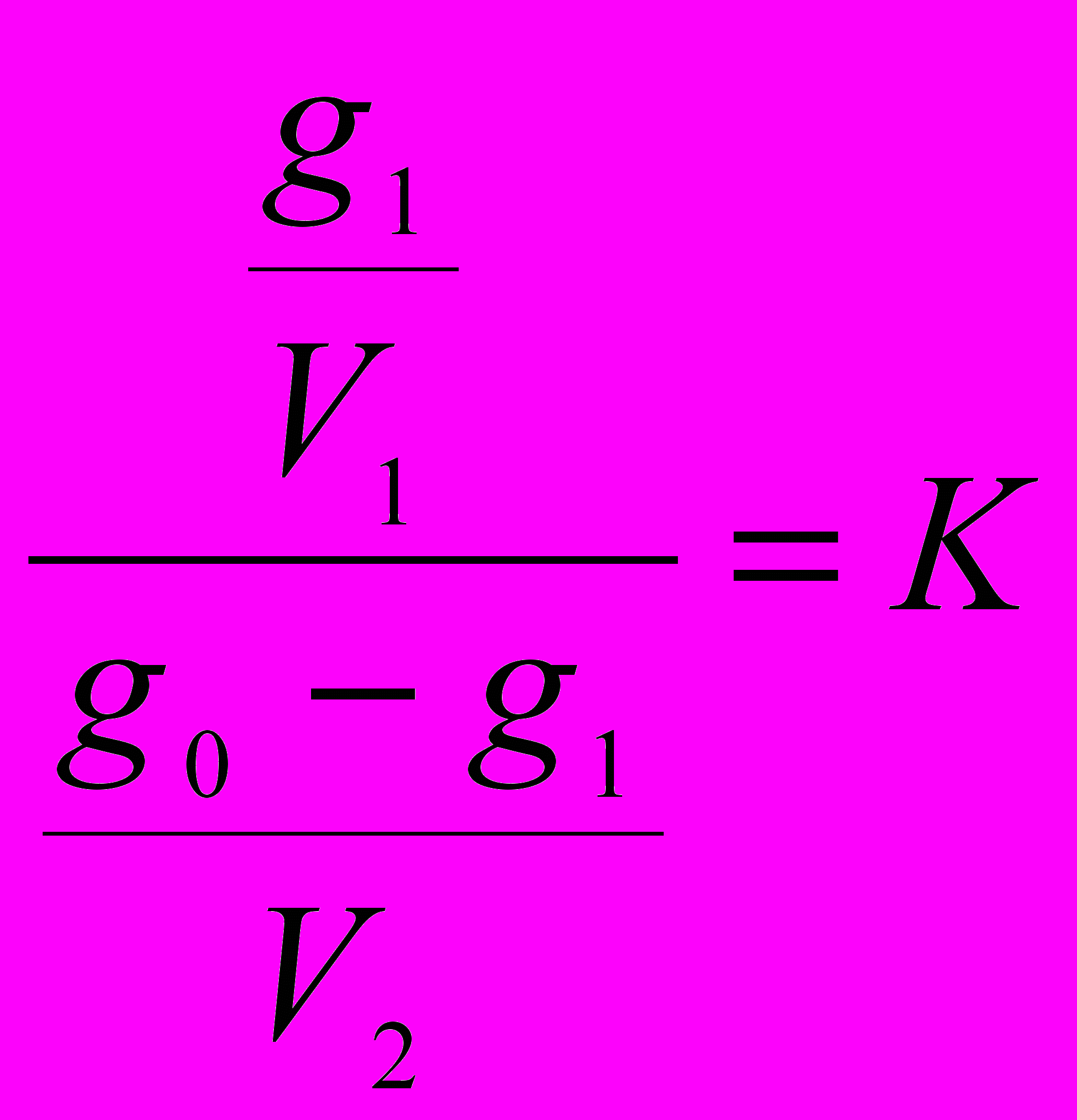
g0 - начальное количество экстрагируемого вещества;
V1 - объем раствора, в котором находится экстрагируемое вещество ;
V2-объем растворителя, употребляемый на одно экстрагирование;
g1,g2....gn-количество вещества, остающееся в первоначальном растворе после 1,2......n -го экстрагирования.
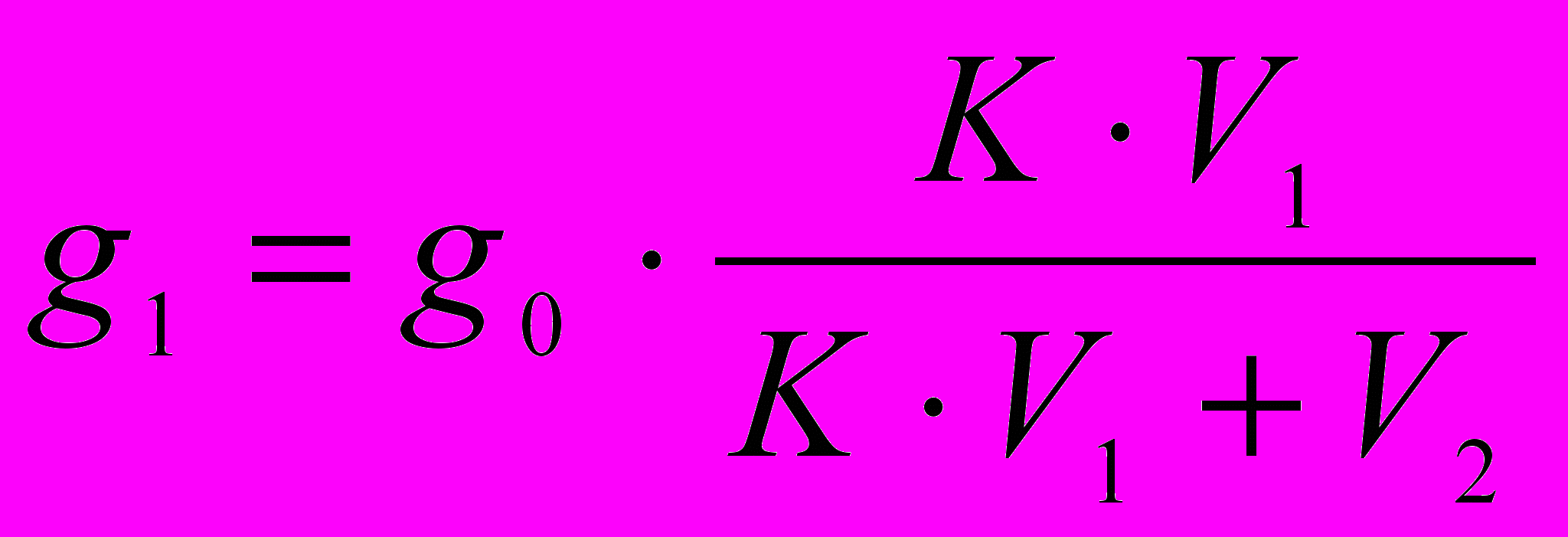
После второго экстрагирования:
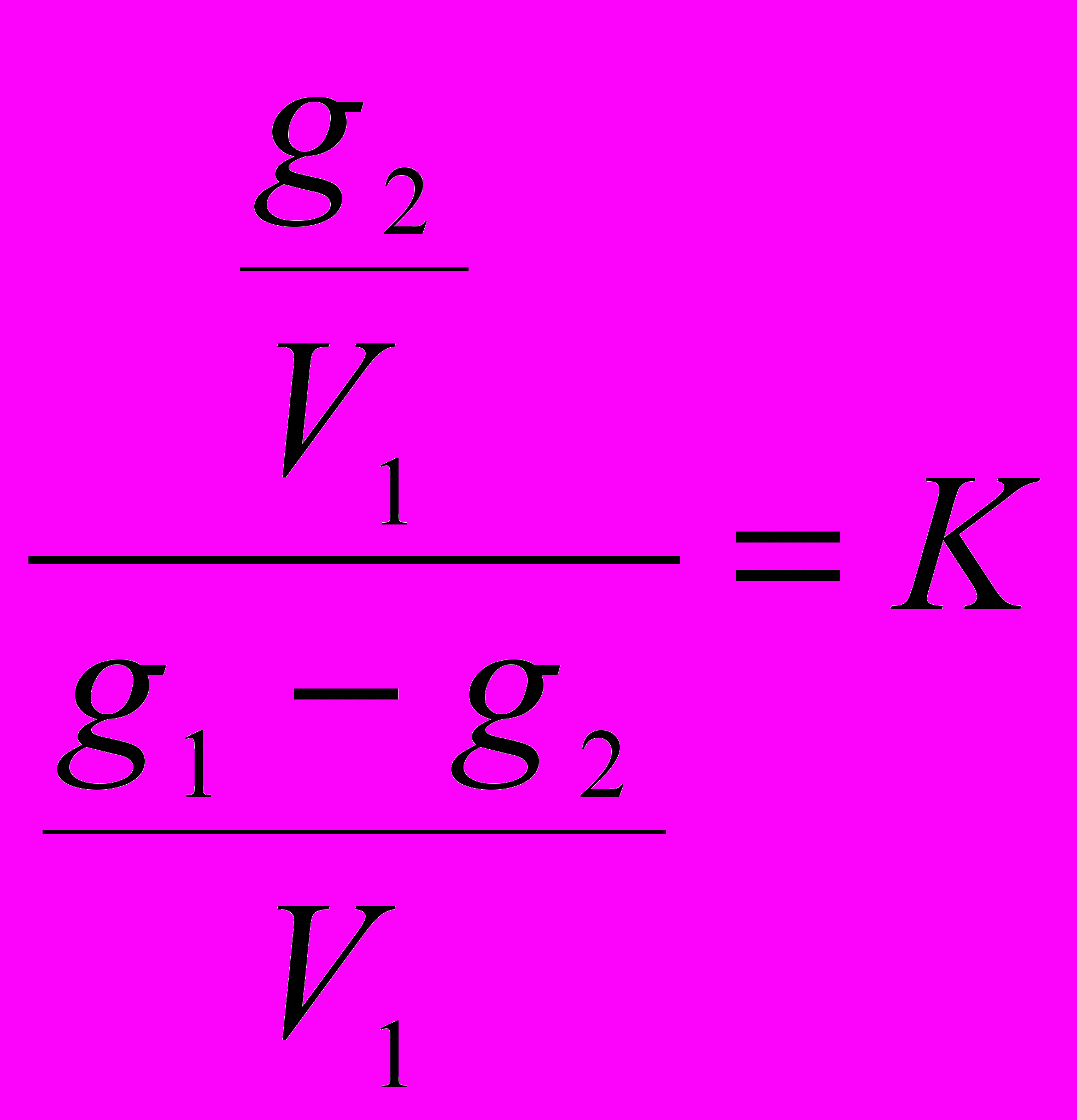 и
и 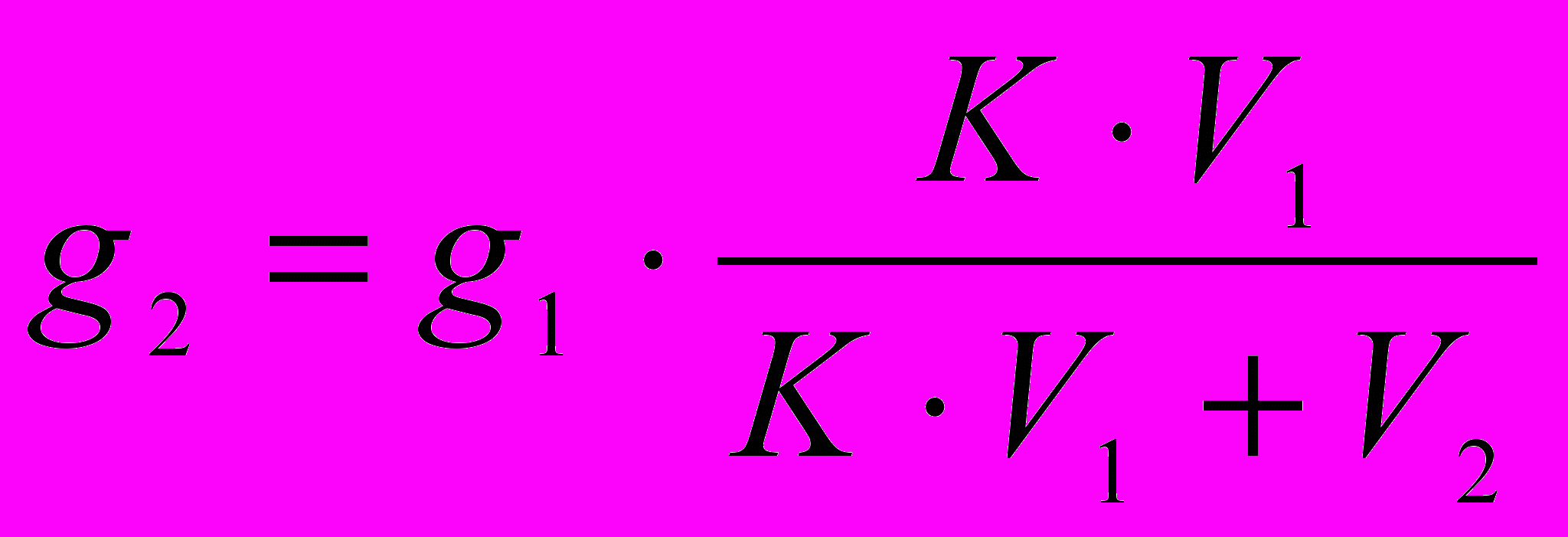
При совместном решении: g2=g0 ·
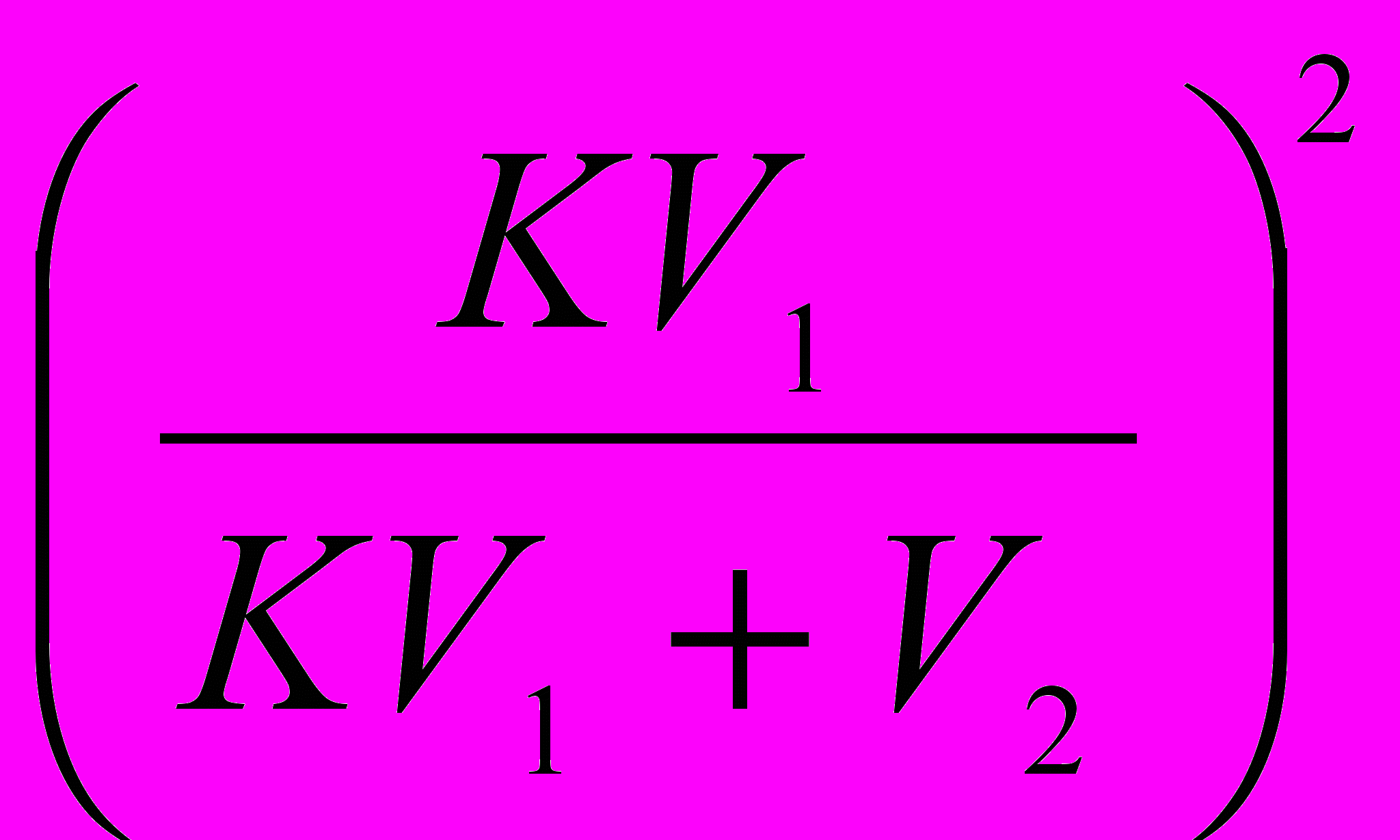
После n- экстрагирований: gn=g0 ·
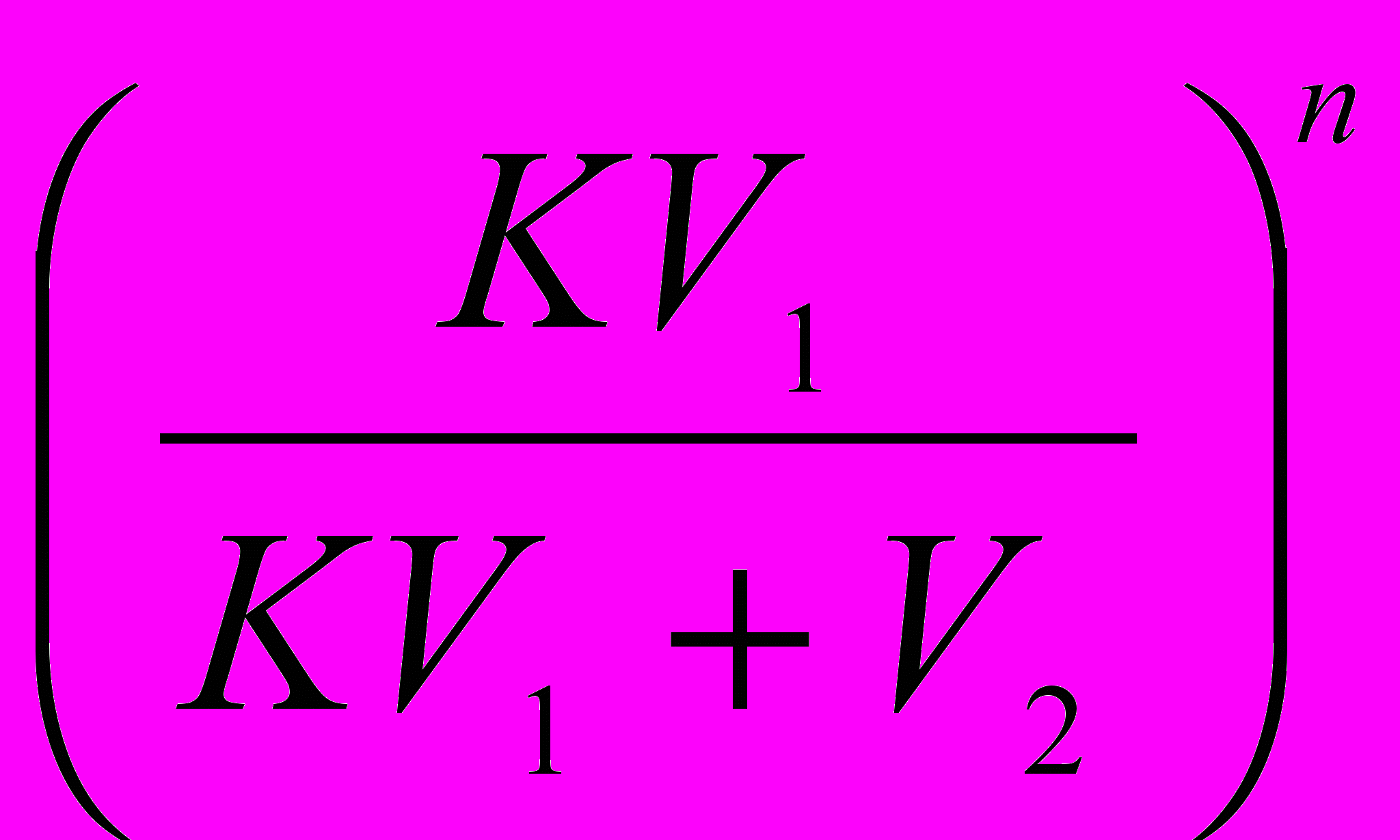 .
. Суммарное выделенное вещество с помощью n экстракций gЭ:
gЭ = g0 · [ 1 –
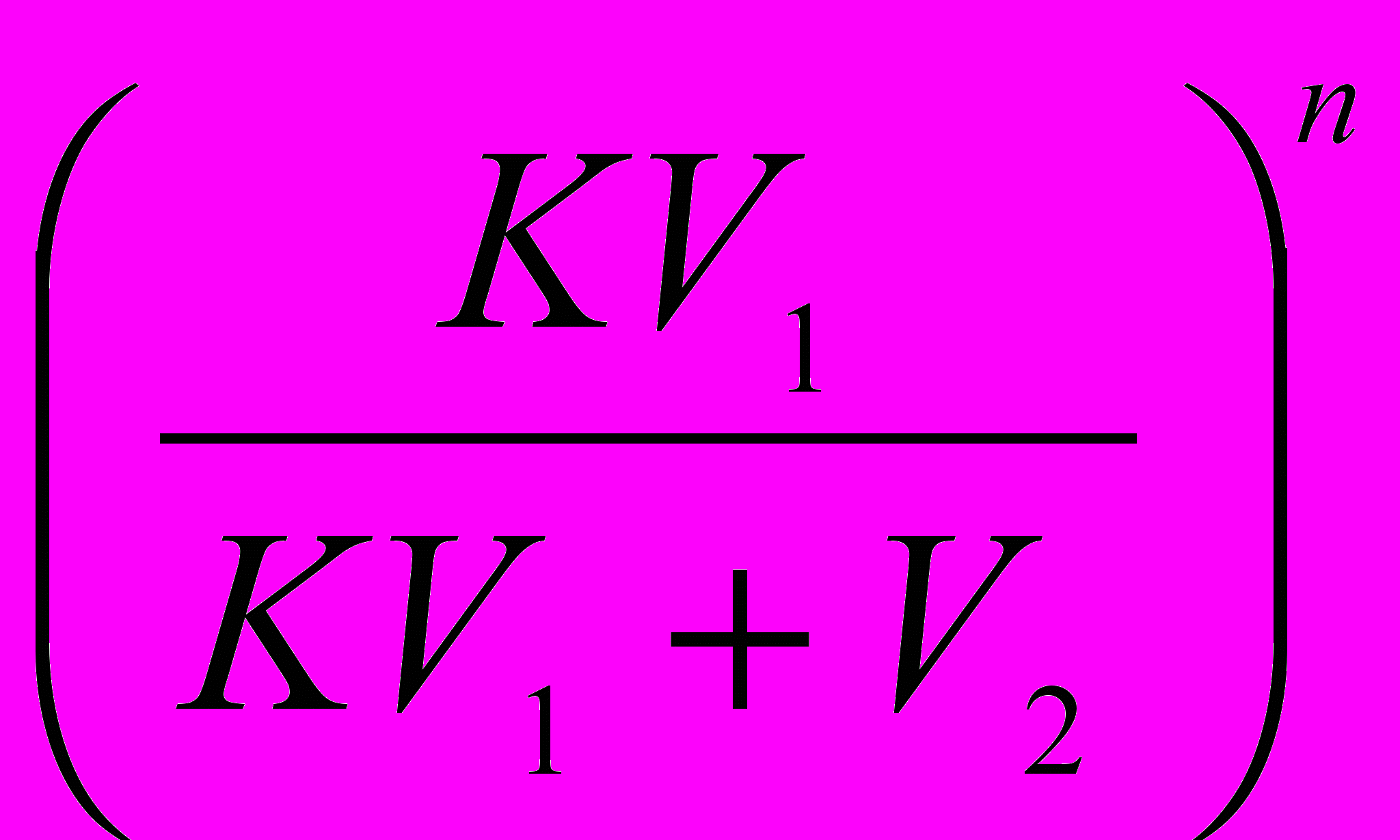 ]
]Пример. Коэффициент распределения уксусной кислоты между амиловым спиртом и водой равен 0,914. Сколько воды потребуется для извлечения уксусной кислоты из 2 л 0,2М раствора уксусной кислоты в амиловом спирте, если ее концентрация в водном растворе должна быть 0,1 моль/л?
Решение. Необходимо определить, сколько граммов уксусной кислоты находится в 2000 мл спиртового раствора:
если в1000мл раствора-----0,2 моль кислоты
то в V1=2000 мл раствора ------0,4моль кислоты, а g0= 0,4·60 = 24г
(молекулярная масса CH3COOH составляет 60 уг. ед.).
Количество уксусной кислоты, выделенной при однократной экстракции водой объемом V2 из амилового спирта, находится из соотношения:
если концентрация кислоты в водном растворе должна быть 0,1 моль/л, то
в 1000 мл водного раствора-------(0,1·60)г кислоты
в V2 мл водного раствора----------gЭ г кислоты, тогда gЭ =
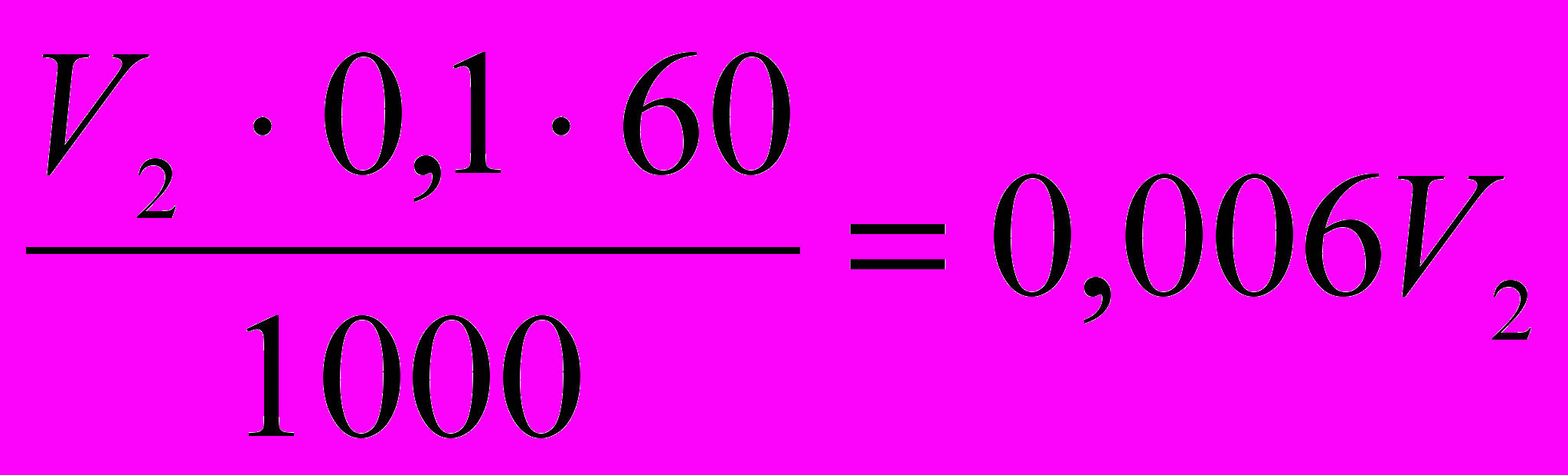 .
.Таким образом, выделенное вещество с помощью однократной экстракции водой:
gЭ = g0 · [ 1 –
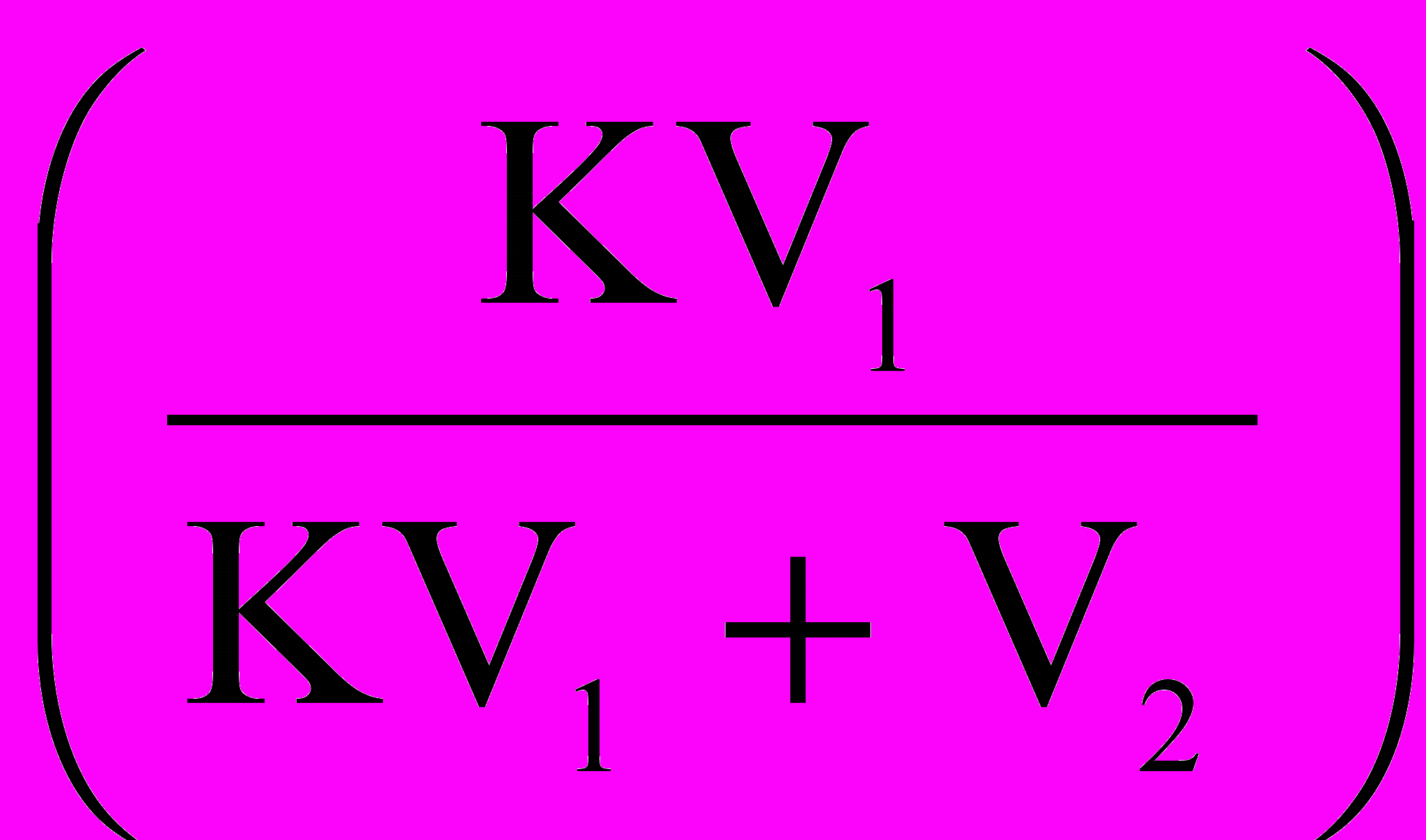 ], тогда 0,006V2 =24· (1-
], тогда 0,006V2 =24· (1- 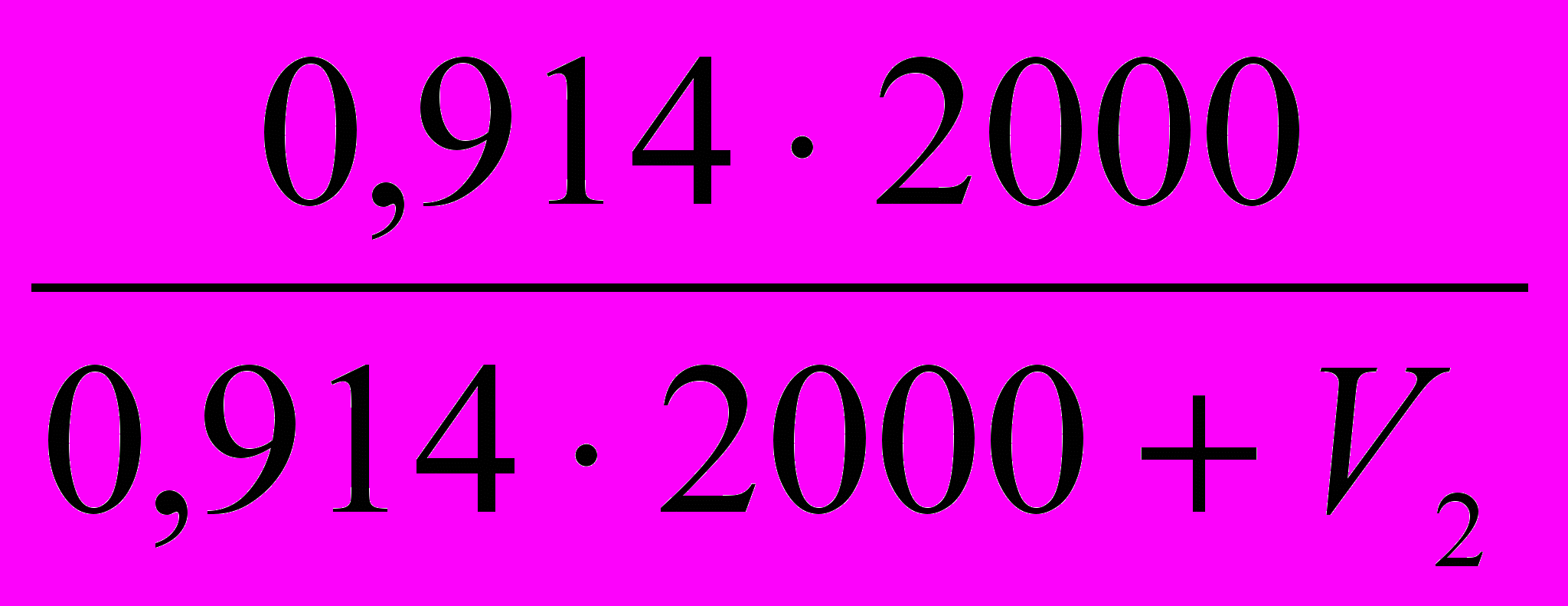 ).
).Преобразуя 0,001V2 = 4 · (
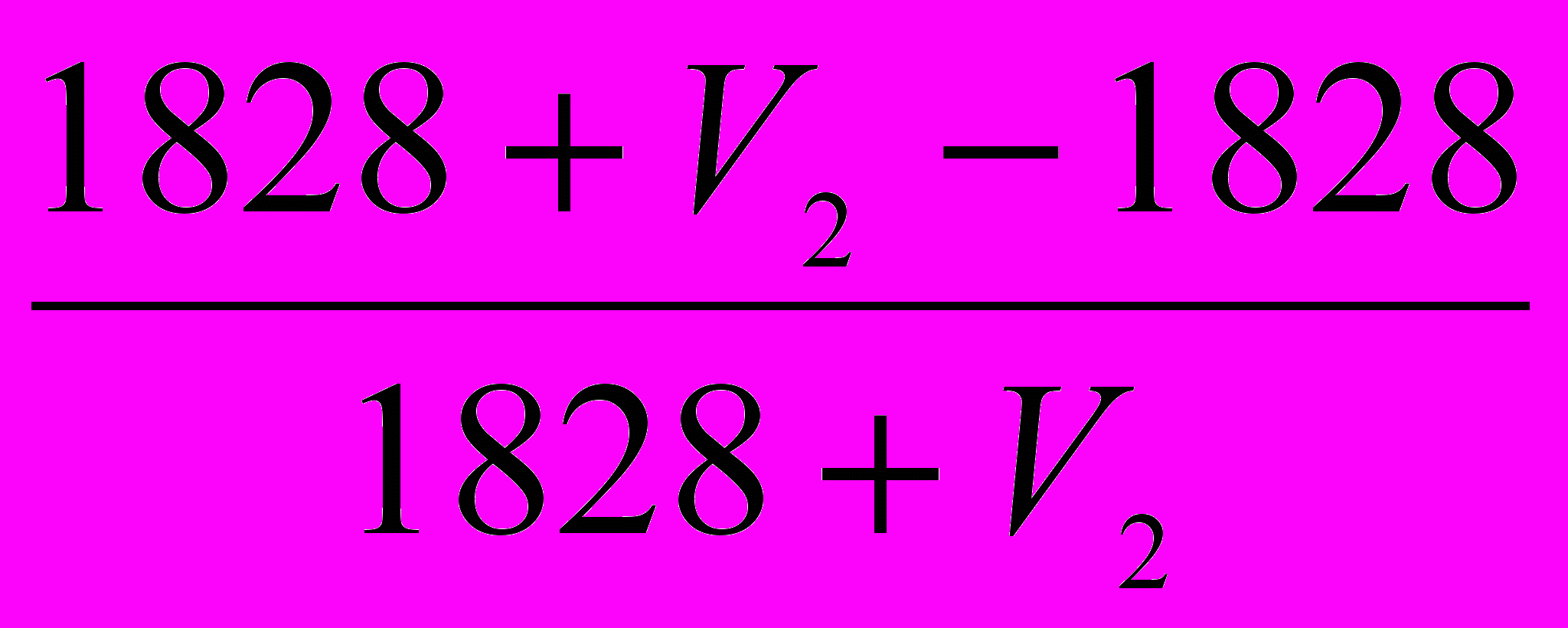 ), получается выражение
), получается выражение0,001V2· (1828+V2) = 4V2. Отсюда 1,828 + 0,001V2 = 4 и
V2=
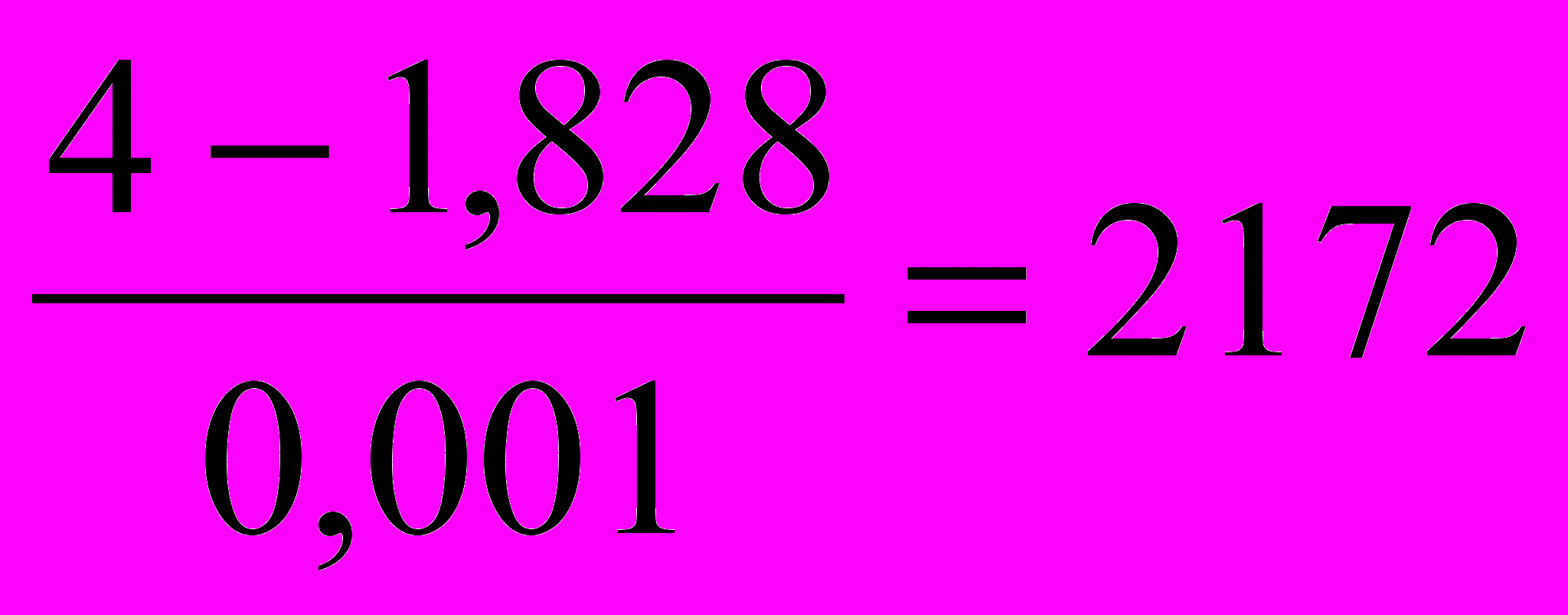 мл воды потребуется для извлечения уксусной кислоты.
мл воды потребуется для извлечения уксусной кислоты.Контрольные вопросы
62. В 5 л водного раствора находится 0,04 г йода. Какое количество йода останется в водном растворе после экстракции его 50 мл сероуглерода:
а) если экстракцию проводить однократно всем количеством CS2; б) если экстракцию проводить пятикратно порциями по 10 мл CS2? Коэффициент распределения йода для системы H2O – CS2 составляет 1,67·10-3.
63. 5 г синтезированного органического вещества оказалось растворенным в 1 дм3 воды. Вычислите массу этого соединения, экстрагируемую 50 см3 эфира за один раз, и за два раза, но по 25 см3. Коэффициент распределения вещества между эфиром и водой при комнатной температуре равен 40,0.
64. Коэффициент распределения вещества А между эфиром и водой равен 5,0. Раствор содержащий 10,0 г А в 500 мл воды обрабатывают 100 мл эфира. Какое из перечисленных значений: 2,5; 5,0; 7,5 или 12,5 г – соответствует массе вещества А, экстрагированной из воды.
65. Равновесная концентрация брома в воде составляет 0,052 моль/л, а равновесная концентрация брома в сероуглероде – 4,063 моль/л (при 250С). Определить коэффициент распределения брома для системы H2O – CS2, если в 2 л воды растворено 0,5 г брома. Сравнить количество выделенного брома методом экстракции из 3 л водного раствора 60 мл сероуглерода: 1) всем количеством экстрагента или 2) порциями по 20 мл.
66. Равновесная концентрация этилового спирта в воде составляет 0,252 моль/л, а в диэтиловом эфире – 0,356 моль/л (при 250С). Определить коэффициент распределения С2H5ОH для системы вода – диэтиловый эфир. Рассчитать количество этилового спирта, перешедшее в 25 мл диэтилового эфира из 1л 0,1М водного раствора спирта.
67. В 4 л водного раствора находится 0,3 г йода. Какое количество йода останется в водном растворе после экстракции его 60 мл хлороформа:
а) если экстракцию проводить двумя порциями хлороформа по 30 мл; б) если экстракцию проводить троекратно порциями по 20 мл экстрагента? Коэффициент распределения йода для системы вода – хлороформ составляет 7,41·10-3.
68. Равновесная концентрация этилового спирта в воде составляет 1,477 моль/л, а в четыреххлористом углероде – 0,055 моль/л (при 250С). Определить коэффициент распределения С2H5ОH для системы H2O – CCl4. Рассчитать количество этилового спирта, перешедшее в 20 мл четыреххлористого углерода из 0,5 л 0,5М водного раствора спирта.
69. 25 г синтезированного органического вещества оказалось растворенным в 1 дм3 воды. Вычислите массу этого соединения, экстрагируемого 45 см3 бензолом за один раз, и за три раза, но по 15 см3. Коэффициент распределения вещества между бензолом и водой при комнатной температуре равен 7,4.
70. Равновесная концентрация бензойной кислоты в водном растворе при 100С составляет 9·10-4 моль/л, а концентрация ее в диэтиловом эфире – 0,064 моль/л. Рассчитать коэффициент распределения для бензойной кислоты между водой и диэтиловым эфиром. Определить какое количество экстракций необходимо провести для 0,03 г бензойной кислоты в 400 мл водного раствора порциями по 5 мл диэтилового эфира, чтобы в воде осталось 1% кислоты от первоначального содержания.
71. Сколько воды потребуется для извлечения уксусной кислоты из 500 мл 0,1М раствора уксусной кислоты в амиловом спирте, если ее концентрация в водном растворе должна быть доведена до 0,05 моль/л? Коэффициент распределения уксусной кислоты между амиловым спиртом и водой равен 0,914.
72. Бензольный раствор, содержащий 0,5 г/л Hg2Cl2, экстрагируется водой порциями по 20 мл. Сколько раз необходимо проводить экстракцию, чтобы остаток соли в исходном растворе составил 1% от первоначального количества, если К= Свода/Сбензол=0,084?
73. При 200С коэффициент распределения брома между водой и сероуглеродом К=0,0125. Какой объем сероуглерода CS2 необходим для извлечения 90% брома из 5л 0,05М водного раствора при однократном экстрагировании?
74. Коэффициент распределения йода между водой и сероуглеродом составляет 0,0017. Водный раствор (содержащий 1 кг йода в 1 м3 воды) интенсивно перемешивают с сероуглеродом. Определить количество йода (в процентах от первоначального содержания), оставшееся в водном растворе, если перемешивать с 0,005м3 и 0,05м3 сероуглерода последовательно.
75. 0,012 м3 водного раствора с концентрацией 0,015 кмоль/м3 смешали с 0,02 м3 бензола. Коэффициент распределения бромида ртути между водой и бензолом составляет К=Свода/Сбензол=0,9. определите, насколько изменилась концентрация бромида ртути в воде при достижении равновесия.
