Физическая
| Вид материала | Рабочая программа |
- Методика подбора средств профессионально-прикладной подготовки. Основные факторы, определяющие, 46.84kb.
- Рабочая программа дисциплины физическая культура Степень выпускника, 873.87kb.
- Основная образовательная программа высшего профессионального образования Направление, 4490.7kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Программа аттестационных испытаний Факультет Физической культуры Бакалавриат по направлению, 289.66kb.
- Лекция 1 Физическая картина природы и ее «изобразительные средства», 164.13kb.
- М. К. Аммосова Институт физической культуры и спорта рабочая программа, 78.29kb.
- Программа дисциплины «Физическая культура» Утверждена умс председатель, 83.66kb.
- Тематический план 1 по дисциплине «Физическая культура», 404.41kb.
- Условия проведения конкурса знатоков по специальности Физическая культура для лиц, 27.28kb.
Контрольные вопросы
47.На основе закона действия масс определите как изменится скорость указанных простых реакций при изменении условий эксперимента.
2NO + Cl2 2NOCl
а) при увеличении NO в 3 раза;
б) при уменьшении Cl2 в 2 раза;
в) при сжатии смесей в 2 раза;
г) при двукратном разбавлении смеси при постоянном давлении.
48. Условие то же, что в задаче №51 :
H2 + 2 NO N2O + H2O
а) при увеличении H2 в 4 раза;
б) при уменьшении NO в 4 раза;
в) при увеличении объема в 2 раза;
г) при сжатии смеси в 2 раза.
49. Определите температурный коэффициент реакции, если с повышением температуры на 50о С скорость реакции возросла в 625 раз?
50. В системе: CO + Cl2 COCl2 концентрацию СО увеличили с 0,03 до 0,12 моль/л, а концентрацию Cl2 от 0,02 до 0,06 моль/л. Во сколько раз возросла скорость реакции? Ответ: в 12 раз.
51. Константа равновесия реакции FeOг + COг Feт + СО2 г при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если их начальные концентрации составляли: СОисх=0,05 моль/л, СО2исх=0,01 моль/л. Ответ: 0,04 моль/л; 0,02 моль/л.
52. Определите начальные концентрации реагентов, если равновесные концентрации NOp,O2р,NO2р при некоторой температуре равны 0,5 моль/л, а начальная концентрация NO2исх равна нулю. NOисх.=0,75 моль/л; O2исх.=1 моль/л.
53. Изменение энергии Гиббса (G0298) в реакции образования воды Н2(г) + 0,5 О2(г) = Н2О(г) равно -228,6 кДж/моль. Вычислите константу равновесия при стандартной температуре. Ответ: 1040.
54. Константа равновесия реакции 4HCl(г) + О2(г) = 2Н2О(г) + 2Cl2(г) при 250С равна 2,3 1013. Вычислите G0 реакции. Ответ: -76,26 кДж/моль.
55. Пользуясь константой равновесия определите в каком направлении идет реакция: Zn + CuSO4 = Cu + ZnSO4..
57. Вычислите константу равновесия для реакции: Fe + CuSO4=FeSO4 + Cu. Ответ: 26,4.
58. Равновесие в системе H2/г/ + I2/г/ = 2HI/г/ установилось при концентрациях: Н2р=0,025 моль/л, I2р=0,005 моль/л и HIр=0,09 моль/л. Определите исходные концентрации йода и водорода. Ответ: 0,05 моль/л; 0,07 моль/л.
59. Рассчитайте константу равновесия реакции: 2Cl2/г/ + 2Н2О/г/4HCl/г/ + О2/г/ пользуясь справочными данными G. Ответ: 3,42.
60. Рассчитайте константу равновесия реакции: 2SO3/г/2SO2/г/+О2/г/., пользуясь справочными данными G. Ответ: 4,04.
61. Рассчитайте константу равновесия реакции : 4NH3/г/ + 5О2/г/6Н2О/г/ + 4NO/г/, пользуясь справочными данными G. Ответ: 6,6.
62. Константа равновесия реакции С(графит) + Н2О(г)СО(г) + Н2(г) при температуре 250С равна 7,8 10-17. Вычислите G0298 реакции. При какой температуре начнется течение реакции в прямом направлении.? Ответ:91,92 кДж/моль; 6870К.
63. Равновесие реакции 4HCl(г) + О2(г) 2Н2О(г) + 2Cl2(г) при нормальных условиях установилось при следующих концентрациях реагирующих веществ:Н2О=0,14 моль/л; Cl2=0,14 моль/л; HСl=0,20 моль/л; О2=0,32 моль/л. Вычислите стандартную энергию Гиббса.
64. Рассчитайте энергию активации, если при увеличении температуры с 200 до 500 К константа скорости возросла в 100 раз. Ответ: 12,73 Дж/моль.
65.Рассчитайте изменение константы скорости реакции при увеличении температуры от 200 до 500 К, если энергия активации равна 11,6 кДж/моль. Ответ: в 66 раз.
66. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз. Температурный коэффициент равен 2,7. Ответ : 45,30 с.
67. Вычислите при какой температуре реакция закончится за 45 мин, если при 293 К на это требуется 3 ч. Температурный коэффициент скорости реакции равен 3,2. Ответ: 304,9 К.
68. При 393 К реакция заканчивается за 18 мин. Через сколько времени эта реакция закончится через 453 К, если температурный коэффициент скорости реакции равен 3. Ответ: 1,5 сек.
69. Реакция разложения пентахлорида фосфора протекает по уравнению
РСl5 ( г ) = РСl3 ( г ) + Сl2 ( г ) Н = + 92,59 кДж
Как надо изменить а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции разложения РСl5.
70. Как влияет на равновесие гетерогенной системы
С( к ) + СО2( г ) 2 СО( г ) Н = + 119,8 кДж
а) добавление СО2( г ); б ) добавление С( к ); в) повышение температуры; г) повышение давления; д) введение катализатора; е) удаление СО( г ) ?
71. Почему изменение давления смещает равновесные системы
N2 + 3 H2 2NH3
72. В каком направлении будут смещаться равновесия с повышением температуры и давления для следующих обратимых реакций
2 SO2 + O2 2 SO3 ; H0298 = - 196,6 к Дж
N2 + O2 2 NO ; H0298 = + 180,7 к Дж
3O2 2 O3 ; H0298 = + 184,6 к Дж
73. Как повлияет понижение температуры и давления на равновесие следующих обратимых реакций
N2 O4 2 NO2 ; H0298 = + 58,4 к Дж
N2 + 3 H2 2 NH3 ; H0298 = - 92,4 к Дж
2 NO + O2 2 NO2 ; H0298 = - 113,0 к Дж
74. Как повлияет изменение давления и температуры на равновесие следующих обратимых реакций
2 СO СO2 + С ; H0298 = - 172,5 к Дж
2 Н2 S 2 SH2 + S2 ; H0298 = + 169,4 к Дж
2 H Cl + O2 2 H2O( г ) + Cl ; H0298 = - 114,5 к Дж
75. В каких обратимых реакциях изменение давления не вызовет нарушения равновесия:
2 SO2 + O2 2 SO3 ;
4 HСl + O2 2 H2O + 2 Cl 2 ;
CH3COOH + C2H5OH CH3 COOC2 H5 + H2O ;
MgCO3 MgO + CO2 ;
H2 + J2 2 HJ .
ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Различают 2 основные группы проводников электрического тока: проводники I рода, электрическая проводимость которых обусловлена электронами (металлы, графит), и проводники II рода, обладающие проводимостью за счет движения ионов (расплавы и растворы электролитов).
Величина, характеризующая способность вещества проводить электрический ток под действием внешнего электрического поля, называется электрической проводимостью (L) – она является обратной электрическому сопротивлению проводника (R). Измеряется в сименсах: См = Ом –1.
Если

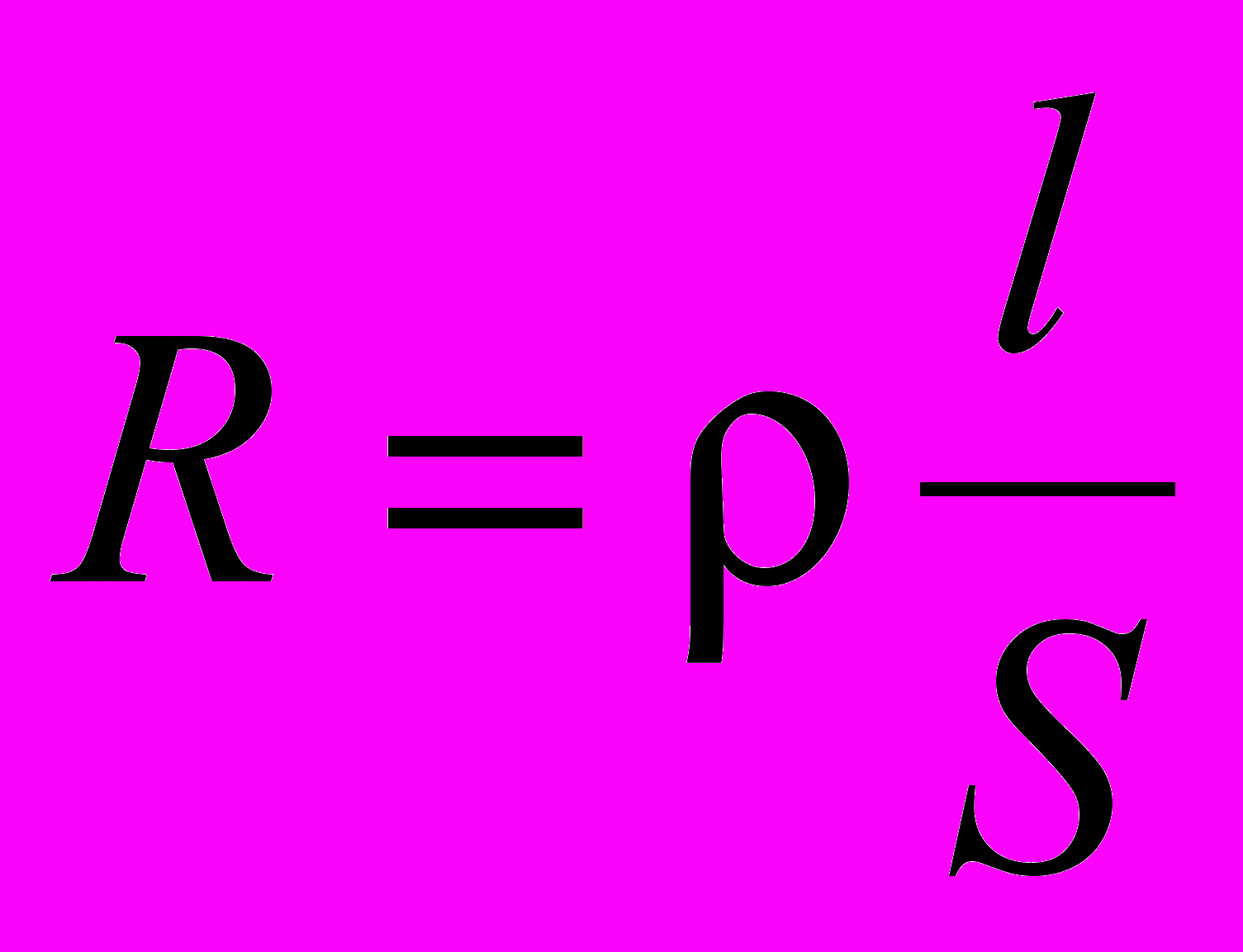 , то
, то 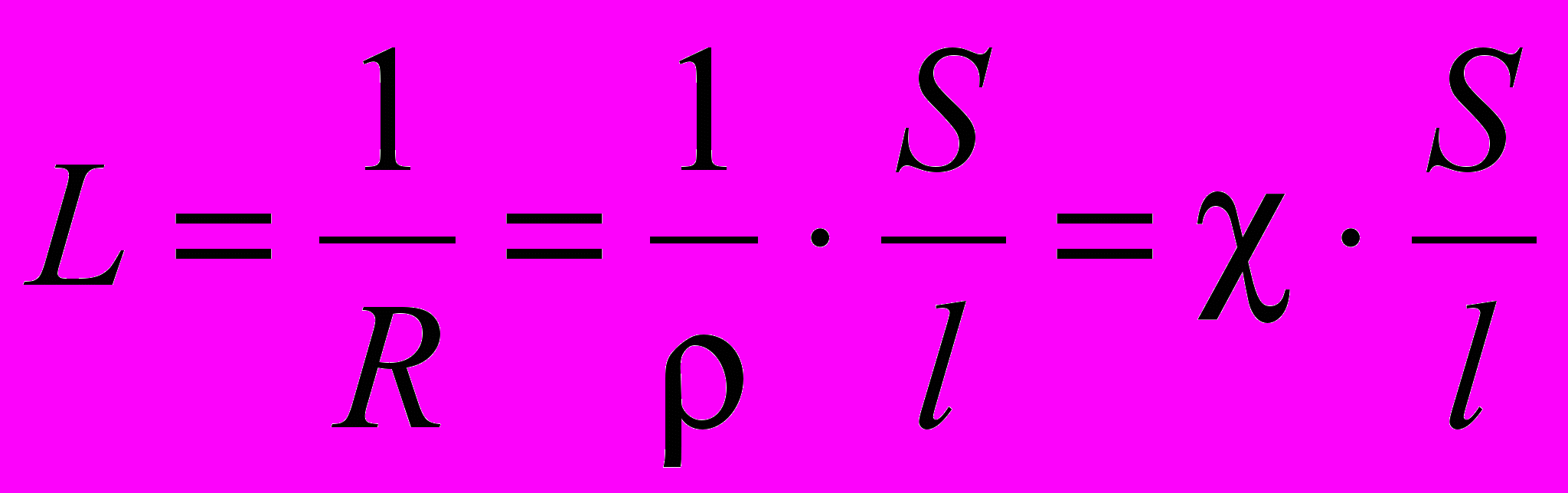 , где ρ – удельное сопротивление, Ом·м; χ – удельная электрическая проводимость, См/м; S – площадь сечения проводника, м2; l – длина проводника, м.
, где ρ – удельное сопротивление, Ом·м; χ – удельная электрическая проводимость, См/м; S – площадь сечения проводника, м2; l – длина проводника, м.Для оценки проводимости растворов и влияния на нее различных факторов применяют две величины: удельную χ и молярную λм (или эквивалентную λэ) электрическую проводимость.
Удельной электрической проводимостью χ (См·см-1) называют электропроводность раствора, находящегося между параллельными электродами площадью 1 см2, расположенными на расстоянии 1см.
χ = α · с · F·(z+u+ + z – u --), где
α – степень диссоциации электролита; с – концентрация электролита, экв/см3; F–число Фарадея (96500 Кл); u+ , u -- - электрическая подвижность ионов (или абсолютная скорость ионов) м2/В·с; z+ , z -- - заряд катионов и анионов.
Сравнение скоростей движения различных ионов производится при напряженности электрического поля 1 В/м.
При повышении температуры электролита возрастает подвижность ионов и удельная электрическая проводимость:
χ2 = χ1 · [1 + γ (T2 – T1)], где
γ – температурный коэффициент электрической проводимости (для сильных кислот 0,016, для сильных оснований 0,019 и для солей в водных растворах 0,022).
Молярная электрическая проводимость – мера электропроводимости всех ионов, образующихся при диссоциации 1 моль электролита при данной концентрации. Она численно равна электрической проводимости такого объема раствора (V, см3), в котором содержится 1 моль растворенного электролита, причем электроды находятся на расстоянии 1 см друг от друга.
λм = χ · V =
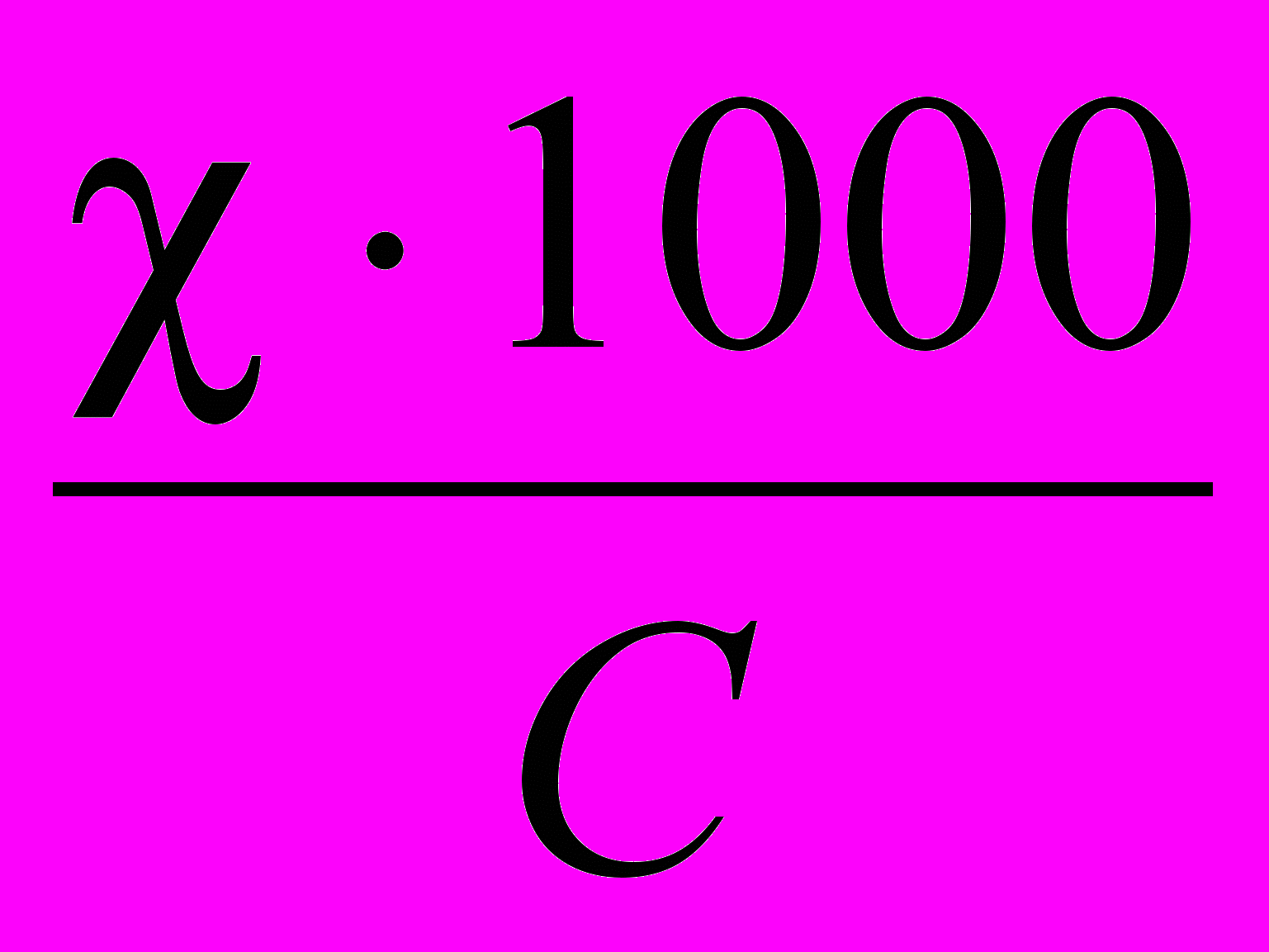 , где
, где λм- молярная электрическая проводимость, См·см2/моль; χ - удельная электрическая проводимость, См/см; V – разведение раствора см3/моль; С – молярная концентрация, моль/л.
С увеличением разведения молярная электрическая проводимость возрастает и в области больших разведений стремится к предельному значению λм∞.
λм∞ = z · F · (u+∞ + u - ∞).
Произведения zFu+∞=λм+∞ и zFu-∞=λм-∞ называются предельными молярными проводимостями, или предельными подвижностями катионов и анионов. Следовательно:
λм∞ = λм+∞ + λм-∞,
т.е. величина молярной электрической проводимости бесконечно разбавленного раствора электролита равна сумме предельных подвижностей катионов и анионов. Это соотношение называется законом независимого движения ионов (закон Кольрауша).
Предельная подвижность ионов зависит только от природы растворителя и температуры.
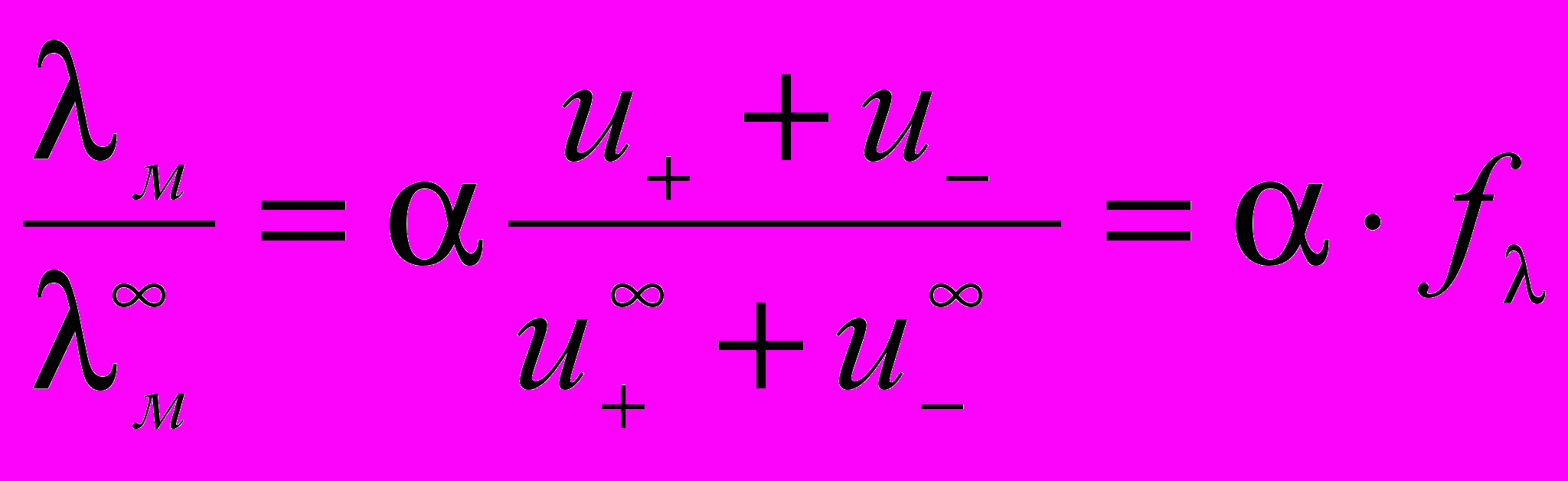 , где
, где fλ – коэффициент электрической проводимости.
Для слабых электролитов fλ=1 и λм/λм∞ = α, а для сильных электролитов α = 1, поэтому для них λм/λм∞ = fλ..
Согласно представлениям теории Дебая – Хюккеля, в концентрированных растворах сильных электролитов вокруг каждого иона существует оболочка из противоионов. При движении иона в электрическом поле наличие его оболочки вызывает появление двух эффектов, тормозящих движение иона в растворе:
электрофоретический эффект – оболочка стремиться перемещаться в противоположную сторону, что замедляет движение самого иона;
релаксационный эффект – в процессе движения иона его оболочка деформируется, так что с одной стороны от иона создается избыток отрицательных зарядов, а с другой стороны – дефицит. Следовательно, возникает поле, ослабляющее внешнее электрическое поле.
С ростом концентрации сильного электролита взаимодействие ионов увеличивается, и поэтому молярная проводимость снижается.
λС = λ∞ - (∆λЭ + ∆λР), где
молярная проводимость при данной концентрации λС всегда меньше проводимости бесконечно разбавленного раствора λ∞ за счет эффектов электрофоретического и релаксационного торможения.
Зависимость молярной электрической проводимости от концентрации для электролита, образованного однозарядными ионами выражается уравнением Онзагера:
λС = λ∞ - (А + В ·λ∞)·
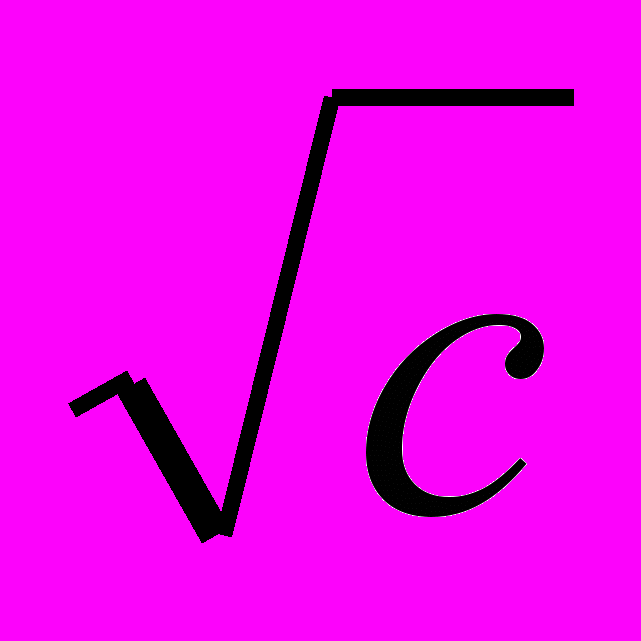
 ,
,А и В – константы, полученные с учетом сил электрофоретического и релаксационного торможения и зависящие от температуры, вязкости раствора и диэлектрической проницаемости растворителя.
Для разбавленных растворов (до 2·10-2 моль/л) зависимость λм от концентрации для электролитов, образованных однозарядными ионами была экспериментально установлена Кольраушем:
λм = λм∞ - А ·
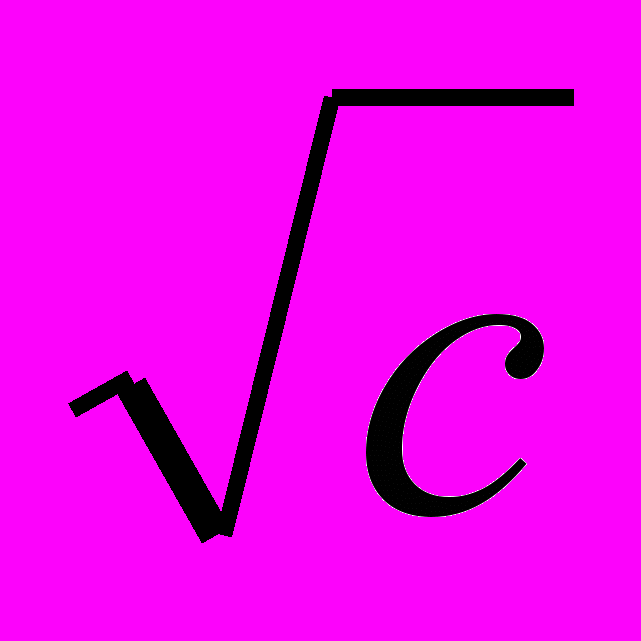
 , где
, гдеА – константа, полученная с учетом электрофоретического и релаксационного торможения.
Зависимость λм -
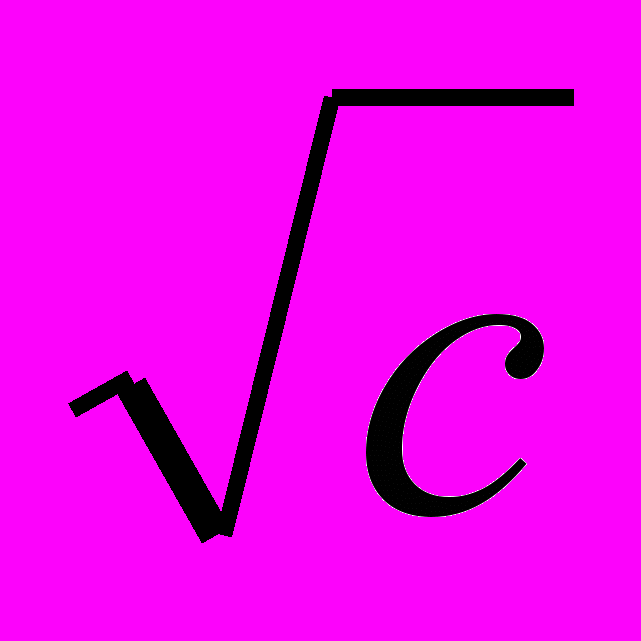 линейна, что позволяет рассчитать для сильных электролитов λм∞ экстраполяцией графика λм = f(
линейна, что позволяет рассчитать для сильных электролитов λм∞ экстраполяцией графика λм = f(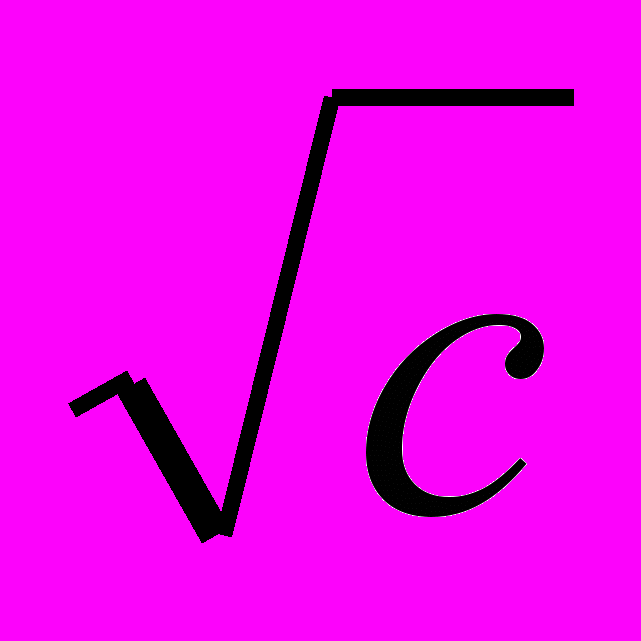 ) до С=0.
) до С=0.Исследования, основанные на измерении электрической проводимости электролитов, проводятся с помощью кондуктометрических методов. Удельная электрическая проводимость раствора пропорциональна проводимости L, измеряемой с помощью кондуктометра:
χ = К·L, где
К – константа кондуктометрической ячейки (см-1), представляющей собой стеклянный сосуд с вмонтированными электродами. Величина К определяется площадью электродов S (см2) и расстоянием между ними l (см) и зависит от формы сосуда и объема раствора.
Кондуктометрия используется для определения степени и константы диссоциации слабых электролитов, константы гидролиза солей, растворимости труднорастворимых соединений и произведения растворимости солей.
Степень диссоциации электролита рассчитывается по формуле:
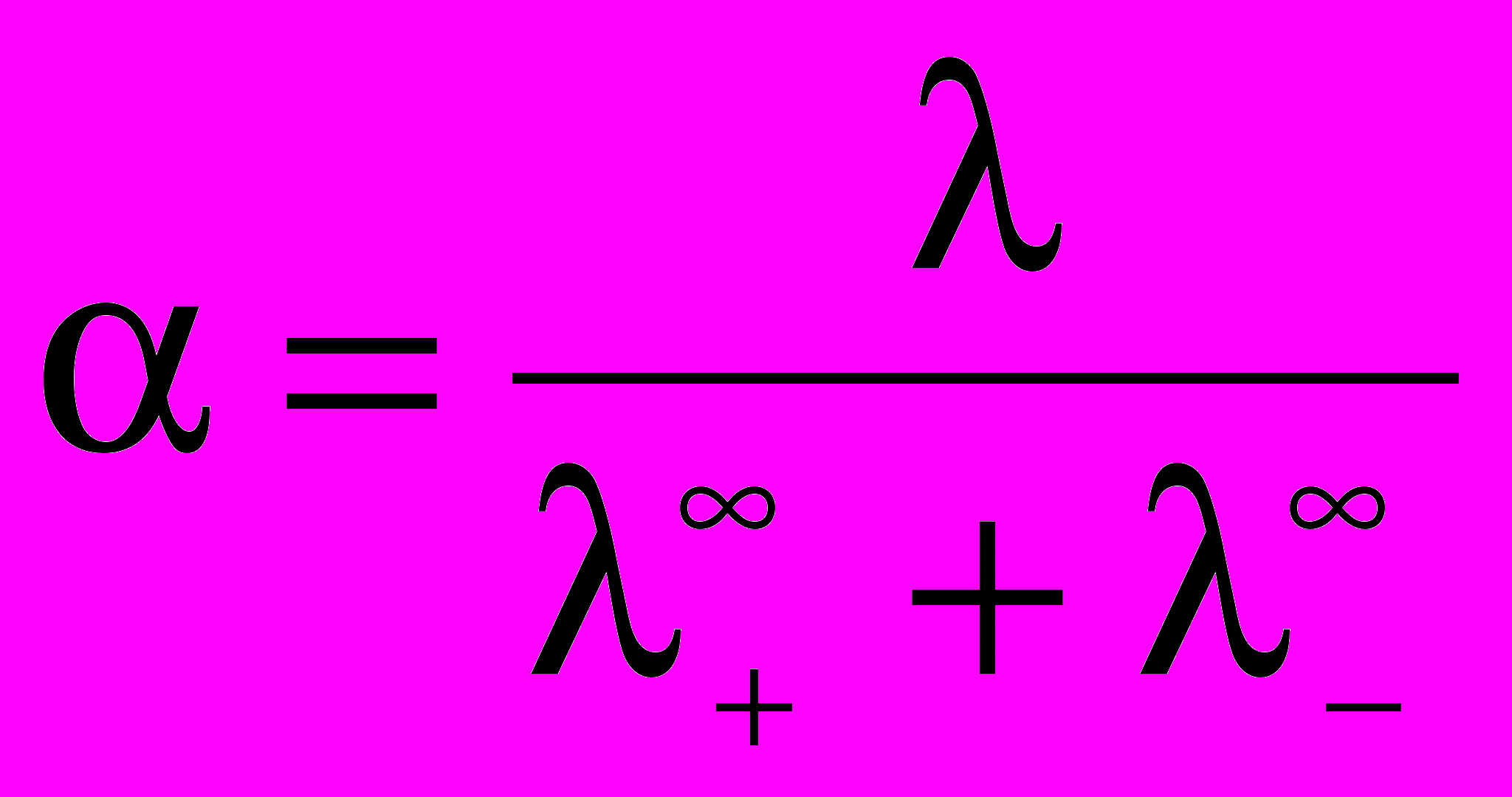

Константа диссоциации для бинарного электролита по закону разбавления Оствальда:
Кдис=
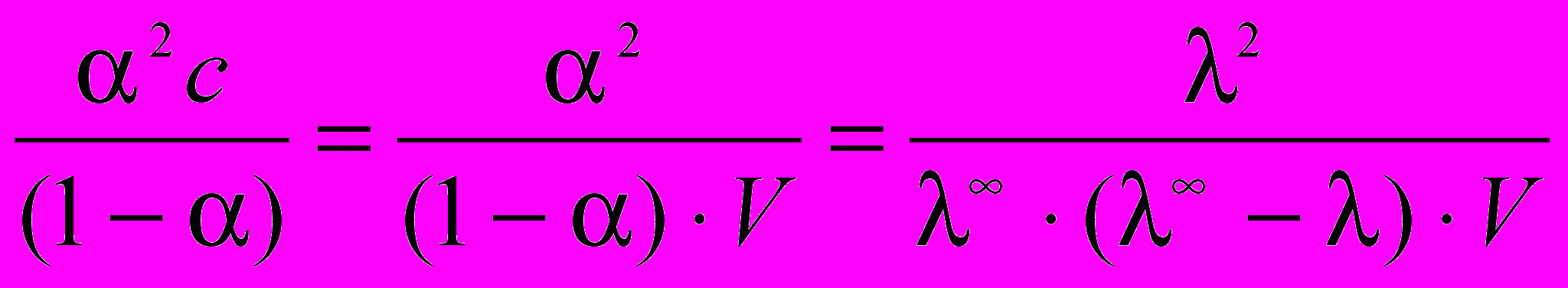 , где
, гдеV – разведение раствора см3/моль; С - молярная концентрация моль/л.
Пример 1. Вычислить степень и константу диссоциации уксусной кислоты при 250С и разведении 20 л, если удельная электрическая проводимость 0,05 моль/л раствора CH3COOH составляет 3,62ּ10ˉ4 См/см, а предельная молярная электрическая проводимость ионов H+ и CH3COO‾ соответственно равна 349,8 и 40,9 См·см2/моль.
Решение. В первую очередь определяется концентрация и молярная электрическая проводимость раствора:

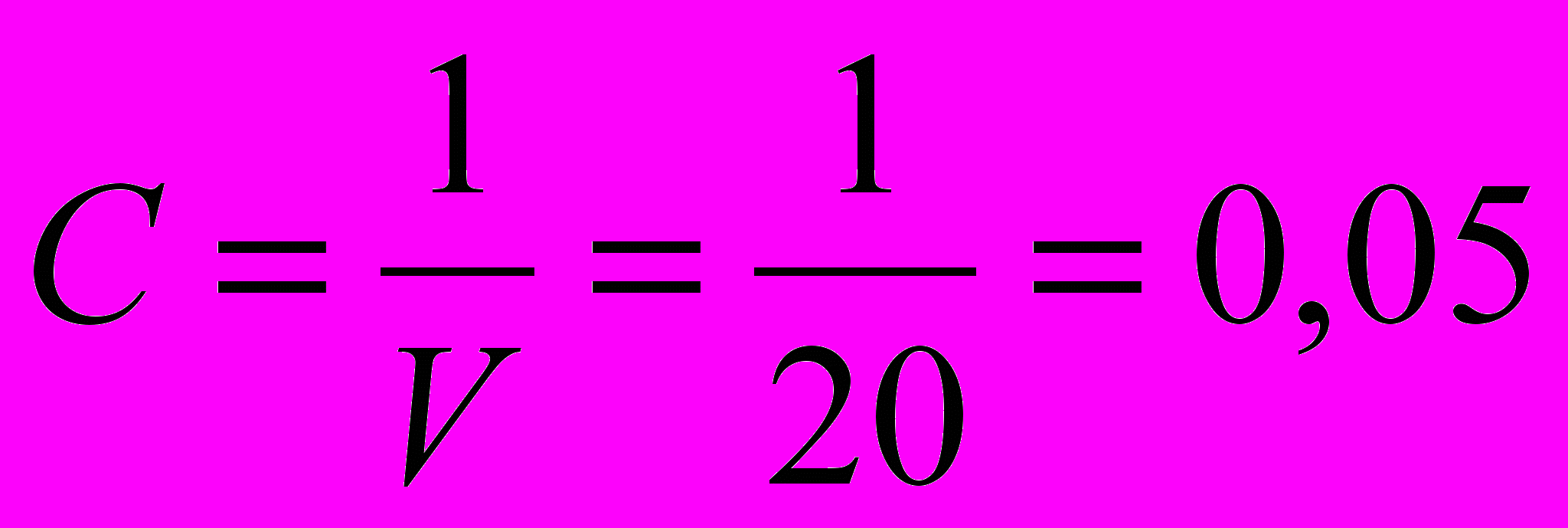 моль/л
моль/лλм =
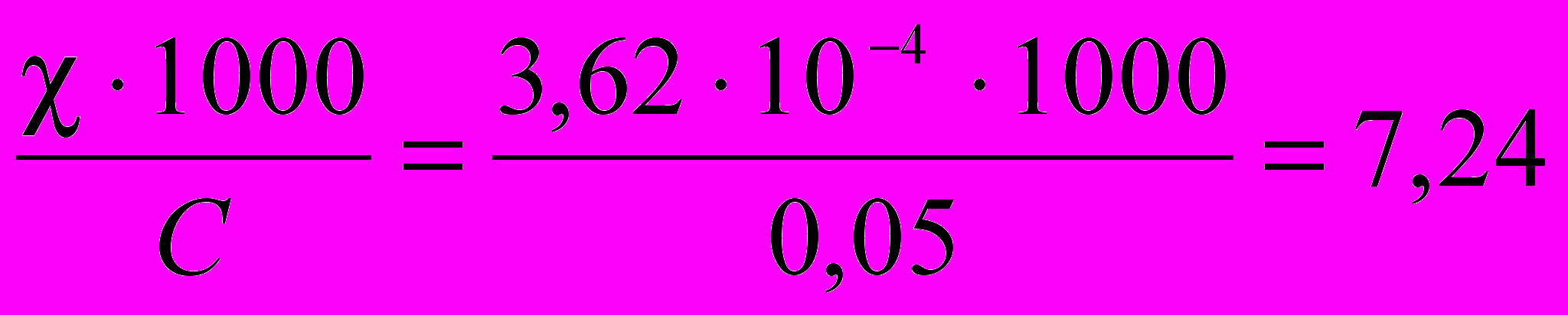 См·см2/моль.
См·см2/моль.Используя закон независимого движения ионов Кольрауша, вычисляется величина молярной электрической проводимости бесконечно разбавленного раствора электролита:
λм∞ = λм+∞ + λм-∞=349,8 + 40,9 = 390,7 См·см2/моль.
Степень диссоциации раствора кислоты в данных условиях равна:
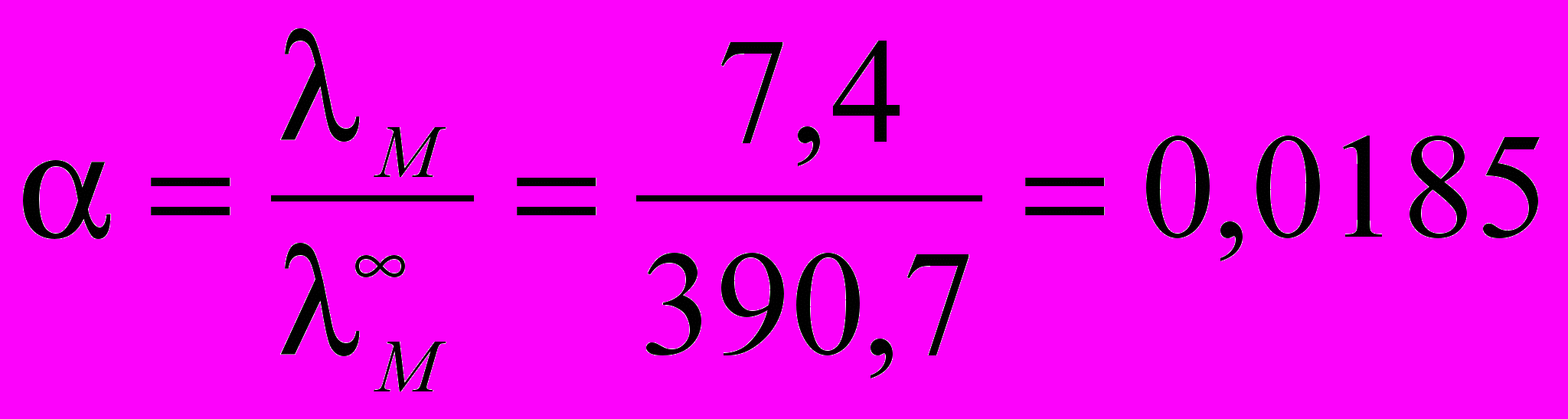 ;
;Константа диссоциации соляной кислоты при 250С составляет:
Кдис=
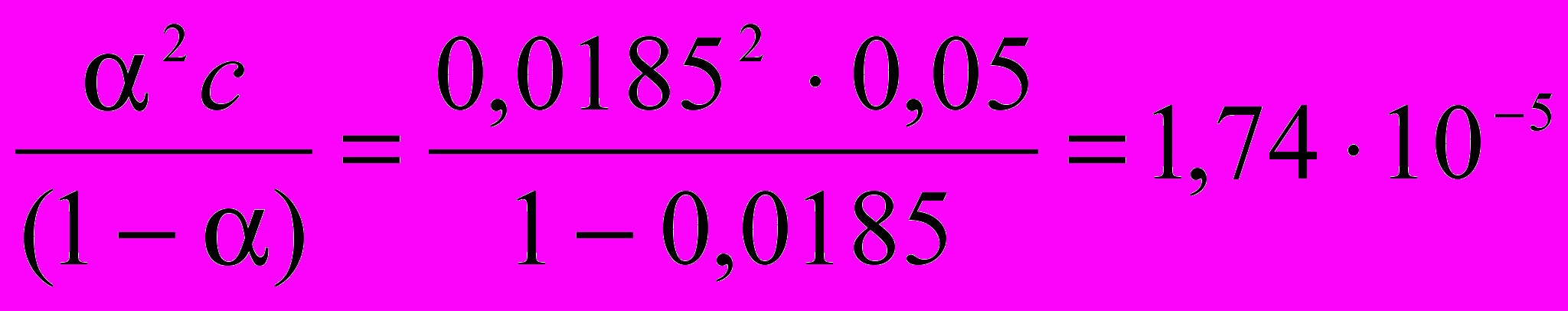 .
.Пример 2. Удельная электрическая проводимость насыщенного раствора хлорида серебра при 250С составляет 3,41·10‾6 См/см. Вычислите произведение растворимости AgCl, если известно, что удельная электрическая проводимость воды при 250С равна 1,6·10‾6 См/см и предельные подвижности ионов λAg+∞=61,9 См·см2/моль, λCl-∞=76,3 См·см2/моль.
Решение. Удельная электрическая проводимость насыщенного раствора труднорастворимой соли χр-ра можно представить как сумму удельных проводимостей соли и воды:
χр-ра = χсоли + χводы .
Следовательно, молярная проводимость насыщенного раствора AgCl:
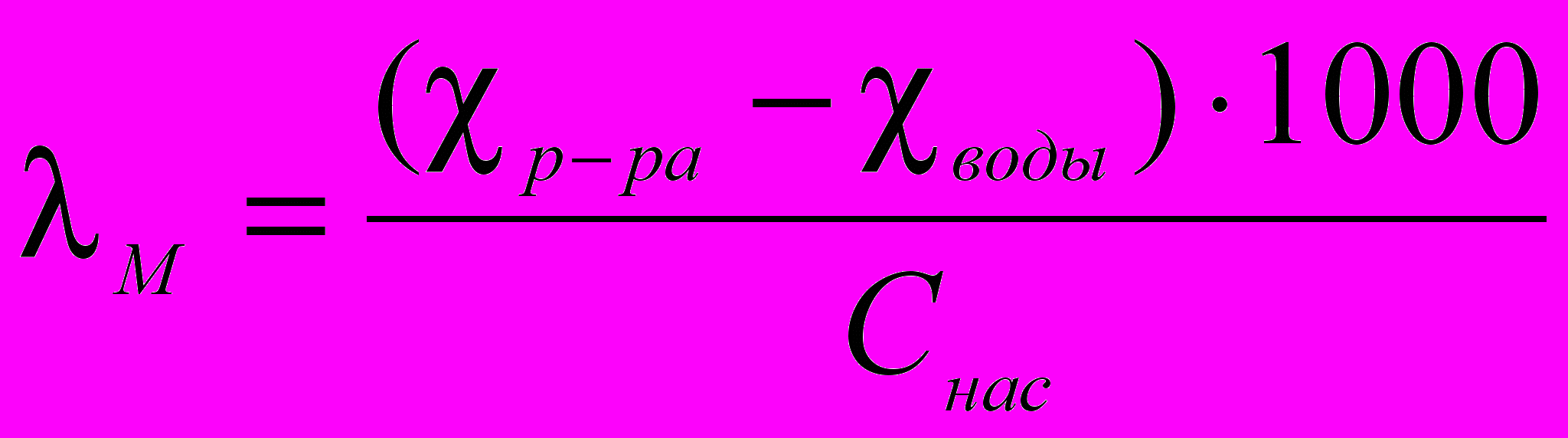 , где Снас – растворимость соли, моль/л.
, где Снас – растворимость соли, моль/л.Поскольку в растворе труднорастворимой соли концентрация ионов очень мала, можно принять, что молярная электрическая проводимость λм раствора равна предельной молярной электрической проводимости λм∞.
Таким образом, растворимость соли может быть рассчитана:
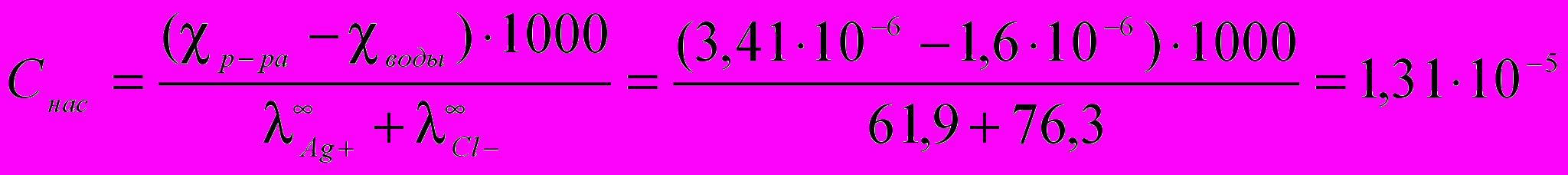 моль/л.
моль/л.Произведение растворимости хлорида серебра рассчитывается по формуле:
ПРAgCl= [Ag+]·[Cl¯]= Cнас2= (1,31·10-5)2 = 1,72·10-10.
Контрольные вопросы
76. Электрическая проводимость 0,01 моль/л раствора хлорида калия при 250С равна 0,0034См. Удельная проводимость этого раствора 1,41·10-3См/см. Чему равна постоянная кондуктометрической ячейки? Во сколько раз увеличится удельная электрическая проводимость раствора, если повысить температуру на 100С?
77. Сопротивление кондуктометрической ячейки, содержащей 0,1 моль/л раствора KCl составляет 1,16 Ом. Удельная электрическая проводимость этого раствора равна 1,29·10-2 См/см. Сопротивление другого раствора в этой же ячейке равно 15 Ом. Чему равна удельная электрическая проводимость второго раствора?
78. Молярная электропроводность хлората серебра AgClO3 для ряда концентраций приведена в таблице. Найдите предельную молярную электропроводность этого соединения.
| №№ | С, моль/л | λм, См·см2/моль |
| 1 | 0,0010256 | 123,43 |
| 2 | 0,0013694 | 122,94 |
| 3 | 0,0029782 | 121,14 |
| 4 | 0,0032500 | 120,95 |
79. Молярная проводимость водного 0,03M раствора амида азотной кислоты H2N2O2 при 150С составляет 1,017 См·см2/моль. Предельные подвижности ионов равны: λН+∞=298См·см2/моль; λNa+∞=39,9См·см2/моль; λ∞=93См·см2/моль (для NaHN2O2). Вычислите константу диссоциации амида азотной кислоты в соответствии с уравнением H2N2O2 ↔ H+ + HN2O2‾ .
80.Постоянная кондуктометрической ячейки К= 0,41 см‾1 . Электрическая проводимость 0,02 моль/л раствора уксусной кислоты при 250С составляет 5,8ּ10ֿ4См. Определите молярную электрическую проводимость раствора и степень диссоциации CH3COOH, если предельные подвижности ионов H+ и CH3COO‾ соответственно равны 349,8 и 40,9 См·см2/моль.
81. Молярная электропроводность азотной кислоты HNO3 для ряда концентраций при 180С приведена в таблице. Найдите предельную молярную электропроводность этого соединения.
| №№ | С, моль/л | λм, См·см2/моль |
| 1 | 0,001 | 375 |
| 2 | 0,005 | 371 |
| 3 | 0,01 | 368 |
| 4 | 0,05 | 357 |
| 5 | 0,1 | 350 |
82. Удельная электрическая проводимость раствора муравьиной кислоты при 250С и при разведении 64 л составляет 6,75·10‾2 См/м, а предельные подвижности ионов H+ и CHOO‾ соответственно равны 349,8ּ10ˉ4 и
54,6 ּ10ˉ4 См·м2/моль. Определите константу диссоциации муравьиной кислоты и удельную электрическая проводимость раствора при 300С.
83.Произведение растворимости сульфата бария 1,3·10-10.Вычислите удельную электропроводность насыщенного раствора BaSO4, если предельные подвижности ионов Ba2+ и SO42‾ соответственно равны 127,26 и 160,04 См·см2/моль. Удельная электропроводность воды составляет 1,3·10-6См/см.
84.Найдено, что при 250С насыщенный раствор ферроцианата кобальта Co2[Fe(CN)6] имеет удельную электрическую проводимость 2,06·10-6 См/см, в то время как удельная электропроводность воды была 4,1·10-7 См/см. Подвижность иона Со2+ равна 86 См·см2/моль и иона [Fe(CN)6]4- равна 402 См·см2/моль. Определить растворимость соли Co2[Fe(CN)6] в воде.
85. Электрическая проводимость 0,02 моль/л раствора хлорида калия при 250С равна 5,04·10-3 См. Удельная проводимость этого раствора 2,77·10-3См/см. Чему равна постоянная кондуктометрической ячейки? Во сколько раз увеличится удельная электрическая проводимость раствора, если повысить температуру на 150С?
86.Удельная электрическая проводимость 0,1М раствора этиламина при 250С составляет 1,5·10‾3 См/см. Предельная молярная электропроводимость равна 204 См·см2/моль. Определите степень диссоциации и константу диссоциации C2H5NH2.
87 Молярная электрическая проводимость 0,05М раствора гидроксида натрия при 180С равна 190 См·см2/моль. Определите удельную электрическую проводимость этого раствора при 250С.
88. Молярная электропроводность соляной кислоты HСl для ряда концентраций при 180С приведена в таблице. Найдите предельную молярную электропроводность этого соединения. Определите степень и константу диссоциации 0,01М раствора HCl.
| №№ | С, моль/л | λм, См·см2/моль |
| 1 | 0,001 | 377 |
| 2 | 0,005 | 373 |
| 3 | 0,01 | 370 |
| 4 | 0,05 | 360 |
| 5 | 0,1 | 351 |
89. Произведение растворимости карбоната кальция 5·10-9.Вычислите удельную электропроводность насыщенного раствора CaCO3, если предельные подвижности ионов Ca2+ и CO32‾ соответственно равны 119,0 и 138,6 См·см2/моль. Удельная электропроводность воды составляет 1,0·10-6См/см.
90. 0,001М раствор нитрата цезия при 180С имеет удельную электрическую проводимость 1,27·10-4См/см. Ионная проводимость NO3¯ в этих условиях равна 60,4 См·см2/моль. Определите молярную проводимость раствора CsNO3 и подвижность (ионную электропроводимость) иона Cs+.
Электродные потенциалы и электродвижущие силы
Пример 1. Рассчитайте стандартную ЭДС элемента, в котором при 298 К протекает реакция по уравнению Н2 + 1/2О Н2О.
Решение. Стандартная ЭДС элемента Е0 определяется уравнением
Е0298 = - G0298,
nF
где G - стандартная энергии Гиббса реакции;
nF - количество электричества, которое теоретически можно получить при электрохимическом превращении одного моля вещества;
F - число Фарадея; F = 96500 Кл/моль = 96500 (Дж/моль В).
G0298 = G0обрН2О- 1/2 G0обрО2 - G0обрН2;
G0обрН2О = 237,4 кДж /моль; G0обрН2 = G0обрО2 = 0;
G0 = - 237,4 - 0 - 0 = 237,4 к Дж/ моль.
В соответствии с законом Фарадея при окислении одного моля водорода через электрод протекает два числа Фарадея электричества (1F=96500Кл), следовательно,
Е0298 = - - 237, 4 103 Дж / моль = 1,23 В
2 96,5 103 Дж/ моль В
Пример 2. Рассчитайте ЭДС элемента, в котором при 298К установилось равновесие Zn + 2Ag+ Zn2+ + Ag; aZn2+= 0,01 моль/л; а Ag+ = 10 моль/ л. Напишите электронные уравнения электродных процессов.
Решение. ЭДС элемента равна разности потенциалов положительного и отрицательного электродов. Из табл. 1 приложения видно, что положительным будет серебряный, а отрицательным - цинковый электрод. На электродах:
на катоде Ag+ + e Ag,
на аноде Zn - 2e Zn 2+ .
Потенциалы металлических электродов по уравнению Нернста равны
Меn+ /Me = 0 Меn+ /Me + 2,3 RT lg aМеn+
nF .
Подставляя в уравнение значения 0 из табл. 1 приложения и значения R, T, F, получаем:
Zn2+ /Zn = - 0,76 + 0,059 lg 10-2 = - 0,82 B;
2
Ag+ /Ag = + 0,80 + 0,059/2 lg 10-3 = +0,62 B;
E = Ag+ /Ag - Zn2+ /Zn = 1,44 В.
Контрольные вопросы
91. Составьте схемы двух гальванических элементов, в одном из которых кадмий является анодом, а в другом - катодом. Напишите уравнения электродных процессов и вычислите ЭДС каждого элемента.
92. Составьте схему, напишите уравнения электродных процессов и рассчитайте ЭДС элемента, состоящего из медной и кадмиевой пластин, опущенных в раствор собственных ионов Сcu2+=0,1 и CCd2+=0,1 моль/л. Изменится ли ЭДС, если концентрация каждого вида ионов увеличится в 10 раз? Ответ: Е=0,74 В.
93. Какой должна быть концентрация цинка в растворе, чтобы элемент
(-)Mg/Mg2+//Zn2+/Zn (+) при СMg2+ = 1 моль/л имел ЭДС = 1,6 В? Ответ: 0,1 моль/л.
94. Определите значение электродного потенциала меди, погруженной в 0,0005н раствор Cu(NO3)2. Ответ: 0,231 В.
95. Вычислите потенциал железного электрода, опущенного в раствор, содержащий 0,0699 г FeCl2 в 0,5 л. Ответ: -0,5289 В.
96. Составьте схему гальванического элемента, образованного железом и свинцом, погруженными в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса. Ответ: 0,314 В; -60,6 кДж.
97. Вычислите ЭДС и изменение стандартной энергии Гиббса для гальванического элемента, образованного магнием и цинком, погруженными в растворы их солей с концентрацией ионов (моль/л) СMg2+= 1,810-5, СZn2+= 2,510-2. Ответ: 1,7 В, -328,1 кДж.
98. Вычислите ЭДС и изменение стандартной энергии Гиббса в медном концентрационном элементе, если у одного электрода Сcu= 1 моль/л, а у другого - 10-3 моль/л.
99. ЭДС гальванического элемента состоящего из никеля, погруженного в раствор его соли с концентрацией 10-4 моль/л, и серебра, погруженного в раствор его соли ,равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли. Ответ: 0,1 моль/л.
100. Гальванический элемент состоит из железа , погруженного в раствор его соли с концентрацией ионов Fe2+равной 0,001 моль/л и меди, погруженной в раствор ее соли. Определите концентрацию ионов меди, чтобы ЭДС элемента стала равной нулю. Ответ: 0,4810-29 моль/л.
101. Какие реакции протекают у электродов, образованных железом и оловом, погруженных в растворы двухвалентных металлов, которые соединены солевым мостиком? Рассчитайте ЭДС и G0298 гальванического элемента.
102. Что является окислителем и восстановителем в гальваническом элементе, составленном из олова и серебра, которые погружены в 1н растворы их солей? Составьте схему соответствующего гальванического элемента. Исходя из величин стандартных электродных потенциалов и значения G0298 укажите, можно ли осуществить данную реакцию в гальваническом элементе?
103. Рассчитайте стандартное ЭДС элемента в котором установилось равновесие: Fe + Cu2+ Fe2+ + Cu
 G0обр..Cu2+=+66,2 кДж/моль, G0обр.Fe2+ =-84,8 кДж/моль
G0обр..Cu2+=+66,2 кДж/моль, G0обр.Fe2+ =-84,8 кДж/моль Ответ: Е0=0,78 В.
Ответ: Е0=0,78 В.104. Рассчитайте стандартную ЭДС элемента в котором установилось равновесие при 298К
Zn + 2Ag + Zn2+ + 2Ag
G0обр.Zn2+=-146,5 кДж/моль, G0обр.Ag+=+77,2 кДж/моль.
Ответ: Е0= 1,56 В.
105. Вычислить ЭДС элемента (-)Mg/Mg2+//Zn2+/Zn(+) при следующих концентрациях солей:
СMg2+=1 моль/л; СZn2+=0,1 моль/л;
СMg2+=0,1 моль/л; СZn2+=1 моль/л;
СMg2+=0,01 моль/л; CZn2+ =0,01 моль/л;
СMg2+=0,01 моль/л; CZn2+=0,001 моль/л.
106. Определить электродные потенциалы цинка при следующих концентрациях солей: СZn2+=1моль/л; СZn2+=0,1 моль/л; СZn2+=0,001 моль/л; СZn2+=0,0001 моль/л.
107. Исходя из значений стандартных электродных потенциалов, рассчитайте для 298К значения G реакций:
Zn + H2SO4 = ZnSO4 + H2
Cu + 2Ag+ = Cu2+ + 2Ag.
Ответ: -146,7 кДж; -88,8 кДж.
108. Составьте схему концентрационного элемента при СAg+ = 10-1 моль/л у одного электрода и CAg+ =10-4 моль/л у другого электрода. Напишите уравнения электродных процессов и рассчитайте ЭДС элемента.
Ответ: Е0=0,18 В.
109. Составьте схему концентрационного элемента при CZn2+= 10-2моль/л у одного электрода и CZn2+ = 10-6 моль/л у другого электрода. Напишите уравнения электродных процессов и рассчитайте ЭДС гальванического элемента.
Ответ: Е0=0,12 В.
110. Что такое газовый электрод? Приведите пример газового электрода и напишите уравнение для вычисления его равновесного потенциала.
Электролиз
Пример 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течении 1 ч при силе тока 4 А?
Решение. Согласно закону Фарадея
m = Эlt/ 96500,
где m - масса вещества;
Э - эквивалентная масса ,г;
l - сила тока, А;
t - продолжительность электролиза, с.
Эквивалентная масса меди в CuSO4 равна 63,54 : 2 = 31,77 г -
моль. Подставив в формулу значения Э = 31,77; I = 4A; t = 60604, получим
m = 31,77 4 3600 = 4,74 г.
96500
Контрольные вопросы
111. Электролиз CuSO4 проводили в течение 15 мин при силе тока 2,5 А, при этом выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах для медного и угольного анода. Найдите выход по току.
Ответ: 97,3%.
112. При рафинировании меди током 25А выделяется за 4 часа 112 г меди. Рассчитайте выход по току.
Ответ: 94,4%.
113. Через раствор соли Ni(NO3)2 в течении 2,45 часа поступал ток силой 3,5А. Определите на сколько граммов за это время уменьшилась масса никелевого анода?
Ответ: 9,39г
114. Через раствор сульфата цинка пропускали ток в течение 30 мин. При этом выделилось 0,25г цинка. Амперметр показал 0,4А. Какова ошибка в показаниях амперметра?
Ответ: 2,44%.
115. Какую массу алюминия можно получить при электролизе расплава Al2O3, если в течение часа пропускать ток силой 20000А при выходе по току 85%?
Ответ: 5,7 кг.
116. Определите силу тока, необходимую для процесса электролиза расплава хлорида магния проходящего в течение 10 часов при выходе по току 85%, чтобы получить 0,5 кг металлического магния?
Ответ:129,8 А.
117. При пропускании тока силой 2А в течение 1 часа 14 минут 24 секунд через водный раствор хлорида металла (11) на одном из графитовых электродов выделилось 2,94 г металла. Чему равна атомная масса металла, если выход по току 100% ? Какой это металл? Напишите уравнения реакций, протекающих на электродах.
Ответ: 63,54г.
118. Выход по току при получении металлического кальция при электролизе расплава хлорида кальция равен 70%. Сколько электричества надо пропустить, чтобы получить 200 г кальция?
Ответ: 382Ач.
119. Через раствор сульфата железа (11) пропустили ток силой 13,4А в течении 1 часа. Определите количество железа, которое выделилось на катоде, если выход по току был равен 70%. Напишите уравнения реакций протекающих на электродах.
Ответ: 13,96г.
120. Железный предмет общей площадью 0,08м2 помещен в качестве катода в раствор соли никеля. Какова толщина отложившегося слоя никеля? Плотность никеля 89000 кг/м2. Ток силой 3,15А пропускали в течение 42 мин.
Ответ: 3,410-6м.
121. Через раствор сульфата металла (11) пропустили 400 Кл электричества. При этом на катоде выделилось 0,196 г металла. Выход металла по току 80%. Определите металл и составьте уравнения реакций, протекающих на электродах: а) для графитовых электродов; б) для металлических электродов.
122. При токе силой 2А в течение 40 мин выделилось на катоде 4,542 г некоторого металла. Вычислите электрохимический эквивалент этого металла е (г/А час).
123. Раствор NiCl2, содержащий 0,1297 кг соли, подвергали электролизу током 5А в течение 5,36 часов. Определите массу никеля и объем хлора.
124. При электролизе раствора CuSO4 с медными электродами масса катода увеличилась на 0,005 кг. Какое количество электричества было пропущено?
Ответ: 15200 Кул.
125. При электролизе раствора Cr2(SO4)3 током 1А масса катода возросла на 0,01 кг. Определите количество электричества и время в течение которого оно было пропущено. Какой газ и в каком количестве выделился на аноде? Ответ: 55900 Кул; 15,5 час;4,63г О2.
126. Вычислите объем Н2, выделенного при пропускании тока в 5А в течение 1 часа через раствор H2SO4. Ответ: 4,2л.
127. Какие вещества и в каком количестве образуются при пропускании тока в 6А в течение 1 часа через раствор КОН? Ответ: 0,112г Н2 и 0,895 г О2.
128. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора сульфата кадмия: а) с графитовым анодом; б) с кадмиевым анодом. Определите количество выделившегося кадмия а) на катоде при выходе по току 80%; б) на аноде при выходе по току 100%. Через растворы пропускали тое силой 134А в течение 2 часов.
129. В растворе находились 0,1 моль HgCl2 и 0,2 моля CuCl2. Какие вещества и в каком количестве выделяются на угольных электродах, если через раствор пропустить ток в 12А в течение 1,5 часов?
130. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе а) расплава хлорида магния; б) раствора хлорида магния. Сколько времени необходимо вести электролиз при силе тока 2А, чтобы на катоде выделилось 2,43г вещества для реакций а и б? Ответ: 2,68 часа и 32,5 часа.
Контрольная работа №2
Коррозия и защита металлов от коррозии
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение: Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому цинк является анодом, а кадмий - катодом.
Анодный процесс: Zn0 - 2e = Zn2+
Катодный процесс: в кислой среде 2H+ + 2e = H2
в нейтральной среде 0,5O2 + H2O+ 2e =2 OH-.
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Пример 2. При нарушении целостности поверхностного слоя медного покрытия на алюминии в кислой среде будет проходить коррозия из-за образования микрогальванического элемента. За 45с работы этого элемента (гальванопары) выделилось 0,09л водорода (измеренного при н.у.). Какая масса алюминия растворилась за это время и какую силу тока дает эта гальванопара?
Решение. Максимальная сила тока, образованная гальваническим элементом, определяется следующим соотношением:
I=mF/M
где: I - сила тока, А; m - масса растворившегося за 1с анода или выделившегося на катоде за 1с вещества , г; F- постоянная Фарадея, 96500 Кл; М - масса эквивалента элемента, который выделяется на катоде, г.
За 1с на катоде выделяется 0,09/45 = 0,002л Н2.
Гальванический элемент дает ток силой I = 0,0296500/11,2 = 7,2А
масса эквивалента алюминия равна 9 г.
За 45с работы гальванопары алюминия растворилось:
mAl = 9 17,245 / 96500 = 0,072г.
Контрольные вопросы
1. Алюминий склепан с медью. Какой из металлов будет подвергаться коррозии в кислой среде? Составьте электронные уравнения для электродных процессов. Подсчитайте ЭДС и G0298 этого элемента в стандартных условиях. Ответ: 1,662 В; - 962,3 кДж/моль.
2. Железо покрыто никелем. Какое это покрытие? Какой из металлов будет корродировать при нарушении поверхности в кислой среде. Подсчитайте ЭДС и G0298 этого элемента при стандартных условиях. Составьте электронные уравнения электродных процессов.
3. Олово спаяно с серебром. Какой из металлов будет подвергаться коррозии в щелочной среде? Ответ дайте на основании вычисления ЭДС и G0298 образующегося гальванического элемента.
4. При работе гальванического элемента, образовавшегося при атмосферной коррозии алюминия, который находится в контакте с хромом, за 1мин 20с его работы на хромовом катоде восстановилось 0,034л кислорода. Определите, на сколько уменьшилась при этом масса алюминиевого электрода и чему равна сила тока, протекшего во внешней цепи гальванического элемента? Ответ: 7,32А; 0,05г.
5. Гальванический элемент, образовавшийся при коррозии хрома, спаянного со свинцом в кислой среде, дает ток силой 6А. Какая масса хрома окислится и сколько литров водорода выделится за 55с работы этого элемента? Ответ: 0,06г: 0,04л.
6. Медь покрыта оловом. Какое это покрытие? При нарушении покрытия в кислой среде образуется гальванический элемент, который дает ток 7,5А. Какая масса олова растворится и сколько литров водорода выделится на медном катоде за 25 мин? Ответ: 6,84г; 1,3л.
7. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнение анодного и катодного процессов.
8. Как происходит атмосферная коррозия луженой меди и луженого железа при нарушении покрытия? Составьте уравнения анодного и катодного процесса. В каком случае коррозия протекает быстрее? Ответ подтвердите расчетом ЭДС.
9. Предложите катодное покрытие для защиты меди от атмосферной коррозии. Составьте электронные уравнения анодного и катодного процессов в случае нарушения покрытия.
10. Линии водопровода, изготовленные частично из медных труб, ржавеют значительно быстрее, чем изготовленные из меди или целиком из железа. Почему? Ответ подтвердите составлением электронных уравнений.
11. Какие вещества образуются в результате атмосферной коррозии никеля, покрытого магнием? Составьте электронные уравнения электродных процессов
12. В чем сущность защиты металлов от коррозии? Приведите пример протекторной защиты Fe в электролите, содержащем растворенный кислород. Составьте электронные уравнения катодного и анодного процессов.
13. Железные изделия покрыты кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия во влажном воздухе и соляной кислоте. Какие продукты коррозии образуются в первом и втором случае?
14. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий-железо. Какие продукты коррозии образуются в первом и во втором случае?
15. Две железные пластинки, частично покрытые, одна оловом, другая - медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему Ответ подтвердите составлением электронных уравнений анодного и катодного процессов коррозии этих пластинок.
16. Линии водопровода, изготовленные частично из железных и частично из медных труб, ржавеют значительно быстрее, чем изготовленные целиком из железа. Почему? Ответ подтвердите составлением электронных уравнений.
17. Составьте анодные и катодные процессы коррозии железа, покрытого сурьмой .в случае кислородной деполяризации.
18. Железо покрыто никелем. Какие процессы будут протекать на электродах при электрохимической коррозии в нейтральной среде?
19. Составьте электронные уравнения катодного и анодного процессов с кислородной и водородной деполяризацией при коррозии пары магний-никель. Какие продукты коррозии образуются в первом и втором случаях
20. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов при атмосферной коррозии этих металлов.
ФАЗОВОЕ РАВНОВЕСИЕ СИСТЕМ
Общие закономерности, которым подчиняются равновесные системы, содержащие любое число фаз и компонентов устанавливаются правилом фаз Гиббса f = K - Ф + n, где:
К- число компонентов системы, равное числу составляющих веществ (R ) (составляющим веществом называют каждое вещество, которое может быть выделено из системы и существовать вне ее) минус число реакций (q);
Ф- число фаз (фаза-совокупность всех гомогенных частей системы одинаковых по составу, химическим и физическим свойствам, отделенная от других частей системы, отличающихся по этим свойствам, поверхностью раздела); n - число внешних факторов, определяющих существование системы (если такими факторами являются давление и температура, то n = 2, если один из этих факторов постоянен, то n = 1);
f - вариантность системы, показывающая число переменных, которым можно придавать произвольные значения, не изменяя числа фаз (число степеней свободы).
однокомпонентные системы.
В однокомпонентных системах фазы состоят из одного и того же вещества, но находящегося в различных агрегатных состояниях или в различных твердых модификациях. В этих системах рассматриваются фазовые переходы: испарение, возгонка, конденсация, плавление, превращение модификаций.
Для однокомпонентной системы: f = 3 - Ф.
Количественно условие равновесия фаз в однокомпонентных системах выражается уравнением Клайперона - Клаузиуса:
dP
 Hф.п .= T V,
Hф.п .= T V,dT
где: Нф.п. - теплота фазового перехода в условиях равновесия фаз (испарение, плавление, превращение модификаций): Т - температура; dР/dT - зависимость давления пара от температуры, V - разница в мольных объемах фаз, находящихся в равновесии.
Для процесса испарения при возгонке
dP
 Нф.п. = (Vп -Vк.ф.) Т ,
Нф.п. = (Vп -Vк.ф.) Т ,dT
где: Vп- объем пара; Vk.ф.-объем конденсированной фазы.
В области температур, далеких от критической, можно принять:
RT
Vп - Vк.ф ˜ Vп, т.к Vп.»Vк.ф и Vп = P .
После подстановки и интегрирования предыдущее выражение примет вид:
P2 Нф.п. T2 - T1


 lg = · .
lg = · .P1 2.3R T2 · T1
Значение Нф.п. является средней величиной, справедливой для интервала температур T2 ÷ T1 . В тройной точке теплоты возгонки, плавление и испарение связаны уравнением:
Нвоз. = Нисп. + Нпл.
Для многих неполярных веществ теплота испарения при нормальной температуре кипения приближенно вычисляется по уравнению Трутона :
Нисп.
 21
21Тн.т.к.
или более точно по уравнению Кистяковского:
Нисп.
 = 8,75+4,57 lg Тн.т.к.
= 8,75+4,57 lg Тн.т.к.Тн.т.к.
Зависимость теплоты фазового перехода от температуры:
Т2
Нф.п.(Т2) = Нф.п.(Т1)+ СdT
T1
или Нф.п.(Т) = H0 + СdT ,
где: C-разность теплоемкостей фаз, находящихся в равновесии;
Н0-константа интегрирования, которая определяется по известным значениям С и Нф.п.(т.) .
При допущении, что C = Cп - Ск = const
H0 C

 lgP = - + lgT + const ,
lgP = - + lgT + const , 2.3K RT
где: const рассчитывается по известным значениям P1 , H0 и C.
Пример 1.Определите наибольшее число фаз находящихся в равновесии в системе: вода-хлорид натрия.
Решение. В системе два компонента. По правилу фаз мы знаем, что число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только давление и температура, равно числу компонентов системы, плюс два, минус число фаз. Следовательно, f=2+2-Ф.
Наибольшее число фаз отвечает наименьшему числу степеней свободы. Поэтому наибольшее число фаз Ф = 4. При этом условии раствор NaCl в воде находится в равновесии одновременно со льдом, твердой солью и водяным паром. В таком состоянии система
безвариантна т.е. состояние достигается только при строго определенных температуре, давлении и концентрации раствора.
Пример 2.Зависимость давления пара (Н/м2) от температуры для синильной кислоты выражается уравнением: lgP= 9,16-1237/T. Определите теплоту испарения.
Решение. При P=1.013*105 Н/м2 T=Tн.т.к. и, следовательно, lg1.013*105=9.16-1237/Tн т к, т.е. Tн.т.к. =299 K. Учитывая, что
d lnP d lnP

 Нисп.= RT2 , находим .
Нисп.= RT2 , находим . dT dT
Дифференцируя уравнение lnP=9,16·2,3-(1237·2,3)/T ,
d lnP 2.3*1237
п

 олучаем: = ,
олучаем: = ,dT T2
откуда Нисп. = 2,3·1237·8,314·103 = 2,37·107 Дж/кмоль.
Контрольные вопросы
21.Пользуясь правилом фаз Гиббса, покажите, сколько термодинамических степеней свободы у однокомпонентной системы при температуре кипения.
22.На основании правила фаз определите число компонентов двухфазной системы, состоящей из твердого хлористого аммония и находящихся над ним газообразных аммиака и хлористого водорода.
23.Определите число степеней свободы системы, выражаемой уравнением С(тв)+О2 (г)=СО2 (г) , при горении угля.
24.Определите число степеней свободы системы, состоящей из
СаСО3(тв) , СаО(тв) и СО2 (г) .
25.Определите число степеней свободы системы, находящейся в равновесии: N2 (г) + 3Н2 (г) = 2NH3 (г) .
26.Определите наибольшее число фаз, которые могут находиться в равновесии в однокомпонентной системе, например Н2О.
27.Определите число фаз , возможных в двойной равновесной системе, например, соль К2SО4 и вода.
28.Определите число фаз, возможных при плавлении двойных систем, образованных нелетучими компонентами (сплавы металлов Sn+Zn) при постоянном давлении.
29.Дайте определение понятия «Фаза» и показать на примерах, сколько фаз возможно в гомогенных и гетерогенных системах.
30.Определите число степеней свободы системы, состоящей из хлорита натрия, хлорида натрия и кислорода
NaClO2(тв)==NaCl(тв)+O2(г).
31. Вычислите среднюю температуру испарения СН4 в интервале температур от 88,2 до 113 К, используя следующие данные:
-
Т, К
88.2
92.2
98.2
104.2
112.2
Р*10-3,Н/м2
8
13.31
26.62
53.24
101.3
32.Вычислите теплоту испарения диэтилового эфира по уравнениям Клаузиуса-Клайперона и Трутона, если при нормальной температуре кипения ( 307.9 К ) dP/dT =3.53*103 н/(м2*град) .
33. Вычислите теплоту испарения воды при 273,2 К и 573,2 К, используя данные:
-
Т, К
Vn , м3/кг
Vк*103, м3/кг
dP/dT, н/(м2*град)
273,2
206,3
1,000
44,2
573,2
0,0215
1,400
161*102
Ответ: при 272,2 К Нисп.=2,504*106;
при 573 К Нисп.=1,712*106.
34. Вычислите теплоту испарения воды при 273,2 К и 573,2 К используя данные:
-
Т, К
273,2
274,2
572,7
574,3
Рн2о, н/м2
610,4
656,4
8,814*106
9,017*106
Ответ: при 273,2 К ------2,491*106 дж/кг;
при 573,2 К-------1,403*106 дж/кг.
35. Вычислите теплоту испарения ртути по уравнениям Клаузиуса-Клайперона, Трутона и Кистяковского. Сравните найденные величины с величиной теплоты испарения(58,1*106 дж/г-экв) для нормальной температуры кипения (629,8 К), если: Т1=629,2 К; Р1=1,00*105 Н/м2 ; Т2=631,2 К; Р2=1,037*105 Н/м2.
36 . Вычислите теплоту испарения хлора при Р=1,0132*105 Н/м2 (1 атм), если уравнение зависимости давления насыщенного пара от температуры над жидким хлором имеет вид
Р=3,58*106 - 3,37*104*Т+80,11*Т2; (Т=298 К).
Ответ: Нисп.=4,995*107 Дж/кмоль.
37. Зависимость давления (Н/м2) насыщенного пара от температуры для фреона CCl2F2 выражается уравнением:
lgP=34,5-2406,1/Т-9,26lgT+0,0037T.
Определите давление насыщенного пара и теплоту испарения при испарении 1 моль фреона при 298 К.
Ответ:Р=4,123*104 Н/м2; Нисп. =1,904*107 Дж/кмоль.
- Давление паров над жидким галлием при температуре 10290С равно 0,01мм рт. ст., а при 11540С – 0,1 мм рт.ст.. Чему равна молярная теплота испарения галлия?
- Мольная теплота испарения воды равна 43,09 кДж/моль. Давление насыщенного пара при температуре 400С составляет 55,3 мм рт. ст. Чему равно давление насыщенного пара при температуре 500С?
Диаграмма состояния.
Графическое выражение зависимости между значениями переменных: температура, давление, концентрация, определяющих состояние системы называется диаграммой состояния. Диаграмма состояния позволяет определить не только число фаз и их состав при различных температурах, но и относительное количество каждой фазы. Любая точка на диаграмме называется фигуративной и соответствует одному определенному состоянию системы. Графические расчеты процессов кристаллизации, растворения и испарения основаны на использовании:
1) Правила соединительной прямой: фигуративная точка системы и фигуративные точки частей, составляющих эту систему, лежат на одной прямой - конноде;
2) Правила рычага: количество двух частей, составляющих систему, обратно пропорционально длинам отрезков, заключенных между фигуративными точками этих составных частей и фигуративной точкой системы. Правило фаз позволяет также определить относительные количества одной из фаз и всей системы.
Принцип соответствия.
Каждому комплексу фаз, находящихся в данной системе в равновесии, соответствует на диаграмме определенный геометрический образ.
Каждой твердой фазе на плоской диаграмме состояния отвечает своя кривая температуры начала кристаллизации на объемной поверхности ( рис.1)

 Жидкая фаза из А и В
Жидкая фаза из А и ВРаствор + Раствор +
кристаллы А кристаллы В
расплав, насы-
щеный А и В

t0 Эвтектический раствор+ кристал-
лы А + кристаллы В
кристаллы А + кристаллы В
 А В
А В