Физическая
| Вид материала | Рабочая программа |
- Методика подбора средств профессионально-прикладной подготовки. Основные факторы, определяющие, 46.84kb.
- Рабочая программа дисциплины физическая культура Степень выпускника, 873.87kb.
- Основная образовательная программа высшего профессионального образования Направление, 4490.7kb.
- Рабочая программа дисциплины «физическая химия», 80.79kb.
- Программа аттестационных испытаний Факультет Физической культуры Бакалавриат по направлению, 289.66kb.
- Лекция 1 Физическая картина природы и ее «изобразительные средства», 164.13kb.
- М. К. Аммосова Институт физической культуры и спорта рабочая программа, 78.29kb.
- Программа дисциплины «Физическая культура» Утверждена умс председатель, 83.66kb.
- Тематический план 1 по дисциплине «Физическая культура», 404.41kb.
- Условия проведения конкурса знатоков по специальности Физическая культура для лиц, 27.28kb.
Рис 1
Фазовое равновесие многокомпонентных систем.
Двухкомпонентные системы можно разделить на:
- Равновесие газ – жидкость
- Равновесие жидкость – жидкость :
А) системы с неограниченной взаимной растворимостью жидкостей
Б) системы с ограниченной взаимной растворимостью жидкостей
В) системы с взаимно нерастворимыми жидкостями
- Равновесие кристаллы – расплав
Идеальный двухкомпонентный (бинарный) раствор с нелетучим растворенным веществом.
Растворенное вещество будет нелетучим, если до образования раствора оно находилось в твердом агрегатном состоянии. Двухкомпонентные жидкие растворы существуют в равновесии с насыщенным паром.
Для идеальных растворов, согласно закону Рауля (Давление насыщенного пара Pi прямопропорционально его молярной доле в растворе Niж , где Pi0 – давление насыщенного пара над чистым i-компонентом, называемое парциальным давлением) имеем: Р = Р01 · NЖ1 (1 – растворитель). Давление насыщенного пара создается в этом случае только молекулами растворителя.
Молярная доля растворенного вещества N2ж = 1 – N1ж, следовательно
Р = Р10· (1 - N2ж); Р= Р10 - Р10 · N2ж; Р10 · N2ж= Р10 – Р ;
N2ж =
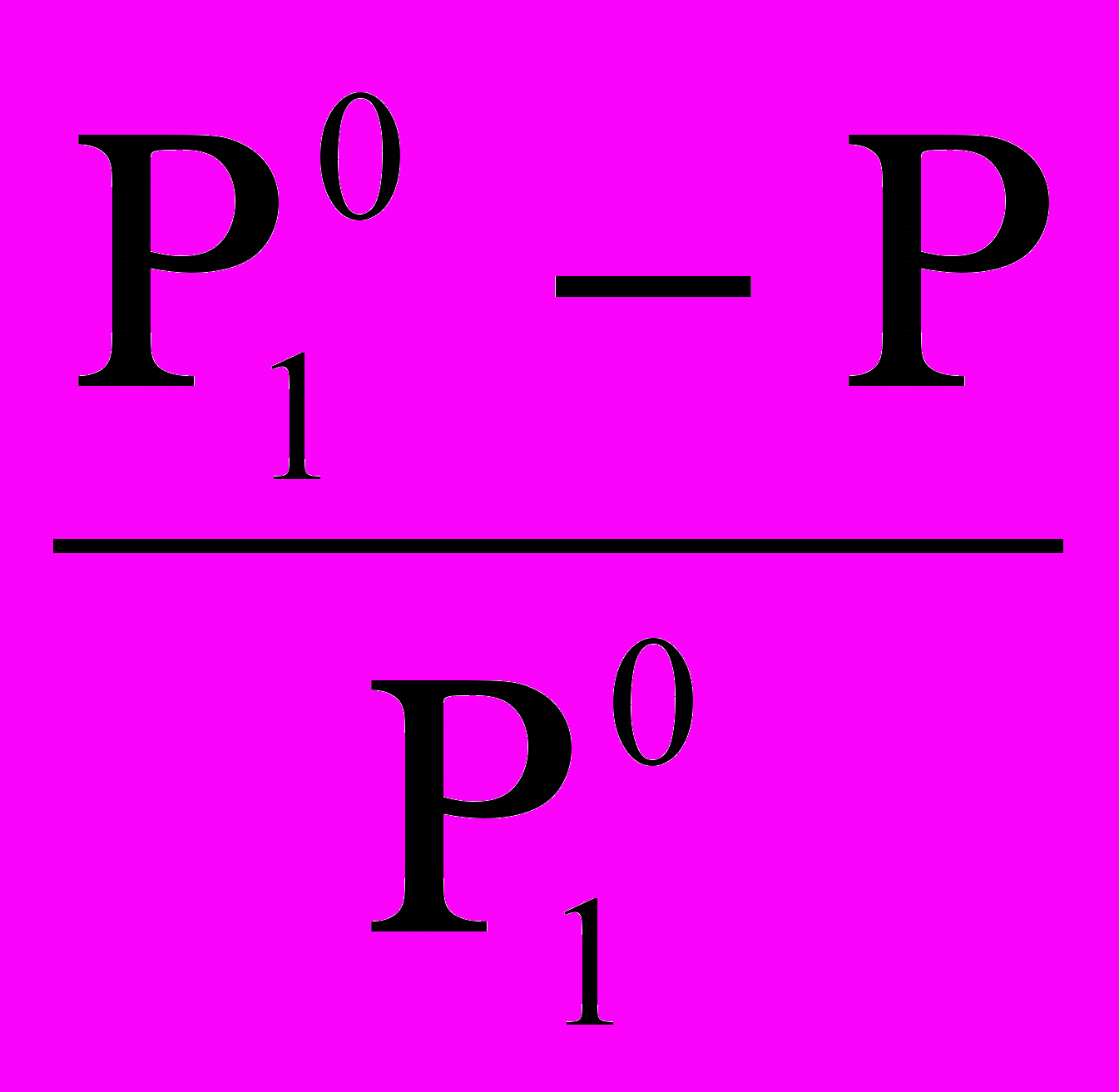 Относительное понижение давления пара над раствором для таких систем равно мольной доле растворенного вещества в растворе.
Относительное понижение давления пара над раствором для таких систем равно мольной доле растворенного вещества в растворе.Жидкость (все равно – чистая или раствор) закипает при той температуре, при которой давление насыщенного пара над ней становится равным внешнему. Для раствора с нелетучим растворенным веществом при любой температуре Р всегда меньше, чем Р10, температура кипения раствора (Ткип) всегда выше, чем температура кипения чистого растворителя (Т 0кип).
ΔТ= Ткип - Т 0кип = Е· b, где Е – эбулиоскопическая постоянная, b – моляльная концентрация раствора.
Е – определяется свойствами чистого растворителя: Е =
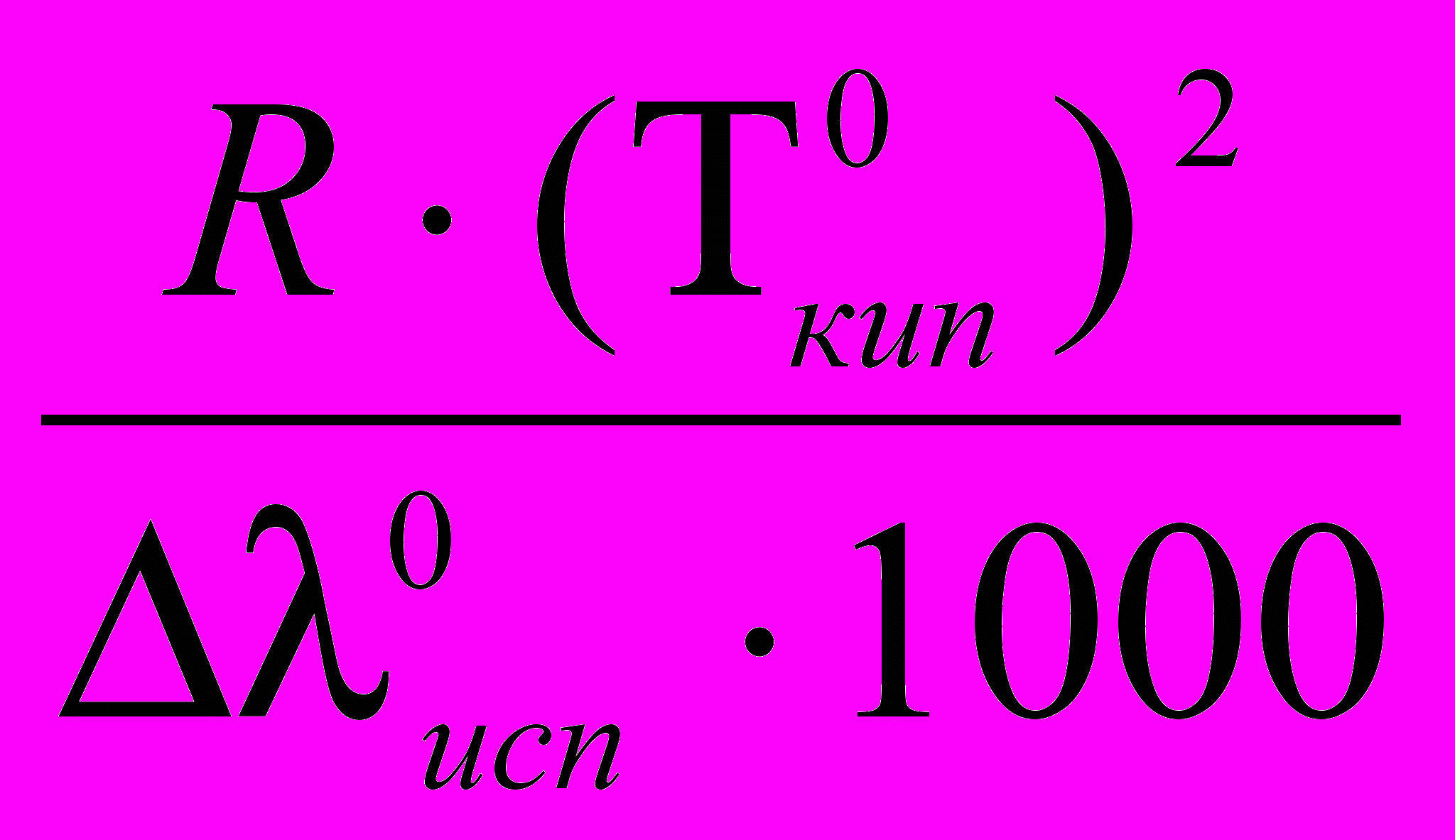 , где R – Газовая постоянная , λ0исп – удельная теплота испарения чистого растворителя. Для воды Е=0,52 град·кг/моль. Для раствора, содержащего m2 граммов растворенного вещества (с молярной массой М2 ) в m1 граммах воды, моляльность раствора рассчитывается по формуле:
, где R – Газовая постоянная , λ0исп – удельная теплота испарения чистого растворителя. Для воды Е=0,52 град·кг/моль. Для раствора, содержащего m2 граммов растворенного вещества (с молярной массой М2 ) в m1 граммах воды, моляльность раствора рассчитывается по формуле: 
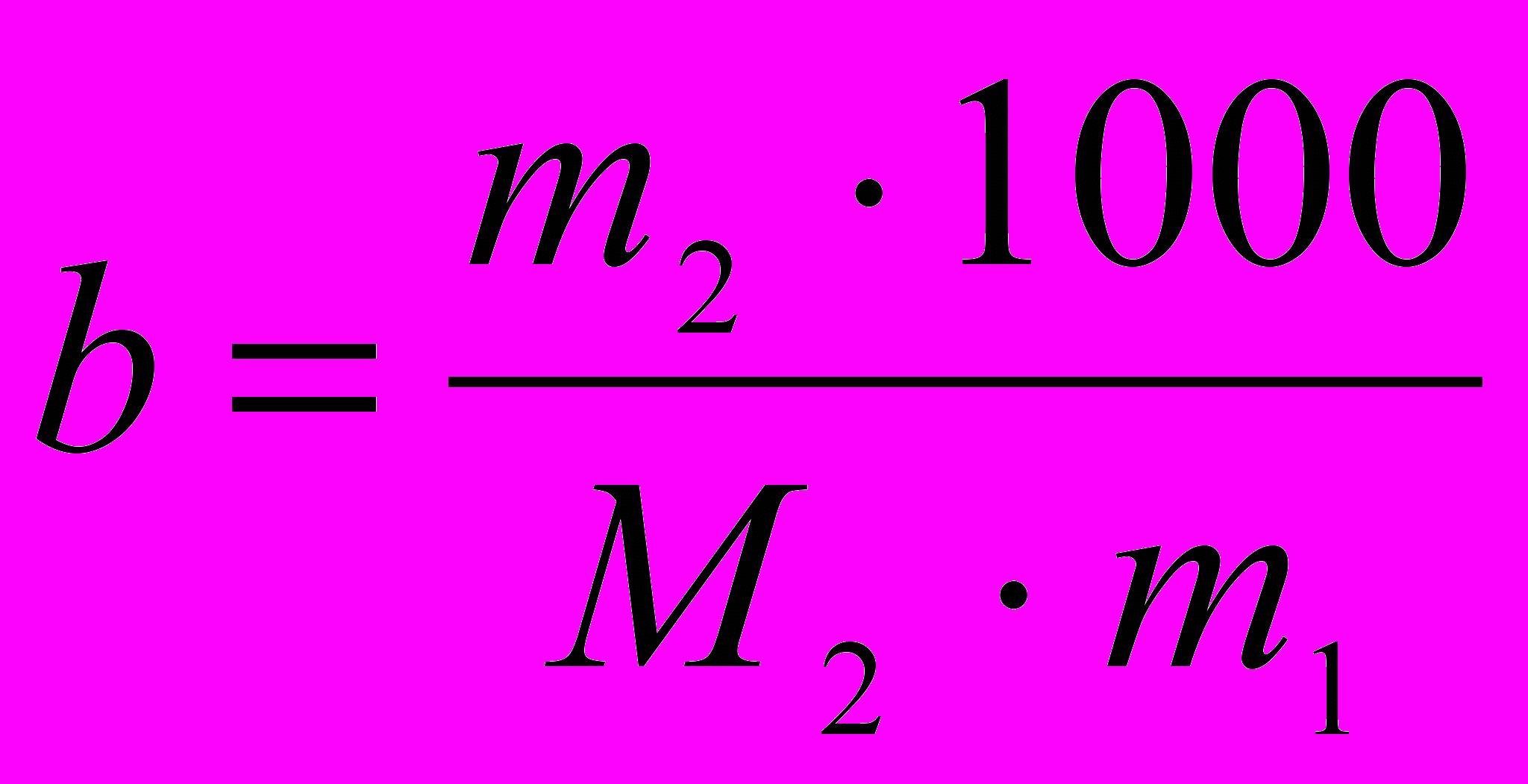 тогда Ткип =Т 0кип+ Е
тогда Ткип =Т 0кип+ Е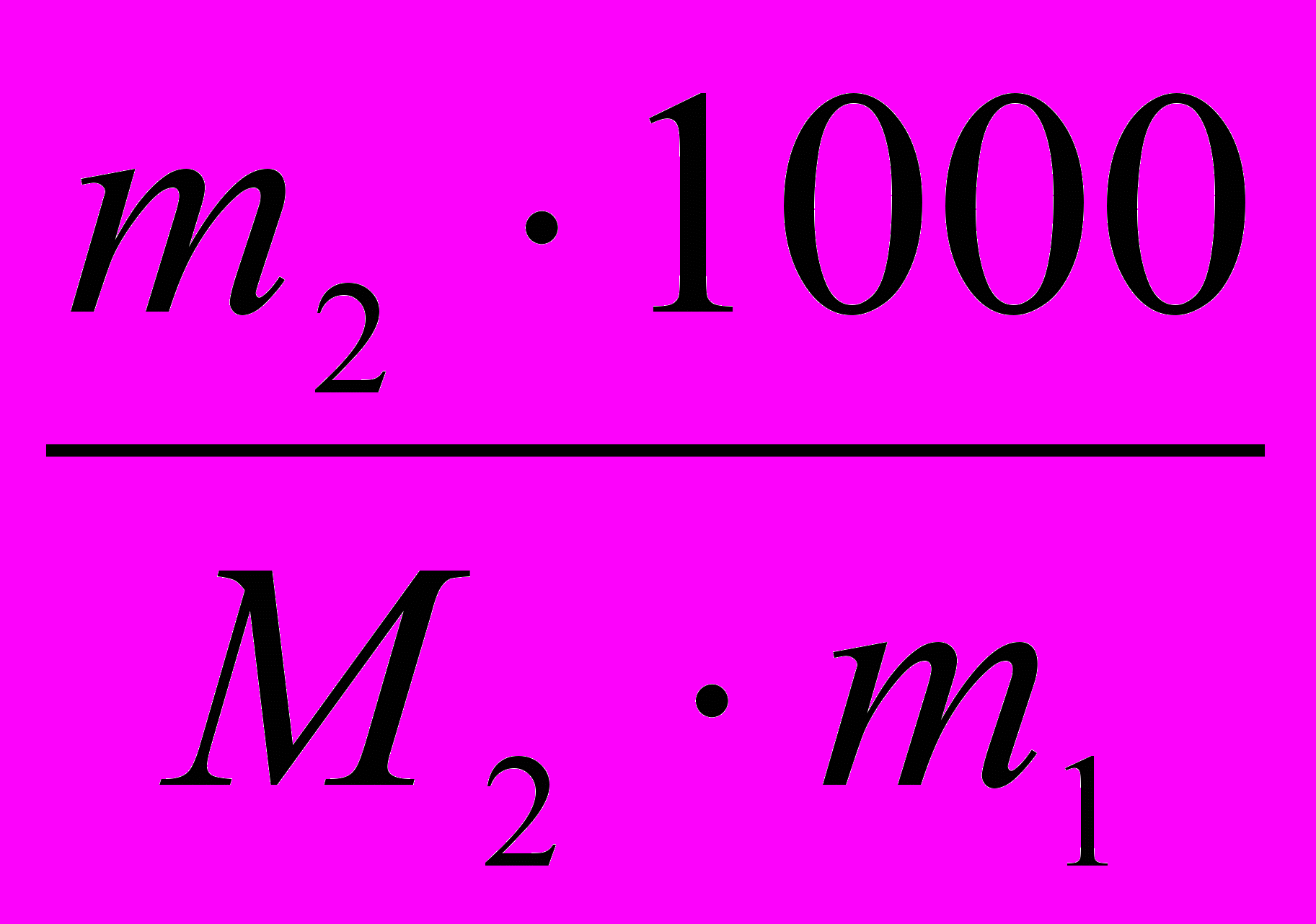 , где Т 0кип – температура кипения чистой воды.
, где Т 0кип – температура кипения чистой воды.Если молярная масса растворенного вещества не известна, то ее находят по формуле: М2 =
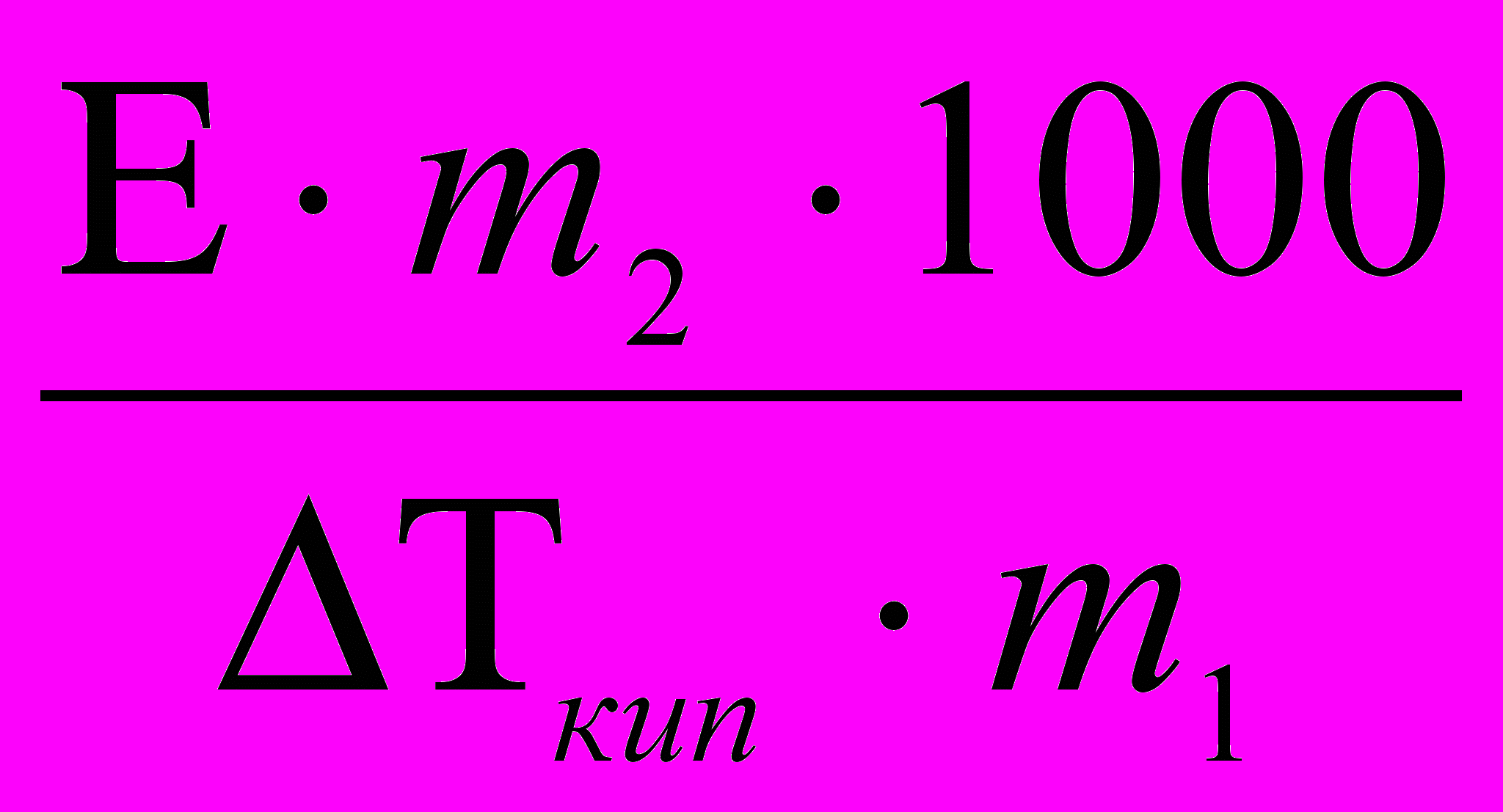 .
.Метод исследования, основанный на экспериментальном определении температуры кипения раствора, называется эбулиоскопией.
Любая жидкость замерзает при той температуре, при которой давление насыщенного пара над ней становится равным давлению насыщенного пара над кристаллами. Тзам всегда меньше чем Т0зам.
ΔТ= Тзам - Т 0зам >0; ΔТ = К ·b, где К – криоскопическая постоянная.
К – определяется свойствами чистого растворителя: К =
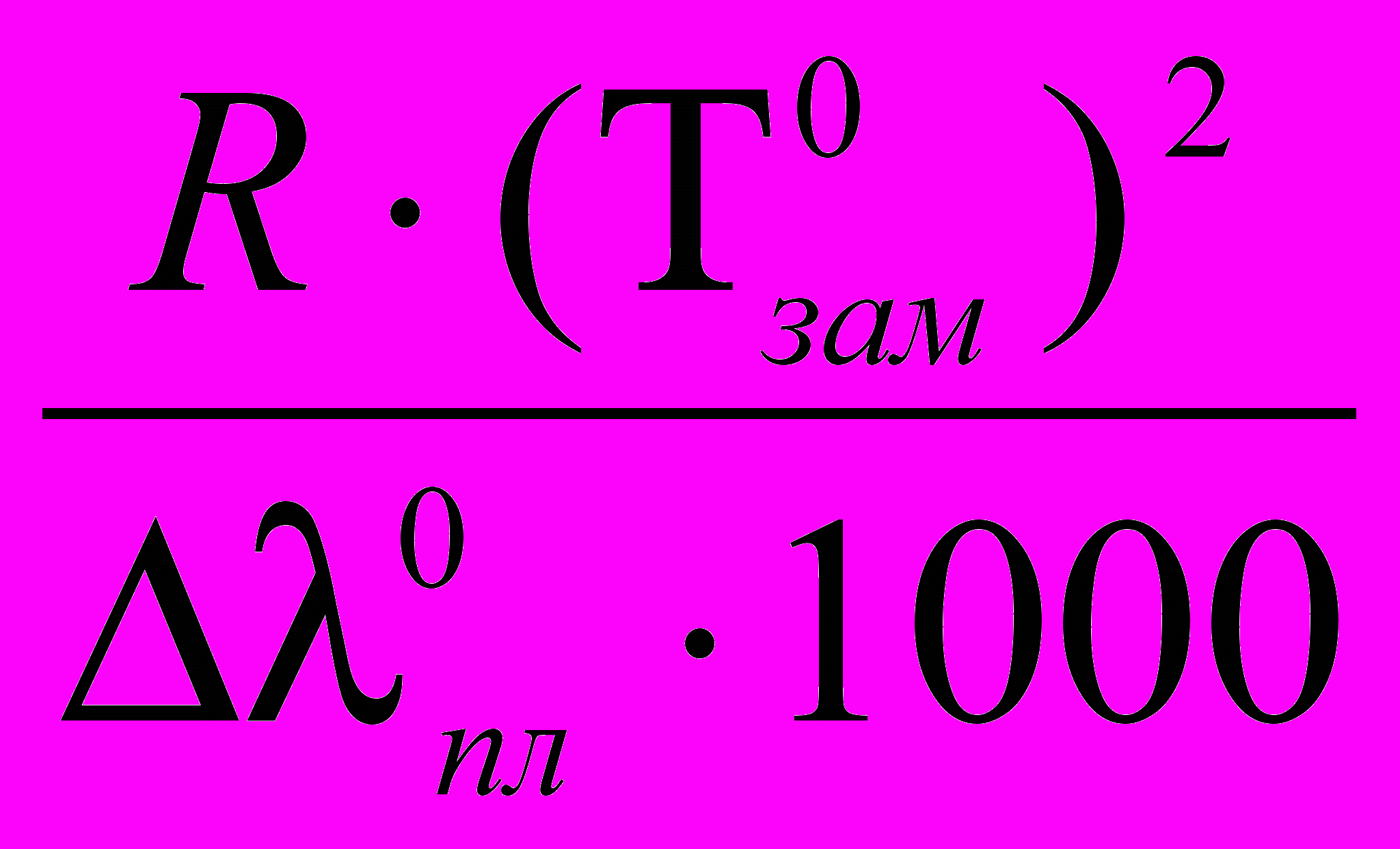 , где Δλ0пл – удельная теплота плавления чистого растворителя. Для воды К составляет 1,86 град·кг/моль.
, где Δλ0пл – удельная теплота плавления чистого растворителя. Для воды К составляет 1,86 град·кг/моль.Метод исследования, основанный на экспериментальном определении температуры замерзания раствора, называется криоскопией.
Идеальные бинарные летучие растворы.
Насыщенный пар над таким раствором образуется обоими веществами А и В. Давление насыщенного пара над раствором Р равно сумме парциальных давлений РА и РВ: Р = РА + РВ. По закону Рауля
РА = Р0А · NЖА и PВ = P0В · NЖВ
Общее давление пара над раствором:
Робщ = Р0А NЖА + Р0В NЖВ=Р0А NЖА+Р0В(1-NЖА )= Р0В + (Р0А- Р0В ) NЖА
Это линейная зависимость давления пара от жидкой фазы. Соотношение между составом пара и жидкости в системах, подчиняющихся законам идеальных растворов, может быть выражено через давление насыщенных паров чистых компонентов и общее давление Робщ. Парциальное давление, согласно закону Дальтона:
РА=Робщ· NГА ; РВ=Робщ · NГВ , тогда
Р0А · NЖА = Pобщ · NГА ; Р0В NЖВ = Pобщ · NГВ ,
NГА=
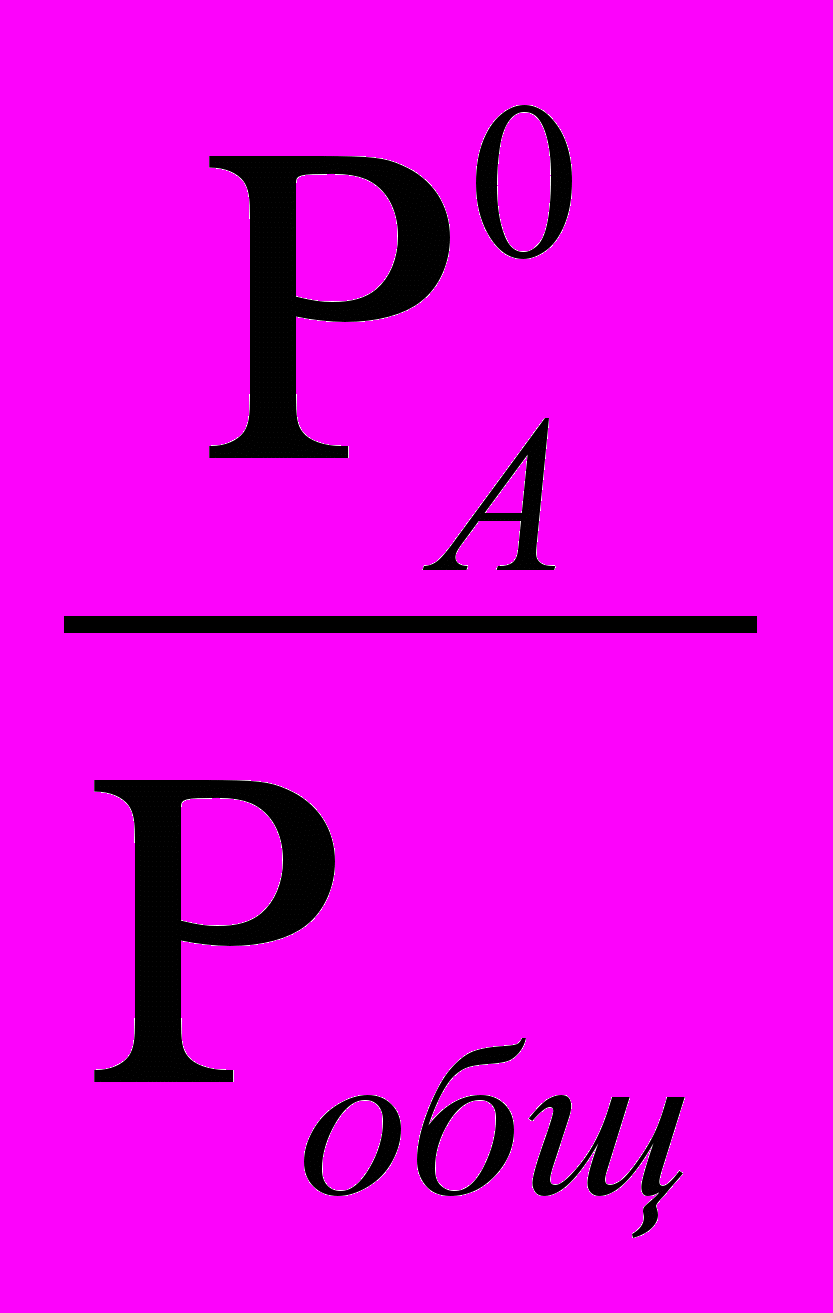 · NЖА
· NЖА  и NГВ=
и NГВ= 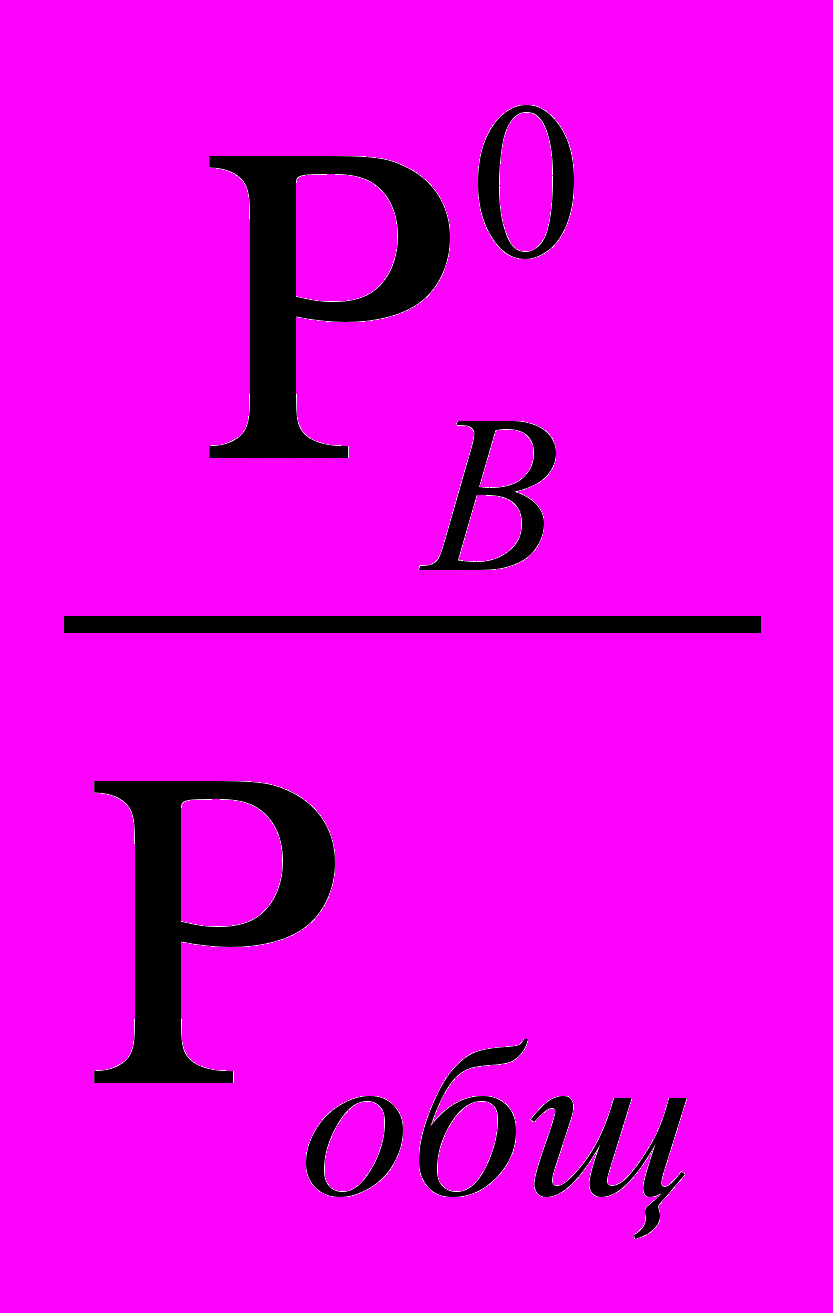 · NЖВ ,тогда
· NЖВ ,тогда 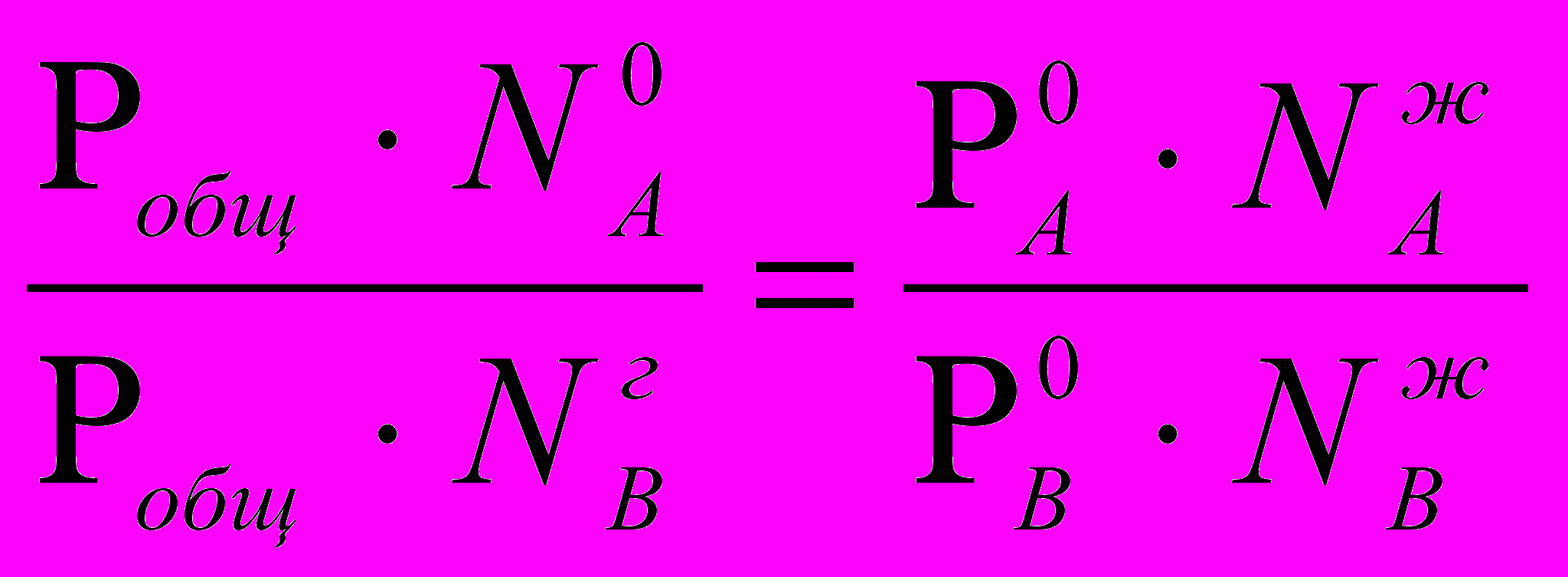
Зависимость состава пара от состава жидкой фазы определяется по законам Д.П. Коновалова:
- Повышение относительного содержания одного из компонентов в жидкой фазе всегда вызывает увеличение относительного содержания этого компонента и в парах.
В двухкомпонентной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т.е. понижает температуру кипения системы при заданном давлении.
2. Точки максимума и минимума на кривой общего давления пара отвечают растворам, состав которых одинаков с составом равновесного с ним пара.
Состав пара над раствором заданного состава определяется главным образом соотношением парциальнных мольных теплот испарения компонентов согласно законам М.С. Вревского:
- При повышении давления насыщенного пара над двухкомпонентной системой в равновесном паре увеличивается относительное содержание того компонента, парциальная мольная теплота и испарение которого больше.
- В системах, обладающих min на диаграмме кипения, при повышении давления насыщенного пара в азеотропном растворе повышается концентрация того компонента, парциальная мольная теплота испарения которого больше. В системах же обладающих max на диаграмме кипения, в этом случае возрастает концентрация того компонента, парциальная мольная теплота испарения которого меньше.
- При изменении давления насыщенного пара состав азеотропного раствора в системах, обладающих min на диграмме кипения, изменяется в том же направлении, как и состав равновесного пара, а в системах, обладающих max , в противоположном направлении.
Если жидкости взаимно нерастворимы, то давление пара каждой из них равно давлению ее пара в чистом виде, а общее давление - сумме давлений паров чистых компонентов.
.
При перегонке двух взаимно нерастворимых жидкостей А и В их относительное количество в паровой фазе, а значит и в конденсате:
nA P0A

 =
=nB P0B , где nA и nB - число молей А и В в конденсате;
P0A и P0B - давление насыщенных паров над чистыми компонентами.
gA gВ
n

 A = ; nв = , тогда
A = ; nв = , тогда МА МВ
P0A gA МВ gВ МВ P0B



 = ; = ,
= ; = ,P0B МА gВ gA МА P0A
если одним из компонентов является вода:
gн2о 18 Р0н2о

 = ,
= , gА MA . P0A
где g А - расход водяного пара для перегонки массовой единицы вещества А .
