Теоретические и экспериментальные аспекты создания лекарственных средств на основе сырья природного происхождения 15. 00. 01 технология лекарств и организация фармацевтического дела
| Вид материала | Автореферат диссертации |
- Методические подходы к разработке учебных средств на основе информационных технологий, 380.75kb.
- Методология аналитических исследований фармацевтического рынка 15. 00. 01 технология, 668.16kb.
- Институциональные и методические основы лекарственного обеспечения больных социально, 1173.2kb.
- Краткая программа курса фармакогнозии для студентов медицинского факультета рудн, обучающихся, 91.24kb.
- Исследование организационно-правовых особенностей и разработка путей оптимизации обеспечения, 305.97kb.
- Курсовая работа по технологии лекарств тема: «Законодательные основы нормирования производства, 628.18kb.
- 11 экзаменационные вопросы по фармацевтической технологии для студентов очно/заочного, 244.55kb.
- Теоретические и экспериментальные исследования закономерностей формирования сырных, 733.87kb.
- Разработка трансдермальных лекарственных форм флаволигнанов 14. 04. 01 «Технология, 297.22kb.
- Производство и применение биологических средств защиты растений на основе энтомофагов,, 37.05kb.
Таблица 19
Стандартизация гранул ФЭС
| Наименование показателей | Характеристика и норма |
| Внешний вид | Крупинки круглой, цилиндрической или неправильной формы от светло-коричневого до коричневато-зеленого цвета со специфическим запахом |
| Потеря в массе при высушивании, %, не более | 3 |
| Гранулометрический состав, гранул размером 0,2 – 3,0 мм, %, не менее | 95 |
| Распадаемость, мин, не более | 15 |
| Подлинность Качественная реакция с 2% раствором алюминия хлорида | зеленовато-желтое окрашивание |
| Содержание суммы флавоноидов (в пересчете на рутин), %, не менее | 0,10 |
| Микробиологическая чистота, не более в 1,0 г | 1*104 |
| Отклонение от средней массы, % | 10 |
Размер гранул соответствует требованиям ГФ XI, вып.. 2, С. 139 (табл. 20).
Таблица 20
Гранулометрический состав гранул ФЭС
| № п/п | Гранулометрический состав, % | |||||
| | > 3 мм | 3-2 мм | 2-1 мм | 1-0,5 мм | 0,5-0,2 мм | <0,2 мм |
| | 0,35 | 51,45 | 44,35 | 1,65 | 1,45 | 0,75 |
| | 0,25 | 46,90 | 47,85 | 2,10 | 1,95 | 0,95 |
| | 0,75 | 44,40 | 49,85 | 1,95 | 2,10 | 0,95 |
| | 0,35 | 44,85 | 47,85 | 2,25 | 3,85 | 0,85 |
| | 0,25 | 58,20 | 35,55 | 2,30 | 2,80 | 0,90 |
Результаты исследования срока годности гранул ФЭС, упакованных в пакеты из пленки с металлизированным покрытием, при температуре 15-250С и влажности не более 60+5%, позволили установить стабильность показателей качества в течение 3 лет.
Изучение фармакологических свойств субстанций и
лекарственных форм на их основе
Исследование острой токсичности. Определение острой токсичности ФЭС и НЭС проводили на беспородных неполовозрелых белых крысах самцах по методу В.В. Прозоровского с соавт. (1978). Результаты однократного внутрибрюшинного и перорального введения экстракта свидетельствует о его низкой токсичности. Вычислить LD50 не удалось, т.к. в течение первых суток эксперимента и в последующих двух недель гибели животных не наблюдалось. В ходе оценки хронической токсичности специфических ее видов не выявлено аллергенности, мутагенности и местнораздражающего действия экстракта.
Антимутагенное действие сухих водных экстрактов изучаемых растений и НЭС исследовали на модели индуцируемых хромосомных аберраций (ХА) в клетках костного мозга мышей линии СВА. Выбор индуктора производили среди мутагенов с известным механизмом ДНК - повреждающего действия (циклофосфамид – непрямой алкилирующий мутаген, диоксидин – прямой мутаген прооксидантного действия), а также на модели радиационного индуцированного мутагенеза. Экстракты вводили животным в дозах 1, 5 и 20 мг/кг внутрижелудочно в течение 7 дней до мутагенного воздействия.
Из данных, представленных в таблице 21, следует, что исследуемые препараты обладали достаточно выраженным антимутагенным действием. ФЭС и НЭС снижает число хромосомных мутаций при использовании непрямого мутагена циклофосфамида. Экстракт цветков ноготков, ФЭС и НЭС снижали количество радиационно - индуцированных хромосомных аберраций в клетках костного мозга мышей лини и СВА. Максимальной активностью на этой модели обладал экстракт цветков ноготков, более чем в 2 раза снижавший уровень радиационного повреждения клеток костного мозга.
Это хорошо согласуется с многочисленными литературными данными об антиоксидантных свойствах флавоноидов, которые в большей или меньшей степени присутствуют у большей части веществ этой группы.
Иммуномодулирующее действие. В наших исследованиях изучено влияние водного НЭС и экстрактов отдельных растений, входящих в его состав, на спонтанную пролиферацию лимфоцитов, выделенных из селезенки мышей и их способность стимулировать пролиферативный ответ этих клеток на Т- и В- клеточные митогены.
Таблица 21
Мутаген-индуцированные хромосомные аберрации клетках костного мозга
мышей линии СВА при курсовом введении экстрактов цветков ноготков, ФЭС и НЭС
| Группа животных | % спонтанных хромосомных аберраций | % хромосомных аберраций при введении циклофосфамида | % хромосомных аберраций при введении диоксидина | % хромосомных аберраций при радиационном облучении | |
| Экстракт цветков ноготков | Контроль | 2,5±0,42 | 32,5±2,2 | 18,3±2,1 | 26,09±3,6 |
| 1 мг/кг | 1,1±0,29 | 28,8±3,0 | 18,2±1,4 | 17,34±2,87* | |
| 5 мг/кг | 1,3±0,50 | 27,1±3,7* | 16,6±1,1 | 13,11±1,97** | |
| 20 мг/кг | 0,9±0,31 | 23,3±2,6** | 15,3±1,1* | 10,93±2,76** | |
| ФЭС | Контроль | 1,9±0,55 | 36,1±4,0 | 19,6±2,1 | 19,93±2,07 |
| 1 мг/кг | 1,8±0,13 | 29,89%±3,1 | 17,1±0,9 | 14,44±2,01* | |
| 5 мг/кг | 0,8±0.16 | 25,85±2,6* | 16,7±2,0 | 10,13±0,42** | |
| 20 мг/кг | 0,4±0.23 | 21,66±2,1** | 14,6±2,9* | 8,44±0,39** | |
| НЭС | Контроль | 2,1±0,37 | 36,8±3,3 | 18,4±0,9 | 19,56±0,26 |
| 1 мг/кг | 1,1±0,29 | 24,1±2,2* | 16,6±1,4 | 11,11±1,97** | |
| 5 мг/кг | 1,3±0,27 | 23,4±1,3** | 15,5±0,9* | 7,44±1,04** | |
| 20 мг/кг | 0,8±0,18 | 19,6±1,4** | 13,1±1,4** | 9,00±1,7** | |
| *Р<0,05, **P<0,01 |
В качестве Т- клеточного митогена нами использовался фитогемагглютинин (ФГА), в качестве В- клеточного митогена - бактериальный липополисахарид.
Экстракты отдельных растений и НЭС спонтанную пролиферацию лимфоидных клеток селезенки мышей, пролиферативный ответ на Т-клеточный митоген фитогемагглютинин. Экстракт цветков ромашки обладает умеренным стимулирующим действием на супрессорный Т-клеточный митоген конканавалин-А, а также обладает выраженным стимулирующим влиянием на индукцию пролиферативного ответа спленоцитов В-клеточным митогеном липополисахаридом (табл.22).
Таблица 22
Влияние курсового введения экстрактов цветков ромашки, травы очанки, ФЭС и НЭС на спонтанную и митоген-индуцированную пролиферацию Т-лимфоцитов
| Группа животных | Без митогена | ФГА | Кон - А | ЛПС | |
| Экстракт цветков ромашки | Контроль | 70080±958 | 55473±6583 | 63720±9441 | 25029±3610 |
| 1 мг/кг | 16949±268** | 56484±7671 | 75476±7140 | 37394±2087* | |
| 5 мг/кг | 16659±916** | 57307±6622* | 81234±9734** | 45020±1907** | |
| 20 мг/кг | 21721±998* | 55143±6204** | 84053±6110* | 41293±2760** | |
| ФЭС | Контроль | 7090±536 | 61246±7185 | 69643±6311 | 19993±2907 |
| 1 мг/кг | 17080±958** | 69589±3119 | 7171±9998 | 14144±2801 | |
| 5 мг/кг | 16124±348** | 65785±2640* | 6467±6203 | 17143±4210 | |
| 20 мг/кг | 17054±429** | 61166±2110** | 65463±12928 | 18564±3900 | |
| Экстракт травы очанки | Контроль | 7062±645 | 73444±8196 | 59013±6830 | 21129±3940 |
| 1 мг/кг | 6640±725 | 88976±9113 | 67121±4569 | 19078±4012 | |
| 5 мг/кг | 6141±705 | 96588±8950* | 62011±7111 | 24144±2920 | |
| 20 мг/кг | 6907±603 | 137449±9423** | 63189±7010 | 23025±1090 | |
| НЭС | Контроль | 8261±790 | 66223±8301 | 68420±9035 | 19506±2656 |
| 1 мг/кг | 16995±692** | 71927±9727 | 83016±4040 | 21911±1970 | |
| 5 мг/кг | 17204±695** | 74927±9727 | 89550±9125** | 24344±4040* | |
| 20 мг/кг | 17810±801** | 101809±9706** | 98101±14101** | 29340±3171** | |
| *Р<0,05, **P<0,01 |
Таким образом, включение в состав сбора растений действующих на отдельные звенья иммунной системы приводит к его сбалансированному стимулирующему влиянию на все звенья иммунной системы.
Влияние на рост опухолевых клеток. В качестве модели опухолевого роста мы использовали перевиваемые клеточные линии цервикальной карциномы (HeLa), колоректального рака (CaCo-2) и карциномы яичника (CaOv). В исходной культуре подсчитывали число клеток и преинкубировали в течение суток, затем добавляли к ним изучаемые растительные экстракты (фильтрационно стерилизованные) в дозе 0.1, 1.0, 10.0 мкг/мл. Исследуемые препараты добавляли в культуру клеток вместе с с радиоактивно (Н) меченным тимидином.
Большая часть исследуемых экстрактов не оказывала ни положительного, ни отрицательного эффекта на пролиферацию опухолевых клеток (рисунок 9).
Однако установлено, что экстракт листьев земляники тормозит рост низкодифференцированной линии опухолевых клеток СаОv на модели IN VITRO. В литературных данных мы нашли косвенное подтверждение этого факта, т.к. экстракт этого растения может индуцировать запрограммированную гибель клетки (апоптоз). В то же время, мы считаем более вероятным влияние компонентов экстракта на усиление дифференцировочных процессов и связанное с этим подавление митотической активности.
Безусловно, экстракт земляники или НЭС нельзя рассматривать как возможные противоопухолевые агенты. В то же время, их применение, возможно, будет полезно в целях профилактики развития опухолевого процесса, когда число образовавшихся опухолевых клеток невелико, и некоторое торможение их развития будет достаточным для полноценной активации иммунного процесса способного элиминировать злокачественный рост.
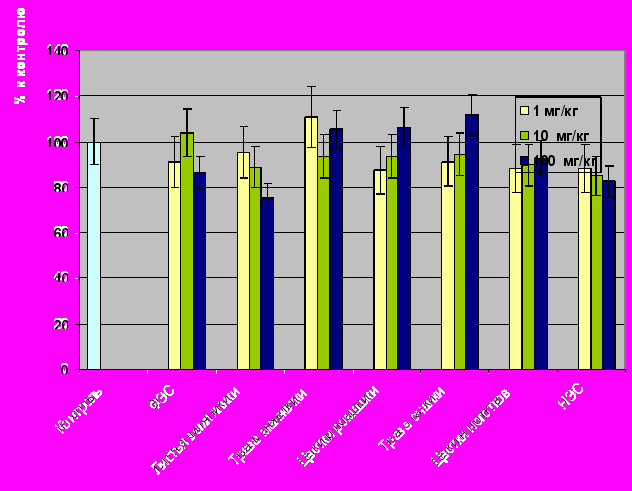
Рисунок 9. Влияние растительных экстрактов на уровень включения тимидина в ДНК опухолевых клеток линии CaOv
Влияние на репарационные процессы. В работе использовали эпителиальные клеточные линии WI-38, а также фибробласты, полученные из аорты крыс линии WISTAR. В опытные серии добавляли изучаемые экстракты в дозах 0,1; 1,0; 10,0 мкг/кг. После 72 часов инкубации клетки отделяли с помощью трипсина и подсчитывали количество живых клеток.
Результаты, представленные на рисунке 10 свидетельствуют, что ни один из изучаемых экстрактов не подавлял рост эпителиальных клеток или фибробластов в культуре. Экстракт травы манжетки, экстракт цветков ромашки и НЭС повышают пролиферацию нормальных эпителиальных клеток линии WI-38 до 110-130% от контрольного уровня. Эти же экстракты умеренно (до 20%) стимулируют пролиферацию нормальных фибробластов аорты крыс линии WISTAR (рис. 11).
В обоих случаях не было отмечено какого-либо влияния на морфологию клеток. Количество погибших клеток во всех опытных сериях и контроле было одинаковым. Это свидетельствует об отсутствии цитотоксических свойств у исследуемых экстрактов.
Ранее предполагалось, что возможное их ранозаживляющее действие связано с торможением процессов перекисного окисления возникающим в ране и препятствующим ее заживлению или предотвращением ферментативной деградации здоровых клеток в ране.
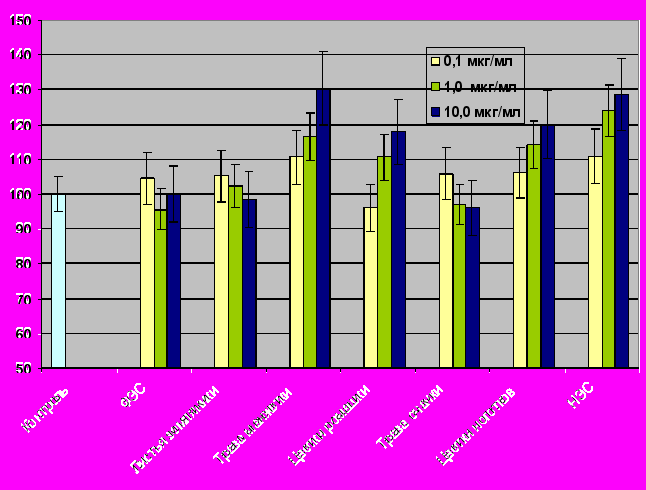
Рисунок 10. Влияние экстрактов растений и НЭС на пролиферативную активность эпителиальных клеток WI-38.
Теперь, можно утверждать, что вещества, содержащиеся в исследуемых растениях и их экстрактах, могут оказывать и прямое стимулирующее действие на пролиферативные процессы в ране, что способствует ее быстрому заживлению.
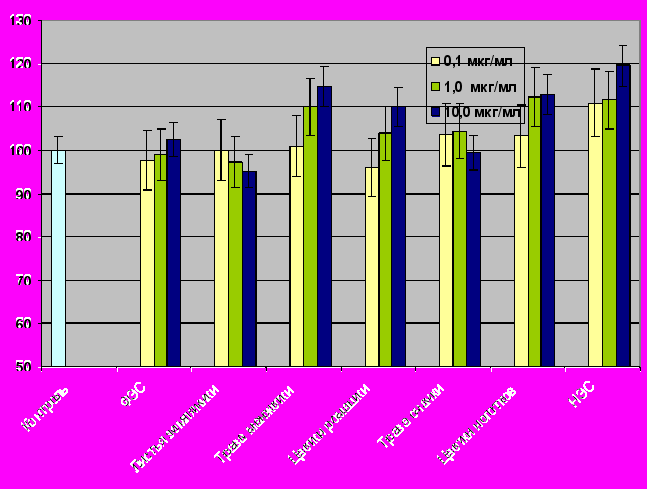
Рисунок 11. Влияние экстрактов растений и НЭС на пролиферативную активность фибробластов аорты крыс
Методом линейных ран на белых беспородных крысах обоего пола установлено ранозаживляющее действие ПЛ «Фиадент».
Противовоспалительное действие. Антиэкссудативные свойства ФЭС изучены на моделях адреналинового отека у мышей и формалинового отека лапы крыс. Установлено, что он проявляет активность сопоставимую с ортофеном. На модели острого каррагенинового отека установлено антиэкссудативное действие ПЛ «Фиадент».
Антипролиферативные свойства ФЭС оценивали на модели «ватной гранулемы». Экстракт оказывал выраженное влияние на фазу пролиферации, сопоставимое с действием фенилбутазона.
Общие выводы
- Разработана методология создания лекарственных средств на основе сырья природного происхождения.
- На основании литературных данных и собственных исследований разработан сбор «Нормофит», определены его товароведческие показатели, установлены нормы содержания основных групп БАВ: флавоноидов, полисахаридов, а также аминокислот, макро- и микроэлементов. Предложен унифицированный подход к стандартизации сырья, экстрактов, лекарственных форм на их основе.
- На основании изучения основных факторов влияющих на процесс извлечения БАВ разработаны технологии получения ФЭС и НЭС.
- Сформулированы медико-фармацевтические требования к пленочным системам трансмукоидного назначения, обеспечивающие их функциональную пригодность при аппликационной терапии. Теоретически и экспериментально обоснованы составы и технология полимерной матрицы – носителя на основе биодеградирующих полимеров природного происхождения (Na КМЦ, Na альгинат).
- С учетом сформулированных требований созданы новые лекарственные формы – ПЛ «Фиадент», ПЛ «Нормофит», ПЛ с пиявитом. Предложена оптимизация проведения биофармацевтических исследований по изучению БД и кинетики высвобождения лекарственных веществ из лекарственных форм методом кондуктометрии. Изучен механизм релиза БАВ, позволяющий охарактеризовать пленки как матричные системы диффузионного типа.
- Разработан состав и технология получения гранул ФЭС. Предложена влажная грануляция с добавлением экстракта дробно рассчитанными порциями.
- Результаты исследований лекарственных форм нашли отражение в разработке нормативной документации: ФСП «Фиалки экстракт сухой», проектов ФСП «Пленки лекарственные «Фиадент», «Гранулы фиалки экстракта сухого», «Сбор «Нормофит», «Нормофит» экстракт сухой», «Пленки лекарственные «Нормофит», «Пленки лекарственные с пиявитом».
- На основании фармакологических исследований установлено наличие противовоспалительной, регенерирующей, иммуномодулирующей активности экстрактов и их ЛФ. Результаты доклинического токсикологического исследования ФЭС свидетельствуют, что препарат обладает малой токсичностью как при однократном введении внутрь белым мышам и крысам, так и при длительном (6 мес) введении крысам и собакам. Препарат не вызывает отдаленных отрицательных эффектов (мутагенность, эмбриотоксичность, тератогенность, аллергизирующие свойства).
Основное содержание работы изложено в следующих публикациях:
- Исследование по разработке состава и технологии фитопленок /Олешко Л.Н., Олешко Г.И., … Блинова О.А. //Тез. докл. Научно - практ. конф., посв. 25-ти летию фармац. факультета Самарского ГМУ.- Самара: Сам ГМУ, 1996.- С. 58-59.
- Биорастворимые лекарственные пленки - эффективное средство аппликационной терапии в стоматологии /Олешко Л.Н., Симановская Е.Ю., Болотова М.Ф., Блинова О.А. и др. //Материалы конференции, посвященной 35-летию ЦНИИС, М., 1998.-С.88-92.
- Исследования по выбору состава матрицы для биорастворимых лекарственных пленок. /Олешко Л.Н., Голованенко А.Л., Блинова О.А. и др. //Материалы юбил. межвуз. научно-практ. конф. профессорско-препод. состава, посв. 275-летию г. Перми и 80-детию фармац. образования на Урале.- Пермь, 1998.- С.117.
- Идентификация биологически активных соединений методами ТСХ и ВЭЖХ /Петухова Т.В., Олешко Л.Н., Блинова О.А. и др.//Актуальные проблемы медицины и фармации: Мат. 63-й итоговой научн. конф. молодых ученых и студ. - Курск, 1998.-С. 232-233.
- Исследование фитопленок, содержащих биологически активные вещества из травы фиалки трехцветной и полевой /Олешко Л.Н., Симановская Е.Ю., Печерская Л.Г., Блинова О.А. и др. //Стоматология западного Урала: состояние, проблемы, перспективы: Мат. научно-практ. конф. Пермской ассоциации стоматологов. - Пермь, 1998.- С.25-26.
- Использование лекарственных пленок в комплексной терапии стоматологических заболеваний /Олешко Л.Н., Симановская Е.Ю., Болотова М.Ф., Блинова О.А. и др. //Стоматология западного Урала: состояние, проблемы, перспективы: Мат. научно-практ. конф. Пермской ассоциации стоматологов. - Пермь, 1998.-С.23-24.
