Конкурс «Моя творческая лаборатория» Урок химии в 8 классе Учитель: Сеитова Г. Б
| Вид материала | Конкурс |
- Урок презентация по химии в 8 классе на тему: Предмет химии. Вещества, 263.29kb.
- Урок химии в 9 классе Тема: История в металлах, металлы в истории, 101.92kb.
- О. Ю. учитель химии, Горюнов А. Е. учитель географии, Жарких Н. В. учитель биологии, 53.71kb.
- Марина Ольга Васильевна Учитель русского языка и литературы моу кудиновская средняя, 59.24kb.
- Конкурс "Современный урок" Урок биологии в 7 классе. Тип членистоногие, 119.78kb.
- Урок литературы в 6 классе. Учитель О. С. Маевская Вконце прошлого года мы прочитали, 39.61kb.
- Урок развития речи в 6 классе. Тема: Сочинение- описание с элементами повествования., 40.89kb.
- Урок-презентация по химии, биологии, географии. Тема урока : «Нефть, состав нефти, 132.15kb.
- Урок литературного чтения в 4 классе. Творческая мастерская «Сочиним сказку», 66.36kb.
- Творческая работа на конкурс молодёжных творческих проектов: «Моя профессиональная, 442.49kb.
Акмолинская область
Щучинский район
Конкурс «Моя творческая лаборатория»
Урок химии в 8 классе

Учитель: Сеитова Г.Б.
Окжетпесская средняя школа
2008-2009 учебный год
Тип урока: комбинированный
Задачи урока:
Образовательные:
повторить и обобщить изученный материал о структуре ПСХЭ;
изучить планетарную модель атома;
дать понятие о строении атома и составе атомного ядра.
Развивающие:
отработать навыки определения состава атома, состава ядра атома по периодической системе химических элементов;
продолжить развитие навыков работы с Периодической системой Д.И.Менделеева;
реализовать элементы программ развития мышления, внимания, мотивации;
развивать интеллектуальные и творческие способности учащихся;
раскрыть взаимосвязь понятий: протон, нейтрон, массовое число, состав, строение;
стимулировать познавательную активность ребят, развивать интерес к предмету, смекалку, эрудицию, умение быстро и четко формулировать и высказывать свои мысли, логически рассуждать, применять свои знания на практике.
Воспитательные:
формирование химической культуры;
формирование взаимопомощи, доброжелательного отношения друг к другу, умения выслушать других при работе в классе, в группах;
воспитывать чувство сопричастности общему делу, умение работать коллективно;
воспитывать у учащихся трудолюбие, аккуратность и ответственность, любовь и интерес к предмету.
Методы обучения:
Перцептивный аспект – объяснение по презентации
Гностический аспект - эвристический метод
Управленческий аспект - работа под управлением, самостоятельная, парная
Мотивационный аспект - игры, неожиданность, занимательность
Аспект контроля: устный, письменный, фронтальный, групповой, индивидуальный, тестовый.
Формирование компетентности учащихся на различных этапах урока
I. Оргмомент
II. Ориентировочно-мотивационный этап - формирование самообразовательной компетентности
III. Операционно-исполнительский этап - формирование познавательной и информационной компетентности
Динамическая пауза - формирование компетентного отношения к своему здоровью
IV. Коррекция и первичная проверка знаний - формирование компетентности, которая оказывает содействие саморазвитию; формирование коммуникативной и познавательной компетентностей, развивать индивидуальные способности
V. Рефлексивно-оценочный этап - формирование интеллектуальной компетентности
VI. Домашнее задание - формирование интеллектуальной компетентности и компетентности, которая оказывает содействие саморазвитию.
Дидактическое и методическое оснащение урока:
1. Учебник «Химия», 8 класс, Н.Н.Нурахметов.
2. Презентация.
3. Раздаточный материал.
4. «Чёрный ящик»
Оборудование:
1. Периодическая система Д.И.Менделеева.
2. Компьютер, мультимедийный проектор, экран.
Эпиграф урока: “Отыщи всему начало и ты многое поймёшь”. (Козьма Прутков.)
Ход урока
I. Оргмомент (эмоциональный настрой)
Учитель.
Вот и прозвенел звонок,
Начинается урок.
Урок сегодня вроде и обычный,
И в то же время от других отличный…
Работы много предстоит,
Никто без дела не сидит!
Уважаемые ребята, я рада приветствовать вас. Представлюсь – Сеитова Гульнара Байтасовна, учитель химии и биологии Окжетпесской средней школы.
II. Ориентировочно-мотивационный этап.
Когда человек знакомится с чем-то новым, то всегда задается вопрос: " Чем оно так интересно и значимо для меня?" Ответом на этот вопрос будут слова Козьмы Пруткова. Слайд 1
Учитель.
Прежде чем приступить к уроку, заранее
Приготовила я сегодня для вас задания.
Вначале
 мы о таблице Менделеева
мы о таблице Менделеева Устно поговорим
А потом письменно задания решим
Не будь тороплив, будь памятлив! (девиз)
1. Игра «Найди свою пару» Одному ученику - вопрос, другому – ответ.
1. Ко времени открытия периодического закона сколько элементов было известно? 63
2. Когда и кем был открыт Периодический закон? Менделеевым в 1869 году
3. Вертикальные ряды, в которых находятся элементы, принадлежащие к одному естественному семейству, – это группы
4. Как называются металлы I группы Периодической системы? щелочные
5. Как называются элементы главной подгруппы VII группы? галогены
6. Ряд химических элементов, который начинается щелочным металлом и заканчивается инертным элементом - это период.
7. Периоды бывают … малые и большие
8. Группы делятся на … главные и побочные
9. 1 марта этого года у Периодической системы – юбилей. Сколько лет мы будем праздновать? Сто сорок
2. Тесты
Вариант 1.
1. Какой элемент наиболее распространен в Солнечной системе:
А) водород
Б) кислород
В) углерод
2. Четвертый период периодической системы содержит:
А) 2 элемента
Б) 18 элементов
В) 8 элементов
3. Какой из приведенных элементов назван в честь континента:
А) азот
Б) золото
В) америций
4. Периодический закон был сформулирован Д И.Менделеевым 1 марта:
А) 1769 г.
Б) 1869 г.
В) 1800 г.
5. Малые периоды — это:
А) 1, 2 и 3-й
Б) 3-й и 4-й
В) 5-й и 6-й
Вариант 2.
1. Какой элемент в Периодической системе стоит под номером 1:
А) водород
Б) кислород
В) углерод
2. Второй период периодической системы содержит:
А) 2 элемента
Б) 8 элементов
В) 18 элементов
3. Какой из приведенных элементов назван в честь страны:
А) кремний
Б) нептуний
В) индий
4. Кто открыл Периодический закон?
А) Ломоносов М.В.
Б) Менделеев Д.И.
В) Лавуазье А.Л.
5. Большие периоды – это:
А) 5-й и 6-й
Б) 3-й и 4-й
В) 1, 2 и 3-й
3. Проверка тестов. Слайд 2.
Гимнастика для глаз.
III. Операционно-исполнительский этап. Мудрым никто не родился, а научился!(девиз)
1. Игра "Чёрный ящик"
– Попробуйте с 3-х попыток угадать содержимое ящика:
1 попытка – «Отыщи всему начало и ты многое поймёшь» Слайд 3.
2 попытка – в переводе с греческого обозначает «химически неделимый»
3 попытка – из него состоит молекула
Напомните, пожалуйста, определение «Химический элемент»
Учитель: Вы догадались, о чём пойдёт сегодня речь?
Ученики отвечают: атом
Итак, тема урока: “Строение атома. Состав атомного ядра”. Запишите тему в тетрадь. Слайд 4.
Цель урока: Слайд 5
- Формирование знаний о строении атома, составе атомного ядра.
- Развитие внимания, мышления, мотивации.
- Умение работать в коллективе, группе.
2. Изучение темы «Строение атома. Состав атомного ядра». Слайд 6. пауза
Атом - наименьшая частица химического элемента, являющаяся носителем его свойств.
Ребята, на прошлом уроке вы давали формулировку периодического закона Менделеева. Напомните её.
Все ли элементы расположены в ПСХЭ в порядке возрастания атомных масс? Оказывается, нет. Почему? Ответ на этот вопрос нашли учёные – физики. Слайд 7.
Планетарная модель строения атома предложена Э.Резерфордом в 1911 году.
В центре атома находится положительно заряженное ядро, вокруг которого
вращаются отрицательно заряженные электроны. Слайд 8.
Ядро-это центральная часть атома, в котором сосредоточена практически
вся его масса. Ядро имеет положительный заряд, равный количеству
протонов, находящихся в нем. Кроме протонов в ядре также находятся
нейтроны-частицы, имеющие массу, но не обладающие зарядом
Ar = m (p)+ m (n) Слайд 9.
Протоны и нейтроны имеют следующие характеристики:
масса заряд
p+ 1 +1
n0 1 0
Mасса атома складывается из суммы масс протонов и нейтронов Слайд 10.
Вокруг ядра движутся электроны (e-), образующие электронную оболочку,
размеры которой определяют размеры самого атома.
Заряд e- по величине равен заряду p+, но противоположен по знаку.
Обобщим все полученные сведения Слайд 11. пауза
Основные характеристики элементарных частиц
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон -p+ | 1 | +1 | Число протонов равно порядковому номеру элемента |
| Нейтрон –п0 | 1 | 0 | Число нейтронов находят по формуле: N=Ar-Z |
| Электрон е- | 1/1837 | -1 | Число электронов равно порядковому номеру элемента |
Ребята, как вы думаете, в каком порядке стоят элементы в ПСХЭ?
Ответы учащихся. Правильно.Итак, Слайд 12.
Современная формулировка Периодического закона.
Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.
Запись строения атома Слайд 13.
Пример: показать строение атома цинка.
65
Zn (31 p+, 34 n0) 31e-
31
Заставка Слайд 14.
Динамическая пауза « Периодическая система»
| Слоганы | Упражнения |
| Раз – два – руки в горизонтали, | Обе руки в горизонтальной плоскости одновременно вправо – влево; |
| Три – четыре – руки по вертикали. | Обе руки одновременно резким движением поднимаются вверх и опускаются вниз. |
| Помни, период – это горизонталь, | Руки на пояс, наклоны туловища вправо и влево; |
| Ну а группа – это вертикаль! | Руки на пояс, прыжки на месте. |
20 минут
IV. Коррекция и первичная проверка знаний.
1. Загадки
Он бежит по проводам, он бывает тут и там,
Свет зажег, нагрел утюг, он, конечно, - лучший друг.
Если в атом он попал – то, считай, почти пропал:
Он с утра и до утра носится вокруг ядра. (Электрон)
Очень положительный с массой внушительной.
А таких, как он – отряд, создают в ядре заряд.
Лучший друг его – нейтрон.
Догадались? Он … (Протон)
Зарядом я похвастать не могу,
А потому сижу в ядре, и ни гу-гу.
А то еще подумают: шпион,
А я нейтральный и зовусь … (Нейтрон)
2. Конкурс “Светофор”. Не обдумав, не решай, а, решив, не передумай! Слайд 15.
Для этого конкурса каждому ученику выдаётся “Светофор”. “Светофор” - это длинная полоска картона, с одной стороны - красная, с другой – зелёная. Во время конкурса по одному ученику выполняют задание на доске, а остальные учащиеся – в тетрадях. Когда задание выполнено, если ученик согласен с решением – поднимает зелёный сигнал “Светофора”, не согласен – красный. На второе задание выходит отвечать следующий учащийся.
Заполните пропущенные клетки в таблице.
| | Число | Элемент | ||
| | протонов | нейтронов | электронов | |
| 1 | 7 | 7 | 7 | N |
| 2 | 24 | 28 | 24 | Cr |
| 3 | 56 | 81 | 56 | Ba |
3. Работа в парах по алгоритму (он на доске) Слайд 16.
Ум – хорошо, а два – лучше!
Алгоритм
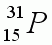
1. III период, V группа
2. Заряд ядра +15
3. Состав атома: (15 p+, 16 n0) 15 е-.
Задания для групп
Карточка №1
1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева.
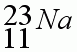
2. Определите заряд ядра.
3. Каков состав атома?
Карточка №2
1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева.
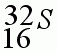
2. Определите заряд ядра.
3. Каков состав атома?
Карточка №3
1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева.
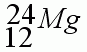
2. Определите заряд ядра.
3. Каков состав атома?
Карточка №4
1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева.
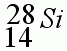
2. Определите заряд ядра.
3. Каков состав атома?
Карточка №5
1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева.
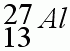
2. Определите заряд ядра.
3. Каков состав атома?
Карточка №6
1. Запишите “домашний адрес”, т.е. положение в периодической системе химического элемента Д.И.Менделеева.
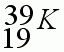
2. Определите заряд ядра.
3. Каков состав атома?
Умелые руки – помощники науке!
Карточка №7
В ядре атома химического элемента содержится 1 протон, 1 электрон. Определите элемент. Составьте формулу его оксида. Опытным путем докажите наличие его в пробирке.
Карточка №8
В ядре атома химического элемента А содержится 11 протонов, а в ядре атома химического элемента В 17 электронов. Определите элементы. Составьте формулу соединения этих элементов. Получите раствор данного вещества.
Карточка №9
В ядре атома химического элемента содержится 6 протонов, 6 электронов. Определите элемент. Составьте формулу его оксида. Охарактеризуйте оксид.
Дополнительные задания: №2, №3 стр. 147 учебника.
V. Рефлексивно-оценочный этап. Мало хотеть, надо уметь! (девиз)
1. «Крестики-нолики» Если согласны – руки вверх, не согласны – машем руками. Слайд 17.
Вопросы:
1. Модель строения атома была предложена Э.Резерфордом в 1911 году. Х
2. В центре атома находится отрицательно заряженное ядро. О
3. Вокруг ядра вращаются положительно заряженные электроны. О
4. Заряд протона равен -1. О
5. Заряд нейтрона равен 0. Х
6. Величина и знак зарядов электрона и протона равны. О
7. Число протонов равно порядковому номеру элемента. Х
8. Число нейтронов находится по формуле N=Ar + Z. О
9. Всему начало – атом. Мы сегодня в этом убедились. Х
2. Творческий проект
3. Синквейн Слайд 18.
4. Сочинение.
Как вы думаете, о чём идёт речь в сочинении?:
“Атом мне представляется одной большой семьёй. В центре семьи, конечно же, родители: очень добрая, заботливая, положительная мама и строгий, но справедливый, словом нейтральный папа. А вокруг них вечные двигатели, вечные прыгатели – дети, которые не присядут ни на минутку. Они словно маленькие “энерджайзеры”, у них много-много дел, им хочется всё увидеть, всё услышать, всё узнать. И чем больше запас их энергии, тем дальше убегают они от родителей. Для того чтобы семья была гармоничной: чтобы дети могли получить хорошее образование, развивать свои способности в музыкальной школе, в изостудии, в танцевальных коллективах, в спортивных секциях и т.д.; чтобы папа и мама могли позволить себе посещать театры, концерты, путешествовать и прочие радости жизни, родители очень много трудятся. Папа выполняет нейтральные дела, а мама – только положительные, за каждое дело они получают единицу зарплаты. Поэтому общая зарплата папы и мамы составляет доход всей семьи. Чем больше в семье детей, тем больше трудятся родители. Вот такой он крошечный, невидимый, но сложный и интересный атом”.
Как вам кажется ребята, какими научными терминами можно назвать положительная мама, нейтральный папа, дети, нейтральные дела, положительные дела, единица зарплаты, доход всей семьи.
VI. Домашнее задание: § 53, 54 №4 стр. 146, №4 стр.147, опорный конспект Слайд 19.
Творческое задание: написать эссе об атоме
На маленьких атомах составить предложения.
Учитель.
Сейчас прозвенел для всех нас звонок. Слайд 20.
Увы, но к концу подошел наш урок.
И я благодарность вам всем объявляю,
Оценки все ваши в журнал выставляю.
Большое спасибо я вам говорю.
Мы цели достигли. Благодарю!
