Тема 21. Авторские педагогические технологии, приемы и средства обучения химии в школе
| Вид материала | Документы |
- Доклад на тему: «Здоровьесберегающие технологии в школе», 39.98kb.
- Применение информационных технологий в процессе обучения химии, 213.65kb.
- Методические приемы и педагогические технологии, связанные с формированием у учащихся, 87.53kb.
- Рабочая программа дисциплины (модуля) Технологии обучения химии, 282.52kb.
- Программа вступительного экзамена для поступления в магистратуру по профессиональнообразовательной, 85.07kb.
- Тема 18. Современные педагогические технологии в повышении эффективности обучения, 216.86kb.
- Планы лекций по дисциплине б. 5 Педагогические технологии для специальности/направления, 24kb.
- Формы, модели обучения, методы, технологии, приемы развития универсальных учебных действий, 244.05kb.
- Педагогические технологии, 89.2kb.
- Тема Методика обучения химии как наука и учебный предмет в педвузе, 398.5kb.
Загадки
| Я - газ редчайший на Земле. Мне близки радий и свинец. Но если переставить буквы мне, То я уже - истории творец. /Радон - народ/ Элемент IV группы Перед всеми на виду. Если Т на Р исправить Будет деспот наяву. /Титан - Тиран/ | Я - энергии источник. И сказать могу вам точно: «Сумел Клапрот меня открыть, Эжен Пелиго – получить». Но если буквы переставить И в углу меня поставить, Буду стойко там стоять, Молча мусор собирать. /Уран - Урна/ |
Высказывание М.В. Ломоносова.
Перед вами не гигантская формула неизвестного вещества. Здесь зашифрованы слова М.В. Ломоносова о том, каким должен быть настоящий химик.
| Ti2 S Hg2 О2 Na Ne As2 K 5 Cr Li2 Cu I K Cu3 H2 Cl2 Те Nе Br As2 F2 Cu4 N4 Bе2 Sn Ag3 Fe2 Тс Zn2 Cd I2 Mg О2 Pt Rb Ar K Te K4 Si Os Mo |
| Ответ. Чтобы расшифровать запись нужно в названии элемента выбрать по одной букве, соответствующей индексу химического знака. В итоге получим слова великого ученого: «Истинный химик должен быть теоретиком и практиком». |
Игра "ПАРАД ХИМИЧЕСКИХ ЭЛЕМЕНТОВ"
Цель. Заинтересовать учащихся, повысить уровень их внимания к изучаемому материалу.
Описание игры. Из картона готовится карточка /20x15см/ с семью отверстиями. Возле каждого отверстия пишутся символ и название элемента. Ведущий предлагает одному из учащихся задумать один из элементов на карточке, кладет ее на стол тыльной стороной вверх и "волшебной" палочкой прикасается поочередно к отверстиям на карточке. Ученик в это время на каждое прикосновение произносит про себя по одной букве название задуманного элемента, а на последней букве произносит вслух: "Стоп". Ведущий продевает палочку через указанное отверстие и поднимает карточку. Отверстие, в которое вдета палочка, соответствует задуманному элементу.

П р и м е р к а р т о ч к и
Объяснение. Первые три прикосновения делаются произвольно. Четвертым – указывается на отверстие слева /цинк/, следующие прикосновения – через одно отверстие против часовой стрелки. Принцип игры основан на последовательном увеличении числа букв в названиях приведенных элементов и их закономерном расположении по кругу отверстий. Вместо химических элементов можно вписать названия любых групп понятий или веществ в зависимости от дидактической цели игры, и вы получите совершенно другой "парад".
Краткий "энциклопедический" словарь
Наш словарик необычный. Определяемые слова зашифрованы в виде буквенных ребусов. Однако и буквы здесь не обычные, а знаки химических элементов.
1,Э,2,
Ar, ,At - летательный аппарат, наполняемый газом легче воздуха. (Аэростат)
B Ne, - остров в Малайском архипелаге. (Борнео).
;Au - настольная игра, в которой особыми фишками закрываются карточки с номерами или картинками. (Лото)
M=В
Cu, Cu - крупное хищное животное класса млекопитающих. (Медведь)
As; - животное из отряда грызунов. (Мышь)
6,5 7,2
Ge Se Ge - жители страны, местности, города. (Население)
 тонко скрученная пряжа или изделие. (Нитка)
тонко скрученная пряжа или изделие. (Нитка)a=o
Pt - гидротехническое сооружение на реке или другом водоеме, предназначенное для подъема уровня воды. (Плотина)
Rn; Ar; - радиолокационная установка. (Радар)
;Ag - отрезок, лежащий на пересечении граней геометрического тела. (Ребро)
,Xe, - корм для домашних животных в виде высушенной травы. (Сено)
1=C
Sn - структурная единица языка, служащая для обозначения понятий, предметов, действий. (Слово)
1,2,4
U, Hf - ветер разрушительной силы. (Ураган)
 Металлы и неметаллы
Металлы и неметаллыВ этих маленьких ребусах зашифрованы названия двенадцати химических элементов. Расшифруйте их и установите, какие из этих элементов образуют простые вещества в виде металлов, а какие - в виде неметаллов. Есть ли среди данных элементов такие, которые образуют аллотропные видоизменения? Какие из этих веществ находятся при обычных условиях в газообразном состоянии?
Какой из этих элементов был известен человечеству с давних времен, а какой из них был открыт последним?
Примеры ЗАНИМАТЕЛЬНЫХ ОПЫТОВ
ПОЛУЧЕНИЕ "ЗОЛОТА"
Готовят равные объемы 3%-ного раствора иодида калия и 4%-ного раствора ацетата свинца. Перед опытом растворы доводят до кипения и сливают вместе в колбу. При остывании в осадок выпадает иодид свинца, который хорошо растворим в горячей воде, но весьма мало — в холодной (менее 0,1 %). Осадок образуется в виде тонких блестящих на свету чешуек золотистого цвета. Размеры их зависят от скорости осаждения, чем медленнее охлаждается раствор, тем крупнее кристаллы.
ДЫМ БЕЗ ОГНЯ
Описано много различных вариантов занимательных опытов, основанных на реакциях взаимодействия газообразных аммиака и хлороводорода с образованием аэрозоля хлорида аммония. Приводим один из них. В чистую сухую широкогорлую колбу объемом 200 мл наливают 3-5 мл концентрированного раствора соляной кислоты. Вращательным движением колбы смачивают кислотой стенки сосуда, выливают избыток раствора и плотно закрывают пробкой. В другую, точно такую же, колбу аналогичным способом набирают раствор аммиака (25%).
Во время опыта колбы открывают и соединяют горлышками одна к другой, поворачивая их в таком положении на 180°. Колбы заполняются густым белым дымом.
РАЗНОЦВЕТНОЕ ПЛАМЯ
Готовят насыщенные растворы бертолетовой соли в воде (около 8 г соли на 100 мл воды), с добавлением различных других солей.
Из фильтровальной бумаги вырезают различные фигуры (круги, треугольники, квадраты и т.д.) небольшого размера, опускают в соответствующий раствор и высушивают, повторяя эту операцию несколько раз, чтобы в порах бумаги появились кристаллики бертолетовой соли. Хорошо высушенные бумажные фигурки при поджигании быстро сгорают, образуя разное по цвету пламя.
В качестве добавок к раствору бертолетовой соли берут по 2-3 г хлорида натрия (желтое пламя), нитрата стронция, хлорида лития (красное пламя), хлорида меди (изумрудное пламя), нитрата бария (зеленоватое пламя). Часть бумажных фигурок пропитывают раствором бертолетовой соли без добавок, пламя приобретает фиолетовый оттенок.
"ВОДА" ЗАЖИГАЕТ КОСТЕР
На асбестовую сетку ставится небольшая фарфоровая чашечка (можно часовое стекло) с небольшим количеством смеси перманганата калия с серной кислотой. На фарфоровую чашечку и вокруг нее накладывают сухие лучинки, имитирующие костер.
Для зажигания полученного костра, смачивают ватку "водой" (этиловым спиртом) и выжимают над ним так, чтобы капли попали в чашечку. Спирт (можно брать денатурат) воспламеняется, поджигая затем и лучинки.
ЗОЛА — КАТАЛИЗАТОР
Если кусочек сахара внести с помощью пинцета в пламя горелки, то он начнет плавиться и обугливаться, но не загорается.
Если же на сахар насыпать немного пепла от сожженного лаврового листа и внести в пламя, то сахар загорится и будет гореть даже вне пламени горелки.
ЗАЖИГАНИЕ СПИРТОВКИ
Спиртовку можно зажечь с помощью сильных окислителей. Одним из таких является оксид марганца (VII). Для его получения насыпают кучкой в фарфоровую чашечку 0,5 г марганцовокислого калия и подливают сбоку к кучке соли 2-3 капли концентрированной серной кислоты. Образовавшуюся кашицу набирают на кончик стеклянной палочки, которой касаются фитиля спиртовки (фитиль должен быть хорошо смочен спиртом). Спиртовка тут же загорается. Примечание. Следует избегать больших количеств перманганата и кислоты для приготовления смеси.
ИСЧЕЗНОВЕНИЕ ОКРАСКИ
В трех стаканах налиты окрашенные водные растворы, в первом — фиолетовыми чернилами, во втором — синим лакмусом, в третьем — красным лакмусом (лакмоидом).
Из колбы, в которую налита бесцветная жидкость (раствор отбеливателя "Белизна" с несколькими каплями соляной кислоты), приливают раствор в стаканы. Окрашенные растворы обесцвечиваются. Опыт можно разнообразить, применяя другие органические красители для приготовления окрашенных растворов, обесцвечивающиеся под действием хлора.
ПОЛУЧЕНИЕ "МОЛОКА"
Смеси, имитирующие молоко, можно получать, смешивая 10%-ные растворы нитрата бария и сульфата натрия; хлорида кальция и гидрокарбоната натрия.
"Молоко", полученное вторым способом, можно превратить в газированную "воду", добавив в него небольшими порциями концентрированную соляную кислоту до полного растворения карбоната кальция.
ВОПРОСЫ И ЗАДАНИЯ
- Какие варианты из приведенных игр, вербальных форм занимательности и занимательных опытов, на ваш взгляд, наиболее эффективны?
- Составьте варианты дидактических игр, вербальных форм занимательности и занимательных опытов к Вашей теме.
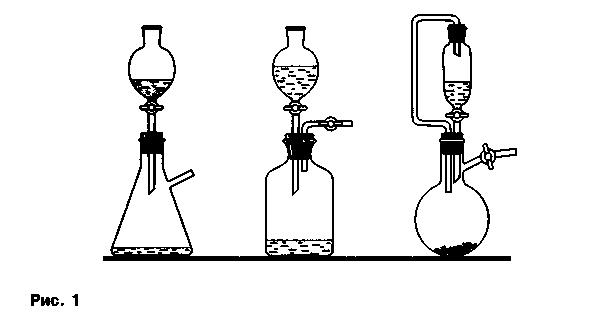
8. Унификация химического эксперимента. Под унификацией химического эксперимента в обучении мы подразумеваем рациональное сокращение видов приборов и установок, с помощью которых осуществляется проведение опытов. В предлагаемом приборе (иногда с дополнениями или изменениями) можно с успехом проводить различные химические реакции, как во время демонстрационных опытов, так и в ходе ученического эксперимента.
Основу прибора составляют колба или склянка вместимостью 50-200 мл, пробка с делительной воронкой (соответственно колбе) на 25-100 мл, у прибора должна быть газоотводная трубка. Возможны самые разные модификации унифицированного прибора (с использованием колб Вюрца, Бунзена и т. д.) (рис. 1).
Применение данной установки обеспечивает безопасность проведения химических опытов, так как выделение газообразных и летучих ядовитых веществ можно количественно регулировать и направлять их либо непосредственно для проведения реакций с участием этих газов, либо для улавливания поглотительными приборами.
Другое преимущество данного прибора — возможность быстрой и точной дозировки исходных веществ, используемых для эксперимента. Вещества и растворы помещают в колбы и делительные воронки заранее, до начала занятий, в необходимом количестве, а не на глазок, как это обычно бывает при демонстрации опытов в пробирках или стаканах, когда вещества и растворы набирают непосредственно на уроке во время показа опытов.
При использовании прибора достигается восприятие опыта всеми учащимися, а не только теми, кто сидит на первых партах, как это бывает при проведении опытов в пробирках. Рекомендуемый прибор позволяет осуществлять качественные и количественные эксперименты по химии в школе, а также в средних специальных и высших учебных заведениях. Проиллюстрируем принципиальное применение прибора на примере некоторых опытов, сгруппировав их по сходным признакам.
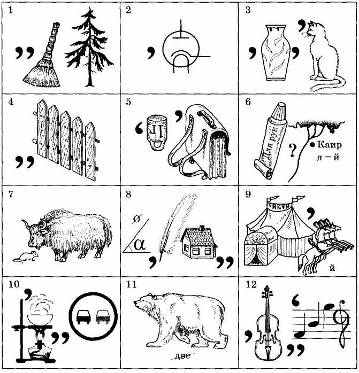
Получение газов. В основе получения большинства газов, изучаемых в школе, лежат гетерогенные реакции между твердыми и жидкими фазами. Твердую фазу помещают в колбу, которую закрывают пробкой с воронкой и газоотводной трубкой. В воронку наливают соответствующий раствор или жидкий реагент реакции, прибавление которого в колбу дозируется с помощью крана делительной воронки. При необходимости колбу с реакционной смесью нагревают, регулируя объем выделяющегося газа и скорость реакции.
Используя прибор и соответствующие реактивы, можно получать кислород, озон, хлор, водород, углекислый, угарный и сернистый газы, галогеноводороды, азот и его оксиды, азотную кислоту из нитратов, этилен, ацетилен, бромэтан, уксусную кислоту из ацетатов, уксусный ангидрид, сложные эфиры и многие другие газообразные и летучие вещества.
Естественно, что одновременно при получении газов с помощью прибора можно демонстрировать их физические и химические свойства.
Реакции между растворами. В данном приборе удобно проводить эксперименты, в которых добавление жидкого реактива необходимо осуществлять небольшими порциями или по каплям, когда на ход реакции влияет избыток или недостаток одного из исходных веществ и т. д., например:
-растворение серной кислоты в воде и соблюдение правил безопасности при этой операции;
-опыты, иллюстрирующие диффузию веществ в жидкостях или газах;
-определение относительной плотности взаимно нерастворимых жидкостей и образование эмульсий;
-растворение твердых веществ, явление флотации и образование суспензий;
-реакции гидролиза солей, если важно показать изменение степени гидролиза в зависимости от объема воды, прибавляемой к раствору соли;
-опыты, иллюстрирующие окраску индикаторов в различных средах и реакции нейтрализации;
-реакции между растворами электролитов;
-реакции, продолжительные по времени;
-реакции органических веществ (бромирование и нитрование бензола, окисление толуола, получение мыла и анилина, гидролиз углеводов).
Демонстрация характерных свойств изучаемого вещества. С помощью прибора можно последовательно и наглядно, с минимальной затратой времени демонстрировать характерные физические и химические свойства изучаемого вещества. При этом экономятся реактивы, достигается необходимая безопасность эксперимента (выделяющиеся вредные газы и летучие вещества улавливаются соответствующими поглотительными растворами), обеспечивается лучшее восприятие эксперимента всеми учащимися класса.
Рассмотрим подготовку и проведение эксперимента при демонстрации свойств соляной кислоты. Учитель до урока готовит необходимое число колб (по числу изучаемых реакций) и одну пробку с делительной воронкой и газоотводной трубкой в ней. В колбы заранее помещают вещества или растворы (цинк, медь, оксид меди (П), гидроксид меди (П), раствор гидроксида натрия с фенолфталеином, карбонат натрия, раствор нитрата серебра и т. д.). В делительную воронку наливают около 30 мл раствора 10-20 %-ной соляной кислоты. Во время урока учителю надо лишь переставлять пробку с делительной воронкой, наполненной кислотой, из одной колбы в другую, расходуя на каждую реакцию 3-5 мл раствора.
Если в ходе реакций образуются ядовитые летучие соединения, то газоотводную трубку прибора опускают в соответствующие растворы для поглощения этих веществ, а реакционную смесь в колбе после окончания опыта обезвреживают.
Растворимость газов в воде. Демонстрационный опыт растворимости газов в воде рассмотрим на примере оксида серы (IV). Для опыта потребуются два прибора. В первом приборе (в колбе — сульфит натрия, в делительной воронке — концентрированная серная кислота) получают оксид серы (IV), который способом вытеснения воздуха собирают в колбу второго прибора. После заполнения этой колбы газом в воронку наливают воду, газоотводную трубку опускают в стакан с водой, подкрашенной фиолетовым лакмусом или другим индикатором (рис. 2).
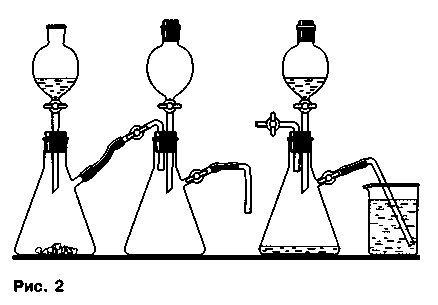 |
Если теперь открыть зажим или кран газоотводной трубки, то вследствие небольшой поверхности контакта (через внутреннее отверстие трубки) оксида серы (IV) и воды, заметное растворение газа с последующим фонтанированием жидкости в колбу происходит не сразу, а через довольно долгий промежуток времени, пока в колбе не создастся достаточное разрежение.
Чтобы ускорить этот процесс, из воронки в колбу наливают (при закрытом зажиме на газоотводной трубке) 1-2 мл воды и слегка встряхивают.
Этого объема воды вполне достаточно, чтобы давление в колбе понизилось, а подкрашенная индикатором вода при снятии зажима с газоотводной трубки фонтаном устремилась в колбу, меняя при этом цвет индикатора. Для усиления эффекта колбу можно перевернуть вверх дном, закрыв предварительно делительную воронку пробкой и не вынимая газоотводную трубку из стакана с водой.
Обесцвечивание красителей. В колбу прибора помещают около 0,5 г перманганата калия. В нижнюю часть пробки вкалывают две иголки, на которые накалывают по лоскутку окрашенной ткани или полоски лакмусовой бумаги. Один из образцов смачивают водой, второй оставляют сухим. Колбу закрывают пробкой, в делительную воронку наливают несколько миллилитров концентрированной соляной кислоты, газоотводную трубку опускают в раствор тиосульфата натрия для поглощения избытка выделяющегося хлора (рис. 3).
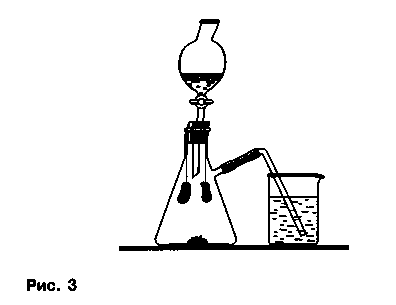
Во время демонстрации опыта кран делительной воронки приоткрывают и выливают кислоту по каплям в колбу, затем вновь закрывают кран. В колбе идет реакция между веществами с выделением хлора, влажная ткань или полоска лакмусовой бумаги обесцвечивается быстро, а сухой образец — позже, по мере его увлажнения.
Примечание. Многие ткани окрашены устойчивыми к хлору и другим отбеливателям красителями, поэтому необходимо провести предварительные испытания и заранее выбрать соответствующие образцы тканей. Таким же образом можно показать обесцвечивание красителей сернистым газом.
Адсорбционные свойства угля или силикагеля. В колбу помещают около 0,5 г порошка или стружки меди. В нижнюю часть пробки вкалывают кусочек металлического провода с загнутым концом, к которому прикрепляют небольшую сеточку, предназначенную для удержания активированного сорбента массой 5-15 г (рис. 4).
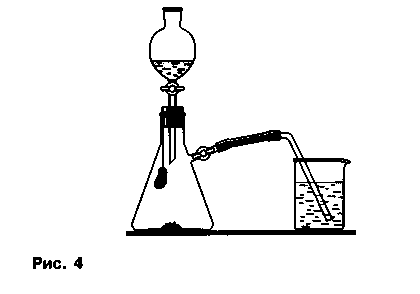
Колбу прибора закрывают подготовленной таким образом пробкой, а в воронку наливают азотную кислоту. Газоотводную трубку, снабженную зажимом (зажим до начала опыта открыт), опускают в стакан с подкрашенной водой. После сборки прибор проверяют на герметичность. В момент демонстрации опыта кран делительной воронки приоткрывают и выливают несколько капель кислоты в колбу, в которой происходит реакция с выделением оксида азота (IV). Не следует добавлять избыток кислоты, необходимо чтобы объем выделившегося газа соответствовал объему колбы.
После окончания реакции, что определяют по прекращению выделения пузырьков вытесняемого из колбы воздуха через газоотводную трубку, зажим на ней закрывают. Прибор устанавливают перед белым экраном. Об адсорбции оксида азота (IV) в колбе судят по исчезновению окраски газа. Кроме того, вследствие образования в колбе некоторого разрежения в нее засасывается жидкость из стакана, если на газоотводной трубке открыть зажим.
Опыты по изучению электропроводности веществ и растворов. Если через пробку прибора пропустить дополнительно два металлических или лучше два графитовых стержня (электрода), нижние концы которых почти касаются дна колбы, и присоединить их через лампочку или гальванометр к источнику тока, то получим установку для определения электрической проводимости растворов веществ и изучения положений теории электролитической диссоциации (рис. 5).
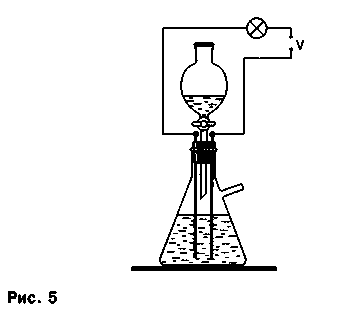
Количественные опыты на основе реакций, протекающих с выделением газов. Если подвести газоотводную трубку прибора под градуированный цилиндр с водой, установленный в кристаллизатор с водой, и собирать выделяющийся в ходе реакции газ методом вытеснения воды, то по объему полученного газа можно провести количественные расчеты по установлению молярных масс веществ, подтверждению закономерностей химической кинетики и термохимии, определению формулы этанола и других
веществ и т. д. (рис. 6). Если выделяющийся в ходе реакции газ растворяется или реагирует с водой, то необходимо использовать в опытах другие жидкости и растворы.
Рис. 6. Установка для проведения количественных опытов.
Приведенные примеры не исчерпывают все возможности предлагаемого унифицированного прибора в учебном химическом эксперименте. Если иметь в запасе пробки с двумя газоотводными трубками или с двумя делительными воронками, а также другие варианты установки, то число опытов с использованием унифицированного прибора можно значительно увеличить, что будет способствовать научной организации труда учителя химии.
Составные детали прибора: колбы, градуированные делительные воронки, пробки, зажимы и т.д. — следовало бы включить в типовые наборы посуды и оборудования для школьных кабинетов химии и учебных химических лабораторий педагогических высших учебных заведений.
9. Домашний эксперимент. Не отрицая возможного использования в домашних условиях использования различных компьютерных программ "Виртуальных лабораторий", все же реальный домашний эксперимент дает учащимся больше пользы. Представить себе химию без химических опытов невозможно. Поэтому изучить эту науку, понять ее законы и, конечно, полюбить ее можно только через эксперимент. Естественно, химические реакции лучше всего поводить в специально оборудованных химических кабинетах и лабораториях под руководством учителя, на уроках или на занятиях химического кружка и факультатива.
К сожалению, не во всех школах работают химические кружки, не у всех учащихся, интересующихся химией, есть возможность посещать дополнительные занятия в школе. Поэтому только домашний химический эксперимент может восполнить тот пробел в обучении химии в современных условиях, когда программы перенасыщены теоретическим материалом, учителя отказываются от проведения практических работ, а лабораторные опыты вообще стали редкостью в школьной практике. Следует приветствовать и поддерживать тех авторов учебников и рабочих тетрадей, которые включают в тексты параграфов те или иные опыты и наблюдения, которые учащиеся должны выполнить вне урока, в домашних условиях.
Трудно переоценить значение такого эксперимента на формирование интереса к химии и мотивации к изучению этого предмета. Домашний эксперимент имеет огромное значение в углублении и расширении знаний, совершенствовании специальных умений и навыков, в общем развитии учащихся.
В связи с этим, учителю химии следует помочь школьникам в организации проведения домашнего химического эксперимента. При этом следует учесть несколько факторов. Во-первых, учитель должен побеседовать с родителями по всем вопросам организации домашнего эксперимента по химии, прежде всего по проблеме обустройства места для проведения опытов в домашних условиях. Во-вторых, учащиеся должны твердо знать и неукоснительно выполнять правила техники безопасности лабораторных работ. В-третьих, учителю химии необходимо методически и практически помочь школьнику в приобретении необходимого оборудования для проведения опытов, приготовлении растворов и получении некоторых веществ из пищевых продуктов, средств бытовой химии и т.д. В-четвертых, необходимо наметить программу проведения учебных опытов и план исследовательского эксперимента по определенной тематике. В-пятых, следует научить юных химиков проводить соответствующие наблюдения и оформлять результаты опытов в лабораторном журнале.
Приведем варианты некоторых опытов для домашнего эксперимента школьников.
Опыты с железом. 1. В две пробирки налейте по несколько капель раствора поваренной соли (5%), в одну добавьте несколько капель раствора щелочи. Подберите к пробиркам пробки. Зачистите до блеска железный гвоздь длиной 10-15 см и введите его через обе пробки так, чтобы часть гвоздя со шляпкой закрыть пробкой в одной пробирке, а острие гвоздя закрыть в другой пробирке. Часть гвоздя (середина) должна оставаться между сосудами и контактировать с окружающим воздухом. Пробирки с гвоздем поместите в положении лежа. Таким образом, вы проведете одновременно три варианта опыта коррозии железа: во-первых, - обычные условия; во-вторых, - влажная соленая атмосфера; в-третьих, - влажная щелочная атмосфера. Наблюдайте состояние поверхности трех участков гвоздя в течение нескольких дней и сделайте выводы. (Нарисовать)
2. В три пробирки налейте раствор поваренной соли, подкисленный уксусной кислотой. В первую пробирку добавьте таблетку уротропина (лекарственный препарат) и растворите ее; во вторую – добавьте несколько капель иодной настойки до появления желтой окраски. В каждую пробирку опустите зачищенный до блеска железный гвоздь, чтобы один конец его выступал из раствора. Проследите, как влияют добавки на коррозию железа в условиях опыта, и сделайте выводы.
3. Поместите несколько мелких гвоздей (кнопки, скрепки) в пробирку и добавьте 3-5 мл соляной кислоты (1:1). Что наблюдали? Запишите уравнение реакции. Добавьте в реагирующую смесь несколько кристалликов медного купороса. Что наблюдали? Дайте объяснение.
4. Налейте в пробирку 4-6 мл раствора медного купороса, добавьте в раствор порошок железа. Что наблюдали? Запишите уравнение реакции. После окончания реакции слейте раствор сульфата железа (II) в другую пробирку и сохраните для следующего опыта. Железный порошок, покрытый рыхлым слоем меди, промойте 2 раза чистой водой, высушите на листе бумаги и отделите порошок меди.
5. К раствору сульфата железа (II) (опыт 4) добавьте несколько капель раствора щелочи. Взболтайте полученную смесь. Что наблюдали? Запишите уравнения реакций.
6. Небольшую порцию осадка из опыта 5 нагрейте на жестяном совочке. Что наблюдали? Запишите уравнение реакции.
Иод и его свойства. 1. Налейте в пробирку несколько капель иодной настойки и осторожно выпарите. Вставьте в пробирку стеклянную палочку и продолжайте осторожно нагрев. Обратите внимание на цвет паров в пробирке и на кристаллики, осаждающиеся на палочке. Опишите наблюдения.
2. Чем отличается возгонка иода от возгонки хлорида аммония?
3. Разбавьте 2-3 мл иодной настойки до 10-15 мл водой и разлейте полученный раствор в несколько пенициллиновых пузырьков или пробирок по 3 мл. К каждой порции раствора добавьте какой-либо металл в виде порошка или мелких опилок (приготовьте с помощью напильника), например, железо, алюминий, медь, олово и т. д. Опишите наблюдаемые изменения и запишите соответствующие уравнения реакций.
4. Металлическую пластинку очистите от загрязнений и покройте тонким слоем лака для ногтей (попросите у мамы). Штопальной иглой, процарапывая лак, сделайте на пластинке надпись или рисунок. Смочите пластинку раствором иода и оставьте на некоторое время. После реакции промойте пластинку в воде, высушите тряпочкой и снимите лак специальной жидкостью. На пластинке останется вытравленный рисунок. Опишите, что у вас получилось. Запишите уравнение реакции.
5. Налейте в пробирку до 1/3 объема воды и добавьте несколько капель иодной настойки. Прилейте к раствору половинный объем бензина или растворителя для масляных красок и хорошо взболтайте смесь. Что вы видите после разделения жидкостей на два слоя? Можно ли на основании данного опыта судить о различной растворимости иода в воде и в органическом растворителе?
Опыты с глицерином. 1. Растворы глицерина в воде замерзают при низких температурах. Налейте в четыре пенициллиновые скляночки по 0,5 мл глицерина, в первую – добавьте столько же воды, во вторую – 1 мл воды, в третью – 1,5 мл воды, а в четвертую – 2 мл воды. Выставите растворы на холод или в морозильную камеру, отметьте температуру и установите, какие растворы при этом не замерзли.
2. Смочите конец железной проволоки или стеклянной палочки в глицерине и внесите в пламя. Глицерин загорается. Обратите внимание на характер пламени и дайте объяснение. Запишите уравнение реакции.
3. Налейте в пробирку 2 мл раствора гидроксида натрия, 2-3 капли раствора медного купороса, затем по каплям добавляйте глицерин до растворения осадка. Запишите уравнения проведенных реакций и ваши наблюдения.
4. Немного (1-2 мл) глицерина, купленного в аптеке, нагрейте (осторожно!) в ложке для удаления из него воды. После охлаждения прибавьте к глицерину щепотку перманганата калия. Через 1-2 мин глицерин вспыхивает и сгорает ярким пламенем. (Если в вашем распоряжении будет безводный глицерин, то предварительный нагрев излишен). Опишите ваши наблюдения.
ВОПРОСЫ И ЗАДАНИЯ
- Каково Ваше мнение о методике унификации химического эксперимента?
- Разработайте вариант демонстрационного эксперимента с применением унифицированного прибора к Вашей теме.
- Разработайте варианты химического эксперимента для проведения в домашних условиях по Вашей теме.
10. Тестовые технологии в обучении химии. Процесс учета и контроля знаний учащихся - это один из наиболее ответственных и сложных видов деятельности в процессе обучения, как для учащихся, так и для учителя. Контроль усвоения знаний учащихся осуществляет целый ряд функций в процессе обучения: оценочную, диагностическую, стимулирующую, развивающую, обучающую, воспитательную и др.
Для определения качества знаний, умений и навыков применяются различные приемы, средства и методы, среди которых в последние годы в школьной практике существенное значение приобрело тестирование.
Тесты – это задания особой формы, позволяющие оперативно, объективно и строго индивидуально оценить уровень знаний и умений учащихся. Цели и задачи тестов могут быть различными, например, тесты достижений, предназначенные для оценки усвоения знаний по конкретным дисциплинам или их циклам; тесты для оценки отдельных умений и навыков; тесты на определения развития мышления, логики, речи; тесты на определение склонностей, интеллекта и т.д.
По форме проведения тесты могут быть индивидуальными и групповыми, устными и письменными, бланковыми, компьютерными, вербальными и невербальными. При этом каждый тест имеет несколько составных частей: инструкцию по работе с тестом, тестовое задание или бланк с заданиями, лист ответов (для бланковых методик), шаблоны для обработки данных.
Тесты, предназначенные для оценки усвоения знаний по конкретным дисциплинам, можно классифицировать на тесты открытой формы, закрытые тесты, тесты на соответствие, тесты на установление последовательности и комбинированные тесты.
Тесты закрытой формы представляют собой задания или вопросы с набором (как правило) четырех вариантов ответов, из которых тестируемый должен выбрать и отметить только один верный ответ, например:
1. Соли можно получить при взаимодействии металла с кислотой, металла с неметаллом, металла с солью, металла с оксидом, металла с основанием, металла с водой. Сколько здесь допущено ошибок? а) 1; б) 2; в) 4; г) 3.
2. В перечне химических элементов: водород, натрий, медь, железо, литий, магний, олово, фосфор, хром, барий, цинк, алюминий, бор - число элементов с постоянной валентностью равно: а) 6; б) 7; в) 8; г) 9.
3. Электронная формула ...3d14s2 принадлежит химическому элементу: a) Zn; б) Sc; в) Са; г) Se.
4. Общая формула предельных одноатомных спиртов:
а) СnН2nОН; б) (СН3)nОН; в) Rn(ОН)m; г) СnН2n+2O
5. Реакция отщепления водорода от органического соединения:
а) гидролиз; б) конденсация; в) дегидрирование; г) дегидратация.
Тесты открытой формы представляют собой задания, ответ на которые вписывается в текст теста самим испытуемым или оформляется в виде отдельной записи, т.е. в самом тесте нет возможных вариантов ответа, например:
1. Вставьте пропущенные слова, буквы и обозначения. Электронные орбитали сферической формы обозначают буквой ____. _______________, имеющие форму объемной восьмерки, обозначают буквой ____. Орбитали более сложных форм обозначают буквами ____ и ____.
2. Молибден находится в шестой группе между неметаллами селеном и теллуром. Почему молибден является, в отличие от селена и теллура, металлом? ___________________________________________________________
3. Какая навеска оксида фосфора необходима для получения раствора ортофосфорной кислоты массой 400 г с массовой долей 2 % путем его растворения в воде? ___________________________________________________
4. Дистилляция – это один из способов выделения веществ в чистом виде из (А), основанных на (Б). Например, (В). При этом применяют (Г). Определите термины или суждения, обозначенные буквами и запишите их если: А – характеристика смеси; Б – принцип, на котором основана дистилляция; В – примеры разделения смесей дистилляцией; Г – оборудование и приборы, используемые при дистилляции.
А: __________________________________________________________________
Б: __________________________________________________________________
В: __________________________________________________________________
Г: __________________________________________________________________
Тесты на установление соответствия обычно состоят из двух перечней терминов или понятий, между которыми нужно найти соответствие, записав ответ отдельной строкой после задания, например:
1. Какой основной метод нужно применить для разделения указанных смесей?
1) Песок и глина; а) Дистилляция;
2) Спирт и вода; б) Отстаивание;
3) Медные и железные стружки; в) Магнитное разделение;
4) Вода и бензин; г) Фильтрование;
5) Мел и вода. д) Хроматография.
2. При разделении смеси (А) используют способ разделения (Б). Составьте и запишите суждения, если:
А – песок и глина; спирт и вода; медные и железные стружки; мел и вода; вода и бензин. Б – дистилляция, делительная воронка, отстаивание, магнитное разделение, фильтрование.
3. Найдите соответствие (синонимы) между терминами:
1) ассоциация; а) возгонка;
2) дистилляция; б) разложение;
3) диссоциация; в) перегонка;
4) сублимация; г) присоединение;
5) конденсация; д) соединение;
6) сольватация; е) уплотнение.
Тесты на установление последовательности предлагают определенный перечень предметов, явлений или операций, который тестируемый должен расположить в установленном порядке в соответствии с заданием, например:
1. Расположите формулы веществ (CuO; FeO, MnO; ZnO) в порядке возрастания их молярных масс. ____________________________________________________
2. Процесс производства серной кислоты в промышленности состоит из нескольких стадий: 1) поглощение серного ангидрида раствором серной кислоты; 2) образование олеума; 3) теплообмен; 4) очистка печного газа; 5) обжиг сырья; 6) окисление сернистого ангидрида. Какова последовательность стадий производства? _________________________________________________
Комбинированные тесты могут содержать в тексте несколько вопросов и заданий, например:
1. Какую реакцию относят к реакциям замещения?
а) Zn + НСl → в) ZnO + H2SО4 →
б) Zn + HNO3 → г) ZnCl2 + AgNO3 →
Завершить все уравнения реакций
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
По организации проведения испытаний, тестирование может быть индивидуальным или групповым, устными или письменными, на специальных бланках или на чистых листах, с применением компьютера или шаблонов и т.д. В любом случае, тестируемые должны быть предварительно хорошо проинструктированы по всем вопросам процедуры тестирования.
Общие рекомендации для составления тестовых заданий по определенной теме, разделу или по курсу химии в целом сводятся к следующему.
Прежде всего, необходимо определить цели и задачи тестирования. Из этого вытекает его продолжительность. В зависимости от оснащенности школы информационными средствами обучения выбирается тот или иной способ организации тестирования. При необходимости для каждого ученика готовят отдельные бланки и задания.
Учебный материал, усвоение которого необходимо протестировать, разбивают на отдельные тематические блоки. Например, при составлении тестовых заданий в объеме программы девятилетней школы в можно выделить следующие разделы.
1. Первоначальные химические понятия.
2. Лабораторное оборудование, правила работы в лаборатории.
3. Свойства кислорода, водорода и воды.
4. Основные классы неорганических веществ.
5. Основные стехиометрические законы и расчеты.
6. Периодический закон и периодическая система химических элементов Д.И. Менделеева.
7. Строение атома. Химическая связь. Строение вещества.
8. Растворы. Основы теории электролитической диссоциации.
9. Химические реакции.
10. Химия неметаллов и их соединений.
11. Химия металлов и их соединений.
12. Основные положения и первоначальные понятия органической химии.
14. Основные классы органических веществ и их свойства.
15. Химия в нашей жизни.
Число тестов, составляемых по каждому разделу должно быть одинаковым, тесты данного раздела должны быть равными по трудности и сходными по типу. Если объем и содержание материала темы предполагают необходимость большего или возможность меньшего числа тестов, то блок делят на части или несколько блоков укрупняют в один. Из всех тестов составляют тестовые задания в виде отдельных комплектов. Каждое тестовое задание (вариант) должно состоять из равного числа тестов, все задания должны быть одинаковы по трудности и по форме их составления. Тесты в задании расставляют в соответствии с логикой учебного материала и нумеруют.
Текст теста должен быть сформулирован ясно, кратко и недвусмысленно, чтобы тестируемые понимали смысл задания или вопроса. Чтобы сократить число тестов, можно в одно задание включить несколько понятий, терминов, формул, однако тест не должен содержать второстепенные вопросы, особенно требующие механического запоминания, должна быть устранена любая двусмысленность или неясность формулировок. Задание должно быть составлено так, что оно требовало только однозначного ответа и не допускало двоякого толкования. Задание должно быть корректным и иметь максимально простой грамматически правильный порядок. Тестовые задания должны проверять только уровень усвоенных знаний, а не умственные способности и склонности ученика.
Варианты ответов в тесте должны быть краткими, однозначными и подбираться так, чтобы исключить возможность примитивного домысла или догадки. Частота одного и того же номера правильного ответа в любом тестовом задании должна быть приблизительно одинакова, а сам номер выбирается в случайном порядке.
Содержание заданий и всего теста в целом должно удовлетворять определенным требованиям: 1) полнота отображения материала учебной программы; 2) соответствие теста требованиям Образовательного стандарта по дисциплине; 3) соответствие содержания теста знаниям и умениям, на проверку которых тест направлен; 4) качество содержания тестовых заданий.
Главными параметрами тестов должны быть надежность и валидность. Надежность - устойчивость результатов теста, получаемых при его применении. Валидность - пригодность теста, т.е. способность качественно измерять то, для чего он создан по замыслу авторов. Определение надежности и валидности тестов проводится путем статистической обработки результатов массового тестирования по различным группам испытуемых.
Продолжительность тестирования зависит от форм, количества и трудности заданий. Например, для выполнения простого тестового задания закрытой формы с выбором одного элемента из предложенных достаточно 10-15 секунд; на выполнение тестирования по заданию Единого государственного экзамена или при поступлении в вуз отводится не более 180 минут.
Основные требования к программному обеспечению компьютерного тестирования сводятся к следующему.
- Современная контролирующая система должна быть построена на основе общих принципов, не зависящих от вида дисциплины и содержания тестов, то есть должна быть универсальной. Каждый предметник может наполнять ее содержательную часть по своему усмотрению.
- Контролирующая система должна иметь возможность обеспечить создание тестов, проведение тестирования, и подведение итогов тестирования в соответствующей базе данных.
- Компьютерной программой должна быть предусмотрена невозможность доступа тестируемых к правильным ответам теста.
- Компьютерная программа должна обладать возможностью настройки на проведение тестирования с применением различных режимов тестирования и типов вопросов, случайной выборки заданий, ограничения времени тестирования и т.д.
Отдельные тесты в тестовых заданиях (вариантах) могут быть различной степени сложности. Выбор формы и степени сложности тестовых заданий зависит от вида, цели и задач тестового контроля знаний учащихся. В среднем на решение одного теста должно затрачиваться около 2-3 минут. Время диагностического тестирования может быть в пределах 5-7 минут, текущего – 15-20 минут, итогового – 2-3 часов.
Вопросы и задания
1. Проанализируйте вариант тестового задания для выпускников 11 класса. Определите, какие разделы и темы курса химии включены в задание; оцените степень охвата учебного материала в соответствии с образовательными стандартами.
ТЕСТОВОЕ ЗАДАНИЕ № 4
1. Растворимость нитрата бария при 75 оС составляет 25 г в 100 г воды. Чему равна масса соли в насыщенном ее растворе массой 500 г при этой температуре?_________________________________________
2. Какую реакцию относят к реакциям обмена?
а) Na2О + Н2О → в) Na2О + СО2 →
б) Na2О + H2SО4 → г) Na + Н2О →
Завершить все уравнения реакций _________________________________ _______________________________________________________________________
3. Важнейшими химическими свойствами щелочей являются:
а) взаимодействие с кислотами, кислотными оксидами и солями;
б) растворимость в воде и реакции с кислотами и солями;
в) реакции нейтрализации, разложение при нагревании;
г) взаимодействие с веществами, проявляющими неметаллические свойства.
Привести примеры уравнений реакций ____________________________
_______________________________________________________________________4. Бензольное кольцо в молекуле анилина влияет на аминогруппу, вызывая при этом: а) усиление донорно-акцепторных свойств; б) ослабление донорно-акцепторных свойств; в) ослабление оснóвных свойств; г) усиление оснóвных свойств.
Написать соответствующие уравнения реакций ______________
_______________________________________________________________________5. Химическая формула вещества дает информацию о его: а) массе, составе, названии; б) свойствах, названии, составе; в) названии, составе, количестве; г) плотности, составе, названии, массе.
6. Химические соединения постоянного состава называют: а) бертоллидами; б) веществами; в) дальтонидами; г) корпускулидами.
7. Химические элементы главных подгрупп обладают сходными химическими свойствами, так как: а) относятся к одной группе; б) образуют естественные группы элементов; в) обладают одинаковой валентностью; г) атомы этих элементов имеют одинаковую электронную формулу внешнего энергетического уровня.
8. В хлориде цезия химическая связь: а) сильнополярная; б) слабополярная; в) металлическая; г) ионная.
9. В каком ряду приведены ионы, которые можно легко выделить из раствора методом осаждения?
а) Fe3+, СН3СОО-, H+, Сl-; в) РО43-, SО42-, Ag+, Cа2+;
б) СО3 2-, NO3-, А13+, Fe2+; г) Ва2+ , SО32-, NH4+, Cu2+ .
10. В ряду галогенов с возрастанием атомного номера:
а) плотность простых веществ увеличивается, интенсивность окраски усиливается;
б) плотность уменьшается, интенсивность окраски усиливается;
в) плотность увеличивается, интенсивность окраски убывает;
г) плотность веществ уменьшается, интенсивность окраски убывает.
11. Азот проявляет отрицательную степень окисления в соединении:
а) (NH4)2SО4; б) NО2; в) HNО2; г) N2.
12. Адсорбция представляет собой:
а) обесцвечивание красителей;
б) взаимодействие угля с газами;
в) поглощение газов поверхностью твердого вещества;
г) один из способов очистки веществ.
13. Продукт реакции полимеризации называют:
а) капроном; в) пластмассой;
б) полимером; г) высокомолекулярным соединением.
14. Нейтральный лакмус в водном растворе этанола имеет окраску:
а) синюю; б) фиолетовую; в) красную; г) бесцветную.
15. Крахмал и целлюлоза отличаются друг от друга: а) по составу; б) структурой макромолекулы; в) растворимостью в воде; г) характером реакции гидролиза. Укажите ошибку.
16. Физическое состояние вещества без определенной формы и объема:
а) газ; б) аморфное состояние; в) пар; г) флюид.
17. Реакция обнаружения белка раствором сульфата меди (II) в щелочной среде:
а) биуретовая реакция; в) реакция Вюрца;
б) иодкрахмальная проба; г) реакция Зинина.
2. Составьте вариант тестового задания к Вашей индивидуальной теме.
11. Рабочие тетради на печатной основе. Рабочие тетради представляют собой дополнение к основному учебнику по химии и входят в учебный комплект наряду с другими пособиями для учащихся. Рабочие тетради обычно соответствуют содержанию и построению определенного учебника, однако более интересны и вполне приемлемы варианты, когда данная рабочая тетрадь полностью отвечает требованиям государственных образовательных стандартов и может применяться в комплекте со всеми действующими школьными учебниками по предмету.
Учебный материал в тетради должен соответствовать материалу учебника, но не дублировать его. Обычно каждая тема в тетради разбита на отдельные рубрики, в том числе: "Основные понятия", "Эксперимент", "Тесты" и др. с интересными и нетрадиционными вопросами и заданиями, домашними и школьными опытами, которые дают возможность применения тетради и в обычных классах, и в классах с углубленным изучением химии.
Выполнение заданий и их содержание в рабочих тетрадях должны предусматривать не столько контроль знаний, сколько формирование и развитие умений учащихся работать с литературой, планировать, проводить наблюдения и эксперименты; фиксировать полученные данные и систематизировать их в виде таблиц, графиков, диаграмм; интерпретировать полученные результаты и формулировать теоретические выводы, как того требует современная парадигма образования в стране.
Работа учащихся с тетрадью призвана развивать мыслительные и творческие способности, расширять кругозор, способствовать воспитанию аккуратности, трудолюбия и других положительных качеств личности школьника.
Рабочие тетради позволяют осуществлять индивидуальный подход к обучению, экономят учебное время, избавляя учащихся от переписывания условий задач и заданий.
Ниже приводится фрагмент «Рабочей тетради по химии для 9 класса».