Тема 21. Авторские педагогические технологии, приемы и средства обучения химии в школе
| Вид материала | Документы |
- Доклад на тему: «Здоровьесберегающие технологии в школе», 39.98kb.
- Применение информационных технологий в процессе обучения химии, 213.65kb.
- Методические приемы и педагогические технологии, связанные с формированием у учащихся, 87.53kb.
- Рабочая программа дисциплины (модуля) Технологии обучения химии, 282.52kb.
- Программа вступительного экзамена для поступления в магистратуру по профессиональнообразовательной, 85.07kb.
- Тема 18. Современные педагогические технологии в повышении эффективности обучения, 216.86kb.
- Планы лекций по дисциплине б. 5 Педагогические технологии для специальности/направления, 24kb.
- Формы, модели обучения, методы, технологии, приемы развития универсальных учебных действий, 244.05kb.
- Педагогические технологии, 89.2kb.
- Тема Методика обучения химии как наука и учебный предмет в педвузе, 398.5kb.
Общая характеристика
Бром относится к галогенам. Галогены – химические элементы главной подгруппы 7 группы. Поскольку к концу периода неметаллические свойства усиливаются, то галогены, расположенные в конце периодов (за ними только инертные газы), являются типичными неметаллами. На их внешней электронной оболочке, близкой к завершению, находится семь электронов. Недостающий до завершения оболочки один электрон галогены присоединяют в химических реакциях, проявляя степень окисления –1. У хлора, брома, иода может происходить распаривание двух пар р–электронов и одной пары s- электронов за счет энергии, сообщаемой извне, тогда степень их окисления повышается до +7. Наличие неспаренного электрона приводит к соединению атомов галогенов между собой с образованием двух атомных молекул.
Таким образом, галогены в виде простых веществ имеют молекулярное строение (Hal2). Связи между молекулами усиливаются с увеличением их молекулярной массы. Поэтому сверху вниз в группе повышаются температуры кипения и плавления. Так как размеры атомов уменьшаются в периодах слева направо, то радиусы атомов галогенов оказываются наименьшими. Это значит, что атомы галогенов сильнее других элементов притягивают электроны. Поэтому каждый галоген – самый сильный окислитель в своём периоде.
Сверху вниз в группе размеры атомов возрастают, и в этом направлении ослабевает окислительная способность электронов. Самым сильным окислителем оказывается фтор.
Названы от греческих hals — соль и genes — рождающий (при соединении с металлами образуют соли).
История открытия
В 1826 году в одном из французских журналов появилась статья “Мемуары о специфическом веществе, содержащемся в морской воде”. Она была подписана неким Ж. Бонаром, препаратором в фармацевтической школе в городе Монпелье, на юге Франции. Исследуя флору соляных болот, он обратил внимание на осадок каких-то солей, выкристаллизовывающихся из маточных растворов после добычи из них поваренной соли. Этот осадок он растворил и, обрабатывая раствором хлора, получил красно-бурое вещество. Ещё интересней был опыт со щёлоком, т.е. щелочным раствором, полученным путём обработки водой золы одной из водорослей (Fucus). Обрабатывая этот щелок хлором и крахмалом, он получил два слоя: нижний – синий и верхний – тёмно-жёлтого цвета. Из наблюдаемого А. Болар сделал правильный вывод, что нижний слой содержит соединения иода с крахмалом. А что же содержится в верхнем слое? После долгих и тщательных исследований А. Болар убедительно показал, что в верхнем слое содержится неизвестный ещё элемент, который он назвал “ муридом” (от лат.”мурия”- рассол). Сообщение о своём открытии А. Болар послал в Парижскую академию наук 30 ноября 1825года. В июне 1826 года оно было заслушано. Комиссия Академии наук проверила все опыты А. Болара и признала выводы из них правильными. Не согласилась она лишь с названием элемента; поскольку соляная кислота называлась тогда муриевой, отсюда могли возникнуть недоразумения. Комиссия предложила назвать элемент бромом (от греческого “бромос”- зловонный).
За открытие брома А. Болару была присуждена медаль Лондонского Королевского общества, которая давалась лишь за крупные научные заслуги. Но А. Балар был не единственным, кому удалось выделить бром. В 1825 году студент Гейдельбергского университета К. Лёвиг, работавший в лаборатории известного профессора химии и медицины Л. Гмелина, во время каникул изучал состав воды из минерального источника в немецком городе Крейцнахе. При действии хлора на раствор, полученный после кристаллизации солей из этой воды, К. Лёвиг наблюдал красно-бурое окрашивание. Произведя экстракцию этого раствора эфиром, К. Лёвиг выделил жидкость, которую показал своему учителю. Заинтересовавшись работой К. Лёвига, Л. Гмелин посоветовал ему получить побольше нового вещества, чтобы детально изучить его свойства. Но пока К. Лёвиг готовил значительные количества красно–бурой жидкости, научный мир узнал об открытии А. Болара.
А. Болар “отнял” открытие брома не только у К. Лёвига, тогда ещё никому не известного студента, но и у крупного немецкого химика Ю. Либиха. Незадолго до открытия брома Ю. Либих получил для анализа бутыль с жидкостью, окрашенной в тёмно-красный цвет. Не производя химического анализа, на основании внешнего вида и запаха, Ю. Либих заключил, что жидкость является соединением хлора с иодом. Узнав об открытии А. Балара, он немедленно подверг анализу содержимое бутыли и убедился, что он упустил из рук открытие брома. Досадуя на себя, Ю. Либих с раздражением высказался: “Не Болар открыл бром, а бром открыл Болара.”
В 1824 году немецкие химики Д. Джосс и В. Мейснер также были очень близки к открытию брома, однако первый принял его за селен, а второй за хлорид иода. Лишь после публикации Болара они получили возможность убедиться в своей ошибке.
Нахождение в природе
Содержание брома составляет 1,6 10-4 % от общего числа атомов земной коры. Подобно другим галогенам он встречается только в форме соединений, из которых наиболее обычны бромиды. Основным источником брома является морская вода, 1м3 которой в среднем содержит 66г брома. При испарении внутренних морей образуются залежи поваренной соли, вслед за которыми осаждаются более растворимые бромиды калия, натрия и магния. Таким образом, бромиды встречаются в верхних слоях залежей поваренной соли. Другим источником соединений брома являются воды соляных озёр и нефтяных буровых скважин. Бром – постоянный спутник хлора. Так, в сильвине и карналлите содержится до 3 масcовых долей брома в виде твёрдого раствора замещения.
Физические свойства
Бром тёмно-красная жидкость, а его пары – желто-бурого цвета с резким раздражающим запахом. Красно-коричневые игольчатые кристаллы брома обладают слабым металлическим блеском. Бром растворим в воде (3,35г в 100г воды при комнатной температуре), во многих органических растворителях, обладает высокой упругостью паров.
Энергия диссоциации молекулы Br2= 193,2 кдж/моль.
Плотность брома равна 3,1 г/см3. При + 59 0С бром кипит, при –7 0С затвердевает.
Химические свойства
Как и другие галогены, бром непосредственно соединяется со многими химическими элементами, причём активность брома, хотя и уступает хлору, всё же близка к нему. Бром соединяется с водородом лишь при нагревании:
H2 + Br2 = 2HBr
Наиболее энергично бром реагирует с металлами. Например, раскалённая медная проволока сгорает в парах брома:
Cu + Br2 = CuBr2
В парах брома сгорают также оловянная фольга и порошок сурьмы:
Sn + 2Br2 = SnBr4
2Sb + 3Br2 = 2SbBr3
Очень легко бромом окисляется аммиак:
2NH3 + 3Br2 = N2 + 6HBr
Реагирует с некоторыми неметаллами. Так кусочек фосфора воспламеняется в броме и сгорает, образуя бромид фосфора (III)
2P + 3Br2 = 2PBr3
Взаимодействует с водой:
Br2 + H2O
 HBr + HOBr
HBr + HOBrПрименение
Области применения брома очень разнообразны. Его соединения используются в медицине как успокаивающие средства, антисептики, антибиотики. Соединения брома добавляют в этилированные бензины с целью удаления из двигателя свинца, образующегося при разложении антидетонатора – тетраэтилсвинца. В органическом синтезе с помощью брома и его соединений получают целый ряд веществ (броминдиго, бромбензол).
Бром применяется в фото- и кинопромышленности. Без фотоплёнок, светочувствительный слой которых содержит бромид серебра, невозможной была бы фотография.
Фотографирование основано на светочувствительности бромида серебра, т.е. на его свойстве разлагаться под действием света:
2AgBr + hv = 2Ag + Br2
Получение
Основным методом получения брома является окисление бромидов. В качестве окислителей обычно пользуются хлором или смесью оксида марганца (IV) с серной кислотой. При этом протекают реакции, например:
2NaBr + Cl2 = 2NaCl + Br2
2NaBr + MnO2 + 2H2SO4 = Na2SO4 + Br2 + MnSO4 + 2H2O
В нашей стране сырьём для промышленного получения брома является озёрная (а также морская) рапа, т.е. насыщенная солью вода, и буровые воды нефтяных скважин. После выделения хлорида натрия рапу подкисляют серной кислотой и обрабатывают хлором, выделяется бром:
MgBr2 + Cl2 = MgCl2 + Br2
Раствор, содержащий бром, поступает в башню, заполненную небольшими кольцами из керамики. Навстречу этому раствору движется поток воздуха, который извлекает бром из жидкости. Выделяющийся бром током воздуха направляется в раствор карбоната натрия, который по насыщении его бромом подкисляют серной кислотой. При этом протекают реакции:
3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
5NaBr + NaBrO3 + 3H2SO4 = 3Br2 + 3Na2SO4 + 3H2O
Физиологическое действие
Бром, как и хлор, имеет удушливый запах и токсичен. Первая помощь при отравлении бромом – покой, тепло, вдыхание распылённого тиосульфата натрия Na2S2O3 и раствора гидрокарбоната натрия. Жидкий бром вызывает тяжёлые, долго не заживающие ожоги кожи. Поэтому, если, например, на руки попал бром, его необходимо сразу же смыть разбавленным раствором аммиака (или раствором серы), а затем смазать поражённое место мазью, содержащей гидрокарбонат натрия.
Бромиды натрия и калия издавна применяли в медицине в качестве средства, способствующего успокоению нервной системы и вызывающего сон. Следует помнить, что при длительном применении бромистых препаратов могут возникнуть побочные явления: насморк, кашель, кожные сыпи.
Краеведческий материал
Бром в Саратовской области не вырабатывается. Применяются лишь его соединения, как описано выше.
Дополнительный материал по свойствам брома
1. 2Br2(р) + 2H2O = 4HBr + O2 (на свету или кип.)
2. 3Br2 + NaOH(конц.) = 5NaBr + NaBrO3 + 3H2O (50-800С)
Br2 + 2NaOH(разб.) = NaBr + NaBrO + H2O (0-50С)
3Br2 + 3Na2CO3(конц., горяч.) = 5NaBr + NaBrO3 + 3CO2
3. Br2 + 3F2 = 2BrF3 (-400С, в жидк. CCl3F)
Br2 + F2 = 2BrF (до 00С)
Br2 + 5F2 = 2BrF5 (2000С)
4. Br2 + Cl2 = 2BrCl (00С)
Br2 + 5Cl2 + 6H 2O=2HBrO3 + 10HCl
5. Br2 + I2= 2IBr
6. 3Br2 + S + 4H 2O = H 2SO4 + 6HBr (100-1500С)
7. Br2(р) + H 2S(насыщ.) = 2HBr + S
8. Br2 + 2NaI = 2NaBr + I2
9. 4Br2 + 4H 2O + BaS =BaSO4 + 8HBr
Br2 + SO2+ 2H 2O = 2HBr + H 2SO4
10. 2Br2 + H 2O + HgO = 2HbrO + HgBr2 (0-50С)
3Br + 5AgBrO + 3HO = 5AgBr + 6HbrO
11. Br2 + Na2SO3 + 2NaOH = 2NaBr + Na2 SO4 + H2O
4Br2 + Na2SO3 + 10NaOH = 2Na2SO4 + 8NaBr + 5H2O
12. Br2 + H 2O + KNO2 = 2HBr + KNO3
Br2 + Cl2 + 2CsCl(конц.) = 2Cs[BrCl2]
13. Br2 + CsBr(конц.) = Cs[Br(Br)2 ]
14. Br2 + 4O3= Br 2O4(жёлт.) + 4O2 (-500С, в жидк. CCl3F)
Краткая характеристика термина Бром (словарный вариант)
Бром - Br, химический элемент (галоген) главной подгруппы VII группы периодической системы химических элементов, атомный номер 35, средняя относительная атомная масса 79,904, электронная формула [Ar]3d104s24p5, относится к р-элементам. Природный Б. состоит из двух стабильных изотопов 79Br и 81Br, общее содержание в земной коре 0,00016% по массе, в свободном виде не встречается. В природе не образует самостоятельных месторождений, в основном сопутствует природным соединениям хлора. Соли Б. в малых количествах содержатся в морской воде, в некоторых подземных водах и в рассолах соляных озер. При обычных условиях – летучая темная красно-бурая жидкость, желто-бурые пары имеют сильный неприятный запах. Т. пл. -7,25 оС, т. кип. 59,2 оС. В воде Б. малорастворим (см. Вода бромная), в органических растворителях – растворяется хорошо. Молекула двухатомна – Br2, проявляет неметаллические свойства, характерные для галогенов. В соединениях проявляет степени окисления -1 (бромиды) , +1 (гипобромиты), +3 (бромиты), +5 (броматы), +7 (перброматы). Несмотря на высокую химическую активность непосредственно с кислородом, углеродом и азотом не взаимодействует. С серой, селеном, иодом и другими неметаллами образует бромиды (S2Br2, SeBr4, PBr3, IВr и др.). С водородом образует бромоводород. Взаимодействует с большинством металлов, особенно энергично идут реакции в присутствии воды, при этом также образуются бромиды. С хлором и фтором дает соответствующие галогениды (BrF5, BrCl и др.). Как и другие галогены, Б. – сильный окислитель. В водных растворах окисляет иодиды до I2, сульфиты – до сульфатов, аммиак – до свободного азота. Бромид-ион окисляется сильными окислителями (Cl2, KMnO4, K2Cr2O7) до Br2. С органическими соединениями вступает в реакции присоединения (по месту кратных связей), а также при определенных условиях замещает водород в насыщенных соединениях. Название получил от греческого – "зловонный". Получают Б. из рассолов калийных солей, воды озер и подземных источников. Применяют для получения многочисленных неорганических и органических соединений.
ВОПРОСЫ И ЗАДАНИЯ
- Каковы варианты повышения эффективности обучения на примере Вашей индивидуальной темы?
- Приведите тематический план изучения Вашей индивидуальной темы.
- Предложите план изучения одного из веществ на примере Вашей индивидуальной темы.
3. Изготовление и использование опорных сигналов. Использование схем и обобщающих материалов в виде особых знаков и рисунков в педагогике известно давно. Особый бум идея опорных сигналов получила в результате работ Шаталова В. Ф. в 80-е годы ХХ века.
ШАТАЛОВ Виктор Федорович (р. 1927), украинский ученый-педагог, народный учитель СССР (1990), преподаватель математики ряда школ. На педагогической работе с 1951. С 1987 заведующий лабораторией проблем интенсификации учебно-воспитательного процесса НИИ содержания и методов обучения АПН СССР в Донецке. Разработал систему обучения с использованием опорных сигналов — взаимосвязанных ключевых слов, условных знаков, рисунков, формул с кратким выводом. Практическая деятельность основана на педагогике сотрудничества.
(Работы Шаталова В.Ф. изучить самостоятельно).
На наш взгляд опорные схемы, или блок-схемы лучше всего применять не по Шаталову, а использовать при закреплении или обобщении материала. Рассмотрим алгоритм этой методики на примере изучения темы "Карбоновые кислоты"
Учитель объясняет тему по вышеприведенному плану. После чего совместно с учащимися составляет блок-схему.
Карбоновые кислоты (блок-схема)
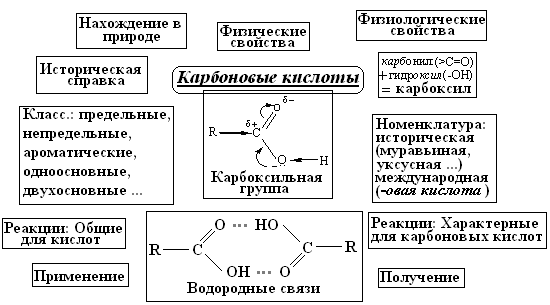
Совместное составление обобщающей блок-схемы вовлекает учащихся в активную деятельность, позволяет ненавязчиво (непроизвольно) включить память учащихся для закрепления материала, поможет учителю организовать опрос по теме на следующем уроке, повторить материал при подготовке к итоговой проверке знаний учащихся. Блок-схемы подобного рода изготавливают также в виде демонстрационных таблиц в дидактический табличный фонд химического кабинета.
4. Система работы с учащимися по карточкам. Работа по карточкам позволяет индивидуализировать и дифференцировать обучение, особенно в части контроля и учета знаний учащихся. Для учителя подготовка карточек – это кропотливая и длительная работа. Предлагаю несколько вариантов карточек различного типа.
а) Карточка – переписка. Такие карточки даются индивидуально каждому ученику или выборочно для выполнения задания дома. Для краткости записи эти задания могут быть обозначены номером задачи или упражнения из учебника или задачника. Выполнив задание на самой карточке, ученик возвращает ее учителю. Учитель проверяет, ставит оценку и на этой же карточке дает новое задание. Карточки по переписке удобно применять для определения остаточных знаний, усвоения знаний учащимися, пропустивших занятия. По мере выяснения наличия знаний и их уровня, выставляется отметка в журнал.
Пример карточки.
-
Карточка – переписка № 4. Акбарова Д. 9 кл.
№ 5, стр. 86
(длина карточки 10-15 см)
Положительные стороны:
Отрицательные стороны:
б) Карточка – задание для контрольной работы. Такие карточки позволяют, предлагая каждому ученику однотипные задания, не давать возможности списывания у товарища или с книги.
Пример карточки.
-
Карточка № 10. Даневич М.. 9 кл.
1. Конспект § 26;
2. Сравнить свойства: вода и аммиак;
3. Написать уравнения: аммиак – нитрат аммония – оксид азота (II);
4. Составить и решить задачу: избыток – недостаток;
5. Выполнить: Упр.1; стр. 81.
Основа карточки набирается на ПК. Учителю остается лишь дописать в нее несколько фраз (набрано курсивом и подчеркнуто).
Положительные стороны:
Отрицательные стороны:
в) Карточки – универсалы. Такие карточки также позволяют, предлагая каждому ученику однотипные задания, не давать возможности списывания у товарища или с книги. На карточке такого типа учитель пишет одну – две формулы или одно – два термина. Полное задание для всех учащихся одинаково. Его (задание) учитель записывает на доске, либо демонстрирует на экране через кодоскоп, либо выводит на ПК для каждого ученика на обороте карточки.
Пример №1 карточки-универсала.
-
Карточка № 12. Al; P
Такие карточки раздаются всем ученикам. Общее задание будет зависеть от пройденной темы. Например, после изучения основных классов неорганических веществ:
-
Задание к контрольной работе по теме
"Основные классы неорганических веществ"
1. Написать по пять химических формул
веществ различных классов, содержащих
эти элементы; написать их названия.
2. Написать 12 уравнений возможных реакций
различных типов между данными веществами или с
участием данных веществ; укажите типы реакций.
3. По уравнению реакции № 5 составить и решить
задачу на определение массы продукта реакции.
4. Используя вещество – продукт реакции № 4,
составьте генетическую цепочку превращения
веществ.
5. Опишите применение одного из веществ;
укажите, на каких свойствах оно основано.
Пример №2 карточки-универсала.
-
Карточка № 6. Шамазова О. 9 кл.
1. Ag, Sr, Fe
2. V V+5
V+5
3. Cu(NO3)2
4. Составить и решить задачу: закон Авогадро;
Общее задание может быть таким:
-
Задание к контрольной работе по теме
"Теория электролитической диссоциации"
1. Написать по две химические формулы
растворимых и нерастворимых веществ,
содержащих эти элементы; написать их названия и
уравнения реакций диссоциации.
2. Написать уравнения возможных реакций
окисления-восстановления; укажите окислитель
и восстановитель.
3. Рассмотрите процесс водного раствора
вещества с инертными электродами.
Положительные стороны:
Отрицательные стороны:
5. Динамические модели и схемы. Многие понятия химии носят абстрактный характер, и формирование их в сознании учащихся часто вызывает большие затруднения. Преодолеть эти затруднения можно, в частности, с помощью таблиц,
наглядных пособий и моделей, особенно с такими, которые имеют подвижные компоненты и детали, позволяющие проследить сущность понятия в динамике. Так, на таблицах, изображающих процессы химических производств, часто стрелками указывают последовательность процессов или направление прохождения веществ. Если стрелки на таких таблицах будут съемными, то данное наглядное пособие становится дидактически более многогранным. Другим примером может служить схема ректификационной колонны для перегонки нефти, в которой обычно указанные названия отдельных фракций и температуры их отгонки выполнены на отдельных листках и могут быть сняты с основной таблицы.
Большие возможности показа процессов в динамике имеют различные варианты аппликации на магнитных досках (механизм диссоциации электролитов в водных растворах, модели изотопов и т.д.).
В качестве примера привожу более подробное описание динамического наглядного пособия "Состояние электронов в атоме" (рис. 1).

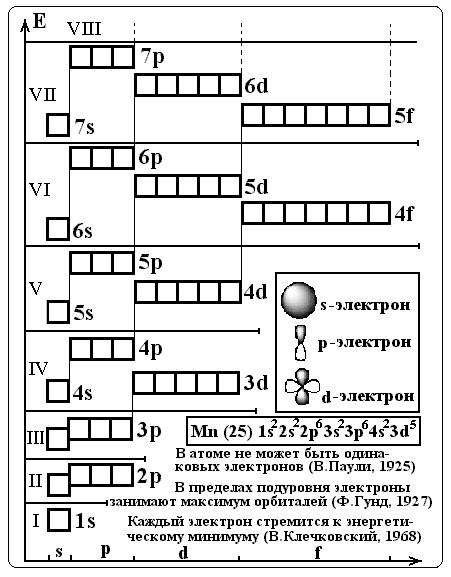
Рис. 1. Наглядное пособие "Состояние электронов в атоме".
Пособие изготавливается на листе фанеры размером 60х80 см. На эту основу наклеивается самоклеющаяся пленка светлого оттенка. На ней темным цветом наносится схема распределения электронов в атоме по энергетическим уровням и подуровням в виде энергетических, или квантовых ячеек.
В каждую ячейку вбивают два небольших гвоздика без шляпки, способных удержать небольшую прямоугольную пластину. Каждая пластинка выполнена в форме стрелки и имеет два отверстия, с помощью которых может подвешиваться на гвоздик, вбитый в фанеру либо стрелкой к верху, либо стрелкой вниз. Эти стрелки символизируют электроны и раскрашены в различные цвета. Пластинки соответствующие s–электронам окрашены в красный цвет, p–электронам — синий цвет, d–электронам — зеленый цвет, и f–электронам — оранжевый цвет.
Кроме схемы электронных оболочек на доске делается «карман» с двумя отделениями для хранения пластмассовых пластинок. На свободных местах схемы даны формулировки основных принципов и правил заполнения электронных оболочек электронами при переходе от атома одного элемента к следующему в периодической химических элементов системе Д.И. Менделеева.
Остальное свободное место на фанерном листе используется для схематического изображения s-, р- и d-электронов и электронной конфигурации одного из химических элементов (марганца).
В области начала координат вбиваются еще четыре гвоздика без шляпок, два из которых служат для навешивания пластинок розового цвета с целыми числами от единицы и выше, символизирующие заряд ядра атома или иона. Вторая пара гвоздиков служит для навешивания пластинок голубого цвета с числами от 1 и выше, символизирующих число нейтронов в ядре атома или иона.
В зависимости от наличия материалов, пособие может быть выполнено из пластика, иметь другие размеры и т.д.
Применяя описанное пособие, можно сформировать у учащихся понятия, раскрывающих строение атомов химических элементов и состояние в них электронов, в том числе: состав атомных ядер, изотоп, электронная оболочка атома, энергетический уровень и подуровень, квантовые числа, число электронов на уровне и подуровне, спаренные и неспаренные электроны, принципы распределения электронов в электронной оболочке атома по уровням и подуровням, электронная формула, переход атома в возбужденное состояние, валентные электроны и т.д.
С помощью данного пособия значительно облегчается формирование у учащихся диалектических понятий, раскрывающих физический смысл периодического закона, периодичность изменения свойств элементов, закономерность изменения свойств химических элементов внутри периодов и групп, незавершенность периодической системы, связь между строением атома и его химическими свойствами и др.
Рассматриваемое пособие ценно также тем, что применимо не только в процессе объяснения нового материала, но и может эффективно использоваться для закрепления и обобщения, а также в ходе контроля и учета знания учащихся. В качестве примера приводим ряд вопросов и упражнений, которые могут быть предложены учащимся на всех этапах обучения с использованием пособия.
- Изобразите схему строения атома данного химического элемента.
- На схеме показано строение атома одного из химических элементов. Назовите этот элемент. Исходя из строения атома, опишите свойства элемента.
- Каково строение внешних энергетических уровней элементов данной подгруппы, данного периода?
- Каково максимальное число электронов на данном энергетическом уровне, подуровне?
- Как происходит заполнение электронных уровней от атомов одного элемента до другого по периодической системе (например, от натрия до аргона)?
- Укажите значения квантовых чисел электрона, который соответствует по схеме данной квантовой ячейке.
- Как идет заполнение электронных уровней от калия до криптона? Каковы особенности и причины такого заполнения? Как это отражается на свойствах элементов данного периода?
- Даны два электрона (например, 4d и 5s), энергия какого из них имеет большее значение?
- Почему третий период включает в себя только 8 элементов, а четвертый – 18?
- Проиллюстрируйте с помощью пособия действие законов (постулатов) перехода количественных отношений в качественные, единства и борьбы противоположностей, отрицания отрицания в изменении свойств химических элементов и их соединений в зависимости от строения атомов.
- Схеме показано строение атома одного из химических элементов. Какие свойства у него будут преобладать, металлические или неметаллические? Дайте развернутый ответ.
- Изобразите на схеме строение атома данного элемента (например, углерода, азот, хлора) и покажите варианты перехода атома в возбужденное состояние.
- Почему VII период называют незавершенным? Сколько еще химических элементов необходимо открыть до его завершения? Какими свойствами будут обладать еще неоткрытые элементы?
Перечень вопросов и упражнений можно продолжить. Каждый учитель сможет это сделать в зависимости от конкретных целей темы, уровня подготовки класса и других условий.
Следует отметить, что предлагаемое пособие с успехом используется также в высшей школе, как при формировании у студентов основных понятий строения атома в курсе общей химии, так и при изучении методов преподавания этих вопросов в курсе методики обучения химии в педагогическом вузе.
С внедрением в процесс обучения современных информационных и компьютерных технологий с огромным потенциалом анимации, возможности создания динамических схем и моделей многократно возрастают.
Так с помощью программы Macromedia Flash 6 MX в соответствии с периодической системой создана таблица "Строение атомов и свойства химических элементов" (рис. 2).
Выделяя курсором химический знак элемента, на экране выплывает табличка с перечнем некоторых его свойств.
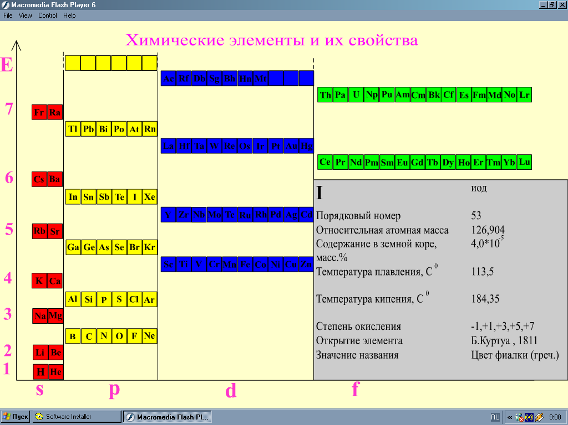
Рис. 2. Компьютерная динамическая таблица "Строение атомов и свойства химических элементов"
Привожу пример динамической схемы, выполненной на листе ватмана. Стрелки, показывающие направление перехода одних форм азота в другие можно с помощью наклеенных бумажных полосок менять местами или убирать совсем.
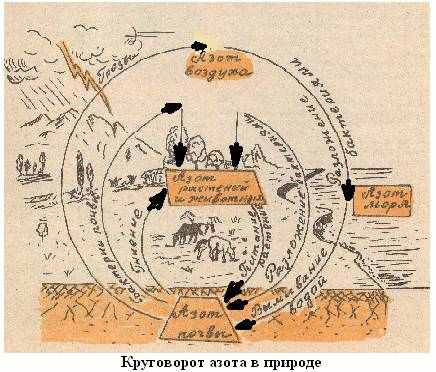
Рис 3. Динамическая схема (стрелки установлены неверно).
Схема позволяет объяснить круговорот азота и его соединений в природе (когда стрелки установлены верно). Стрелки можно убрать, и дать задание ученику правильно установить их на схеме. Стрелки можно "перепутать", как на рисунке, и дать задание исправить ошибки.
Такие схемы возможно выполнить на ПК в виде интерактивных заданий по примеру детских игр, когда определенные букву или предмет нужно перетащить на определенное место.
Положительные стороны:
Отрицательные стороны:
ВОПРОСЫ И ЗАДАНИЯ
- Предложите блок-схему, отражающую материал Вашей индивидуальной темы.
- Составьте дидактические карточки к Вашей индивидуальной теме.
- Предложите динамическую модель к Вашей индивидуальной теме.
6. Дидактические игры.
В энциклопедических словарях понятие "игра" определяется, как вид непродуктивной деятельности, мотив которой заключается не в ее результате, а в самом процессе. В словарях русского языка понятие игра толкуется более многогранно и в прямом смысле этого слова связывается с отдыхом, развлечениями и соревнованиями.
Психологи, педагоги и ученые рассматривают игру как своеобразный пласт общечеловеческой культуры, основу досуга, сферу деятельности взрослых и детей, средство познания и самовыражения.
Особое место среди многообразия различных игр занимает дидактическая игра как специальный метод обучения, методический прием или средство обучения в виде игровой ситуации, направленные на достижение определенных дидактических целей в процессе обучения
Дидактические игры возбуждают интерес учащихся к предмету, активизируют их на протяжении всего урока, развивают мышление, речь, память, формируют познавательные интересы, оказывают положительное воспитывающее действие.
Включение в обучение элементов игры делает процесс более интересным и эмоциональным, облегчает усвоение и закрепление изучаемого материала. Однако дидактическую игру нельзя рассматривать как развлечение или отдых на уроке. Дидактическая игра - это действенный методический прием, позволяющий непроизвольно включить ученика в активную творческую учебную деятельность. И мы не призываем превращать обучение в игру. Игра в учебе - не самоцель, а средство обучения, применение которого в сочетании с другими методами должно внести свой определенный вклад в решении образовательно-воспитательных задач курса химии средней школы.
В дидактической игре, с одной стороны, сохраняются элементы забавы – это игровые приемы и правила, определенный эмоциональный настрой и условность игровой ситуации, элементы удовольствия, занимательности и соревнования, наличие победителей и побежденных, то есть, все основные признаки, присущие обычной игре. С другой стороны, в дидактической игре должен превалировать дидактический результат: усвоение тех или иных знаний и умений, развитие мыслительных и речевых качеств, воспитание социальной культуры и других сторон личности учащихся.
Естественно, что в любых играх присутствуют элементы познавательности, но мы считаем, что в дидактической игре эти элементы должны стать определяющими. В обычные игры играют ради игры, а дидактические игры целенаправленно вводятся в учебный процесс, чтобы получить соответствующие результаты.
Дидактические игры можно подразделить на обучающие, развивающие, воспитывающие и комбинированные, позволяющие решать одновременно несколько дидактических задач.
В свою очередь обучающие игры можно подразделить на:
- игры, формирующие новые понятия;
- игры, систематизирующие изучаемый материал;
- игры, используемые при контроле и учете знаний.
Игры обучающего характера могут быть использованы учителем на уроках при изучении новой темы для усвоения понятий, при обобщении и систематизации полученных знаний, а также при контроле и учете знаний учащихся.
Среди развивающих игр, на наш взгляд, следует выделить следующие:
- игры, развивающие свойства личности (память, внимание, мышление и др.);
- игры, развивающие практические умения и навыки.
Воспитывающие игры чаще всего находят место при контроле домашнего задания, закреплении изученного материала, а также при проведении практических и лабораторных занятий, но особый результат с их помощью достигается в процессе подготовки и проведения уроков-семинаров, зачетных занятий, при проведении внеклассных соревновательных мероприятий по предмету. Среди игр такого рода можно выделить:
- игры, воспитывающие мировоззрение;
- игры, воспитывающие личностные качества;
- игры, способствующие политехнической подготовке.
Более широкое применение в процессе обучения имеют комбинированные игры, помогающих решению одновременно нескольких дидактических задач урока.
Дидактические игры также, на наш взгляд, целесообразно для учителя-практика классифицировать, взяв за основу форму их проведения:
- словесные, или вербальные;
- с применением игровой атрибутики;
- сюжетно-ролевые;
- компьютерные.
Предложенные классификации позволяют провести параллель между целями, формами проведения дидактических игр и дидактическими целями, методами проведения урока и увидеть их идентичность, которая еще раз доказывает, насколько игровой метод близок к процессу обучения и поэтому может оказывать на него определенное воздействие.
Дидактические игры также можно условно разделить на три группы в зависимости от времени их проведения: игры-минутки; игры-пятиминутки и игры, длительные по времени. Игры-минутки, требующие минимального затрата времени следует, на наш взгляд, проводить учителем в основном для возбуждения интереса и привлечения внимания учеников к изучаемому материалу. Их можно применять, как при объяснении новой темы, так и при закреплении, повторении, обобщении, а также в процессе контроля знаний учащихся.
Игры-пятиминутки, могут проводиться в течение 5-10 минут индивидуально, небольшими группами учащихся, но также и всем классом на всех этапах обучения. Игры-тридцатиминутки проводятся чаще всего с участием всего класса в течение 10-40 минут и применяются главным образом при обобщении и в ходе контроля знаний.
Приведенную классификацию игр по времени их проведения можно считать достаточно условной. Так как игры-минутки можно объединить или “растянуть” во времени на целый урок. Кроме того, из небольших игр можно составить интересные командные конкурсы типа “Веселые химические старты”, включив в них 5-7 игр в виде командных конкурсов.
В любом случае дидактическая цель, которая ставиться учителем в начале игры должна соответствовать целям урока (формирование новых понятий, повторение и обобщение раннее изученного материала и т.д.). В игровой ситуации дидактическая цель ставится перед учащимися в форме игровой задачи. Ученики в период выполнения игровой задачи усваивают общие принципы работы с учебным материалом и используют эти умения при решении других задач, где эти знания и умения применимы. Игра здесь исполняет роль средства, с помощью которого организуется процесс усвоения, отрабатываются и совершенствуются определенные знания, умения и навыки учащихся, расширяется их кругозор.
Принимая активное участие в игре и стремясь добиться игрового результата, учащиеся одновременно достигают и определенного результата своей учебной деятельности, так как их цели и задачи являются едиными.
Итог игры никогда никого не оставляет равнодушным, он стимулирует и побуждает ребят к дальнейшим учебным действиям, что также оказывает положительное влияние на активизацию учебной деятельности и результаты обучения в целом. В свою очередь следует отметить, что результаты учебной деятельности, заключающиеся в изменении самого субъекта обучения, способствуют достижению дидактической цели и развитию дидактического и психологического факторов игры.
В разработке и организации дидактических игр учитель должен подробно и внимательно проработать следующие вопросы и этапы игры:
- название игры;
- объявление о проведении игры и подготовка к ней учащихся;
- дидактические факторы игры;
- занимательные факторы игры;
- атрибуты игры;
- правила игры;
- число играющих;
- ход (сценарий или модель) игры;
- продолжительность игры;
- подведение итогов.
Главным моментом организации дидактических игр в процессе обучения, мы считаем, является умелое и разумное сочетание в них элементов забавы и дидактических факторов.
Приведем ряд методических рекомендаций по разработке и использованию дидактических игр, которые считаем наиболее существенными в данном вопросе.
1. Дидактические игры следует использовать не ради игры, а с целью получения определенного результата в процессе обучения и воспитания. К дидактическим играм следует готовить детей заранее, учитывая, прежде всего, психолого-педагогические аспекты, время проведения, некоторые атрибуты и правила. Это позволяет заранее настроить детей на игру и подготовиться к ней теоретически.
2. В названии, правилах и сюжете игры должны преобладать элементы забавы, занимательности и соревновательности, но, в то же время, игра не должна быть слишком азартной.
3. Дидактический фактор игры должен обеспечить достаточно широкую, но посильную творческую и мыслительную деятельность учащихся в области химии и смежных дисциплин, соответствовать возрастным особенностям, степени подготовки и развитию кругозора учащихся. Игру следует начинать с более простых заданий, постепенно переходя к более сложным, они должны содержать элементы увлекательности и давать возможность принимать несколько вариантов ответов, в том числе и нестандартных.
4. Атрибуты игры должны быть красивыми, яркими, загадочными, необыкновенными. Их изготавливают так, чтобы была возможность многократного использования.
5. Правила игры должны быть простыми и однозначно сформулированными, чтобы ребенок смог хорошо осмыслить ход и содержание игры, ее правила и цель.
6. Во время игры необходимы дисциплина и порядок. Подведение результатов игры должно быть ясным, открытым, эмоциональным, справедливым и фиксироваться определенным образом для всеобщего обозрения. При необходимости для подсчета результатов выбирают или назначают специальное жюри или помощников-консультантов из школьников.
7. Игры лучше всего проводить в быстром темпе, чтобы каждый ученик с максимальной активностью мог участвовать в игре. При этом необходим предварительный расчет продолжительности каждого этапа игры и обязательное его выполнение в процессе игры. Во многих играх в качестве атрибутов могут понадобиться секундомер и гонг. Вместо гонга можно взять судейский свисток.
8. Учителю следует быть активным участником игры, не допуская при этом снижение интереса у детей к игре, субъективности и нечестности. Необходимо умело регулировать ход игры так, чтобы не было проигрыша одной команды с «сухим» счетом. Во время игры обеспечивается нормальный психолого-педагогический климат, активизируется работа пассивных учеников. Иногда бывает полезно ввести в правила игры поощрительные и штрафные баллы.
9. Результаты игры подводятся двояко: с одной стороны, кто победил, с другой – кто проиграл по очкам или баллам. Подведение результатов имеет большое значение, так как дает участникам моральное удовлетворение. Однако важнее то, как реализован дидактический замысел игры, то есть, как ученики усвоили соответствующие знания и умения, как они справились с дидактической задачей. Результаты игры, в том числе и дидактические, должны быть объявлены непосредственно после игры.
10. Для каждой игры должны быть определены призы - красочные, эффектные, вызывающие у детей положительные эмоции. В качестве призов могут быть книги, торт, конфеты, медали, открытки, значки «Лучший химик класса», право провести занимательный химический опыт и т.д. Призы изготавливают или заранее покупают и вручают победителям в виде приятных сюрпризов. Если призы значительны по своему содержанию, то имеет смысл выставить призовой фонд до начала игры. В любом случае необходимо оценить дидактический результат игры в виде поурочных баллов в классном журнале.
11. Лучшее признание успеха игры - желание учеников ее повторить. Однако чрезмерного увлечения играми на уроке допускать нельзя, чтобы не превратить весь учебный процесс в развлечение.
12. Дидактический эффект усиливается, если ученики принимают участие в подготовке атрибутов и призов, а также в разработке правил игры. Если дидактические игры используют для изучения химии систематически, то ученики с большим удовольствием начинают разрабатывать свои собственные игры. Игровая форма проведения уроков позволит сделать интересными и привлекательными для ребят даже скучные темы урока.
Примеры дидактических игр
Игра "КТО ДАЛЬШЕ?"
Цель. Активизировать процесс запоминания химических элементов и веществ, их дифференциацию на металлы и неметаллы, на отдельные группы и т.д.
Задание. Играющий должен прошагать как можно дальше, называя на каждый шаг химический элемент. Игру можно усложнить, обусловливая перечень названий (металлы или неметаллы, названия простых или сложных веществ и т.д.).
В игре участвуют одновременно 2-3 ученика /по числу соревнующихся команд/. Выигрывает тот, кто прошагает дальше без ошибок, запинок и повторений.
Игра "ХИМИЯ - ЭТО СТРАНА ЧУДЕС"
Цель. Заинтересовать учащихся, повысить уровень их внимания к изучаемому материалу.
Описание игры. Для этой игры потребуется тридцать небольших карточек из плотной бумаги. На одной стороне этих карточек пишутся химические символы и названия различных химических элементов или сложных веществ. Ведущий просит одного из учеников назвать любое число от 1 до 10. Предположим, что названо число 4. Ведущий убирает из стопки любые четыре карточки, оставшиеся отдает ученику и просит их пересчитать и определить в полученном числе сумму цифр. Далее ведущий предлагает ученику запомнить ту карточку снизу, номер которой равен этой сумме. Затем ведущий забирает все карточки и начинает откладывать их сверху по одной, произнося по буквам фразу: "Х-и-м-и-я - э-т-о с-т-р-а-н-а ч-у-д-е-с" так, чтобы на каждую произнесенную букву откладывалась одна карточка. Карточка, которая выпадает при произнесении последней буквы, переворачивается надписью вверх. Это и будет та карточка, которую запомнил ученик.
Объяснение игры. Принцип игры состоит в том, что для любого числа от 20 до 29 разность между этим числом и суммой его цифр равна 18. Поэтому выбранная карта всегда будет в стопке девятнадцатой сверху, если их общее количество будет в пределах указанных чисел. Этот предел обеспечивается первой частью игры. Поскольку в фразе "химия - это страна чудес" содержится девятнадцать букв, а на каждую произнесенную букву убирается одна карточка, то последняя буква фразы и укажет на замеченную зрителем карточку, то есть на соответствующий химический элемент. Естественно, что наука химия в этой игре ни при чем.
Игра "УЗНАЙ-КА"
Цель. Развить внимание, наблюдательность, зрительную память и закрепить знания учащихся о лабораторной посуде.
Атрибуты. Пластмассовая воронка; стеклянная палочка (с оплавленными концами); тигельные щипцы; фарфоровая чашка; фарфоровый пестик; держатель для пробирок; спиртовка, не наполненная спиртом; штатив для пробирок; другие безопасные предметы из числа химического оборудования; платок для завязывания глаз.
Задание. На столе раскладываются предметы, указанные выше. Игрок в течение 5 секунд запоминает их, и затем ему завязывают глаза. Ведущий быстро меняет местами предметы. Участник игры с завязанными глазами поворачивается по команде и берет любой из предметов, лежащих на столе. Его задача – узнать предмет по его внешним признакам, дать название и рассказать для чего он используется в химии.
Игра "ХИМИЧЕСКАЯ ТАЙНОПИСЬ"
Цель. Облегчить запоминание названий химических элементов и их символов.
Атрибуты игры. Карточки с названиями химических элементов и их символами.
| | | | | | | | | | | |
| | НАТРИЙ | | I | | | | ЛИТИЙ | | Ag | |
| | | | | | | | | | | |
| | МАРГАНЕЦ | | Na | | | | БРОМ | | Li | |
| | | | | | | | | | | |
| | ИОД | | Cu | | | | ХРОМ | | S | |
| | | | | | | | | | | |
| | СВИНЕЦ | | Au | | | | СЕРЕБРО | | Cr | |
| | | | | | | | | | | |
| | ЗОЛОТО | | Pb | | | | СЕРА | | Zn | |
| | | | | | | | | | | |
| | МЕДЬ | | Mn | | | | ЦИНК | | Br | |
| | | | | | | | | | | |
Задание. Как можно быстрее соедините линией прямоугольники /название элемента/ с соответствующими прямоугольниками /химический знак/.
Чтобы обеспечить многократное использование карточек, можно линии проводить на листочках полиэтиленовой пленки соответствующего размера.
Игра "СКОЛЬКО ЗНАКОВ?"
| Al O B He Li C N Sr F Ne W Be Na Mg Si Rb Ti Ra Ca Te Zn Te I Pb Mo Se H Br Po |
Пример карточки
Выигрывает тот, кто точнее угадает число элементов и быстрее справится с остальной частью задания.
Игра "КТО ЛИШНИЙ?"
Цель. Развить внимание, наблюдательность и умение ориентироваться в периодической системе химических элементов Д.И. Менделеева.
Атрибуты. Карточки в соответствии с вариантами игры.
Задание. Исключить из данного перечня или группы элементов один "лишний", то есть тот элемент, который не подходит по основным признакам к другим. Выигрывает тот, кто первым правильно справляется с заданием.
ВАРИАНТ I
/Карточки с символами химических элементов/
Fe
Mg
He
Li
Ag
Cl
C
N
Na
Br
Cl
Cs
Ca
Cu
Zn
Ответ. Главный признак: металл - неметалл.
"Лишние" - а/ гелий; б/ натрий; в/ хлор.
Игра "ОТГАДЫВАЮ ЗАДУМАННЫЙ ЭЛЕМЕНТ"
Цель. Заинтересовать учащихся, повысить уровень их внимания к изучаемому материалу. Развить внимание, наблюдательность и умение ориентироваться в периодической системе химических элементов Д.И. Менделеева.
Атрибуты. Периодическая система Д.И. Менделеева и калькуляторы.
Описание игры. Ведущий просит одного из учеников задумать любой химический элемент по периодической системе. После этого ведущий предлагает провести с номером этого элемента следующие вычисления без сообщения промежуточных результатов.
1) Номер элемента удвоить. 2) К произведению прибавить 5.
3) Сумму умножить на 5. Последний результат сообщается ведущему, который тотчас объявляет задуманный играющим элемент.
Объяснение игры. Разгадка заключается в следующем. Пусть задуман элемент №25 /марганец/. Проведем с числом 25 соответствующие математические действия:
25 × 2=50; 50+5=55; 55 × 5 = 275.
Число 275 сообщается ведущему, который в уме отбрасывает последнюю цифру /получается 27/ и отнимает от полученного числа число 2 - получается 25. Это и есть номер задуманного элемента. После этого ведущему остается только назвать этот элемент - марганец.
Игра "МАГИЧЕСКИЕ ЭЛЕМЕНТЫ"
Цель. Активизировать процесс запоминания названий химических элементов.
Атрибуты. Периодическая система химических элементов Д.И. Менделеева.
ВАРИАНТ I. Ведущий называет порядковый номер какого-либо химического элемента, в названии которого отсутствовали бы буквы Ь, Й, Я и т.д. /нет названий химических элементов, которые начинались бы с этих букв/.
Задание. Играющие записывают название данного химического элемента по вертикальной линии, а рядом - названия химических элементов, начинающиеся с соответствующей буквы из первого слова. Выигрывает тот, кто первым справится с заданием.
П
 ример. ЭЛЕМЕНТ НОМЕР 86
ример. ЭЛЕМЕНТ НОМЕР 86
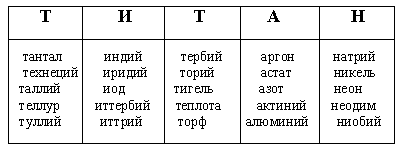
ВАРИАНТ II. Ведущий называет номер химического элемента или его индивидуальные признаки. Играющие записывают его название в таблицу так, чтобы в каждой верхней графе находилось по одной букве, ниже записывают столько слов, сколько их в исходном слове. Эти слова должны начинаться с соответствующей буквы и быть названиями химических элементов. Если окажется, что на данную букву нет достаточного числа названий химических элементов, то их заменяют другими химическими терминами.
Пример. ЭЛЕМЕНТ НОМЕР 22
Игра "ПУТЕШЕСТВИЕ В МИР ХИМИЧЕСКИХ ЭЛЕМЕНТОВ"
Цель игры. Продолжить формирование и развитие знаний учащихся о химических элементах и периодической системе.
Атрибуты. Игровое поле Периодическая система химических элементов Д.И. Менделеева большого формата, фишки и кубик с очками от 1 до 6.
Играют 2-5 человек, можно играть парами или командами. При игре командами можно использовать несколько игровых полей /по числу команд/.
Ход игры. Каждый играющий бросает кубик и, если выпадает шесть очков, получает право вступить в игру, поставив свою фишку в клеточку водорода, элемента №1. Далее участники игры поочередно бросают кубик и передвигают свою фишку на соответствующее число клеточек периодической системы. Если фишка попадает в клеточку с условным обозначением, то играющий должен выполнить требуемое задание, иначе этот игрок пропускает один ход. Данные условия определяются уровнем подготовленности учащихся, и учитель может заранее их обозначить специальными флажками, на которых указано задание (кто открыл элемент, формула гидроксида, латинское название элемента, важнейшие области применения и т.д.). Можно также заранее оговорить, что если во время игры фишка попадет в клеточки элементов лития, фосфора, калия и др., играющий получает право экспрессного передвижения на пять номеров вперед. Если же фишка очутится в клеточках элементов магния, хлора, брома и др., то фишка возвращается на пять номеров назад.
Выигрывает тот, чья фишка первой достигнет клеточки 118, символизирующей окончание VII периода, последние элементы которого с номерами до 118 еще предстоит открыть.
7.Занимательность в обучении химии.
Занимательность в обучении в определенной степени имеет много общего с дидактическими играми, выполняя в основном те же задачи, но в первую очередь формирование интереса к изучаемому предмету. Однако в организации различных форм занимательности ведущая роль принадлежит педагогу; обучаемые играют здесь более пассивную роль, нежели в дидактической игре.
Занимательность в химии можно систематизировать по двум важнейшим направлениям: вербальные формы занимательности и занимательные химические опыты.
Примеры ВЕРБАЛЬНЫХ ФОРМ ЗАНИМАТЕЛЬНОСТИ
