Модуль Теория строения атома. Периодический закон и периодическая система Д. И. Менделеева
| Вид материала | Закон |
- И. А. Моу «исош №1» п. Ивня Игра по химии «Умники и умницы» Тема: «Периодический закон, 114.97kb.
- Тема урока: «Периодический закон и периодическая система химических элементов, 266.68kb.
- Темы рефератов или презентаций Биотехнология и генная инженерия технологии XXI века, 47.96kb.
- Урок а «Периодический закон и периодическая система химических элементов Д. И. Менделеева.», 106.31kb.
- Химическая конференция (к 176-летию со дня рождения Д. И. Менделеева), 204.32kb.
- Жизнь и научная деятельность Д. И. Менделеева. Периодический закон и периодическая, 155.59kb.
- Закон и периодическая система химических элементов Д. И. Менделеева" Значение и место, 131.75kb.
- Бековского района пензенской области, 115.96kb.
- Конкурсное задание «учебное занятие»13 апреля, 71.51kb.
- Применение коллективного способа обучения при изучении темы «Периодический закон, 94.15kb.
1год обучения
Модуль 2. Теория строения атома. Периодический закон и периодическая система Д.И. Менделеева.
Цели модуля: Обобщить и систематизировать знания о строении атома, знать периодический закон и изменения свойств элементов и соединений в периоде и группе.
Задачи:
1. Знать понятие атом, модели строения атома, состав атомных ядер, строение электронных оболочек атомов.
2. Знать понятие орбиталь, формы орбиталей, распределение электронов в оболочках атомов элементов 1 – 4 периодов
3. Уметь писать электронные формулы, электронные ячейки, по электронным формулам определять химический элемент.
4. Знать современную формулировку периодического закона и теоретическое обоснование периодической системы Д.И. Менделеева.
5. Знать закономерности изменения свойств элементов и их соединений.
6. Уметь решать задачи: вычисления по химическим уравнениям, по известному количеству вещества, задачи на лимитирующий реагент.
| | Тема | Всего часов | Теория | Прак-тика | Материалы |
| | 1. Основные понятия и законы химии | 10 | 6 | 4 | |
| №1 | Атом. Ядерная модель строения атома. Состав атомных ядер. | 3 | 1 | 2 | Лекция № 1, тест № 1 |
| №2 | Современная модель состояния электрона в атоме. Строение электронных оболочек атомов. Орбиталь. Формы орбиталей. Электронные формулы. Распределение электронов в оболочках атомов элементов 1 – 4 периодов (электронные формулы, электронные ячейки). | 2 | 1 | 1 | Лекция № 2, тест № 2, лаб. р. № 1 |
| №3 | Периодический закон в свете о теории строении атома. Теоретическое обоснование периодической системы Д.И. Менделеева. Периодическое изменение свойств элементов и их соединений. | 3 | 1 | 2 | Лекция № 3, лабораторная работа № 2 |
| №4 | Расчетные задачи: вычисления по химическим уравнениям, по известному количеству вещества, задачи на лимитирующий реагент. | 2 | | 2 | лабораторная работа №3 |
Лекция № 1. Модуль 2.
Атом. Ядерная модель строения атома. Состав атомных ядер.
Атом (от греч. atomos - неделимый), наименьшая частица химического элемента, носитель его свойств. Каждому химическому элементу соответствует совокупность определенных атомов. Связываясь друг с другом, атомы одного или разных элементов образуют более сложные частицы, например молекулы. Все многообразие химических веществ (твердых, жидких и газообразных) обусловлено различными сочетаниями атомов между собой. Атомы могут существовать и в свободном состоянии (в газе, плазме).
Свойства атома, в том числе важнейшая для химии способность атома образовывать химические соединения, определяются особенностями его строения.
Общая характеристика строения атома.
Атом состоит из положительно заряженного ядра, окруженного облаком отрицательно заряженных электронов. Размеры атома в целом определяются размерами его электронного облака и велики по сравнению с размерами ядра. Электронное облако атома не имеет строго определенных границ, поэтому размеры атома в значительной степени условны и зависят от способов их определения. Ядро атома состоит из Z протонов и N нейтронов, удерживаемых ядерными силами. Положительный заряд протона и отрицательный заряд электрона одинаковы по абсолютной величине и равны е= 1,60*10-19 Кл; нейтрон не обладает электрическим зарядом. Заряд ядра +Ze - основная характеристика атома, обусловливающая его принадлежность к определенному химическому элементу. Порядковый номер элемента в периодической системе Менделеева (атомный номер) равен числу протонов в ядре.
В электрически нейтральном атоме число электронов в облаке равно числу протонов в ядре. Однако при определенных условиях он может терять или присоединять электроны, превращаясь соответственно в положительный или отрицательный ион, например Li+, Са2+ или СI-, О2-. Говоря об атомах определенного элемента, подразумевают как нейтральные атомы, так и ионы этого элемента.
Масса атома определяется массой его ядра; масса электрона ( 9,109*10-28 г) примерно в 1840 раз меньше массы протона или нейтрона ( 1,67*10-24 г), поэтому вклад электронов в массу атома незначителен. Общее число протонов и нейтронов А = Z + N называют массовым числом. Массовое число и заряд ядра указываются соответственно верхним и нижним индексами слева от символа элемента, например 2311Na. Вид атомов одного элемента с определенным значением N называют нуклидом. Атомы одного и того же элемента с одинаковыми Z и разными N называют изотопами этого элемента. Различие масс изотопов мало сказывается на их химических и физических свойствах. Наиболее значительные, отличия наблюдаются у изотопов водорода вследствие большой относительной разницы в массах обычного атома (протия), дейтерия (D) и трития (Т).
История становления понятия
Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами. В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является «неделимым».
На международном съезде химиков в г. Карлсруе (Германия) в 1860 г. были приняты определения понятий молекулы и атома. Атом — наименьшая частица химического элемента, входящая в состав простых и сложных веществ. Современное определение атома: Атом — электронейтральная частица, состоящая из положительно заряженного ядра и компенсирующих его заряд электронов.
Модели атомов
— Кусочки материи. Демокрит полагал, что свойства того или иного вещества определяются формой, массой, и пр. характеристиками образующих его атомов. Так, скажем, у огня атомы остры, поэтому огонь способен обжигать, у твёрдых тел они шероховаты, поэтому накрепко сцепляются друг с другом, у воды — гладки, поэтому она способна течь. Даже душа человека, согласно Демокриту, состоит из атомов.
— Корпускулярно-кинетическая теория тепла. М. В. Ломоносов утверждает, что все вещества состоят из «корпускул» — «молекул», которые являются «собраниями» «элементов» — «атомов».
— Модель атома Томсона «Пудинг с изюмом». Дж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Эта модель не объясняла дискретный характер излучения атома и его устойчивость. Окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
— Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбиталям вращались электроны, объединённые в кольца. Модель оказалось ошибочной, но некоторые важные её положения вошли в модель Резерфорда.
— Планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчеты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Современное представление об атоме
Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов и окружено отрицательно заряженными электронами. Однако представления квантовой механики не позволяют считать, что электроны движутся вокруг ядра по сколько-нибудь определённым траекториям (неопределённость координаты электрона в атоме может быть сравнима с размерами самого атома).
Химические свойства атомов определяются конфигурацией электронной оболочки и описываются квантовой механикой. Положение атома в таблице Менделеева определяется электрическим зарядом его ядра (т.е. количеством протонов), в то время как количество нейтронов принципиально не влияет на химические свойства; при этом нейтронов в ядре, как правило, больше, чем протонов. Если атом находится в нейтральном состоянии, то количество электронов в нём равно количеству протонов. Основная масса атома сосредоточена в ядре, а массовая доля электронов в общей массе атома незначительна (несколько сотых процента массы ядра).
Массу атома принято измерять в атомных единицах массы, равных 1⁄12 от массы атома стабильного изотопа углерода 12C.
Тест № 1, лекция № 1, модуль 2
1. Заряд ядра атома равен числу
1) протонов, 2) электронов во внешнем электронном слое,
3) нейтронов, 4) энергетических уровней
2. Атом состоит из
1) положительно заряженного ядра и электронной оболочки,
2) отрицательно заряженного ядра и протонной оболочки,
3) нейтронов и электронов,
4) протонов и нейтронов.
3. В состав атомного ядра входят
1) электроны и протоны,
2) протоны, нейтроны и электроны,
3) нейтроны и электроны,
4) нейтроны и протоны.
4. Число нейтронов в ядре равно
1) порядковому номеру,
2) числу электронов,
3) сумме числа протонов и нейтронов,
4) разности массового числа и числа протонов в ядре.
5. Порядковый номер химического элемента равен
1) заряду ядра атома,
2) атомной массе,
3) числу нейтронов в ядре,
4) числу валентных электронов атома.
6. Относительная атомная масса изотопа численно равна
1) сумма числа электронов и протонов,
2) разности между числом протонов и числом нейтронов,
3) сумме числа протонов и нейтронов,
4) порядковому номеру элемента.
7. Изотопы одного элемента имеют
1) одинаковое число нейтронов,
2) одинаковое число протонов,
3) равную сумму числа протонов и нейтронов,
4) одинаковую разность числа протонов и нейтронов.
Лекция № 2, модуль № 2
Современная модель состояния электрона в атоме. Строение электронных оболочек атомов. Орбиталь. Формы орбиталей. Электронные формулы. Распределение электронов в оболочках атомов элементов 1 – 4 периодов (электронные формулы, электронные ячейки).
В начале XX века была принята планетарная модель строения атома, предложенная Резерфордом, согласно которой вокруг очень малого по размерам положительно заряженного ядра движутся электроны, как планеты вокруг Солнца.
Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь. Двигаясь вокруг атома, электроны образуют в совокупности его электронную оболочку.
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке? Исследования Нильса Бора – основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями – оболочками и в определенном порядке.
Строение электронных оболочек атомов имеют важную роль для химии, так как именно электроны обуславливают химические свойства веществ. Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома. Электроны, обладающие близкими значениями энергии образуют единый электронный слой, или энергетический уровень. Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n (совпадает с номером периода) и принимает целочисленные значения 1, 2, 3, 4, 5, 6 и 7. Чем больше значение n, тем больше энергия электрона в атоме. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2 ,
где N – максимальное число электронов на уровне;
n – номер энергетического уровня.
Установлено, что на первой оболочке располагается не более двух электронов, на второй – не более восьми, на третьей – не более 18, на четвертой – не более 32. Заполнение более далеких оболочек мы рассматривать не будем. Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Как ранее было сказано, электрон движется не по орбите, а по орбитали и не имеет траектории.
Пространство вокруг ядра, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона, или электронным облаком.
Орбитали, или подуровни могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s), второй – два (s,p), третий – три (s,p,d) и т.д. Электроны разных подуровней одного и того же уровня имеют разную форму электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию (d) и (f). Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
S – орбиталь
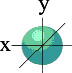
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и, наконец, превращается в гантелеобразную p-орбиталь:

Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
Три p – орбитали

Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве – разное.
Составим схему последовательного заполнения электронами энергетических
уровней
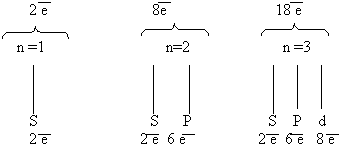
Теперь мы можем составить схему строения электронных оболочек атомов:
1. Определяем общее число электронов на оболочке по порядковому номеру элемента.
2. Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
3. Определяем число электронов на каждом энергетическом уровне.
4. Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой – квадратиком на энергетической диаграмме.
На s-подуровне может находиться одна атомная орбиталь

а на p-подуровне их может быть уже три –
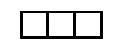
(в соответствии с тремя осями координат).
Орбиталей d– и f-подуровня в атоме может быть уже пять и семь соответственно:
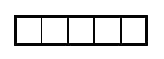
Пример: Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода

Следующий за водородом элемент-гелий. Ядро атома гелия имеет заряд +2, поэтому атом гелия содержит два электрона на первом энергетическом уровне:

Так как на первом энергетическом уровне может находиться не более двух электронов, то он считается завершенным.
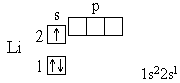
Элемент № 3 – литий. Ядро лития имеет заряд +3, следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня. Электрон, находящийся на втором уровне слабее связан с ядром, чем два других.
Далее формирование электронных оболочек у элементов 2-го периода происходит следующим образом:

Для атома углерода уже можно предположить три возможных схемы заполнения электронных оболочек в соответствии с электронно-графическими формулами:

Анализ атомного спектра показывает, что правильна последняя схема. Пользуясь этим правилом, нетрудно составить схему электронного строения для атома азота:
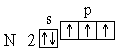
Этой схеме соответствует формула 1s22s22p3. Затем начинается попарное размещение электронов на 2p-орбиталях. Электронные формулы остальных атомов второго периода:

У атома неона заканчивается заполнение второго энергетического уровня, и завершается построение второго периода системы элементов.
Найдите в периодической системе химический знак лития, от лития до неона Ne закономерно возрастает заряд ядер атомов. Постепенно заполняется электронами второй слой. С ростом числа электронов на втором слое металлические свойства элементов постепенно ослабевают и сменяются неметаллическими.
Третий период, подобно второму, начинается с двух элементов (Na, Mg), у которых электроны размещаются на s-подуровне внешнего электронного слоя. Затем следуют шесть элементов (от Al до Ar), у которых происходит формирование p-подуровня внешнего электронного слоя. Структура внешнего электронного слоя соответствующих элементов второго и третьего периодов оказывается аналогичной. Иначе говоря, с увеличением заряда ядра электронная структура внешних слоев атомов периодически повторяется. Если элементы имеют одинаково устроенные внешние энергетические уровни, то и свойства этих элементов подобны. Скажем, аргон и неон содержат на внешнем уровне по восемь электронов, и потому они инертны, то есть почти не вступают в химические реакции. В свободном виде аргон и неон – газы, которые имеют одноатомные молекулы.
Атомы лития, натрия и калия содержат на внешнем уровне по одному электрону и обладают сходными свойствами, поэтому они помещены в одну и ту же группу периодической системы.
III. Выводы.
1. Свойства химических элементов, расположенных в порядке возрастания заряда ядра, периодически повторяются, так как периодически повторяется строение внешних энергетических уровней атомов элементов.
2. Плавное изменение свойств химических элементов в пределах одного периода можно объяснить постепенным увеличением числа электронов на внешнем энергетическом уровне.
3. Причина сходства свойств химических элементов, принадлежащих к одному семейству, заключается в одинаковом строении внешних энергетических уровней их атомов.
Квантовые числа электронов
Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел: главного (n), орбитального (l), магнитного (m) и спинового (s). Первые три характеризуют движение электрона в пространстве, а четвертое - вокруг собственной оси.
Главное квантовое число (n). Определяет энергетический уровень электрона, удаленность уровня от ядра, размер электронного облака. Принимает целые значения (n = 1, 2, 3 ...) и соответствует номеру периода. Из периодической системы для любого элемента по номеру периода можно определить число энергетических уровней атома и какой энергетический уровень является внешним.
Пример.
Элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны раcпределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Орбитальное квантовое число (l) характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. Набор орбиталей с одинаковыми значениями n называется энергетическим уровнем, c одинаковыми n и l - подуровнем. Для
l=0 s- подуровень, s- орбиталь – орбиталь сфера
l=1 p- подуровень, p- орбиталь – орбиталь гантель
l=2 d- подуровень, d- орбиталь – орбиталь сложной формы
f-подуровень, f-орбиталь – орбиталь еще более сложной формы
s-облако p- облака

d-облака

На первом энергетическом уровне (n = 1) орбитальное квантовое число l принимает единственное значение l = (n - 1) = 0. Форма обитали - сферическая; на первом энергетическом только один подуровень - 1s. Для второго энергетического уровня (n = 2) орбитальное квантовое число может принимать два значения: l = 0, s- орбиталь - сфера большего размера, чем на первом энергетическом уровне; l = 1, p- орбиталь - гантель. Таким образом, на втором энергетическом уровне имеются два подуровня - 2s и 2p. Для третьего энергетического уровня (n = 3) орбитальное квантовое число l принимает три значения: l = 0, s- орбиталь - сфера большего размера, чем на втором энергетическом уровне; l = 1, p- орбиталь - гантель большего размера, чем на втором энергетическом уровне; l = 2, d- орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня - 3s, 3p и 3d.
