«Военно-медицинская академия им. С. М. Кирова»
| Вид материала | Автореферат |
- «Военно-медицинская академия им. С. М. Кирова», 377.83kb.
- «Военно-медицинская академия им. С. М. Кирова», 327.67kb.
- «Военно-медицинская академия имени С. М. Кирова», 465.69kb.
- «Военно-медицинская академия имени С. М. Кирова», 449.26kb.
- Кувакин Владимир Иванович Заслуженный деятель науки РФ доктор медицинских наук профессор, 361.78kb.
- С психосоматической патологией, 371.97kb.
- Осложненных фибрилляцией предсердий, 434.13kb.
- Информационное письмо, 39.43kb.
- «Военно-медицинская академия им. С. М. Кирова», 279.28kb.
- «Военно-медицинская академия им. С. М. Кирова», 417.13kb.
МРТ молочных желез выполняли на аппарате Magnetom Symphony с напряженностью магнитного поля 1,5 Тесла, используя специальную поверхностную катушку Breast Coil. Для первичной оценки структуры молочных желез выполняли Т2 ВИ без и с использованием подавления сигнала от жировой ткани (FS); затем выполняли одну преконтрастную серию Т1ВИ 3D FLASH FS в аксиальной плоскости с толщиной среза 1,2 мм. Далее с помощью автоматического инъектора внутривенно болюсно вводили контрастное вещество из расчета 0,1 ммоль/кг и после 10–20 секундной задержки выполняли 5 постконтрастных серий с теми же техническими параметрами. Затем проводили Т1ВИ 3D FS последовательность в сагиттальной плоскости с толщиной среза 0,5–0,8 мм, обладающей высокой разрешающей способностью. Для контрастного усиления использовали парамагнитные контрастные средства 0,5 и 1 ммоль/мл. Общее время МРТ с ДКУ молочных желез в среднем составляло 20–26 минут.
В завершение исследования проводили постпроцессорную обработку: цифровую субтракцию (вычитание из постконтрастных изображений преконтрастных); оценивали степень накопления контрастного вещества патологическим образованием; производили построение MIP-реконструкций для визуализации сосудистой сети опухоли. Затем проводили анализ динамики захвата и выведения контрастного вещества тканью молочной железы и построение кривых, отображающих этот процесс. Для этого из нескольких серий, полученных в результате динамического сканирования, выбирали срез (уровень), на котором более четко определялся патологический участок. Затем с использованием специализированных программ Mean Curve, анализировали изменение МР-сигнала в выбранных областях во всех сериях динамического сканирования. Данные анализа представляли либо в табличном виде, либо в виде кривых «интенсивность сигнала – время», в которых за точку отсчета принимали интенсивность сигнала от зоны интереса до контрастного усиления. Для стандартизации показателей динамики накопления контрастного вещества использовали классификацию Kuhl C.K et al. (2003), в которой все виды кривых были разделены на три типа по характеру хода в раннюю, среднюю и позднюю фазы ДКУ: I тип – кривая постоянного роста, II тип – кривая с быстрым увеличением с формированием плато, III тип – кривая с выраженным максимумом и быстрым снижением амплитуды МР-сигнала в первые минуты. Таким образом, основными параметрами, оцениваемыми при ДКУ, были: время максимального пика, уровень повышения интенсивности сигнала, выраженный в процентах, и тип графической зависимости. По характеру накопления и выведения контрастного вещества представлялось возможным судить о предположительной природе образования.
В дальнейшем результаты динамического исследования обсчитывали в специальном пакете программ Breast Perfusion. Методика перфузионной МРТ представляет собой математический обсчет изображений, полученных при первом прохождении болюса контрастного вещества с последующим цветовым картированием полученных данных. Анализ динамических кривых по картам распределения контрастного вещества позволяет получать оценку скорости и количества притока (Wash in) и его вымывания (Wash out) контрастного вещества, а также расчет времени до пика контрастного усиления ткани молочных желез – TTP (Time To Peak), построение реконструкции максимальной интенсивности изображений за все время динамического сканирования – MIP time и перфузии опухоли – PEI (Positive Enhancement Integral), рассчитываемый как интеграл положительного накопления, или площадь под графической кривой прохождения контрастного болюса. Мы использовали цветовое картирование по красно-желто-сине-черной шкале, в которых минимальные изменения окрашивались синим цветом, а максимальные – красным, или их оттенками; для построения изображений оттока и времени пика контрастного вещества использовались инвертированные данные. Перфузионно-взвешенные изображения (PEI) являются наиболее чувствительными в оценке васкуляризации образований.
Таким образом, применение разработанной методики на высокопольном МР-томографе с проведением постпроцессорной обработки и построением перфузионных карт позволяет оценивать структуру желез, выявлять и проводить дифференциальную диагностику на этом фоне образований молочных желез.
Статистическую обработку результатов исследования проводили с использованием процедур и методов статистического анализа (определение числовых характеристик переменных; оценка соответствия эмпирического закона распределения количественных переменных теоретическому закону нормального распределения по критерию Колмогорова-Смирнова; оценка значимости различий средних значений количественных показателей в независимых выборках по t-тесту Стьюдента). Проверку гипотезы о происхождении групп, сформированных по качественному признаку из одной и той же популяции, проводили на основе построения таблиц сопряженности наблюдаемых и ожидаемых частот с применением критерия Хи-квадрата Пирсона (Pearson Chi-square), при его неустойчивости использовали двусторонний точный тест Фишера (Fisher exact test); логистический регрессионный анализ.
Результаты МР-исследования возрастных вариантов развития и
особенностей строения молочных желез
Контрольную группу составили 72 женщины, средний возраст – 48,0±11,2 года. Все женщины были распределены на 4 возрастные подгруппы – до 30 лет, от 31 до 40, от 41 до 50 и старше 50 лет. Нами был проведен эксперимент по выбору наиболее оптимального способа расчета объемов молочной железы и железистой ткани для определения типа строения железы в зависимости от размеров железы и ее соотношения с чашей катушки для исследования. Для определения типа внутреннего строения молочных желез использовали классификацию, предложенную в 1989 г. Wolfe G. et al., которая основана на соотношении железистой и жировой тканей: I тип – это тотальное замещение ткани железы жировой тканью; II тип – до 25–50% объема железы представлено железистой тканью; III тип – до 50–75% объема железы представлено железистой тканью; IV тип – жировая ткань практически отсутствует, железистая ткань хорошо выражена, занимает более 75% объема железы.
Было доказано, что при правильной форме для расчета объема молочной железы можно использовать формулу цилиндра или усеченного конуса (в зависимости от размера желез и её соотношений с чашей катушки). При патологических состояниях, приводящих к изменению и деформации формы железы, необходимо проводить измерения дважды – у основания и посередине с суммированием полученных данных. Для оценки симметричности внутреннего строения мы определяли модуль разницы в процентах между объемами железистой ткани и всей железы. Для расчета объема железистой ткани также использовали формулу усеченного конуса с вычитанием толщины пре- и ретромаммарной клетчатки. У женщин контрольной группы асимметрия размеров молочных желез более 15% была выявлена у 17 женщин (23,6%) и отмечалась во всех подгруппах, что является индивидуальной особенностью и не зависит от возраста женщин (р=0,655). Асимметрия внутреннего строения у женщин контрольной группы, рассчитанная по модулю разницы объемов правой и левой молочных желез, была выявлена у 26 женщин (37,1%), средние его значения составили 13,0±11,6%. Распределение женщин контрольной группы по типам внутреннего строения молочных желез в различных возрастных подгруппах показало, что наиболее вариабельное строение молочных желез имело место у женщин в возрасте от 30 до 50 лет, в этих возрастных подгруппах встречались все типы строения. Эта закономерность более отчетливо прослеживалась при сравнении женщин до 30 и старше 50 лет, это объясняется физиологическими процессами жировой инволюции и было статистически достоверно (p<0,001). Различия значений размеров железы у женщин в других возрастных подгруппах не были значимыми (p>0,05).
При анализе данных динамического контрастирования у женщин контрольной группы было отмечено, что ткань молочной железы незначительно и равномерно накапливает контрастное вещество в течение всего времени исследования. У большинства женщин контрольной группы (86,1%) средние значения накопления контрастного вещества железистой тканью не превышали 100% и имели первый тип графической зависимости. Второй тип накопления встречался значительно реже – у 13,9% женщин. Третий тип графической зависимости накопления контрастного вещества при ДКУ у женщин контрольной группы выявлен не был. Измеряемое повышение интенсивности сигнала на Т1 ВИ от ткани железы составило от 5 до 141%, а среднее повышение интенсивности сигнала – 59,54±29,99%. При анализе параметров ДКУ у женщин контрольной группы было выявлено следующее: с возрастом происходит уменьшение уровня накопления контрастного вещества в среднем с 77,6±22,2% у женщин младше 30 лет до 47,6±26,0% в старшей возрастной подгруппе. В возрастных подгруппах достоверных статистических различий в степени накопления контрастного вещества выявлено не было. При оценке достоверности различий средних значений значимым было только различие у женщин младшей и старшей возрастных подгрупп (F=25,69, df=3, p<0,0001), что объясняется снижением степени пролиферации ткани железы именно в этих возрастных пределах за счет ее уплотнения и фиброза, что связано с физиологическим уменьшением уровня гормонального фона.
Неравномерное очаговое накопление контрастного вещества железистой тканью нами определено у молодых женщин (до 30 лет), особенно при проведении исследования во вторую фазу менструального цикла. Эти изменения необходимо учитывать при проведении исследования, так как они могут приводить к диагностическим ошибкам как в сторону гипердиагностики вследствие неспецифического повышения сигнала при контрастировании, так и гиподиагностики, поскольку могут сочетаться и «маскировать» злокачественную опухоль небольших размеров. На основании этого МРТ с ДКУ молодым женщинам репродуктивного возраста необходимо проводить в период минимального гормонального воздействия – в первую фазу менструального цикла и строго по показаниям.
Таким образом, комплексное МР-исследование является информативным методом определения типов строении железы, оценки размеров и внутренней архитектоники, а также диагностики вариантов и аномалий развития молочных желез. Знание возрастных особенностей строения, критериев накопления контрастного вещества железистой тканью при ДКУ и особенностей МР-перфузии молочных желез позволяет более эффективно проводить дифференциальную диагностику узловых образований на этом фоне.
Результаты комплексного МР-исследования женщин с диффузными изменениями структуры молочных желез
Всего обследованы 175 женщин с диффузными изменениями внутренней структуры молочных желез, средний возраст составил 44,5±9,5 года, большинство женщин были в возрасте от 41 до 60 лет (61,1%). Это объясняется тем, что именно в этом возрасте происходят более выраженные изменения, связанные с перестройкой гормонального фона женщин. Доля женщин других возрастных групп значительно меньше (р<0,001). У женщин данной группы, в отличие от контрольной, имелись различные жалобы – болевые ощущения различной степени отмечали 59,4%, локальные уплотнения в молочных железах, выявляемые при самостоятельной пальпации – 57,7% женщин. При объективном обследовании у 76,6% женщин при пальпации структура железы не соответствовала фазе менструального цикла или возрасту, то есть отмечались клинические признаки дисгормональных изменений структуры желез. Патологические изменения в органах малого таза и в щитовидной железе были выявлены у 49,1% женщин с диффузными изменениями по сравнению с 12,5% у женщин контрольной группы, что статистически является достоверным, р<0,001.
Все пациентки с диффузными изменениями внутренней структуры в зависимости от преобладающего компонента были разделены на 4 вида ФАМ: железистый (39), фиброзный (44), кистозный (41) и смешанный (51). Большая часть женщин имели среднюю степень выраженности проявлений диффузных изменений – 47,43% и характеризовалась II-III типом внутреннего строения. У 90% женщин с диффузными изменениями размеры молочных желез были симметричными, и 85,3% симметричным было и внутреннее строении, что отличало эту группу от женщин других групп и является статистически достоверным, р<0,001.
При проведении МРТ с ДКУ у 125 женщин (71,4%) было выявлено диффузное накопление тканью железы, у остальных накопления было минимальным или отсутствовало. При построении MIP-реконструкций сосудистая сеть при всех видах диффузных изменений внутренней структуры молочных желез была не изменена. У 48,6% женщин с диффузными изменениями внутренней структуры определена средняя интенсивность сигнала, не превышающая 100%, у большинства пациентов выявляли I тип графической зависимости накопления контрастного вещества (84,6%). Накопление контрастного вещества железистой тканью более 100% от первоначального уровня выявлено лишь у женщин со смешанным вариантом ФАМ (13,7%) и у женщин с преобладанием железистого компонента (23,1%), что необходимо принимать во внимание в процессе дифференциальной диагностики.
Главной особенностью диффузных изменений внутренней структуры ткани молочной железы явилось наличие пролиферативных изменений в норме у женщин различных возрастных подгрупп, на фоне которых необходимо выявлять и проводить дифференциальную диагностику узловых образований. Нами были построены усредненные графические кривые для различных видов фиброаденоматоза по средним значениям изменения интенсивности сигнала и по характеру накопления контрастного вещества при ДКУ от ткани молочных желез (рис .1). При построении перфузионных карт у женщин с диффузными изменениями особенностей васкуляризации железистой ткани выявлено не было.
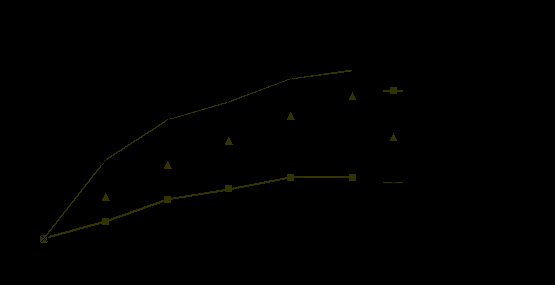
Рис. 1. Диаграмма графической зависимости изменений интенсивности сигнала при проведении ДКУ для различных вариантах ФАМ
Таким образом, кинетика контрастирования при различных видах ФАМ различна и зависит от выраженности пролиферативных изменений в железистой ткани. Максимальных значений она достигает при железистом варианте, минимальных – при фиброзном. При смешанном и кистозном вариантах – диапазон изменения интенсивности сигнала средний, но для значительного большинства различных видов диффузных изменений внутренней структуры молочных железе характерен I тип накопления контрастного вещества.
Результаты комплексного МР-исследования женщин с узловыми образованиями молочных желез доброкачественной природы
Обследованы 162 женщины с доброкачественными узловыми образованиями, природа которых была подтверждена при морфологическом обследовании. Чаще (45,7%) образования встречались у женщин в возрасте до 40 лет. Доля женщин других возрастных групп была значительно меньше (р<0,001). Патологические изменения в органах малого таза и в щитовидной железе были выявлены у 40,1% женщин с доброкачественными образованиями по сравнению с 12,5% у женщин контрольной группы, что статистически является достоверным, р<0,001.
При анализе размеров – симметричными молочные железы были у 132 пациенток (81,5%); а при анализе симметричности внутреннего строения у 130 женщин (80,2%). У превалирующего количества женщин данной исследуемой группы имелись признаки различных вариантов ФАМ (72,3%), на фоне которых выявлялись образования. Чаще были выявлены признаки железистого варианта фиброаденоматоза (40,9%), реже – смешанного варианта (35,8%), еще более редко и приблизительно одинакового количества – кистозного (12,1%) и фиброзного вариантов (11,2%).
По нашим данным, у женщин с доброкачественными образованиями и диффузными изменениями объем железистой ткани достоверно больше, чем в контрольной группе у женщин соответствующих возрастных групп (p<0,05), что соответствовало II и III типам внутреннего строения. Признаки узловых образований молочных желез при рентгеновской маммографии выявлены у 118 человек (72,8%) и при УЗИ – у 132 (81,5%).
Результаты комплексного МР-исследования в диагностике кист
Всего обследованы 47 женщин с наличием в молочных железах крупных кист (более 1 см). Размеры кист варьировали в широких пределах и достигали у четырех женщин 5–6 см, средний размер кист составил 3,2±1,1 см. У 70,2% женщин кисты располагались в верхне-наружном квадранте, у 17,0% больных были множественными и у 36,2% – двусторонними. Кисты сочетались с другими узловыми доброкачественными образованиями молочной железы и проявлениями диффузного фиброаденоматоза у 55,3% и 76,6% женщин, соответственно.
В зависимости от сигнальных характеристик внутреннего содержимого кисты были разделены на простые – 34 женщины (72,3%) и сложные – 13 человек (27,7%).
Для простых кист характерна следующая МР-семиотика: овальная или округлая форма; четкие, ровные контуры; равномерная толщина стенки, не более 1–2 мм. Типичными признаками простых кист являлась однородная внутренняя структура с жидкостными сигнальными характеристиками. Наиболее информативными для выявления кист являлись Т2 ВИ, особенно с использованием жироподавления, и TIRM за счет высокой контрастности жидкостного содержимого на фоне пониженного сигнала от жировой ткани. При проведении МРТ с ДКУ простые кисты на Т1 ВИ до и после введения контрастного препарата не изменяли свою структуру и не накапливали контрастное вещество. При построении перфузионных карт простые кисты не визуализировались на цветовых картах притока и времени транспорта контрастного вещества (TTP) по сравнению с окружающей тканью железы. На перфузионных картах оттока, MIPt и PEI четко визуализируются границы кист на фоне незначительно повышающей интенсивность сигнала от ткани молочной железы.
Сложные кисты выявлены у 27,7% женщин. МР-признаком сложных кист является неоднородное внутреннее содержимое (92,3%) с неравномерно повышенным сигналом на Т1-преконтрастных изображениях (69,2%). Усиление стенок без очагового их утолщения являлось признаком воспаления или пролиферативных изменений окружающей ткани железы. При проведении ДКУ сложные кисты у 76,9% женщин накапливали контрастное вещество стенкой или вокруг нее, что более отчетливо визуализировалось при построении перфузионных карт MIPt и PEI.
После пункции кисты у 6 обследуемых был выявлен уровень неоднородного содержимого за счет разделения сред между жидкостным и геморрагическим содержимым, у двух женщин кисты с воспалением характеризовались наличием разделения сред между жидкостным и белковым (гнойным) содержимым. У трех женщин были выявлены образования молочных желез воспалительной природы, которые характеризовались наличием полостного образования с нечетким контуром, неоднородным содержимым и неравномерно утолщенной капсулой с зоной отека ткани железы. При ДКУ утолщенная капсула кольцевидно накапливала контрастное вещество, что требовало проведение дифференциальной диагностики.
Таким образом, для кист типична следующая МР-семиотика: для простых – однородная внутренняя структура с жидкостными характеристиками сигнала, отсутствие накопления контрастного вещества при ДКУ; для сложных – неоднородное внутреннее содержимое с неравномерно повышенным сигналом на Т1 ВИ, накопление контрастного вещества стенками кисты и окружающей ее паренхимой железы.
Результаты комплексного МР-исследования женщин
с узловыми доброкачественными образованиями
Всего обследовано 115 женщин с узловыми образованиями доброкачественной природы, подтвержденными морфологически. Доброкачественные узловые образования молочной железы чаще были единичными, у 27,8% женщин выявлено несколько образований. Важным критерием для дифференциальной диагностики была ориентация образования. У 70,4% женщин с доброкачественными образованиями поперечный размер образования превышал передне-задний (р<0,001), у 23,5% женщин образования имели округлую форму, реже определить ориентацию образования не представлялось возможным из-за его неправильной формы. Контуры образований в большинстве случаев были ровные и четкие (76,5%), реже они были нечеткие – 11,7% (при локализованной форме фиброаденоматоза), p>0,05. Внутренняя структура образований у 73,0% больных была однородной. Неоднородность структуры образований (27,0%) обусловлена наличием участков пониженного МР-сигнала за счет фиброза и обызвествлений (более отчетливо определяемых на маммограмах). По интенсивности МР-сигнала структура образований до контрастного усиления на Т1ВИ была изоинтенсивной (71,3%), реже гипоинтенсивной – (24,3%); у отдельных пациенток – гиперинтенсивной в 4,3% случаев (липомы, кистозные формы фиброаденом). У пациенток с гамартомой и листовидной фиброаденомой образования имели гетерогенную структуру и состояли, как из участков изоинтенсивного, так и гиперинтенсивного МР-сигнала, что являлось характерным для них МР-признаком.
При ДКУ у большинства женщин (61,7%) данной исследуемой группы накопление контрастного вещества патологическими образованиями отсутствовало или было минимальным. Отсутствие накопления было отмечено у 18 женщин с фиброзными аденомами, не накапливали контрастное вещество и липомы. У трети женщин было выявлено гетерогенное накопление образованием контрастного вещества, у остальных – гомогенное. Асимметричное усиление сосудистой сети вокруг образования было выявлено у 10 больных (8,7%) и, вероятно, связано с наличием сопутствующих воспалительных изменений.
Таким образом, для доброкачественных образований молочных желез при проведении МРТ до использования постпроцессорной обработки было характерно: неизмененные кожные покровы; отсутствие нарушения структуры окружающих тканей; преимущественно единичный характер поражения; преобладание поперечного размера образования; округлая или овальная форма; четкие, ровные контуры; однородная МР-структура; отсутствие или минимальное гомогенное накопление контрастного вещества.
Окончательное суждение о предполагаемом характере узловых образований выносили с учетом постпроцессорной обработки. Нами установлено, что для большинства пациенток с доброкачественными узловыми образованиями характерны следующие динамические критерии: у 74,1% женщин максимальная интенсивность сигнала приходилась на 5–6 минуты и у 73,0% была меньше 100% по сравнению с преконтрастными изображениями. Значительных отличий параметров ДКУ в центральных и периферических отделах у доброкачественных образований не определялось (р<0,05), но отмечалось первоначальное накопление в центральных отделах с распространением к периферии (центробежный), р<0,001. Данные изменения более отчетливо визуализировались при построении перфузионных карт (притока, TTP, MIPt). Васкуляризация образований определялась при построении PEI. Наиболее специфичными для диагностики доброкачественных образований являлись карты оттока, где было характерно задержка вымывания контрастного вещества в опухоли, по сравнению с неизмененной тканью железы в результате аккумуляции контрастного вещества в межклеточной строме доброкачественных образований. При построении кривых «интенсивность сигнала – время» доброкачественные узловые образования по периферии характеризовались преимущественно I типом – кривая постоянного роста МР-сигнала (80,0%), реже II типом накопления (13,9%), а III тип встречался – в 6,1%, что проиллюстрировано на рис. 2.
Быстрое накопление контрастного вещества (более 100% от преконтрастного) было выявлено у восьми женщин с листовидными фиброаденомами (7,1%) и у 24 пациенток (21,4%) с интраканаликулярными фиброаденомами. У семи из них отмечали быстрое накопление и быстрое вымывание контрастного вещества образованиями, что затрудняло их дифференциальную диагностику. III тип накопления был выявлен именно у этой группы пациенток.
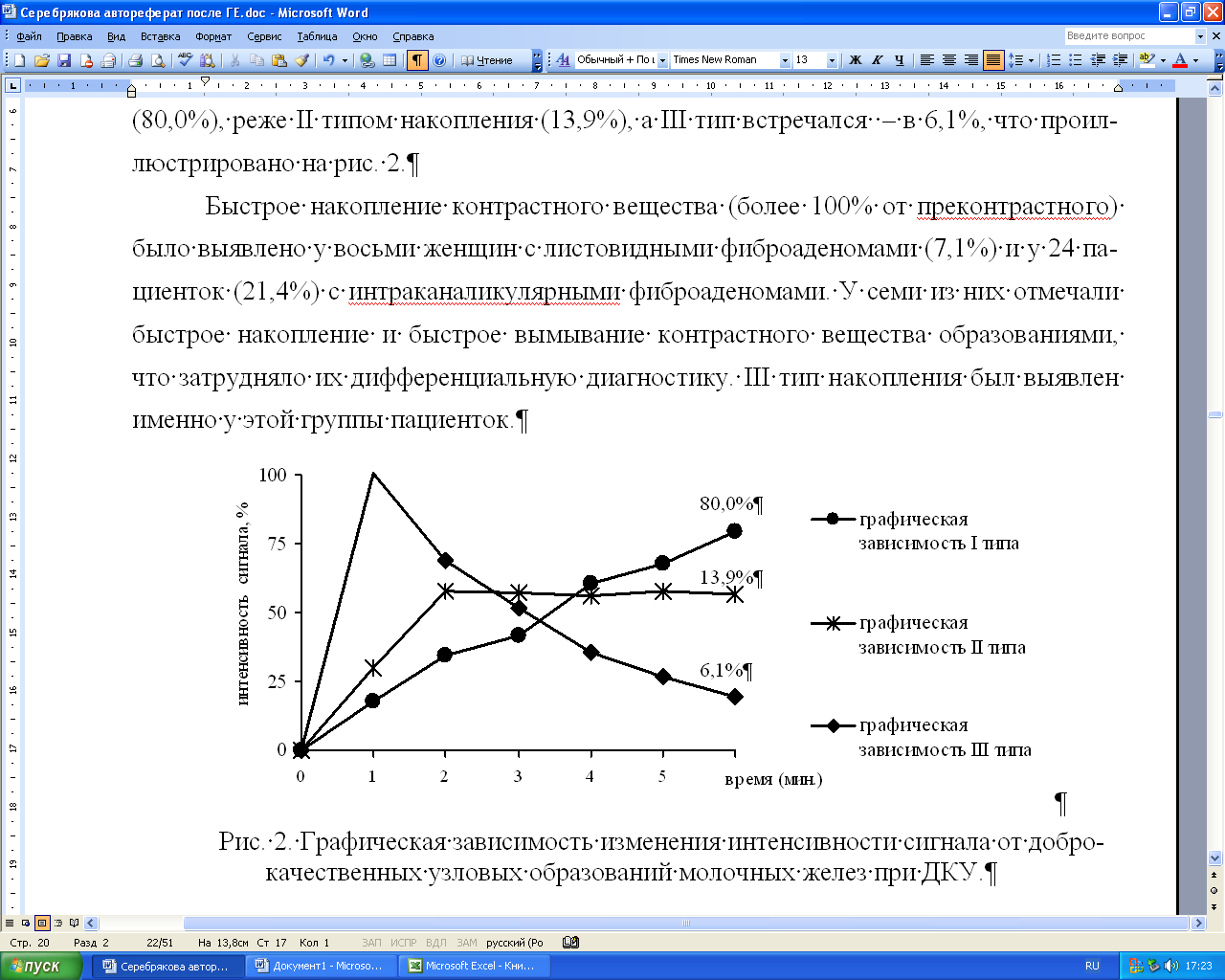
Рис. 2. Графическая зависимость изменения интенсивности сигнала от доброкачественных узловых образований молочных желез при ДКУ.
Изменение сосудистой сети молочной железы на стороне локальных изменений выявлено у 10 женщин. Работы Маряшевой Ю.А. и соавт., (2003); Тернового С.К. и соавт., (2007) указывают на отсутствие лимфоаденопатии аксиллярных лимфатических узлов при доброкачественных узловых образованиях и отмечают их гиперплазию только при воспалении. В нашей работе из всех обследованных пациенток аксиллярные лимфоузлы были выявлены у 39,1% женщин группы, куда вошли все женщины с образованиями воспалительной природы (5,2%); что несколько больше, чем в контрольной группе (23,6%). Остальные обследованные в анамнезе указывали на перенесенные воспалительные заболевания.
Таким образом, для узловых образований доброкачественной природы при МРТ с ДКУ характерно: отсроченное накопление контрастного вещества; низкая и средняя степень интенсивности МР-сигнала; центробежный (первично в центре) характер контрастирования; I тип кривой «интенсивность сигнала – время»; неизмененная сосудистая сеть; отсутствие питающего сосуда.
