«Военно-медицинская академия им. С. М. Кирова»
| Вид материала | Автореферат |
- «Военно-медицинская академия им. С. М. Кирова», 327.67kb.
- «Военно-медицинская академия имени С. М. Кирова», 465.69kb.
- «Военно-медицинская академия имени С. М. Кирова», 449.26kb.
- Кувакин Владимир Иванович Заслуженный деятель науки РФ доктор медицинских наук профессор, 361.78kb.
- С психосоматической патологией, 371.97kb.
- Осложненных фибрилляцией предсердий, 434.13kb.
- Информационное письмо, 39.43kb.
- «Военно-медицинская академия им. С. М. Кирова», 279.28kb.
- «Военно-медицинская академия им. С. М. Кирова», 417.13kb.
- «Военно-медицинская академия имени С. М. Кирова», 476.94kb.
На правах рукописи
ДУБИЦКИЙ
Дмитрий Леонидович
ВОЗМОЖНОСТИ ВЫСОКОПОЛЬНОЙ МАГНИТНО-РЕЗОНАНСНОЙ
ТОМОГРАФИИ В ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ
РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
14.01.13 – лучевая диагностика, лучевая терапия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
САНКТ-ПЕТЕРБУРГ
2011
Работа выполнена в федеральном государственном образовательном учреждении высшего профессионального образования «Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации

Научный руководитель:
доктор медицинских наук МИЩЕНКО Андрей Владимирович
Официальные оппоненты:
доктор медицинских наук профессор ТРОФИМОВА Татьяна Николаевна
доктор медицинских наук профессор СЕМЕНОВ Игорь Иванович
Ведущее учреждение: государственное образовательное учреждение высшего профессионального образования «Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова Федерального агентства по здравоохранению и социальному развитию»
Защита состоится «20» мая 2011 г. в ______ на заседании совета по защите докторских и кандидатских диссертаций Д 215.002.11 в федеральном государственном образовательном учреждении высшего профессионального образования «Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации (194044, Санкт-Петербург, ул. Академика Лебедева, 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке федерального государственного образовательного учреждения высшего профессионального образования «Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации
Автореферат разослан «___» ___________ 2011 г.
Ученый секретарь совета
доктор медицинских наук профессор
ГОЛОВКО Александр Иванович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В настоящее время заболеваемость раком предстательной железы в мире остается стабильно высокой. Смертность от рака простаты в течение последних 25 лет увеличилась на 16% (Кушлинский Н.Е., 2002; Касчиато Д., 2008; Лопаткин Н.А., 2009; Parkin D.M. et al., 2005; Ramon J., Denis L. J., 2007; Kamidono S. et al., 2008; Jemal A. et al., 2009).
Диагностика заболеваний предстательной железы представляет значительные трудности в связи с многообразием нозологических форм, клиническая симптоматика которых зачастую сходна и неспецифична, а тактика их лечения кардинально различается (Зубарев А.В., 2001; Лопаткин Н.А., 2009; Wein A.J. et al., 2007).
В последние годы все шире стали применяться органосберегающие и малоинвазивные методы лечения заболеваний предстательной железы (Петров С.Б., 2004; Wein A.J. et al., 2007; De Reijke T.M., 2008). Целесообразность, объем и эффективность лечебных мероприятий определяются, прежде всего, стадией опухолевого заболевания. Основным критерием в стадировании злокачественных опухолей является дифференциация внутри- и внекапсульного характера роста (Портной Л.М., 2003; Петров С.Б., Харченко П.В., 2005; Матвеев В. Б., 2009; De la Rosette J.J., Gill I.S., 2005; Kamidono S. et al., 2008).
Лучевая диагностика заболеваний предстательной железы шагнула вперед благодаря внедрению в клиническую практику таких методов визуализации как УЗИ, КТ и МРТ. Указанные методы исследования имеют высокие диагностические возможности в определении местнораспространенных форм рака предстательной железы. В тоже время существуют проблемы дифференциальной диагностики форм аденокарциномы, ограниченных исходным органом, а также минимального распространения опухоли за капсулу органа.
Магнитно-резонансная томография все шире входит в практику как объективный, высокоэффективный метод исследования. Этот метод диагностики продолжает развиваться и совершенствоваться (Неронов Ю.И., 2003; Ринк П.А., 2003; Харченко В.П. с соавт., 2006).
Внедрение в клиническую практику МР-томографов с высокой напряженностью магнитного поля, применение сверхбыстрых последовательностей, поверхностных катушек для тела и эндоректальной катушки, совершенствование программного обеспечения позволили сократить время исследования и улучшить качество получаемых изображений (Терновой С.К., Синицын В.Е., 2005; Hricak H. et al., 2007).
В отечественной и зарубежной литературе имеются публикации по применению высокопольной МРТ в диагностике рака предстательной железы (Григорьев Н.А., 2003; Мазаев А.А., 2004; Kim C.K. et al., 2007; Mazaheri Y. et al., 2008). Однако, до настоящего времени не изучены вопросы дифференциальной диагностики рака предстательной железы. Немногочисленны работы, посвященные лучевой диагностике рака на фоне сопутствующих фиброзно-воспалительных и атрофических изменений ткани предстательной железы, а также исследования, изучающие зависимость визуализации аденокарциномы от её гистологического подтипа (Китаев С. В., 2009; Петров С.Б. с соавт., 2009).
В отечественной литературе отсутствуют сведения о применении МРТ с получением ДВИ для дифференциальной диагностики рака предстательной железы. Не стандартизирована методика исследования и не разработаны оптимальные алгоритмы МРТ с применением различных методик исследования для дифференциальной диагностики рака. Не уточнена МР-семиотика рака предстательной железы в зависимости от характера роста и стадии процесса, а также дифференциально диагностические МР-критерии отличия от других заболеваний.
Все вышеизложенное доказывает актуальность данной проблемы и предопределяет цель исследования.
Целью работы являлось совершенствование дифференциальной диагностики злокачественных новообразований предстательной железы с неопухолевыми заболеваниями на основе применения высокопольной магнитно-резонансной томографии.
Для достижения указанной цели были определены следующие задачи:
- Усовершенствовать методику высокопольной (1,5 Тл) МРТ таза с использованием эндоректальной катушки у мужчин с подозрением на рак предстательной железы.
- Определить дифференциально-диагностические МРТ-критерии злокачественных новообразований в зависимости от гистологического строения, локализации, характера роста и стадии процесса и неопухолевых изменений предстательной железы.
- Оценить эффективность высокопольной МРТ в дифференциальной диагностике внутри- и экстрапростатических опухолевых и неопухолевых изменений предстательной железы.
- Провести сравнительный анализ информативности различных методик МРТ (традиционные импульсные последовательности, динамическое контрастное усиление, ДВИ, МР-спектроскопия по водороду) в дифференциальной диагностике злокачественных новообразований предстательной железы.
- Разработать алгоритм применения методик МРТ в дифференциальной диагностике рака предстательной железы.
Научная новизна
Данная работа является обобщающим научным трудом, посвященным изучению возможностей различных методик высокопольной МРТ в дифференциальной диагностике рака предстательной железы.
Впервые разработана многоуровневая дифференциальная диагностика рака предстательной железы: I уровень гистологической пролиферации опухоли, II уровень интрапростатических изменений, III уровень экстрапростатических изменений.
Усовершенствована методика высокопольной МРТ таза при подозрении на рак предстательной железы. В эксперименте определена зависимость интенсивности МР-сигнала от расстояния до эндоректальной катушки. Впервые предложен сравнительный способ анализа интенсивности МР-сигнала от структур таза на Т2-ВИ. Определены приоритетность и целесообразность применения различных методик МРТ в дифференциальной диагностике рака предстательной железы. Уточнены показания к проведению МРТ предстательной железы с динамическим контрастным усилением. Определены особенности изменения интенсивности МР-сигнала на изображениях при выполнении МРТ на основе ДВИ с применением эндоректальной катушки и туловищных катушек.
Впервые выявлены статистически значимые дифференциально-диагностические МР-признаки рака предстательной железы, и оценена эффективность методик МРТ в дифференциальной диагностике рака предстательной железы в зависимости от гистологического строения опухоли, локализации, характера роста и стадии процесса.
Систематизированы МР-признаки рака предстательной железы в соответствиями со стадиями заболевания. Определены МР-признаки рака предстательной железы с использованием ДВИ. При дифференциальной диагностике рака предстательной железы установлена высокая значимость получения диффузионно-взвешенных изображений, полученных с применением градиентных факторов более 1000 с/мм2. Установлено, что анализ ИКД в отрыве от измерения интенсивности МР-сигнала на ДВИ (1000-1400 с/мм2) приводит к ложноположительным результатам наличия рака.
Впервые составлен развернутый алгоритм применения импульсных последовательностей и методик высокопольной МРТ для дифференциальной диагностики рака предстательной железы.
Практическая значимость
Результаты работы позволяют выделить отдельные МР-признаки при различных заболеваниях предстательной железы и дать оценку вероятности выявления злокачественного новообразования.
Предложенный способ анализа интенсивности МР-сигнала при эндоректальной МРТ позволяет сравнивать параметры визуализации структур тканей области таза, минимизируя влияние неконтролируемых факторов при МР-исследовании.
Показано, что использование ДВИ с градиентными факторами более 1000 с/мм2, позволяет повысить диагностическую точность и сократить алгоритм МР-исследования пациента. Установлено, что признак выраженного снижения ИКД на суммационнной карте ДВИ не является достаточным для диагностики злокачественного новообразования.
Выявлены наиболее информативные диагностические критерии для дифференциальной диагностики рака предстательной железы, определена их статистическая значимость. Разработаны критерии рака центральной области предстательной железы (в т.ч. без распространения за капсулу).
Впервые определены МР-критерии дифференциальной диагностики аденокарциномы в зависимости от гистологического строения (высоко- и низкодифференцированные формы), что позволяет корректировать тактику лечения и определять прогноз заболевания.
Сформулированы практические рекомендации применения МРТ с различными импульсными последовательностями, динамическим контрастным усилением, получением ДВИ, а также МР-спекроскопии.
Предложен алгоритм дифференциальной диагностики рака предстательной железы на основе применения МРТ с динамическим контрастным усилением, с получением ДВИ и МР-спектроскопией.
Результаты работы могут быть использованы в клинической работе для выбора оптимальной тактики лечения и контроля проводимой терапии.
Основные положения, выносимые на защиту
- Высокопольная МРТ является высокоинформативным методом лучевой диагностики, позволяющим эффективно проводить дифференциальную диагностику рака предстательной железы, осуществлять стадирование опухолевого процесса.
- МР-семиотика рака предстательной железы зависит от особенностей гистологического строения опухолевой ткани. Умеренно- и низкодифференцированные (с суммой Gleason 6-9) аденокарциномы предстательной железы имеют характерные признаки: наличие повышенного МР-сигнала на ДВИ (>1000 с/мм2), пиковый тип кривой динамического контрастирования, повышение отношения суммы холина с креатином к цитрату до 1,6 [1,0; 2,5], наличие внутрипростатической зональной и экстрапростатической инвазии. При высокодифференцированных аденокарцинах (с суммой Gleason 3-5) отмечается повышение соотношения суммы холина с креатином к цитрату в пределах 0,85 [0,63; 1,4], но не характерно наличие повышенного МР-сигнала на ДВИ (>1000 с/мм2) и пикового характера динамического контрастного усиления.
- Диагностический алгоритм на основе МРТ (традиционные импульсные последовательности, ДВИ, динамическое контрастное усиление, МР-спектроскопия) позволяет проводить дифференциальную диагностику рака предстательной железы.
Реализация результатов работы
Научные положения и выводы работы используются в лечебной работе клиники урологии, внедрены в учебный и диагностический процесс на кафедре рентгенологии и радиологии Военно-медицинской академии им. С.М. Кирова.
Апробация работы
Основные результаты исследования доложены и обсуждены на: заседаниях Санкт-Петербургского радиологического общества (2007, 2008, 2010), отечественных конференциях и симпозиумах: Невском радиологическом форуме (СПб, 2007, 2009); научно-практической конференции «Лучевые методы диагностики патологии тазовых органов» (СПб, 2007); итоговой конференции военно-научного общества слушателей и ординаторов I факультета Военно-медицинской академии (СПб, 2008); конференции «Актуальные вопросы онкоурологии» (М., 2008); научной конференции «От лучей рентгена – к инновациям XXI века: 90 лет со дня основания первого в мире рентгенорадиологического института (Российского научного центра радиологии и хирургических технологий)» (СПб, 2008); конференции «Инструментальные методы диагностики» (СПб, 2009).
По материалам диссертации опубликована 21 работа, из них 2 – в журналах, рекомендованных ВАК Министерства образования и науки РФ; издана 1 глава в руководстве для врачей. Внедрено 3 рационализаторских предложения.
Личный вклад автора в выполнение работы
Автором лично проведено комплексное МР-исследование 274 пациентов. Детальному анализу были подвергнуты результаты МРТ с использованием традиционных импульсных последовательностей, с получением ДВИ, с ДКУ и МР-спектроскопии.
Автором лично проведен эксперимент на фантомах для определения изменения интенсивности МР-сигнала при МРТ с использованием эндоректальной катушки, разработана методика сравнительного анализа интенсивности МР-сигнала на Т2-ВИ от структур таза.
По теме диссертации автору принадлежит формулирование общей цели и задач работы, а также анализ полученных данных. Все результаты МР-исследования, использованные в диссертационной работе, получены и обработаны лично автором.
Объем и структура диссертации
Диссертация представлена в одном томе, состоит из введения, 5 глав, заключения и обсуждения результатов, выводов, практических рекомендаций, списка используемой литературы (79 отечественных и 96 зарубежных авторов). Диссертация изложена на 194 листах машинописного текста, содержит 56 рисунков и 40 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Общая характеристика клинического материала и методы исследования
Работа основана на анализе результатов комплексного клинико-лучевого и морфологического обследования 274 мужчин, проходивших обследование и лечение в клинике урологии, на кафедре рентгенологии и радиологии, при центральной клинико-диагностической поликлинике Военно-медицинской академии в 2007 – 2010 годах. МРТ перед пункционной биопсией выполнили 112 мужчинам.
По результатам клинико-лабораторного, лучевого, инструментального и морфологического исследований все пациенты были разделены на следующие группы: группа 1 – больные с опухолями тазовой области (n=94); группа 2 – пациенты с неопухолевыми заболеваниями предстательной железы (n=18). В группе 1 выделены подгруппы: подгруппа 1а – больные с высокодифференцированной аденокарциномой предстательной железы (n=27); подгруппа 1б – больные с низкодифференцированной аденокарциномой предстательной железы (n=60); подгруппа 1в – больные с неэпителиальными новообразованиями предстательной железы (n=2); подгруппа 1г – больные с опухолями мочевого пузыря области шейки (n=5).
Верификацию диагноза проводили по данным гистологического исследования пункционного и операционного материала. Пункционная биопсия предстательной железы выполнена всем больным (n=112). При этом гистологическое заключение содержало данные о степени дифференцировки (сумма Gleason), протяженности (в препарате) и расположении (верхушка, средняя треть, основание; справа, слева и т.д.) опухоли.
Хирургическому лечению было подвергнуто 47,3% мужчин.
В связи с частым сочетанием опухолевого поражения и неопухолевых изменений наряду с обследованием самих пациентов в некоторых случаях анализировали магнитно-резонансные характеристики отдельных участков простаты с гистологически верифицированным заключением. Всего с применением различных методик МРТ исследовано 343 участка предстательной железы, среди них: аденокарцинома – 29,7%, доброкачественная гиперплазия – 20,7%, хроническое воспаление – 14,0%, неизмененная периферическая зона – 30,3%.
Всем пациентам было проведено клиническое обследование, пальцевое ректальное исследование предстательной железы и определение уровня ПСА в крови. Ультразвуковое исследование преимущественно выполнялось трансректальным датчиком (75,9%). Нативное МР-сканирование с поверхностной катушкой для тела проведено у 12,5% пациентов, у остальных больных – с эндоректальной катушкой. Методики ДВИ, МР-спектроскопии и МРТ с ДКУ использованы у 78,6% пациентов. Остеосцинтиграфия скелета проведена 79 пациентам (70,5%) с подозрением на метастатическое поражение костей. Компьютерная томография выполнена 13 (11,6%) пациентам с целью поиска отдаленных метастазов в легкие, печень или лимфатические узлы.
Для оценки эффективности эндоректальной МРТ в диагностике заболеваний предстательной железы проведены эксперименты на фантомах, в которых изучали изменение интенсивности принимаемого МР-сигнала в зависимости от используемых катушек, произведена оценка отношения МР-сигнал/шум в зависимости от расстояния до катушки. По итогам экспериментального исследования рассчитаны коэффициенты зависимости «интенсивность сигнала – расстояние» на Т2-ВИ при МРТ с применением эндоректальной катушки; предложен способ сравнительного анализа интенсивности МР-сигнала на Т2-ВИ от структур таза. Производили сравнение относительных величин интенсивности МР-сигнала с получением отношений интенсивности в зоне интереса и точкой (областью) сравнения. Точкой (областью) сравнения выбрали интенсивность МР-сигнала от внутренней запирательной мышцы.
Методика МРТ с использованием традиционных импульсных последовательностей (TSE) заключалась в получении Т1-ВИ и Т2-ВИ в аксиальной, сагиттальной и корональной плоскостях. При МРТ с получением ДВИ использовали импульсную последовательность EPI с градиентными факторами 0, 600, 1100 c/мм2. Методика МРТ с ДКУ была основана на Flash-импульсной последовательности. При выполнении МР-спектроскопии предстательной железы использовали многовоксельную методику построения изображений на основе химического смещения в зависимости от молекулярного строения исследуемого метаболита (3D-CSI – Chemical Shift Imaging). Анализировали спектры в каждом вокселе с определением количества холина, креатина и цитрата, а также их отношений.
Дифференциальная диагностика интрапростатических изменений
Cпецифических жалоб, указывающих на злокачественное поражение предстательной железы, не выявлено (p>0,05). При злокачественном поражении были выявлены высокие цифры ПСА (местнораспространенные формы рака), чего не наблюдалось при неопухолевых заболеваниях, однако статистически это было незначимо в связи с малым числом наблюдений. Можно лишь утверждать о наличии тенденции к более частому обнаружению рака при больших значениях ПСА крови.
В ходе обследования выделены количественные МР-признаки, отличающиеся в исследуемых группах. Проанализирована возможность дифференциальной диагностики рака различной дифференцировки от неопухолевых заболеваний на основе выявленного различия интенсивности МР-сигнала на Т2-ВИ (табл. 1).
Таблица 1
Статистическая значимость (р) различия интенсивности МР-сигнала на Т2-ВИ
при различных заболеваниях предстательной железы
| Неопухолевые заболевания предстательной железы | Аденокарцинома | ||
| Все подтипы (Gleason 3-9), n=102 | Высокодиффе-ренцированная (Gleason 3-5), n=33 | Низкокодиффе- ренцированная (Gleason 6-9), n=69 | |
| Хронический простатит, n=48 | <0,001 | <0,001 | <0,001 |
| Доброкачественная гиперплазия (железистые узлы), n=71 | <0,001 | <0,001 | <0,001 |
| Доброкачественная гиперплазия (стромальные узлы), n=71 | 0,33 | 0,41 | 0,29 |
| Рубцово-атрофические изменения, n=8 | 0,36 | 0,17 | 0,55 |
Из данных таблицы 1 следует, что интенсивность МР-сигнала от воспалительных участков и железистых аденоматозных узлов статистически значимо выше, чем при аденокарциноме (р<0,001). Однако не имело статистической значимости различие интенсивностей МР-сигнала рубцовых изменений и стромальных аденоматозных узлов с аденокарциномой, как с высоко-, так и с низкодифференцированной (р>0,05).
Также проанализирована вероятность обнаружения рака предстательной железы в зависимости от характера контуров подозрительного участка. Оказалось, что вероятность выявления рака предстательной железы при четких неровных контурах подозрительного участка в 131 [27,7-622,2] раз выше, чем при четких ровных контурах (критерий Пирсона
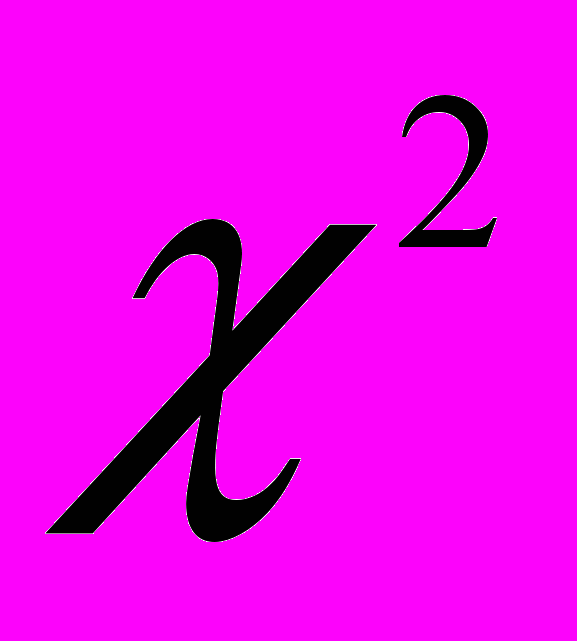 =87,3; число степеней свободы df=3; р<0,001). Менее вероятно обнаружение рака при нечетких неровных контурах (ОШ=58 [13,44-250,3]) и при нечетких ровных контурах (ОШ=38 [5,29-273,2]).
=87,3; число степеней свободы df=3; р<0,001). Менее вероятно обнаружение рака при нечетких неровных контурах (ОШ=58 [13,44-250,3]) и при нечетких ровных контурах (ОШ=38 [5,29-273,2]).Также определено, что вероятность обнаружения рака при неправильной форме участка в 22 [6,09-79,62] раза выше, чем при обнаружении округлой формы; при треугольной форме на широком основании – в 11 [2,78-43,35] раз выше; при диффузном снижении интенсивности МР-сигнала на Т2-ВИ от простаты – только в 8 [1,92-33,41] раз выше (критерий Пирсона
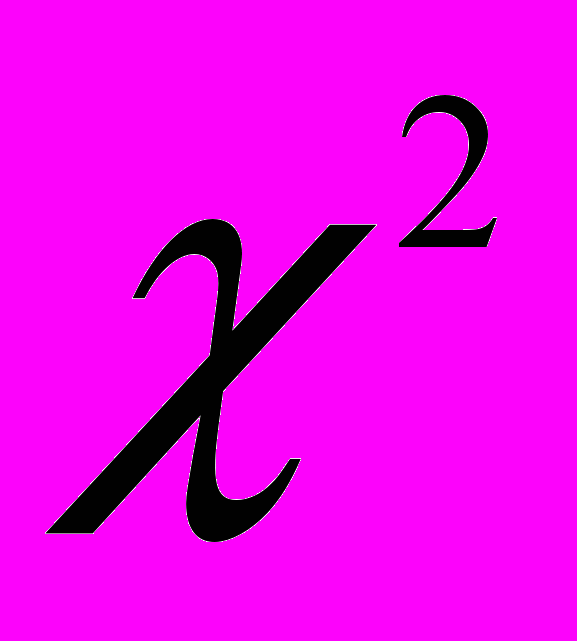 = 66,5; число степеней свободы df = 5; р<0,001). Однако, следует отметить, что овоидная форма участков преимущественно встречалась при неопухолевых заболеваниях предстательной железы (53,5%), а при раке она встречалась в меньшем числе случаев (9,8%). Наличие псевдокапсулы соответствовало пролабированию узла аденоматозной ткани из центральной области (p<0,01). В тоже время, для аденокарциномы не было характерным наличие треугольной формы с узким основанием (p>0,05).
= 66,5; число степеней свободы df = 5; р<0,001). Однако, следует отметить, что овоидная форма участков преимущественно встречалась при неопухолевых заболеваниях предстательной железы (53,5%), а при раке она встречалась в меньшем числе случаев (9,8%). Наличие псевдокапсулы соответствовало пролабированию узла аденоматозной ткани из центральной области (p<0,01). В тоже время, для аденокарциномы не было характерным наличие треугольной формы с узким основанием (p>0,05). Важным критерием дифференциальной диагностики рака предстательной железы являлся признак локального нарушения границы между центральной областью и периферической зоной в области расположения опухолевого узла – признак внутрипростатической зональной инвазии. По результатам исследования выделено три степени внутрипростатической зональной инвазии. При аденокарциномах с суммами Gleason 8 и 9 всегда наблюдались различные степени внутрипростатической зональной инвазии (p<0,05).
При МРТ с ДКУ для рака предстательной железы было характерно: быстрое начальное накопление парамагнитного контрастного вещества (время до пика контрастирования 27 [24; 33,3] с); высокая интенсивность МР-сигнала в пике контрастирования (156 [109,3; 56,3] ед.инт.); большие значения скорости вымывания контрастного вещества из низкодифференцированных раковых участков (0,57 [0,05; 0,96] ед.инт./с); пиковый (V) тип кривой контрастирования.
В таблице 2 проанализирована статистическая значимость различий параметров динамического контрастирования опухолевого поражения и неопухолевых изменений предстательной железы.
Таблица 2
Дифференциальная диагностика рака предстательной железы по количественным показателям динамического контрастирования
| Количественные показатели динамического контрастирования | Нет рака, n=79 | Есть рак, n=60 | Статистическая значимость различия, p |
| Me [Q25;Q75] | Me [Q25;Q75] | ||
| Время до пика контрастирования, с | 36 [29; 53,5] | 27 [24; 33,3] | 0,0045 |
| Интенсивность МР-сигнала в пике, ед.инт. | 161 [102; 242,5] | 156 [109,3; 256,3] | 0,81 |
| Скорость прибывания контрастного вещества до пика, ед.инт./с | 4,27 [2,26; 6,64] | 4,92 [3,24; 9,25] | 0,06 |
| Интенсивность МР-сигнала на 120 секунде, ед.инт. | 161 [117,8; 239,3] | 130,5 [103,5; 185,8] | 0,099 |
| Скорость вымывания контрастного вещества, ед.инт./с | 0,12 [-0,13; 0,36] | 0,46 [0,05; 0,8] | 0,005 |
Из данных таблицы 2 следует, что дифференциальная диагностика рака с неопухолевыми заболеваниями возможна на основании анализа времени до пика контрастирования (p<0,01) и скорости вымывания контрастного вещества из подозрительного участка (р=0,005).
В таблице 3 представлены результаты определения абсолютного риска выявления рака простаты и оценка шансов этого риска при выявлении различных типов кривой динамического контрастирования в зоне интереса.
Таблица 3
Оценка риска выявления рака предстательной железы в зависимости от типа динамического контрастирования (
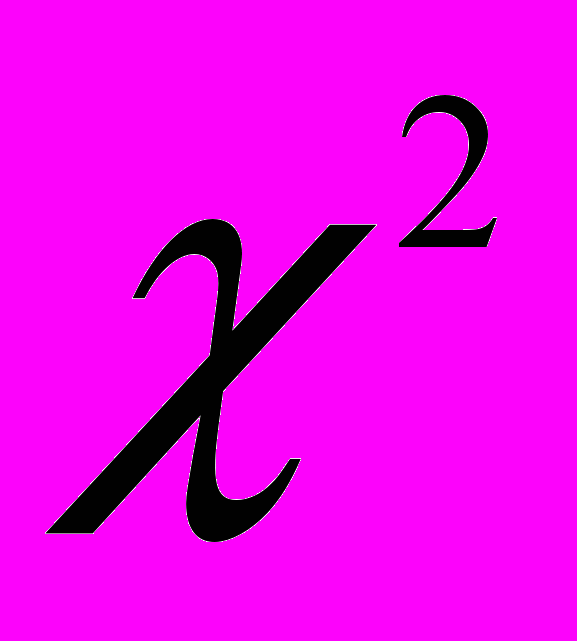 = 35,9; df = 3; р<0,001)
= 35,9; df = 3; р<0,001)| Тип динамического контрастирования | Нет рака | Есть рак | Отношение шансов (ОШ) | 95%-й доверительный интервал отношения шансов | ||
| Абс. | % | Абс. | % | |||
| II тип - Медленное накопление, n=23 | 15 | 65,2 | 7 | 34,8 | 1,47 | [0,5-4,3] |
| III тип - Быстрое начальное и пологое последующее накопление, n=24 | 15 | 62,5 | 9 | 37,5 | 1,89 | [0,68-5,24] |
| IV тип - Быстрое начальное накопление с выходом в фазу «плато», n=58 | 44 | 75,9 | 14 | 24,1 | * | * |
| V тип - Пиковое накопление, n=35 | 5 | 14,3 | 30 | 85,7 | 18,86 | [6,14-57,88] |
| Итого, n=139 | 79 | 56,8 | 60 | 43,2 | | |
* - группа сравнения или минимального прогнозируемого риска
Из данных таблицы 3 следует, что при V типе контрастирования шансы выявить рак в 18,9 [6,14-57,88] раз выше, чем при IV типе. Для II и III типов контрастирования различия в отношениях шансов с группой сравнения (IV тип) статистически не значимы (p>0,05).
МРТ с получением ДВИ предстательной железы выполнена 78,6% пациентам. ИКД неизмененной периферической зоны (n=88) предстательной железы составил 103,5 [98; 119,3] х10-5 мм2/с.
Для возможности дифференциальной диагностики рака предстательной железы от неопухолевых заболеваний на основе МРТ с получением ДВИ проанализирована статистическая значимость различия их ИКД (табл. 4).
Из данных таблицы 4 следует, что по ИКД не представляется возможным проводить дифференциальную диагностику между хроническим воспалением и высокдифференцированной аденокарциномой (p>0,05). Также отмечено, что злокачественные опухоли имеют преимущественно средние значения ИКД (45-75 х10-5 мм2/с), в то время как простатит и железистые аденоматозные узлы высокие значения ИКД, а стромальные аденоматозные узлы и рубцово-атрофические изменения низкие значения ИКД.
При раке простаты статистически значимо (p<0,01) чаще выявляли повышенный МР-сигнал на ДВИ (>1000 c/мм2). Чувствительность этого признака составила 59,3%, специфичность – 97,3%.
Таблица 4
Статистическая значимость (р) различия измеряемого коэффициента диффузии
при различных заболеваниях предстательной железы
| Неопухолевые заболевания предстательной железы | Аденокарцинома | ||
| Все гистол. подтипы (Gleason 3-9), n=91 | Высокодиффе-ренцированная Gleason 3-5, n=30 | Низкодиффе- ренцированная Gleason 6-9, n=61 | |
| Хронический простатит, n=32 | <0,001 | 0,09 | <0,001 |
| Доброкачественная гиперплазия (стромальные узлы), n=51 | <0,001 | <0,001 | 0,03 |
| Доброкачественная гиперплазия (железистые узлы), n=51 | <0,001 | <0,01 | <0,001 |
| Рубцово-атрофические изменения, n=8 | 0,008 | 0,012 | 0,01 |
При выполнении протоннной МР-спектроскопии установлено, что при раке предстательной железы статистически значимо выше были концентрация холина и отношение суммы холина с креатином к цитрату, чем при неопухолевых заболеваниях (p<0,05). В тоже время при раке снижалось количество цитрата (p<0,05).
Таким образом, при высокопольной МРТ с применением традиционных импульсных последовательностей, с ДКУ, получением ДВИ и МР-спектроскопией позволяла проводить дифференциальную диагностику локализованных форм рака предстательной железы с неопухолевыми заболеваниями.
Дифференциальная диагностика местнораспространенных форм рака предстательной железы, стадирование опухолевого процесса
При МРТ признаками инвазии рака простаты в клетчатку являлись (p<0,05): прилегание интрапростатической части опухоли к капсуле простаты на протяжении, нечеткость наружного контура капсулы, наличие внепростатического опухолевого компонента.
Дифференциальную диагностику макроинвазии (n=40) рака предстательной железы в клетчатку проводили с микроинвазией, пролабированием аденоматозных узлов, гематомами, фиброзными изменениями капсулы простаты. Получены статистически значимые дифференциально-диагностические МР-критерии отличия экстензии рака в клетчатку с неопухолевыми изменениями (p<0,05). В тоже время не получено достоверных МР-критериев для дифференциальной диагностики микроинвазии рака в клетчатку и внутрикапсульной инвазии (p>0,05).
Специфичность, прогностичность отрицательного результата и диагностическая эффективность высокопольной МРТ в диагностике инвазии рака в парапростатическую клетчатку составили 88,9 (73,9-96,9)%, 97 (84,2-99,9)% и 87,5 (73,2-95,8)% соответственно. В скобках указаны их 95%-ные доверительные интервалы.
Основным признаком Т3b стадии рака предстательной железы было изменение МР-структуры оснований семенных пузырьков в виде снижения интенсивности МР-сигнала на Т2-ВИ от стенок и содержимого. Нами выделено четыре типа опухолевого поражения семенных пузырьков: внутристеночное распространение опухолевой ткани по семявыносящим структурам (12%), распространение опухоли внутрипросветно (16%), инвазия семенных пузырьков через парапростатическую клетчатку (8%), а также инвазия смешанного типа (65%). Получены статистически значимые дифференциально-диагностические МР-критерии отличия инвазии рака в семенные пузырьки с неопухолевыми изменениями (p<0,05). Выявлена значимая разница ИКД опухолевой и рубцовой ткани оснований семенных пузырьков (p<0,05).
В тоже время для везикулита и амилоидоза семенных пузырьков было более характерно равномерное утолщение стенок семенных пузырьков. Анализ данных показал, что при эндоректальной МРТ на ДВИ (b>1000 с/мм2) МР-сигнал в семенных пузырьках может быть повышен за счет артефактов около полостной катушки.
Специфичность, прогностичность отрицательного результата и диагностическая эффективность высокопольной МРТ в диагностике инвазии рака в семенные пузырьки составили – Me (95% ДИ): 91,1 (76,3-98,1)%, 91,1 (76,3-98,1)% и 85 (70,2-94,3)% соответственно.
Дифференциальная диагностика опухолевой инвазии мочевого пузыря (n=14) проводилась с пролабированием ДГПЖ в мочевой пузырь (n=56), опухолям мочевого пузыря в области его шейки (n=5), циститом (n=23), внутрипузырными сгустками крови (n=2).
Для инвазии рака предстательной железы в мочевой пузырь (Т4 стадия) было характерным (p<0,05): неоднородная структура шейки мочевого пузыря за счет распространения опухолевой ткани из периферической зоны предстательной железы (без значимого расширения шейки пузыря); расположение внутрипузырной части опухоли кзади от внутреннего отверстия мочеиспускательного канала (до уровня межмочеточниковой складки); однородная МР-структура внутрипузырного опухолевого компонента; изоинтенсивный МР-сигнал на Т1- и Т2-ВИ; четкие и неровные наружные контуры; нечеткая граница между опухолью и стенкой мочевого пузыря; снижение ИКД; чаще высокая интенсивность МР-сигнала на ДВИ (<1000 с/мм2); пиковый тип кривой динамического контрастирования; снижение содержания цитрата и повышение количества холина и креатина при МР-спектроскопии.
Выявленные признаки позволяли диагностировать инвазию рака простаты в мочевой пузырь и эффективно проводить дифференциальную диагностику. Затруднения возникали при стелющемся типе инвазии опухоли простаты в треугольник Льето. Отмечено, что сходные характеристики динамического контрастирования опухолевой и аденоматозной ткани снижают значимость методики МРТ с ДКУ в дифференциальной диагностике инвазии рака предстательной железы в мочевой пузырь.
Для инвазии рака предстательной железы в стенку прямой кишки было характерно (p<0,05): признаки разрушения капсулы простаты, наличия экстрапростатического компонента в клетчаточном пространстве; прилегание опухолевого компонента к стенке кишки с изменением МР-структуры ее мышечных слоев; наличие внутрикишечного опухолевого компонента.
Инвазия стенки таза при раке предстательной железы выявлена у 7% больных. Для опухолевой инвазии в стенку таза при раке предстательной железы было характерно (p<0,05): разрушение капсулы железы, опухолевая инвазия парапростатического клетчаточного пространства с прилеганием злокачественного новообразования к мышце, поднимающей анус; исчезновение жировой прослойки между мышцей и простатой; наличие четкой связи инвазированной части мышцы и внутрипростатической части опухоли; изменение МР-структуры мышцы в месте прилегания опухоли, однородность МР-структуры и повышение интенсивности МР-сигнала на Т2-ВИ.
Были рассчитаны показатели эффективности высокопольной МРТ в диагностике рака предстательной железы (табл. 5).
Большинство ложноотрицательных заключений получено при анализе данных локализованных форм высокодифференцированных форм рака предстательной железы (8 из 11; 73%). Ложноположительные результаты были обусловлены неверной интерпретацией МР-картины отграниченных форм воспалительного процесса предстательной железы.
Таблица 5
Диагностические показатели определения рака предстательной железы
при высокопольной МРТ
| Показатель | Значение показателя, % | 95%-й доверительный интервал, % |
| Чувствительность | 89,2 | 81,5-94,5 |
| Специфичность | 93,4 | 87,9-97,0 |
| Прогностичность положительного результата | 91,0 | 83,6-95,8 |
| Прогностичность отрицательного результата | 92,1 | 86,3-96,0 |
| Ложноотрицательный результат | 10,8 | 5,5-18,5 |
| Ложноположительный результат | 6,6 | 3,0-12,1 |
| Диагностическая эффективность | 91,6 | 87,4-94,8 |
Таким образом, МРТ является высокоэффективным методом дифференциальной диагностики рака предстательной железы.
Дифференциальная МРТ-диагностика высокодифференцированных и низкодифференцированных форм рака предстательной железы
В ходе обследования выделены количественные признаки, отличающиеся в исследуемых подгруппах высокодифференцированных (n=33) и низкодифференцированных (n=69) аденокарцином предстательной железы. Размеры и площадь низкодифферецированных опухолей значимо превышали таковые при высокодифференцированных (p<0,05). Интересен факт близкого к статистически значимому различию ИКД опухолевых участков в обеих группах (р=0,053), что косвенно указывает на более плотное расположение клеточных элементов при низкодифференцированных опухолях. При МР-спектроскопии различия отношения (Cho+Cr)/Ci было статистически значимо (р=0,002), и, хотя разница по холину тоже была статистически значима (р=0,0013), дифференциальная диагностика на основе содержания одного метаболита ненадежна. При МРТ с ДКУ количественные показатели для высокодифференцированных опухолей были в большинстве случаев статистически значимо ниже, чем при низкодифференцированных (p<0,05).
Установлено, что при выявлении II и III степени внутрипростатической зональной инвазии вероятность выявить аденокарциному Gleason 6-9 в 4,38 [1,2-15,94] раз выше, чем аденокарциному Gleason 3-5 (p=0,017, df=1, критерий Пирсона
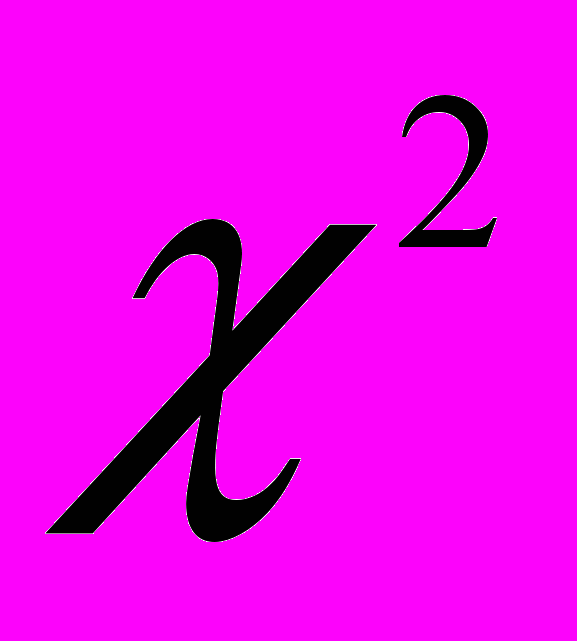 =5,65).
=5,65).Определено, что при выявлении в опухолевом участке повышенного МР-сигнала на ДВИ (>1000 с/мм2) вероятность определить аденокарциному Gleason 6-9 в 14,8 [5,0-43,7] раз выше, чем аденокарциному Gleason 3-5 (р<0,001, df=1, критерий Пирсона
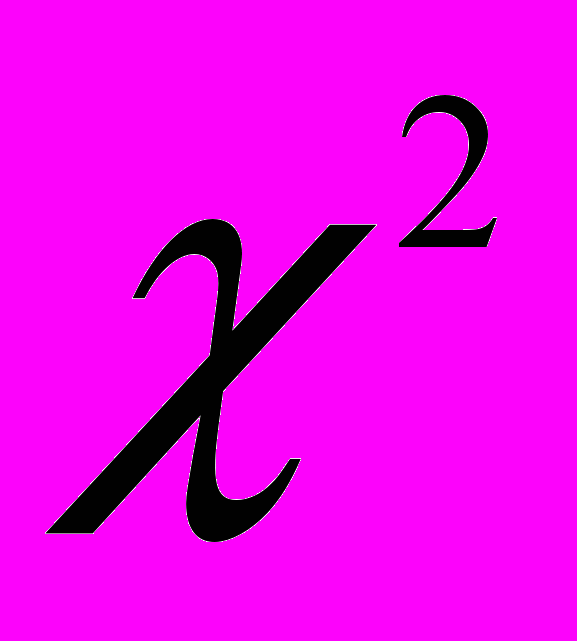 =28,7).
=28,7).Распределение типов кривой динамического контрастирования также оказалось статистически значимым (p=0,036, df=3, критерий Пирсона
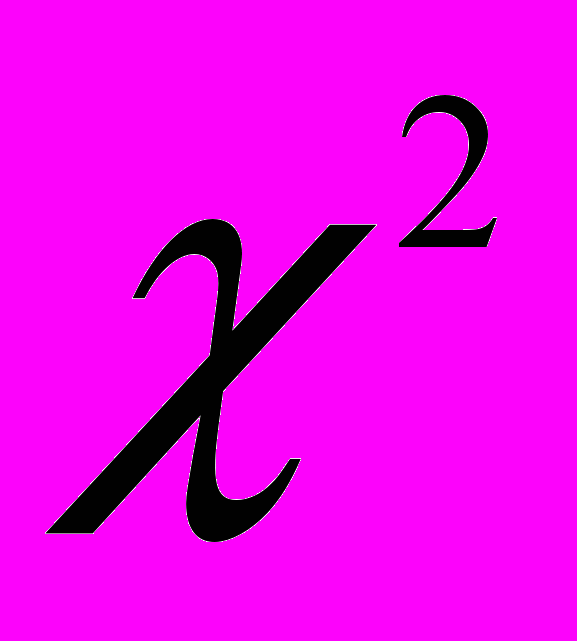 =8,53). Полученные результаты свидетельствуют, что при выявлении IV типа контрастирования в опухолевом участке вероятность диагностировать низкодифференцированный рак в 7,3 [1,1-48,3] раза выше, чем высокодифференцированный, а при выявлении V типа кривой динамического контрастирования шанс выявления аденокарциномы Gleason 6-9 в 6,6 [1,3-33,3] раза выше, чем при выявлении III типа контрастирования.
=8,53). Полученные результаты свидетельствуют, что при выявлении IV типа контрастирования в опухолевом участке вероятность диагностировать низкодифференцированный рак в 7,3 [1,1-48,3] раза выше, чем высокодифференцированный, а при выявлении V типа кривой динамического контрастирования шанс выявления аденокарциномы Gleason 6-9 в 6,6 [1,3-33,3] раза выше, чем при выявлении III типа контрастирования. Также установлено, что при выявлении экстракапсулярного опухолевого компонента в парапростатической клетчатке вероятность определить низкодифференцированный рак в 5,8 [2,0-16,7] раза выше, чем высокодифференцированный (p=0,002, df=1, критерий Пирсона
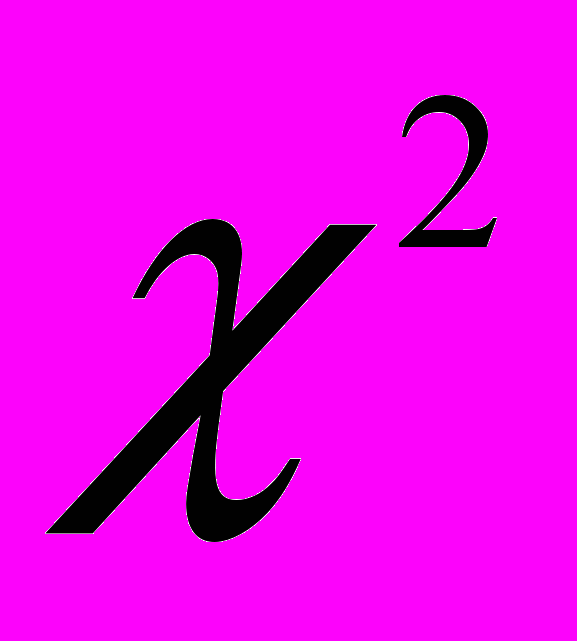 =10,23).
=10,23).В тоже время оказалось, что при выявлении опухолевой инвазии семенных пузырьков вероятность выявления низкодифференцированого рака в 9,4 [2,1-42,4] раза выше, чем высокодифференцированного (p<0,001, df=1, критерий Пирсона
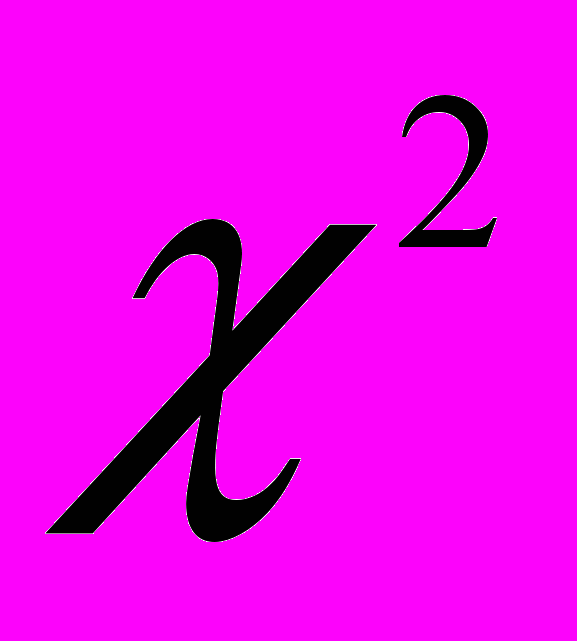 =11,2).
=11,2).Следовательно, МРТ позволяет проводить дифференциальную диагностику рака предстательной железы в зависимости от степени дифференцировки опухолевой ткани. Для аденокарциномы Gleason 6-9 в отличии от аденокарциномы Gleason 3-5 было характерным: наличие повышенного МР-сигнала на ДВИ, полученных с градинентными факторами более 1000 с/мм2 (р<0,001), более высокая интенсивность МР-сигнала в пике динамического контрастирования (р<0,001), более высокая скорость поступления контрастного вещества в опухолевый участок (р<0,001), большее содержание холина при МР-спектроскопии (р=0,013), более высокие значения (Cho+Cr)/Ci (р=0,002). Также при низкодифференцированных аденокарциномах статистически более часто выявляли V тип динамического контрастирования, разрушение капсулы, наличие признаков распространения в клетчатку и семенные пузырьки (p<0,05).
Таким образом, вышеизложенное позволяет утверждать, что высокопольная МРТ является высокоинформативным методом и дает возможность не только дифференцировать аденокарциному и неопухолевые заболевания предстательной железы, но также в отдельных случаях делать вывод о степени злокачественности новообразования. МРТ позволяет достоверно стадировать злокачественный опухолевый процесс, выявлять сопутствующие изменения тазовых органов.
На основе проведенного исследования предлагается алгоритм дифференциальной МР-диагностики рака предстательной железы (рис. 1). В упрощенном виде алгоритм сводится к следующему: на первом этапе при получении Т2- и Т1-взвешенных изображений в трех плоскостях и диффузионно-взвешенных изображений предлагается выявлять признаки инвазивного роста (как внутрипростатического, так и внепростатического), что достоверно указывает на злокачественное поражение. При отсутствии таковых, на втором этапе анализируются локализованные изменения предстательной железы. Прежде всего это участки сниженного МР-сигнала на Т2-ВИ в периферической зоне и в центральной области простаты. Анализируя их контуры и форму можно с определенной долей вероятности выявить доброкачественную гиперплазию или фиброзно-атрофические изменения. Наряду с этим важной частью дифференциальной диагностики рака является анализ интенсивности МР-сигнала на ДВИ. При этом высокая яркость от участков с большой долей вероятности указывает на раковое поражение. Исключением являются абсцессы простаты. МР-спектроскопию мы рекомендуем проводить в сложных дифференциально-диагностических случаях локализованных изменений предстательной железы. Также мы считаем, что методику динамического контрастирования следует проводить в ограниченных случаях: прежде всего для дифференциальной диагностики инвазии рака в соседние органы. При неясных случаях рекомендуются контрольные исследования.
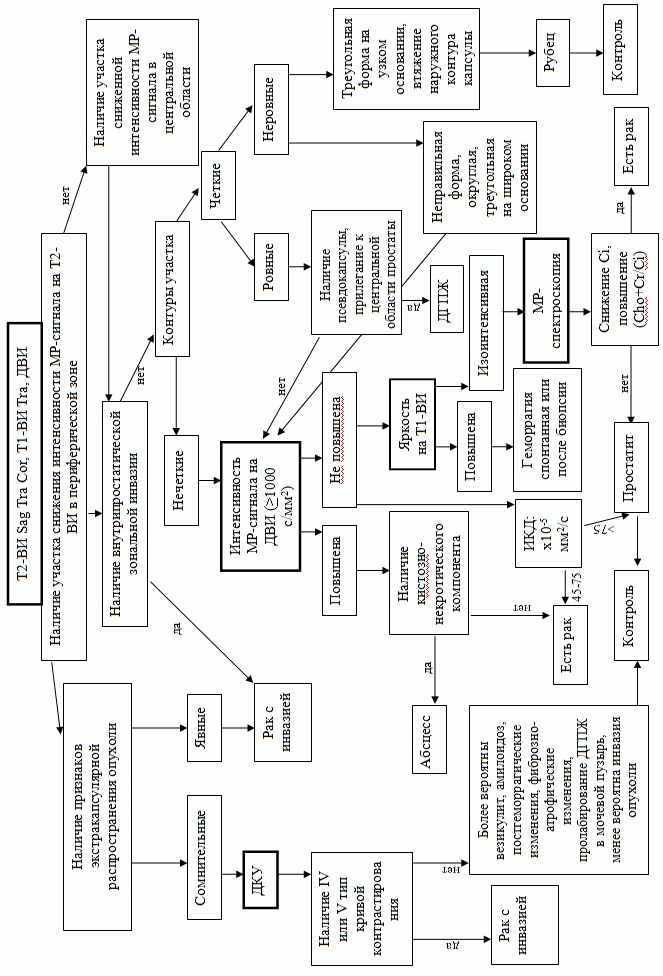
Рис. 1. Алгоритм дифференциальной МР-диагностики рака предстательной железы
ВЫВОДЫ
- Высокопольная МРТ является высокоинформативным методом лучевой диагностики, позволяющим эффективно диагностировать рак предстательной железы и осуществлять стадирование опухолевого процесса с чувствительностью 89,2%, специфичностью 93,4% и точностью 91,6%.
- Усовершенствованная методика МРТ таза позволяет получать дополнительные МР-критерии для дифференциальной диагностики рака предстательной железы.
- Высокопольная МРТ позволяет дифференцировать локализованные формы аденокарциномы от неопухолевых изменений предстательной железы. Основными дифференциально-диагностическими критериями внутрипростатических изменений при раке предстательной железы являются: снижение интенсивности МР-сигнала на Т2-ВИ, неровные и нечеткие контуры, однородная внутренняя МР-структура, внутрипростатическая и внепростатическая инвазия; повышенный МР-сигнал на на ДВИ с градиентными факторами более 1000 c/мм2; при МРТ с динамическим контрастным усилением – пиковый характер прохождения контрастного вещества; при МР-спектроскопии – снижение содержания цитрата и повышением отношения суммы холина и креатина к цитрату.
- Высокопольная МРТ позволяет дифференцировать опухолевую инвазию аденокарциномы предстательной железы в рядом расположенные органы от изменений неопухолевого характера. Специфичность и диагностическая эффективность высокопольной МРТ в определении инвазии рака в парапростатическую клетчатку составили 88,9% и 87,5%, соответственно. Специфичность и диагностическая эффективность высокопольной МРТ в диагностике инвазии рака в семенные пузырьки составили 91,1% и 85%, соответственно.
- Диагностика минимальной инвазии рака предстательной железы в клетчатку и другие структуры таза основана на Т2-ВИ. Методики МРТ с получением ДВИ и ДКУ не позволяют дифференцировать минимальную инвазию рака предстательной железы в связи с малым пространственным разрешением получаемых изображений.
- Высокопольная МРТ с использованием методик динамического контрастирования, получения ДВИ и МР-спектроскопии позволяет дифференцировать высоко- и низкодифференцированные формы аденокарциномы. Вероятность обнаружения низкодифференцированных форм аденокарциномы предстательной железы увеличивается при обнаружении повышенной интенсивности МР-сигнала на ДВИ, полученных с диффузионными факторами более 1000 c/мм2, а также при выявлении пикового характера динамического контрастирования и высоких значениях отношения суммы холина с креатином к цитрату (на уровне 1,6 [1; 2,48] и более).
- Ключевыми этапами в алгоритме дифференциальной МР-диагностики рака предстательной железы являются анализ данных ДВИ и выявление признаков инвазивного роста.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Подготовка к исследованию должна включать: адекватное наполнение мочевого пузыря (300-400 мл), применение спазмолитиков для подавления перистальтики, естественное опорожнение прямой кишки при эндоректальном исследовании.
- При МРТ предстательной железы целесообразно использовать эндоректальную катушку для увеличения отношения «сигнал/шум», что имеет принципиальное значение для методик нативного сканирования и МР-спектроскопии.
- В условиях ограничения времени исследования (тяжелое соматическое состояние, выраженный болевой синдром) возможно сокращение объема исследования. В первую очередь рекомендуется использовать протоколы с получением Т2-ВИ в аксиальной плоскости и ДВИ, имеющие наибольшую информативность.
- Для дифференциальной диагностики и уточнения степени инвазии семенных пузырьков следует применять Т2-ВИ в косокорональной плоскости, параллельной семявыносящим структурам (с уменьшением толщины среза и межсрезового расстояния).
- Получение ДВИ с градиентными факторами более 1000 с/мм2 считаем обязательным в дифференциальной диагностике злокачественных новообразований предстательной железы (в т.ч. центральной области).
- При эндоректальной МРТ с получением ДВИ для исключения артефакта усиления МР-сигнала целесообразно отключать эндоректальную катушку.
- При МР-спектроскопии в случае частичного расположения вокселя в объеме опухолевой ткани целесообразно проводить ручную коррекцию позиции воксельной матрицы; к анализу биохимического состава тканей допускать только спектры без признаков зашумленности.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
- Труфанов, Г.Е. Аденокарцинома предстательной железы: роль эндоректальной МРТ / Г.Е. Труфанов, А.В. Мищенко, Д.Л. Дубицкий // Материалы Всероссийского конгресса лучевых диагностов М., 2007. – С. 229-230.
- Мищенко, А.В. Роль магнитно-резонансной спектроскопии по водороду в диагностике рака предстательной железы / А.В. Мищенко, Д.Л. Дубицкий // Тезисы докладов II международного молодежного медицинского конгресса «Санкт-Петербургские научные чтения 2007». – СПб., 2007. – С. 150.
- Дубицкий, Д.Л. Возможности магнитно-резонансной спектроскопии по водороду в диагностике рака предстательной железы / Д.Л. Дубицкий, А.В. Мищенко // Роль Московской гошпитали в становлении и развития отечественного государственного больничного дела, медицинского образования и науки: Тезисы докл. Науч.-истор. конф. – М.: 2007. – С. 331.
- Дубицкий, Д.Л. Оптимизация методики высокопольного (1,5 Тл) магнитно-резонансного исследования органов таза при подозрении на рак предстательной железы / Д.Л. Дубицкий // Материалы итоговой конференции военно-научного общества слушателей и ординаторов I факультета / ВМедА, 2008. – С. 69-70.
- Дубицкий, Д.Л. Высокопольная (1,5 Тл) магнитно-резонансная томография с применением эндоректальной катушки в стадировании рака предстательной железы / Д.Л. Дубицкий // Материалы итоговой конференции военно-научного общества слушателей и ординаторов I факультета / ВМедА, 2008. – С. 69-70.
- Мищенко, А.В. Использование высокопольной магнитно-резонансной томографии при биохимических рецидивах рака предстательной железы / А.В. Мищенко, Д.Л. Дубицкий // Материалы 2-го Всероссийского национального конгресса по лучевой диагностике и терапии. – М., 2008. – С. 188-189.
- Труфанов, Г.Е. Возможности высокопольной магнитно-резонансной томографии в диагностике рака предстательной железы / / Г.Е. Труфанов, Д.Л. Дубицкий, А.В. Мищенко // Вестник Российской Военно-медицинской академии. – 2008. – № 2 (22). – С. 108-112.
- Дубицкий, Д.Л. Магнитно-резонансная томография в диагностике рецидивов рака предстательной железы / Д.Л. Дубицкий, А.В. Мищенко // Материалы научной конференции «От лучей Рентгена – к инновациям XXI века: 90 лет со дня основания первого в мире Рентгенорадиологического института (Российского научного центра радиологии и хирургических технологий)» (с участием специалистов стран ближнего и дальнего зарубежья) тезисы докладов. – СПб., 2008. – С. 85-86.
- Мищенко, А.В. Дифференциальная магнитно-резонансная диагностика местных изменений при биохимическом рецидиве рака предстательной железы после радикальной простатэктомии / А.В. Мищенко, Д.Л. Дубицкий // Материалы III конгресса Российского общества онкоурологов. – СПб., 2008. – С. 58-59.
- Мищенко, А.В. К вопросу о применении магнитно-резонансной диффузии для дифференциальной диагностики очаговых образований предстательной железы / А.В. Мищенко, Д.Л. Дубицкий // Современные алгоритмы диагностики и стандарты лечения в клинической медицине: Тезисы докл. Науч.-практ. конф. – М.: ГВКГ им. Н.Н. Бурденко, 2008. – С. 359-360.
- Мищенко, А.В. Основы и клиническое применение водородной (протонной) магнитно-резонансной спектроскопии (1Н-МРС) предстательной железы / А.В. Мищенко, Г.Е. Труфанов, Д.Л. Дубицкий // Магнитно-резонансная спектроскопия: Руководство для врачей / Под редакцией Труфанова Г.Е., Тютина Л.А. – СПб.: «ЭЛБИ-СПб», 2008. – С. 137-164.
- Мищенко, А.В. Возможности МР-спектроскопии в диагностике рака предстательной железы / А.В. Мищенко, Д.Л. Дубицкий, Н.В. Марченко // Кремлевская медицина: клинический вестник. - 2008. – №2. – С. 48-50.
- Мищенко, А.В. Методика измерения интенсивности сигнала при магнитно-резонансном исследовании предстательной железы с применением катушки для тела и эндоректального датчика / А.В. Мищенко, Д.Л. Дубицкий // Медицинская визуализация, материалы III Всероссийского Национального конгресса лучевых диагностов и терапевтов «Радиология-2009». – М., 2009. – С. 267.
- Мищенко, А.В. Магнитно-резонансная томография в дифференциальной диагностике инвазии рака предстательной железы в семенные пузырьки с рубцовыми изменениями / А.В. Мищенко, Г.Е. Труфанов, Д.Л. Дубицкий // Вестник Российской Военно-медицинской академии. – 2009. – Прил. № 1 (25), ч. 2. – С. 807-808.
- Дубицкий, Д.Л. Возможности динамического контрастного усиления при магнитно-резонансной томографии в диагностике локализованных форм рака предстательной железы / Д.Л. Дубицкий, А.В. Мищенко // Сборник научных работ «Невский Радиологический форум 2009». – СПб., 2009. – С. 172-173.
- Мищенко, А.В. Влияние сопутствующих заболеваний предстательной железы на выявляемость рака по данным МРТ / А.В. Мищенко, Д.Л. Дубицкий, Е.А. Москаленко // Сборник научных работ «Невский Радиологический форум 2009». – СПб., 2009. – С. 361.
- Мищенко, А.В. Магнитно-резонансная томография в диагностике очагов рака предстательной железы различной локализации / А.В. Мищенко, Д.Л. Дубицкий // Сборник научных работ «Невский Радиологический форум 2009». – СПб., 2009. – С. 361-362.
- Мищенко, А.В. Использование диффузионно-взвешенных изображений в дифференциальной диагностике рака предстательной железы / А.В. Мищенко, Д.Л. Дубицкий // Вестник Российской Военно-медицинской академии. – 2009. – № 4 (28). – С. 90-91.
- Дубицкий, Д.Л. Математическая модель рака предстательной железы по данным протонной магнитно-резонансной спекроскопии / Д.Л. Дубицкий, Е.А. Москаленко, А.В. Мищенко // Медицинская визуализация, материалы IV Всеросийского Национального конгресса лучевых диагностов и терапевтов «Радиология 2010». – М., 2010. – С.138-140.
- Дубицкий, Д.Л. Опыт оптимизации алгоритмов комплексного магнитно-резонансного исследования в диагностике рака предстательной железы в различные периоды лечебно-диагностического процесса / Д.Л. Дубицкий, А.В. Мищенко, А.В. Николаев, В.Н. Малаховский // Лучевая диагностика и терапия. - 2010. - №3 (1). - С. 84-93.
- Мищенко, А.В. Возможности магнитно-резонансной спектроскопии в диагностике аденокарциномы предстательной железы / А.В. Мищенко, Д.Л. Дубицкий, Е.А. Москаленко, А.В. Николаев // Лучевая диагностика и терапия. – 2010. - №4 (1). – С.62-67.
СПИСОК СОКРАЩЕНИЙ
95 ДИ – 95%-ный доверительный интервал
3D-csi – трехмерная последовательность МР-спектроскопии на основе химического смещения (3D Chemical Shift Imaging)
ВПЗИ – внутрипростатическая зональная инвазия
ДВИ – диффузионно-взвешенное изображение
ДКУ – динамическое контрастное усиление
ИКД – измеряемый коэффициент диффузии
МР- – магнитно-резонансный (-ая; -ое)
МРС – магнитно-резонансная спектроскопия
МРТ – магнитно-резонансная томография
ОШ – отношение шансов
ПСА – простатический специфический антиген сыворотки крови
Т1-ВИ – Т1-взвешенное изображение
Т2-ВИ – Т2-взвешенное изображение
Cho – холин (choline)
Ci – цитрат (citrate)
Cr – креатин (creatine)
EPI – импульсная последовательность эхо-планарной томографии
Flash – методика быстрых импульсных последовательностей с единичным возбуждающим импульсом и малым углом отклонения (fast low angle single shot)
ТА – время сканирования одной импульсной последовательности (программы)
TE – время эха (time echo)
TR – время повторения (time repetition)
TSE – импульсная последовательность быстрого спинового эха (turbo spine echo)
