V. свойства органических соединений
| Вид материала | Документы |
- Программа элективного курса по химии «строение и свойства кислородсодержащих органических, 667.3kb.
- Kirgizistan-tüRKİye manas üNİversitesi ders biLGİ formu, 147.19kb.
- Тематический план лекций модуля 1 с органической химии для студентов 2 курса фармацевтического, 25.24kb.
- Календарно-тематический план лекций по биоорганической химии 1 курс (2 семестр) специальность, 65.41kb.
- Лекция Классификация и изомерия органических соединений, 296.86kb.
- Тематический план лекций и самостоятельной работы по органической химии (осенний семестр), 91.46kb.
- 10 класс. Тема урока: «Причины многообразия органических соединений» Тип урока, 145.21kb.
- Дробот Светлана Сергеевна конспект, 69.15kb.
- Дробот Светлана Сергеевна конспект, 57.86kb.
- План лекций по биоорганической химии для студентов 1 курса медицинского факультета, 26.83kb.
V. СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
5.1. Особенности проведения эксперимента по органической химии
Органическая химия, является частью школьного курса химии и, прежде всего, направлена на решение общих задач, стоящих перед школой в целом и перед учебным предметом "химия", в частности. Органическая химия как учебный предмет входит в систему общего среднего образования и способствует повышению уровня политехнической подготовки учащихся. При обучении органической химии учителю предоставляются широкие возможности для решения отдельных образовательных задач и более углубленного решения некоторых вопросов воспитания учащихся. Так, например, более углубленно можно рассмотреть вопросы экологического воспитания, вопросы профессионального ориентирования, мировоз-зренческого характера и др. Учебный эксперимент, как и в неорганической химии, в преподавании органической химии имеет целью способствовать решению основных учебно-воспитательных задач.
Являясь самостоятельной частью химической науки, органическая химия изучает углеродсодержащие вещества и те превращения, которые с ними происходят. Веществ, которыми оперирует эта наука колоссальное множество. Отличие этих веществ от неорганических весьма очевидно. Очень часто органические соединения имеют более сложные состав, строение и особенности химических превращений.
Рассмотрение явлений с такими веществами при изучении органической химии помогает ученикам лучше понимать процессы, происходящие в окружающем растительном и животном мире, познавать сущность и закономерности жизни.
Характерной чертой органической химии является зависимость химических свойств веществ от внутреннего строения молекул, а не только от качественного и количественного состава.
Таким образом, изучение органической химии на базе теории строения даёт широкую возможность расширить представление учащихся о природе и причинах многообразия окружающих нас веществ.
Ознакомление учащихся с важнейшими органическими производствами вносит существенный вклад в их политехническую подготовку. Рассмотрение процессов переработки газа, нефти и каменного угля расширяет понятия об основах топливной промышленности. На примере производства этилового спирта или уксусной кислоты учащиеся знакомятся с промышленностью органического синтеза.
Ознакомление с переработкой жиров, крахмала и других сельскохозяйственных продуктов дает представление о применении химии в пищевой промышленности. Изучение промышленных способов получения каучука, смол, пластмасс и волокон дает понятие о важнейшей в настоящее время отрасли народного хозяйства – промышленности синтетических материалов.
Роль учебного эксперимента и в том, чтобы вооружить учащихся практическими умениями и навыками лабораторного характера. Выполнение учащимися опытов по органической химии, часто более сложных, чем опыты с неорганическими веществами, способствуют выработке умений применять знания по практике и навыки обращения с веществами и лабораторной техникой, что также имеет значение в практической подготовке.
Очевидна роль эксперимента и в понимании учащимися такого теоретического вопроса школьного курса органической химии как проблема взаимного влияния атомов в молекуле. Нет необходимости разрабатывать специальные опыты по этому вопросу, так как взаимное влияние атомов, так или иначе, сказывается почти во всяком химическом опыте. Надо лишь на наиболее ярких примерах давать соответствующее толкование известным реакциям (например, сравнивать подвижность атомов водорода в углеводородах, спиртах и кислотах или бензоле, феноле, анилине; сравнивать силу кислот – уксусной, щавелевой и т.д.).
Эксперимент по органической химии способствует развитию у учащихся внимания, аккуратности, наблюдательности, настойчивости в преодолении трудностей и ряда других качеств.
Чисто описательное изучение органической химии, когда от учащихся требуют лишь перечислить сведения об отдельных веществах и написать уравнения химических реакций, представляется им нагромождением бесконечного количества случайных фактов.
Структурные формулы, введённые догматически, становятся для учащихся лишь схемами, которые надо заучивать и уметь чертить. Без знания реальных основ определения структуры молекул учащиеся усваивают теорию химического строения поверхностно. Сопоставление свойств со строением при этом, если и делается, то оно часто бывает формальным, ассоциативным, а не внутренним, осмысленным. В общем, если техника учебного школьного эксперимента при изучении органической химии и становится несколько сложнее, чем при изучении неорганической химии, то методика его использования в учебно-воспитательном процессе существенно не отличается. Исключать из учебного процесса учебный химический эксперимент по органической химии ни в коем случае нельзя.
5.2. Углеводороды и их галогенпроизводные
Углеводороды – органические соединения, молекулы которых состоят только из атомов углерода и водорода. В зависимости от общего строения молекул и наличия кратных химических связей углеводороды подразделяют на отдельные классы: алканы, циклоалканы, алкены, алкадиены, алкины, арены и др. В природе встречаются в составе нефти, природного газа. Получают углеводороды в результате переработки нефти, угля, природного газа, торфа, древесины и т.д. Находят очень широкое применение в качестве топлива, сырья для органического синтеза и т.д.
Алканы (предельные углеводороды, насыщенные углеводороды, парафины) – углеводороды нециклического строения (с открытой прямой или разветвленной углеродной цепью). Общая формула СnН2n+2 (n³1). В молекулах алканов атомы углерода связаны только одинарными связями, атомные орбитали углерода находятся в состоянии sp3-гибридизации, угол между связями составляет 109о28'. Длина связи С-С в алканах равна 0,154 нм. Простейшие представители – метан, этан, пропан, бутан и т. д. Названия следующих членов гомологического ряда алканов, начиная с пятого, составляются из первого слога греческих числительных с добавлением суффикса –ан, например, пентан, гексан, гептан, октан, нонан, декан, ундекан и т.д. Чтобы назвать алканы с прямой (неразветвленной) углеродной цепью применяют прилагательное нормальный, например, нормальный пентан (н-пентан). Первые четыре члена гомологического ряда при обычных условиях – газы без запаха; с пятого по пятнадцатый – жидкости с запахом; начиная с шестнадцатого – твердые вещества без запаха. С увеличением молярной массы температуры кипения и плавления увеличиваются. Все алканы мало растворимы в воде. В связи с отсутствием в молекулах кратных связей алканы относительно инертные вещества и не вступают в реакции присоединения, полимеризации, не обесцвечивают бромную воду и раствор перманганата калия. Для алканов характерны реакции изомеризации, горения, крекинга (разложения), замещения, неполного окисления, которые протекают в жестких условиях (высокая температура, катализаторы).
Алканы можно получить гидрированием алкенов и алкинов, синтезом на основе водяного газа (смесь СО и H2), реакцией Вюрца, сплавлением солей карбоновых кислот с твердыми щелочами. Входят в состав нефти и природного газа. Применяют в качестве горючего (метан, бутан-пропановая смесь, бензин, керосин, газойль и т. д.), смазочных масел, в составе мазута; для синтеза других органических веществ и материалов. Широкое применение алканы находят в медицине (вазелин, парафин, хлороформ, иодоформ и др.)
Алкены (этиленовые углеводороды, олефины) – ненасыщенные углеводороды гомологического ряда этилена. Общая формула СnН2n (n³2). В молекулах алкенов присутствует одна двойная связь между двумя атомами углерода, у которых электронные орбитали находятся в состоянии sp2-гибридизации. Сигма-связь двойной связи >С=С< и сигма-связи С-Н лежат в одной плоскости под углами 120о. Пи-связь двойной связи >С=С< образуется р-электронами, не подвергшимися гибридизации, и расположена перпендикулярно по обе стороны указанной плоскости. Длина связи С=С равна 0,133 нм, т.е. меньше чем длина одинарной (простой) С-С связи. Следствием такого строения является отсутствие возможности свободного вращения атомов углерода вокруг С=С связи.
Все это приводит к тому, что для алкенов характерна не только изомерия углеродной цепи, как у алканов, но и изомерия положения двойной связи, цис-транс-изомерия и межклассовая изомерия (изомерны циклоалканам). Названия алкенов образуются от названий алканов с заменой суффикса –ан на суффикс –ен. Простейшие представители – этен, пропен, бутен и т. д.
В связи с наличием в молекулах двойных связей вступают в реакции: а) присоединения (реакции гидрогенизации с образованием алканов, галогенирования с образованием дигалогеналканов, гидратации с образованием предельных одноатомных спиртов, гидрогалогенирования с образованием галогеналканов (две последние реакции идут по правилу Марковникова); б) окисления (реакции горения или полного окисления с образованием CO2 и H2O, неполного каталитического окисления с образованием оксидов соответствующих алкенов, окисление раствором KMnO4 при рН³7 с образованием гликолей (реакция Вагнера), окисление-расщепление раствором KMnO4 при рН<7 с образованием карбоновых кислот); в) полимеризации с образованием полимеров.
Перечисленные реакции присоединения, присущие алкенам, могут при определенных условиях протекать и в обратном направлении, что и служит основой для их получения. В связи с высокой реакционной способностью встречаются в составе нефти и природного газа в незначительных количествах. Применяются в производстве полимеров (полиэтилен, полипропилен и др.) и для получения других органических веществ и материалов.
Алкадиены (диеновые углеводороды, диены) – ненасыщенные углеводороды с двумя двойными связями в составе молекулы, общей формулой СnН2n-2. Строение двойных связей такое же, как и в алкенах. Простейшие представители – пропадиен, бутадиен, пентадиен и т. д. Алкадиены так же легко, как и алкены, вступают в реакции присоединения, полимеризации, обесцвечивают бромную воду и раствор перманганата калия. В зависимости от взаимного расположения двойных связей различают алкадиены с изолированными связями (>С=СН-(СН2)n-СН=С<); с куммулированными связями (>С=С=С<); с сопряженными двойными связями (>С=СН-СН=С<). Наибольшее значение имеют алкадиены с сопряженными двойными связями (бутадиен и его производные), которые, применяют в производстве каучуков.
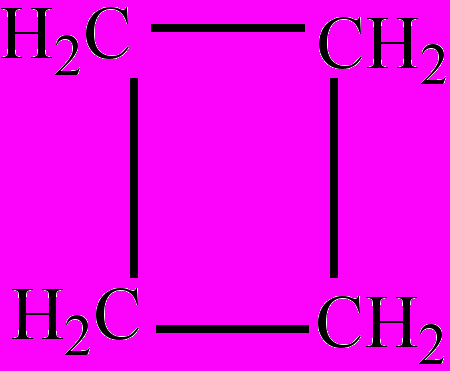 Циклобутан
ЦиклобутанЦиклоалканы (циклопарафины, цикланы) – насыщенные алициклические углеводороды общей формулы СnH2n, где n≥3, например, циклобутан. Плохо растворяются в воде, хорошо – в органических растворителях. Вступают в реакции присоединения, замещения, дециклизации, горения и т.д. Получают циклизацией дигалогенпроизводных алканов, гидрированием аренов. Циклогексан и циклопентан встречаются в составе нефти.
Циклоалкены (циклоолефины, циклены) – ненасыщенные алициклические углеводороды, содержащие одну или несколько двойных связей (С=С). В зависимости от числа двойных связей различают циклоалкены, циклоалкадиены, циклоалкатриены и т.д.
Наиболее устойчивыми являются соединения с 5-7 атомами углерода в цикле. По химическим свойствам сходны с алкенами. Вступают в реакции присоединения, полимеризации и т.д. Получают каталитическим дегидрированием циклоалканов при высокой температуре. Применяют в качестве растворителей, для получения полимеров и многочисленных органических соединений.
Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды гомологического ряда ацетилена, имеющие в составе молекулы одну тройную связь. Общая формула СnН2n-2. В молекулах алкинов электронные орбитали атомов углерода, соединенные тройной связью находятся в состоянии sp-гибридизации, а сама связь придает данному фрагменту молекулы линейное строение. Длина связи СºС равна 0,120 нм. Алкинам присущи изомерия углеродной цепи, изомерия положения тройной связи, межклассовая изомерия (изомерны алкадиенам). Названия алкинов образуются из названий соответствующих алканов с заменой суффикса –ан на -ин, например, этин, гептин и т.д.
Простейшие представители – ацетилен (этин), пропин, бутин и т. д. В связи с наличием в молекулах тройных связей вступают в реакции присоединения, протекают в две стадии. Так, при гидрировании алкинов в качестве конечного продукта получают алканы; галогенирование приводит к тетрагалогеналканам; гидрогалогенирование приводит к дигалогеналканам (протекает по правилу Марковникова); гидратация ацетилена дает ацетальдегид, при гидратации гомологов ацетилена образуются кетоны (реакция Кучерова). Реакции окисления могут протекать по-разному, в зависимости от окислителя. При горении в кислороде наблюдается полное окисление с образованием CO2 и H2O, при недостатке кислорода – сопровождается обильным выделением сажи (копоти). При окислении ацетилена раствором KMnO4 образуется щавелевая кислота; гомологи ацетилена в аналогичных условиях окисляются с расщеплением, образуя карбоновые кислоты. Реакции полимеризации для алкинов нехарактерны, а только ди- и тримеризация. Ацетилен при димеризации дает винилацетилен. Циклотримеризация алкинов приводит к образованию аренов, ацетилен превращается в бензол. Алкины, молекулы которых имеют концевую тройную связь (терминальные алкины), способны при определенных условиях образовывать соли – ацетилениды, например, ацетиленид натрия однозамещенный НСºС-Na, метилацетиленид меди СН3-СºС-Cu. Алкины получают из алканов и алкенов в результате реакций дегидрогенизации. Одним из способом получения алкинов является дегидрогалогенирование (отщепление атомов водорода и галогена) дигалогеналканов с помощью спиртового раствора щелочи. Ацетилен получают в больших количествах термическим разложением метана, а также из карбида кальция. Алкины находят широкое применение в органическом синтезе, ацетилен используется при резке и сварке металлов.
Арены (бензоидные углеводороды, углеводороды бензольного ряда) – углеводороды гомологического ряда бензола, характеризующиеся наличием бензольного кольца (ядра), в котором атомы углерода находятся в состоянии sp2-гибридизации. Общая формула бензола и его гомологов СnН2n-6 (n≥6). Названия аренов оканчиваются словом –бензол, перед которым записывают названия радикалов-заместителей. Если их несколько, то числами указывают их относительное расположение в бензольном ядре:

Для двух заместителей возможно три варианта их взаимного расположения в бензольном ядре: орто- (обозначается буквой о-), мета- (обозначается буквой м-), пара- (обозначается буквой п-):

Часто используются и тривиальные названия.
Для аренов характерны изомерия, связанная со строением радикала-заместителя; изомерия, обусловленная наличием разного числа заместителей различного строения; изомерия, вызванная положением двух заместителей относительно друг друга в ядре (орто-, мета-, пара-изомеры). Низшие арены – бесцветные жидкости с характерным запахом, легче воды и в ней не растворимы. Являются хорошими растворителями многих органических веществ. В молекулах гомологов бензола ярко выражено взаимное влияние бензольного ядра и радикала, находящегося в его боковой цепи, нарушается равномерность распределения электронной плотности в ядре (проявление мезомерного эффекта (М)). В зависимости от оказываемого мезомерного эффекта заместители делятся на две группы. Электронодонорные заместители (заместители 1-го рода) вызывают +М-эффект, повышая электронную плотность в сопряженной системе π-связей бензольного ядра, сосредотачивая ее при этом в орто- и пара-положениях:
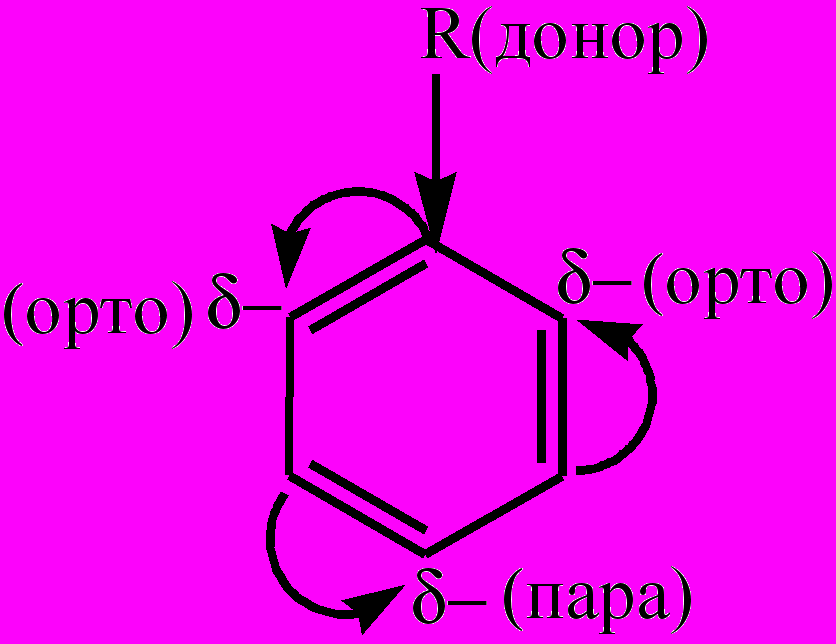 . К электронодонорным заместителям относятся алкилы, гидроксильная группа, аминогруппа, галогены, которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в орто- и пара-положения.
. К электронодонорным заместителям относятся алкилы, гидроксильная группа, аминогруппа, галогены, которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в орто- и пара-положения. Все заместители 1-го рода (кроме галогенов) повышают реакционную активность бензольного ядра и облегчают следующие реакции замещения. Электроноакцепторные заместители (заместители 2-го рода) вызывают -М-эффект, снижая в целом и электронную плотность в сопряженной системе π-связей бензольного ядра, и его реакционную способность в реакциях замещения. Однако в меньшей степени электронная плотность снижается в мета-положениях:
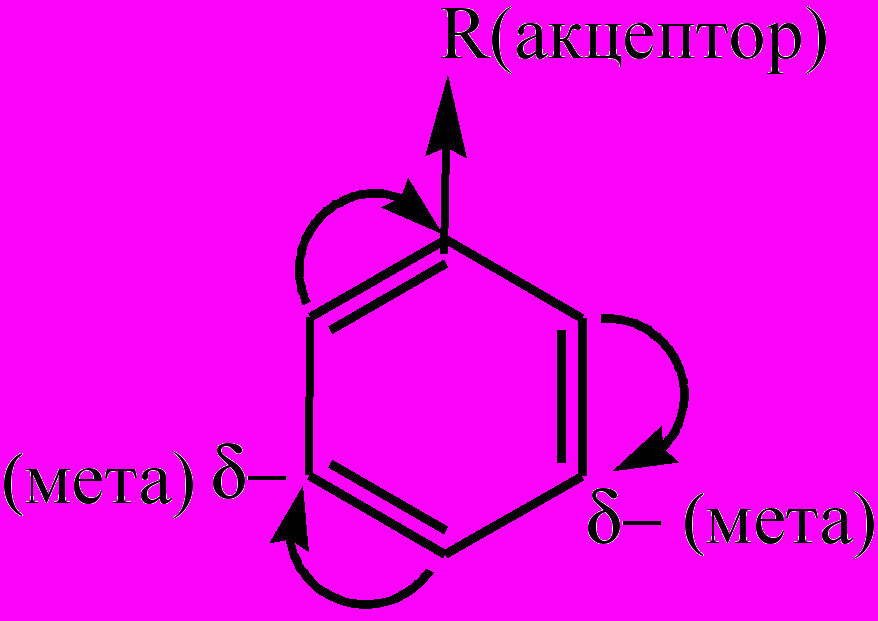 . К электроноакцеторным заместителям относятся альдегидная группа, карбоксильная группа, нитрогруппа, сульфогруппа (-SO3H, или -SO2ОH), которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в мета-положения.
. К электроноакцеторным заместителям относятся альдегидная группа, карбоксильная группа, нитрогруппа, сульфогруппа (-SO3H, или -SO2ОH), которые направляют новые заместители в реакциях замещения атомов водорода в бензольном ядре преимущественно в мета-положения. Несмотря на значительную ненасыщенность атомов углерода в бензольном кольце аренов не вступают в реакции присоединения, характерные для ненасыщенных соединений. Для гомологов бензола характерны реакции электрофильного замещения атомов водорода бензольного кольца, в том числе каталитическое галогенирование (при недостатке галогена получается смесь орто- и пара-изомеров, при избытке – трехзамещенные производные); нитрование (например, при нитровании толуола действием смеси концентрированных HNO3 и H2SO4 образуется тротил); гидрирование аренов в присутсвии катализаторов приводит к образованию циклоалканов. Из реакций аренов с участием боковой цепи следует отметить галогенирование и окисление. Алкильные радикалы производных бензола взаимодействуют с галогенами подобно алканам. Реакции протекают на свету, при этом замещаются (последовательно) те атомы водорода, которые связаны с атомами углерода бензольного кольца. Реакции окисления в боковой цепи протекают легче, чем окисление алканов, и приводят к образованию кислот. Так, при окислении толуола образуется бензойная кислота.
Простейшие представители аренов – бензол, метилбензол (толуол), диметилбензол (ксилол) и др. Получают арены в основном при коксовании каменного угля и ароматизацией нефтепродуктов. Арены находят применение в производстве красителей, лекарств, моющих средств, полимеров, взрывчатых веществ и др.
Опыт 1. Открытие углерода и водорода в составе органических веществ. Кусочек парафина величиной с горошину разотрите в ступке с равной по объему порцией порошка оксида меди. Для опыта лучше всего подойдет свежеполученный тонкодисперсный порошок оксида, полученный прокаливанием малахита.
Смесь поместите в пробирку, насыпьте поверх еще немного порошка CuO и укрепите пробирку почти горизонтально в штативе, чуть наклонив ее в сторону отверстия, у края которого поместите щепотку безводного сульфата меди. Закройте пробирку пробкой с газоотводной трубкой, конец которой опустите в стакан с известковой водой (рис. 40)
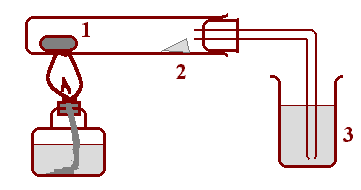
Рис. 40. Открытие водорода и углерода в органических соединениях.
1 – смесь CuO с анализируемым веществом; 2 – безводный CuSO4;
3 – стакан с известковой водой.
Нагрейте смесь в пробирке и наблюдайте образование капель жидкости на стенках пробирки, изменение цвета сульфата меди, выделение газа и помутнение известковой воды. Объясните эти явления, напишите соответствующие уравнения реакций, сделайте выводы.
Опыт 2. Определение галогенов пробой Бейльштейна. Медную проволочку прокалите в пламени горелки до прекращения окрашивания пламени. Концом проволоки (можно горячим) коснитесь анализируемого вещества (хлороформ, бромбензол, хлоруксусная кислота, иодоформ, полихлорвинил и т.д.) и внесите в бесцветное пламя (можно в фарфоровой чашечке зажечь немного этанола). Если анализируемое вещество содержит хлор или бром, то пламя окрашивается в красивый изумрудно-зеленый цвет, если иод – пламя приобретает зеленую окраску. Метод предложен в 1872 г. Ф. Бейльштейном (1838-1906).
Методика получения и демонстрирования
свойств углеводородов
С целью формирования понятий о свойствах углеводородов и других органических соединений удобно и методически правильно использовать единый подход при их объяснении. Это позволяет обобщать, систематизировать и осуществлять более прочное усвоение учащимися знаний о свойствах разных группах органических веществ. Последовательность постановки учебного эксперимента при изучении углеводородов может быть следующей. Одновременно с получением изучаемого вещества демонстрируются его физические свойства, отношение к окислителям (водный раствор KMnO4), взаимодействие с галогенами в водных растворах, проба на взрывоопасность и реакция горения. В целях большей безопасности в газоотводные трубки вставляются медные спирали. Отдельно ставится эксперимент по изучению особых свойств изучаемых веществ.
В школе, при изучении свойств углеводородов, более подробно рассматриваются свойства метана, этилена, ацетилена и бензола.
Учитель заранее готовит к уроку запас посуды и реактивов. Вследствие того, что метан, этилен и ацетилен являются газообразными веществами и опыты с ними проводятся в момент получения, времени для обсуждения каждого свойства после его демонстрации не остается. Поэтому необходимо подготовить учащихся к восприятию всех опытов, быстро провести эти опыты, затем записать соответствующие наблюдения, уравнения реакций и выводы. Такую подготовку учащихся целесообразно провести, зарисовав предварительно на доске таблицу в соответствии с названием того вещества, которое изучается на данном уроке.
Свойства метана (этилена, ацетилена, бензола)
| Свойства | Наблюдения | Уравнения реакции |
| Физические свойства | | |
| Взаимодействие с окислителями | | |
| Взаимодействие с галогенами (aq) | | |
| Взрывоопасность | | |
| Горение | | |
| Особые свойства | | |
Опыты 1-11. Получение и свойства метана. Свойства гомологов метана. а) В ступке перемешайте смесь обезвоженного ацетата натрия и натронной извести (смеси твердого гидроксида натрия с оксидом кальция) в объемном отношении 1:3. Вместо натронной извести с таким же успехом можно взять перемешанную в ступке смесь из равных объёмов обезвоженного ацетата натрия, гидроксида натрия и карбоната кальция (мела). Полученной смесью заполните большую сухую пробирку на 1/4 часть. Пробирку закройте пробкой с газоотводной трубкой с оттянутым концом, в которую поместите медную спираль и закрепите её в лапке штатива, с небольшим наклоном в сторону пробки (рис. 41).

Рис. 41. Установка для получения метана.
Н

 епосредственно перед получением метана приготовьте 4 стакана объемом 50 мл. Налейте в них, соответственно, 30 мл чистой воды, 30 мл разбавленного раствора перманганата калия (светло-розовый цвет), 30 мл иодной воды (соломенно-желтый цвет), 10 мл пенообразующего раствора (раствор мыла, шампуня, стирального порошка) для пробы на взрывоопасность.
епосредственно перед получением метана приготовьте 4 стакана объемом 50 мл. Налейте в них, соответственно, 30 мл чистой воды, 30 мл разбавленного раствора перманганата калия (светло-розовый цвет), 30 мл иодной воды (соломенно-желтый цвет), 10 мл пенообразующего раствора (раствор мыла, шампуня, стирального порошка) для пробы на взрывоопасность.б) Для начала реакции получения метана равномерно прогрейте всю пробирку, а затем сильно нагревайте ту ее часть, где находится основная часть смеси. Сначала из пробирки будет вытесняться воздух, затем начнёт выделяться метан:
CH3COONa + NaOH
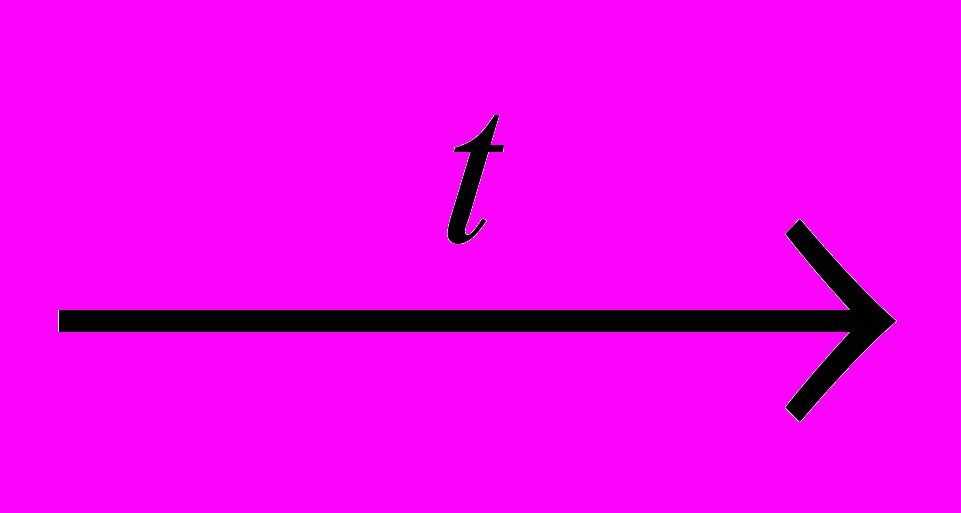 CH4↑ + Na2CO3.
CH4↑ + Na2CO3.Физические свойства метана. Пропускайте метан с помощью газоотводной трубки, через чистую воду. Наблюдаются пузырьки бесцветного газа – метана. Обычно метан собирают по способу вытеснения воды, что дает ученикам основание предположить, что этот газ нерастворим в воде. Учитель подтверждает это заключение. Доказать, что метан легче воздуха быстрее и нагляднее всего путем наполнения этим газом уравновешенной на весах вверх дном колбы, как это показано на рис. 42.
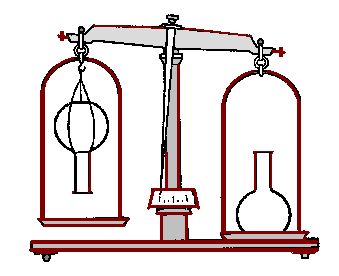
Рис. 42. Доказательство относительной легкости метана.
Отношение метана к водному раствору перманганата калия и иодной воде. Газоотводную трубку введите в стаканчик с раствором перманганата калия и пропускайте метан в течение нескольких секунд. Затем ту же процедуру проведите с иодной водой. Примечание. В связи с тем, что в числе побочных продуктов реакции получения метана могут быть непредельные углеводороды, не следует слишком долго проводить эти опыты. Растворы не изменяют своей окраски, что свидетельствует о том, что метан при комнатной температуре не взаимодействует с водным раствором перманганата калия и иодной водой.
Проба на взрывоопасность (проверка метана на чистоту). Опустите газоотводную трубку в пенообразующий раствор, так чтобы выделяющийся газ образовал пену. Когда стакан наполнится пеной, уберите газоотводную трубку и поднесите к пене горящую лучинку. Наблюдается воспламенение и быстрое сгорание метана. Если вспышка сопровождается резким звуком, то значит выделяющийся из прибора метан содержит примеси кислорода воздуха. В этом случае поджигать газ у газоотводной трубки опасно. Поэтому проверку на чистоту нужно повторить через некоторое время еще раз. Только чистый метан (как и водород), без примеси воздуха можно поджигать в ходе эксперимента.
Горение метана в воздухе. Подожгите метан у конца газоотводной трубки, он загорится несветящимся голубоватым пламенем:
СН4 + 2О2 → СО2 + 2Н2О.
Если внести в пламя метана фарфоровую чашку, то чёрного пятна от сажи на ней не образуется. Цвет пламени становится оранжевым из-за присутствия ионов натрия в стекле, из которого изготовлена трубка.
Горение метана в хлоре. Заранее в высоком прозрачном сосуде получите хлор. Отверстие сосуда закройте ватным тампоном, смоченным раствором тиосульфата натрия. Для демонстрации взаимодействия метана с хлором замените прямую газоотводную трубку трубкой с изогнутым концом, подожгите газ, и внесите в сосуд с хлором, как показано на рис. 43.

Рис. 43. Горение метана в хлоре.
Весь эксперимент при должной подготовке занимает около 5 минут. После чего проводится обсуждение результатов эксперимента, заполняется таблица и делаются выводы о соответствии свойств метана строению его молекулы.
Свойства гомологов метана. Налейте в пробирку 3 мл воды, добавьте 1 мл гексана (можно взять другой насыщенный углеводород или их смесь). Отметьте физические свойства вещества, его нерастворимость в воде и относительную плотность сравнительно с плотностью воды.
Добавьте в смесь несколько капель раствора перманганата калия и убедитесь в отсутствии взаимодействия. Прилейте к иодной воде (3 мл) немного гексана и встряхните пробирку, отметьте отсутствие взаимодействия углеводорода с галогеном. Однако вследствие лучшей растворимости иода в гексане происходит экстракция галогена в слой углеводорода.
Для демонстрирования горючести гексана налейте несколько капель его в фарфоровую чашку и подожгите длинной горящей лучинкой. Обсудите результаты эксперимента, напишите соответствующие уравнения реакций и сделайте выводы о свойствах гомологов метана, обусловленных строением молекул.
Опыты 12-22. Получение и свойства этилена. Свойства полиэтилена. В пробирку налейте 2–3 мл 96%-го этилового спирта и медленно добавьте 6–9 мл концентрированной серной кислоты. Осторожно перемешайте. Во избежание толчков при кипении туда же добавьте щепотку сухого сульфата кальция или сульфата бария для равномерного кипения. Смесь для получения этилена можно приготовить заранее и хранить длительное время. Пробирку закройте пробкой с газоотводной трубкой, как на рис. 44.
Перед получением этилена приготовьте в четырех стаканах растворы реактивов, как это было рекомендовано выше для демонстрации свойств метана.
Осторожно нагрейте сначала всю пробирку, а затем нагревайте ту ее часть, где находится верхняя граница жидкости. Температура должна быть выше 140 С.
H2SO4(конц.)
 С2Н5ОН Н2С=СН2 + H2O
С2Н5ОН Н2С=СН2 + H2O 140–180С этилен
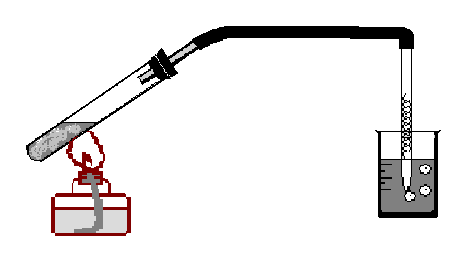
Рис. 44. Установка для получения этилена.
Физические свойства этилена. С помощью газоотводной трубки пропускайте этилен через чистую воду, опустив трубку до дна стакана. Наблюдаются пузырьки бесцветного газа – этилена. Этилен собирают по способу вытеснения воды, что дает ученикам основание предположить, что этот газ нерастворим в воде. Учитель подтверждает это заключение.
Отношение этилена к водному раствору перманганата калия и иодной воде. Газоотводную трубку опустите до дна стаканчика со светло-розовым раствором перманганата калия. Выделяющийся газ проходит через раствор перманганата калия и постепенно обесцвечивает его:
3Н2С=СН2 + 2KMnO4 + 4Н2O → 2KOH + 2MnO2 + 3CH2(OH)-CH2(OH).
Аналогичным образом пропускайте получаемый этилен через соломенно-желтый раствор иодной воды. Раствор обесцвечивается:
Н2С=СН2 + I2 С2Н4I2.
дииодэтан
Проба на взрывоопасность (проверка этилена на чистоту). Опустите газоотводную трубку в пенообразующий раствор, так чтобы выделяющийся газ образовал пену. Когда стакан наполнится пеной, уберите газоотводную трубку и поднесите к пене горящую лучинку. Наблюдается воспламенение и быстрое сгорание этилена. Если вспышка сопровождается резким звуком, то значит выделяющийся из прибора газ содержит примеси кислорода воздуха. В этом случае поджигать этилен у газоотводной трубки опасно. Поэтому проверку на чистоту нужно повторить через некоторое время еще раз. Только чистый этилен (как метан и водород), без примеси воздуха можно поджигать в ходе эксперимента.
Горение этилена в воздухе и хлоре. Для этих опытов поднесите пламя горящей лучинки к концу газоотводной трубки. Этилен загорается и горит светящимся пламенем. При внесении в пламя фарфоровой чашки на ней образуется чёрное пятно сажи, появление которой можно объяснить бóльшим содержанием (%) углерода в молекуле этилена и его неполным окислением:
Н2С=СН2 + О2 → СО2; С; Н2О
При внесении изогнутой трубки с горящим этиленом в цилиндр с хлором (см. опыты с метаном), он продолжает гореть с выделением еще большего количества копоти:
С2Н4 + Cl2 = 2С + 4HCl
Весь эксперимент занимает всего несколько минут. После чего проводится обсуждение результатов эксперимента, заполняется таблица и делаются выводы о соответствии свойств этилена строению его молекулы (в сопоставлении со строением и свойствами метана).
Свойства полиэтилена. Изделие из полиэтилена (пробку, трубочку, пленку и т.д.) осторожно нагрейте над пламенем горелки. Отметьте размягчение материала. Измените форму предмета и охладите его; сохраняется новая форма. Как называется это свойство полимера?
При дальнейшем нагревании (осторожно!) образец плавится; если его поджечь, он загорается и горит голубоватым пламенем без копоти (почему?). Наложите одну полиэтиленовую пленку на другую, накройте листом бумаги и проведите по контуру в виде буквы П разогретым примерно до 100 оС паяльником. Пленки склеиваются между собой, обрезав лишнее, получите полиэтиленовый мешочек.
Опыты 23-32. Получение и свойства ацетилена. Для получения ацетилена поместите 8-10 кусочков карбида кальция величиной с горошину в колбу унифицированного прибора. Подсоедините к тубусу гибкий шланг, на конце которого должна быть стеклянная трубка с оттянутым концом и с медной спиралью внутри, как на рис. 45. Прилейте из делительной воронки несколько миллилитров разбавленного (1:20) раствора серной кислоты, (реакция протекает при этом более спокойно):
CaC2 + 2Н2О → С2H2↑ + Са(OH)2.
Перед получением ацетилена приготовьте 4 стакана объемом 50 мл с растворами как для опытов с метаном и этиленом.
Физические свойства ацетилена. С помощью газоотводной трубки пропускайте выделяющийся газ через воду, опустив конец трубки до стакана. Наблюдаются пузырьки бесцветного газа – ацетилена. Ацетилен собирают по способу вытеснения воды, что дает ученикам основание предположить, что этот газ нерастворим или плохо растворим в воде. Учитель подтверждает это заключение.

Рис. 45. Установка для получения ацетилена.
Примечание. Ацетилен немного растворим в воде. Для подтверждения этого факта можно в стакан с водой, через которую пропускали ацетилен, добавить 1-2 капли иодной воды, которая обесцвечивается.
Отношение ацетилена к водному раствору перманганата калия и иодной воде. Выделяющийся газ пропустите последовательно через разбавленный раствор (розовый) перманганата калия, а затем через светло-желтый раствор иода:
НС≡СН + 4O → COOH-COOH (щавелевая кислота);
НС≡СН + 2I2 → С2Н2I4 (тетраиодэтан).
Наблюдается обесцвечивание растворов. Примечание. Реакции протекают относительно медленнее, чем в случае с этиленом, поэтому растворы веществ для опыта должны быть очень разбавлены, с едва заметной окраской.
Проба на взрывоопасность (проверка ацетилена на чистоту). Опустите газоотводную трубку в пенообразующий раствор, так чтобы выделяющийся газ образовывал пену. Когда стакан наполнится пеной, уберите газоотводную трубку и подожгите пену в стакане горящей лучинкой. Наблюдается воспламенение и быстрое сгорание ацетилена с выделением копоти.
Горение ацетилена в воздухе. Когда опыты сделаны, и ацетилен выделяется из прибора без примеси воздуха, поднесите пламя горящей лучинки к концу газоотводной трубки. Ацетилен загорается и горит светящимся коптящим пламенем. При внесении в пламя фарфоровой чашки на ней образуется чёрное пятно сажи, появление которого можно объяснить бóльшим содержанием (%) углерода в молекуле ацетилена и его неполным сгоранием.
НС≡СН + О2 → СО2; С; Н2О
Взаимодействие ацетилена с хлором. В высокий сосуд, заранее наполненный хлором (см. опыты с метаном), внесите ложечку для сжигания веществ с кусочком карбида кальция, смоченным разбавленным раствором серной кислоты (осторожно!). Выделяющийся ацетилен вспыхивает в атмосфере хлора и сгорает с выделением большого количества копоти:
С2Н2 + Cl2 2С + 2HCl.
Весь эксперимент занимает несколько минут. После чего проводится обсуждение результатов эксперимента, заполняется таблица и делаются выводы о соответствии свойств этилена строению его молекулы (в сопоставлении со строением и свойствами метана и этилена).
Опыты 33-41. Исследование свойств бензола. В отличие от рассмотренных выше представителей углеводородов, бензол – это жидкость, и он не требует опытов по его получению на уроке. Поэтому можно последовательно изучать его свойства, после каждого опыта проводить обсуждение, а затем записывать уравнение реакции.
Физические свойства бензола. В пробирку с 3–4 мл воды прилейте 1–2 мл бензола и перемешайте жидкости. Жидкости не смешиваются, следовательно бензол не растворяется в воде. Слой бензола собирается над поверхностью воды (видна граница раздела фаз), следовательно плотность бензола меньше единицы (0,874 при 20 ºС). Эту же пробирку опустите в чашку с охлаждающей смесью (например, смесь нитрата калия или мочевины с таящим льдом или снегом). Через некоторое время (2–3 минуты) выньте пробирки. Бензол затвердел, а вода осталась жидкой. Следовательно температура затвердевания бензола выше 0 ºС (+5,4 ºС). Затем эту же пробирку нагревайте (не сильно) в пламени горелки. Верхний слой (бензол) начнет кипеть, а нижний (вода) нет. Следовательно температура кипения бензола ниже 100 ºС (80,4 ºС).
Отношение бензола к раствору перманганата калия и иодной воде (или доказательство отсутствия у бензола реакции на непредельность). В пробирку налейте 1–2 мл бензола, а затем - немного раствора перманганата калия (светло-розовый). Смесь взболтайте. Обесцвечивания не происходит (даже при нагревании).
Аналогичным образом проведите опыт с иодной водой. Обесцвечивания также не происходит, но наблюдается явление экстракции (иод переходит в верхний слой бенозла и окрашивает его).
Горение бензола в воздухе. Опустите стеклянную палочку в склянку с бензолом, затем выньте ее и с каплей бензола внесите в пламя. Бензол воспламеняется и сгорает сильно коптящим пламенем. Появление копоти объясняется так же, как и в предыдущих опытах. Образование черного пятна сажи на фарфоровой чашке при внесении ее в пламя, объясняется большим содержанием (%) углерода в бензоле и его неполным сгоранием:.
С6Н6 + О2 → СО2; С; Н2О.
Нитрование бензола. В пробирку налейте 1 мл бензола и прилейте равный объем нитрующей смеси (смесь концентрированных серной и азотной кислот в объемном отношении 2:1). Нагрейте смесь до кипения, затем охладите, перелив ее в стаканчик (30–50 мл). В полученной смеси легко обнаружить нитробензол по запаху горького миндаля:.
H2SO4
С
 6Н6 + HONO2 С6Н5NО2 + Н2О.
6Н6 + HONO2 С6Н5NО2 + Н2О.Окисление гомологов бензола. Налейте в пробирку 2-3 мл разбавленного раствора перманганата калия, подкислите его 2-3 каплями разбавленной серной кослоты, прилейте к смеси около 1 мл толуола и хорошо встряхните. Нагрейте смесь и наблюдайте обесцвечивание раствора вследствие окисления толуола в бензойную кислоту:
С6Н5СН3 + 3О С6Н5СООН + H2O.
Аналогично проведите реакцию окисления ксилола; при этом образуется двухосновная фталевая кислота С6Н4(СООН)2.
Примечание. При изучении каждого последующего представителя углеводородов обсуждаются сходство и различие с ранее изученными веществами. Делается вывод о зависимости свойств от строения веществ. Осуществляя, таким образом, единый подход к изучению свойств углеводородов, учитель добивается более четкого осознания учениками особенностей разных групп углеводородов, и как следствие – более прочного закрепления материала в памяти учащихся.
Дополнительный эксперимент для выполнения на занятиях
химического кружка, при проведении элективных курсов или дома
Опыт 1. Состав природного или сжиженного газа. Поставьте на газовую плиту большую кастрюлю с холодной водой (3–5 л) и подожгите газ. Через некоторое время вы увидите, что на наружной холодной поверхности кастрюли появился капельки жидкости. Это вода. Откуда она появилась? Очевидно, что при горении газа выделяется оксид водорода. Значит, одним из компонентов природного газа является водород.
Ополосните стеклянную банку известковой водой, слейте ее избыток так, чтобы на стенках сосуда остались крупные капли раствора. Подержите банку над пламенем газовой горелки (берегитесь ожога!), и вы увидите, что капельки известковой воды помутнели. Это говорит о наличии диоксида углерода. Значит, вторым компонентом газа является углерод.
Кроме этого, в составе соединений, образующих природный газ, имеются в незначительных количествах азот, кислород, сера.
Опыт 2. Химическая связь между водородом и серой прочнее, чем между водородом и углеродом. Поместите в сосуд небольшой кусочек парафина величиной с пшеничное зерно и столько же серы. Смесь нагрейте. При этом выделяются сероводород (нюхать осторожно!) и свободный углерод.
Опыты 3-5. Свойства бензина. а) В пробирку с 2 мл воды добавьте каплю иодной настойки и равный объем бензина. Смесь хорошо встряхните. После расслоения жидкости возможны два варианта. Первый – окраска исчезла, следовательно, образец представляет собой крекинг-бензин и содержит в своем составе непредельные углеводороды. Второй – иод экстрагировался в верхнем бензиновом слое. Это значит, что у вас бензин прямой перегонки (не содержит непредельных соединений). Кроме того, вы убедились, что иод лучше растворяется в бензине, чем в воде.
б) Разотрите несколько семян подсолнечника или кусочек грецкого ореха с 2-3 мл бензина. Слейте прозрачную жидкость и одну каплю поместите на фильтровальную бумагу. После испарения бензина на бумаге остается жирное пятно. С помощью бензина на маслоэкстракционных заводах извлекают (экстрагируют) масло из семян масличных культур. Бензином очищают одежду от пятен жира. Несколько капель бензина налейте на дно сухой и чистой металлической консервной банки и подожгите длинной лучинкой. (Сосуд с бензином должен при этом стоять на несгораемой подставке.) Бензин очень легко воспламеняется и быстро сгорает без копоти.
Опыт 6. Возгонка нафталина. На дно стеклянной бутылки с широким горлом (из-под кетчупа) или другого аналогичного сосуда поместите нафталин. Затем опустите в бутылку сухую разветвленную веточку. Горлышко сосуда закройте кусочком ваты. Теперь поставьте бутылку на холодную песчаную баню и начните нагрев (опыт делать в вытяжном шкафу). При нагревании (50 ºС) происходит возгонка нафталина и его конденсация на холодных стенках и веточке в виде блестящих чешуек (когда возгонка начнется, прекратите нагрев). Обратите внимание, что возгонкой можно воспользоваться для очистки вещества. Сделайте предположение о типе кристаллической решетки нафталина.
Опыт 7. Определение количественных отношений в реакциях горения газообразных углеводородов в кислороде. Соберите в эвдиометре (рис. 46) кислород и один из газообразных углеводородов в различных объемных соотношениях.

Рис. 46. Эвдиометр.
Подожгите смесь, после установления исходной температуры отмечайте объем газа над жидкостью в эвдиометре и делайте соответствующие выводы в соответствии с законом объемных отношений Гей-Люссака.
Вопросы и задания
1. Выясните наличие природных источников углеводородов в вашем регионе. Какова их современная роль и перспектива использования в экономике региона?
2. Выясните, какой объем природного или сжиженного газа потребляет ваша семья в год. Вычислите объем кислорода, необходимого для сжигания этого количества газа и объем углекислого газа, выделяющегося при этом. Обсудите полученные результаты. Какое количество теплоты при этом образуется?
3. Если в вашем жилье используют другие энергоносители, например, электроэнергию, сделайте предположение, какой источник дешевле и экологически чище.
4. В автомобильном транспорте в качестве моторного топлива широко используется сжатая пропан-бутановая смесь в баллонах. Почему для этих целей не используется боле дешевый и доступный природный газ или метан?
5. Изучая физические свойства простейших предельных углеводородов, вы убедились, что они не обладают запахом. Почему же бытовой газ (природный или в баллонах) обладает запахом?
6. С увеличением числа атомов углерода в молекулах углеводородов, увеличивается число их изомеров. Например, для декана С10Н22 число возможных изомеров равно 75; для боле сложных соединений это число достигает сотен и тысяч. Как вы думаете, можно ли все эти изомеры получить практически?
7. Рассмотрите внимательно обычную зажигалку. Уясните для себя значение каждой его детали. Обратите внимание на принцип ее работы, строение пламени, возможность его регулирования. Напишите "Трактат о зажигалке". Кроме описания внешнего вида, укажите состав и свойства горючего и веществ, из которых сделаны детали, а также физические и химические процессы, протекающие при использовании современного огнива.
8. Могут ли существовать соединения состава: С15Н32; С20Н40; С30Н62; С100Н202? К какому классу соединений эти вещества относятся? Каковы их названия?

