V. свойства органических соединений
| Вид материала | Документы |
СодержаниеОпыты 1-3. Свойства глюкозы. R-СНО + 2Cu(OH) Опыты 20-24. Свойства целлюлозы. Вопросы и задания |
- Программа элективного курса по химии «строение и свойства кислородсодержащих органических, 667.3kb.
- Kirgizistan-tüRKİye manas üNİversitesi ders biLGİ formu, 147.19kb.
- Тематический план лекций модуля 1 с органической химии для студентов 2 курса фармацевтического, 25.24kb.
- Календарно-тематический план лекций по биоорганической химии 1 курс (2 семестр) специальность, 65.41kb.
- Лекция Классификация и изомерия органических соединений, 296.86kb.
- Тематический план лекций и самостоятельной работы по органической химии (осенний семестр), 91.46kb.
- 10 класс. Тема урока: «Причины многообразия органических соединений» Тип урока, 145.21kb.
- Дробот Светлана Сергеевна конспект, 69.15kb.
- Дробот Светлана Сергеевна конспект, 57.86kb.
- План лекций по биоорганической химии для студентов 1 курса медицинского факультета, 26.83kb.
5.7. Углеводы
Углеводы (сахара) – класс природных органических соединений, для которых была предложена общая формула Сm(H2O)n, послужившая основанием для их названия (углерод + вода). Все углеводы подразделяются на моносахариды, олигосахариды (к ним относятся дисахариды), и полисахариды. По строению и химическим свойствам углеводы относятся к соединениям, обладающими множественными функциями – альдегидо-спирты (альдозы), кетоноспирты (кетозы).
По числу атомов углерода в молекуле моносахарида различают триозы (3 атома углерода), тетрозы (4 атома углерода), пентозы (5 атомов углерода) и гексозы (6 атомов углерода). Оба признака можно сочетать в одном термине: альдогексоза, кетотетроза и т.д.
Являясь первичными продуктами фотосинтеза, углеводы входят в состав всех организмов; без этих веществ невозможна жизнь. Получают индивидуальные соединения выделением из природных объектов, а также гидролизом полисахаридов и дисахаридов. Важнейшие представители углеводов: рибоза, дезоксирибоза, глюкоза, фруктоза, сахароза, мальтоза, лактоза, гликоген, крахмал и целлюлоза широко применяются в пищевой, целлюлозно-бумажной, текстильной, химической промышленности и медицине.
Опыты 1-3. Свойства глюкозы. а) Рассмотрите образцы глюкозы, определите ее растворимость в воде и реакцию среды с помощью универсального индикатора. Опишите установленные физические свойства вещества. Отдельные физические константы найдите в справочнике.
б) Налейте в пробирку 3-4 мл раствора щелочи (10%), добавьте 1-2 мл раствора соли меди (II), взболтайте полученную взвесь гидроксида меди (щелочь в этом опыте должна быть в небольшом избытке) и добавьте 2-3 мл раствора глюкозы. Наблюдайте растворение осадка при перемешивании смеси с образованием темно-синего раствора глюконата меди, аналогичного глицерату меди.
в) Нагрейте раствор на медленном огне и наблюдайте изменение окраски в результате образования желтого осадка гидроксида меди (I), который затем разлагается до оксида меди (I):
R-СНО + 2Cu(OH)2
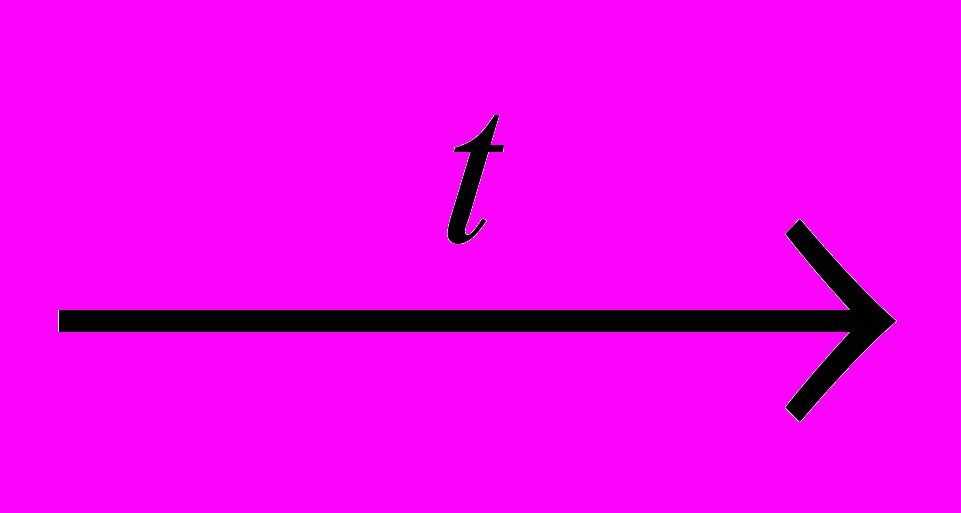 R-СООН + H2O + 2CuОН ;
R-СООН + H2O + 2CuОН ;2CuОН
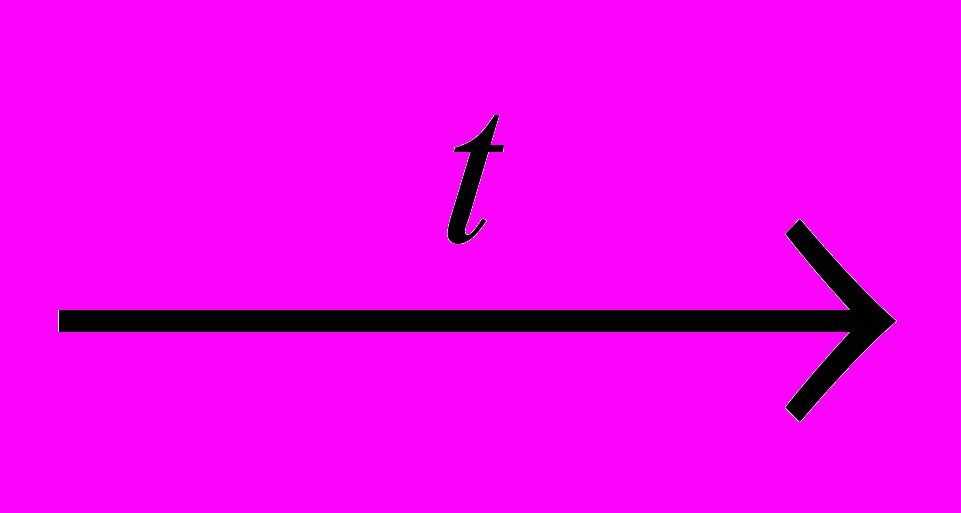 Cu2O + H2O.
Cu2O + H2O.Опишите ваши наблюдения и сделайте выводы о наличии в молекуле глюкозы определенных функциональных групп и о принадлежности данного соединения к определенным классам органических веществ.
г) Наличие альдегидной группы в молекуле глюкозы подтвердите реакцией серебряного зеркала (см. раздел 5.5. Альдегиды. Карбоновые кислоты).
Опыты 4-12. Свойства сахарозы. а) Рассмотрите образцы сахарозы, определите ее растворимость в воде и реакцию среды с помощью универсального индикатора. Опишите установленные вами физические свойства вещества. Отдельные физические константы найдите в справочнике.
б) Смочите сахарный песок небольшим количеством воды и нагрейте в чистой фарфоровой чашечке на песчаной бане, помешивая ложечкой. Как только весь сахар расплавится, вылейте расплав отдельными каплями на металлический противень или в плоскую фарфоровую тарелку. Остывшие капли легко отделяются, и, если вы предварительно добавите в сахар каплю мятного масла или фруктовой эссенции, не отличаются по вкусу от настоящих леденцов. Если вместо воды взять молоко, то получите сливочную карамель.
в) Наберите немного сахарозы в пробирку, укрепите ее вертикально в штативе и нагревайте. Наблюдайте последовательные изменения вещества до полного его обугливания. Поднесите к выделяющимся из пробирки газообразным продуктам разложения горящую лучинку. Опишите ваши наблюдения.
г) Измельчите в ступке около 10 г сахара, слегка смочите его водой и поместите в стакан объемом 100 мл. Тонкой струей, чтобы сахар лучше пропитался, прилейте в стакан равную по объему порцию концентрированной серной кислоты. Через некоторое время сахароза начнет обугливаться. Процесс сопровождается вспучиванием (выделяются CO2, SO2); вся масса чернеет.
д) С помощью свежеприготовленного гидроксида меди (см. "Свойства глюкозы") проверьте наличие гидроксильных и альдегидных групп в молекуле сахарозы. Отсутствие альдегидной группы в составе сахарозы докажите дополнительно отрицательным эффектом посредством реакции серебряного зеркала.
е) Проведите гидролиз сахарозы. Для этого растворите около 5 г вещества в небольшом объеме воды. К раствору прибавьте несколько капель соляной кислоты. Нагрейте смесь и кипятите на слабом огне 1-2 минуты. После охлаждения нейтрализуйте раствор и проведите с отдельными его частями реакции с гидроксидом меди и серебряного зеркала. Опишите ваши наблюдения и сделайте выводы о взаимообусловленности строения и свойств вещества.
Опыты 13-19. Получение и свойства крахмала. Примечания. Приготовление крахмальных растворов описано ниже (см. Раздел 6.1. Растворы). Получение крахмала можно выполнить на занятиях кружка или дома.
а) Около одного килограмма клубней картофеля очистите от кожуры и протрите на мелкой терке. Полученную массу залейте пятикратным объемом холодной воды и хорошо перемешайте, перетирая при этом руками картофельную массу до полного вымывания крахмала в раствор. Взвесь процедите через сито или капроновую сетку. Массу на сите еще несколько раз промойте водой, крахмал проходит через сито. Полученную взвесь крахмала в воде оставьте отстаиваться в течение некоторого времени, затем воду слейте. Если крахмал окажется не вполне белым и чистым, то вновь его залейте пятикратным объемом холодной воды, хорошо перемешайте, дайте отстояться и вновь слейте воду. Крахмал оседает плотным слоем на дне сосуда. Соберите его и поместите на клеёнке рыхлым тонким слоем для просушки. После высыхания крахмала взвесьте его, пересыпьте в чистую посуду и определите выход продукта из килограмма картофеля.
б) Рассмотрите образец картофельного крахмала и опишите его внешние признаки.
в) Налейте в пробирку 2 мл воды, насыпьте щепотку крахмала и хорошо перемешайте. Растворяется ли при этом крахмал? Полученную взвесь вылейте в кипящую воду (50 мл) и, помешивая ложечкой, прокипятите еще минуту. Образовался коллоидный раствор крахмала. (Если крахмала взять побольше – получится крахмальный клейстер.) Проверьте в отдельной пробе, происходит ли взаимодействие полученного раствора крахмала в растворе с иодом.
г) Налейте в пробирку 2 мл раствора крахмала, добавьте 2 капли раствора соляной кислоты и прокипятите при слабом нагревании 3-4 минуты. После этого с каплей раствора проделайте пробу на иод. Если раствор не посинел, значит, гидролиз крахмала прошел до конца. Для проверки наличия глюкозы, образовавшейся в результате гидролиза крахмала, проведите с раствором характерные реакции.
д) Гидролиз крахмала происходит и под действием ферментов амилазы. Смешайте в пробирке 2 мл раствора крахмала с равным количеством слюны и нагрейте минуту, опустив в теплую (около 40 оС) воду. Проверьте с помощью иодной воды, завершился ли гидролиз крахмала, и проделайте реакции, характерные для глюкозы. Сделайте выводы о скорости и условиях ферментативного катализа по сравнению с кислотным.
е) Добавьте несколько капель иодной настойки к 10 мл воды (слабо-желтый раствор), и вы получите индикатор для обнаружения крахмала. Подействуйте этим раствором на крахмальный раствор и крахмалосодержащие продукты (берите минимальные порции) – хлеб, муку, плоды, сырые и вареные овощи и др. Определите наличие крахмала в различных сортах бумаги, детской присыпке, манной каше и др. Там, где появляется синее окрашивание, присутствует крахмал.
ж) Налейте в пробирку 3 мл воды и добавьте по капле иодной воды и крахмального раствора. Отметьте окраску смеси. Осторожно, не доводя до кипения, нагрейте смесь, а затем вновь охладите ее до комнатной температуры. Как изменяется окраска при нагревании и охлаждении. Предложите свою гипотезу для объяснения явления.
з) Опишите ваши наблюдения всех опытов и сделайте выводы о соответствии свойств вещества его строению.
Опыты 20-24. Свойства целлюлозы. а) Рассмотрите образцы хлопковой ваты и фильтровальной бумаги, состоящие в основном из целлюлозы. Определите их растворимость в воде и органических растворителях. Опишите физические свойства целлюлозы.
б) Подожгите небольшой образец ваты или фильтровальной бумаги, обратите внимание на характер горения и запах.
в) Немного ваты или фильтровальной бумаги поместите в пробирку, горизонтально укрепите ее в штативе и нагрейте. Наблюдайте изменение окраски вещества и выделение газообразных веществ в результате разложения вещества. Поднесите к отверстию пробирки горящую лучинку. Что наблюдаете?
г) В продолжение опытов проведите гидролиз клетчатки. Для этого кусочки фильтровальной бумаги, немного ваты или древесных опилок залейте раствором серной кислоты (1:10) объемом 50 мл и кипятите при слабом нагревании (лучше использовать водяную баню) около 10 мин. При упаривании раствора добавляйте небольшими порциями горячую воду. После остывания слейте жидкость и нейтрализуйте содой, мелом или щелочью. В полученном растворе определите наличие глюкозы, проделав характерные реакции.
д) В 50 мл горячего раствора, представляющего смесь концентриро-ванных азотной и серной кислот в отношении 1:2, внесите с помощью стеклянной палочки комочек распушенной ваты (проследите, чтобы вата была не синтетическая, а хлопковая) и оставьте на 5–10 минут. Продукт реакции (нитроклетчатка) выньте палочкой, промойте тщательно водой под краном, избегая слипания волокна в плотный комочек, отожмите и высушите на солнце. Во время высыхания полученные комочки препарата нужно распушить. После полного высыхания проверьте характер горения нитроклетчатки. Для этого немного вещества поместите на асбестовую сетку или на жесть от разрезанной консервной банки и подожгите лучинкой. Для сравнения рядом подожгите кусочек исходной ваты.
е) Опишите наблюдения всех опытов, запишите, где возможно, уравнения реакций и сделайте сравнительный анализ свойств углеводов различного строения. Итоги всех экспериментов и сравнительного анализа свойств углеводов оформите в виде таблицы.
Вопросы и задания
1. Некоторые опыты с сахаром можно с успехом повторить (получение леденцов и карамели) или выполнить дома. 1–2 г сахара поместите в небольшую склянку и осторожно нагрейте на песочной бане. Песочную баню легко сделать из сковородки или широкой консервной банки, насыпав в них промытый и высушенный песок (впрочем, в домашних условиях вместо песка можно использовать сухую поваренную соль). Сахар плавится и приобретает желтовато коричневую окраску. Продолжайте нагрев; расплав чернеет и обугливается. После того как он остынет, добавьте несколько капель разбавленного раствора чернил. Наблюдается обесцвечивание, вследствие адсорбции красящего вещества чернил углем.
К кусочку сахара-рафинада поднесите горящую спичку. Сахар плавится, но не загорается. Если же на сахар насыпать немного пепла сожженного лаврового листа, то попытка поджечь сахар увенчается успехом. Вещества, входящие в состав пепла являются катализаторами реакции полного окисления углеводов.
В чистую склянку насыпьте (до 1/3 объема) сахарного песку, добавьте щепотку лимонной кислоты и немного воды. Нагрейте смесь на песочной бане (не допускать кипения) до полного растворения вещества. Если сироп получится жидким, добавьте еще немного сахара и оставьте на бане 2–3 минуты. За это время произойдет реакция гидролиза (образуются глюкоза и фруктоза), в результате которой вы получите искусственный мёд.
Опишите ваши эксперименты с сахаром с точки зрения его химических свойств; составьте соответствующие уравнения реакций.
2. Продумайте перечень опытов, которые можно выполнить в домашних условиях с другими углеводами. Проделайте эти опыты, опишите их и сделайте выводы о соответствии свойств веществ их строению.
3. Выделите из схемы (см. Раздел 5.2. Углеводороды), отражающей генетические связи между классами органических веществ, те классы соединений, которые вы изучили к данному моменту. Составьте цепочки химических превращений этих веществ и запишите примеры уравнений соответствующих реакций.
