V. свойства органических соединений
| Вид материала | Документы |
Содержание5.9. Аминокислоты. Белки Опыт 1. Свойства аминокислот. Опыты 2-3. Определение азота и серы в составе аминокислот и белков. Опыты 4-10. Свойства белков. Вопросы и задания |
- Программа элективного курса по химии «строение и свойства кислородсодержащих органических, 667.3kb.
- Kirgizistan-tüRKİye manas üNİversitesi ders biLGİ formu, 147.19kb.
- Тематический план лекций модуля 1 с органической химии для студентов 2 курса фармацевтического, 25.24kb.
- Календарно-тематический план лекций по биоорганической химии 1 курс (2 семестр) специальность, 65.41kb.
- Лекция Классификация и изомерия органических соединений, 296.86kb.
- Тематический план лекций и самостоятельной работы по органической химии (осенний семестр), 91.46kb.
- 10 класс. Тема урока: «Причины многообразия органических соединений» Тип урока, 145.21kb.
- Дробот Светлана Сергеевна конспект, 69.15kb.
- Дробот Светлана Сергеевна конспект, 57.86kb.
- План лекций по биоорганической химии для студентов 1 курса медицинского факультета, 26.83kb.
5.9. Аминокислоты. Белки
Аминокислоты (аминокарбоновые кислоты) – органические соединения, содержащие в составе молекул одновременно аминогруппы и карбоксильные группы, связанные с определенным радикалом. В зависимости от строения радикала аминокислоты можно отнести к алифатическим, ароматическим или гетероциклическим соединениям.
По взаимному положению карбоксильной и аминогруппы классифицируют на α-, β-, γ-, δ-, ε-, ζ-аминокислоты (альфа-, бета-, гамма-, дельта,- эпсилон-, дзета-аминокислоты) и т.д. Строчными буквами греческого алфавита обозначают положение аминогруппы в углеродной цепи, начиная с атома углерода, связанного с карбоксильной группой. Название аминокислоты составляется из названия соответствующей карбоновой кислоты с добавлением слова –амино, перед которым указывается буква греческого алфавита:
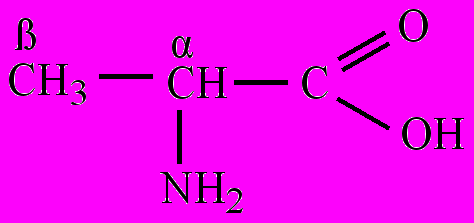
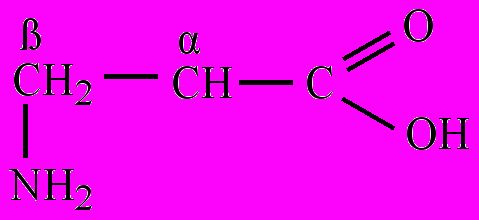
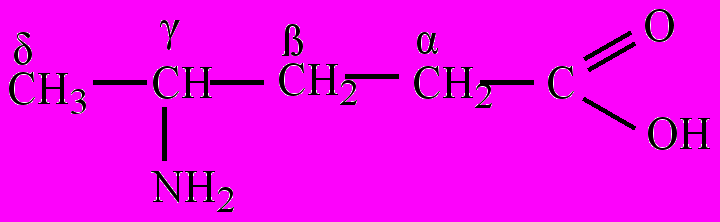
α-Аминопропионовая β-Аминопропионовая γ-Аминопентановая
кислота кислота кислота
По систематической номенклатуре положение аминогруппы обозначают числами, нумеруя атомы углерода в углеродной цепи, начиная с атома карбоксильной группы:


По числу функциональных групп аминокислоты подразделяют на моноаминомонокарбоновые кислоты:
 , например, аминоуксусная кислота; моноаминодикарбоновые кислоты:
, например, аминоуксусная кислота; моноаминодикарбоновые кислоты:  , например, α-аминоянтарная кислота; диаминомонокарбоновые кислоты:
, например, α-аминоянтарная кислота; диаминомонокарбоновые кислоты:  , например, 2,6-диаминогексановая кислота.
, например, 2,6-диаминогексановая кислота. Многие аминокислоты имеют и тривиальные названия. Для амнокислот характерны различные виды изомерии, в том числе: изомерия углеродного скелета (радикала), изомерия положения функциональных групп, межклассовая изомерия с нитропроизводными алканов, оптическая изомерия и др.
Большинство аминокислот – бесцветные кристаллические вещества, плавятся при 230-300 оС с разложением. Многие имеют сладкий вкус. Аминокислоты – хорошо растворимы в воде диссоциируют в водном растворе при определенном значении рН с образованием биполярного иона.
Как кислоты аминокислоты реагируют со щелочами, спиртами и т. д., а как основания (амины) аминокислоты реагируют с кислотами, образуя соли. Таким образом, аминокислоты – это органические амфолиты. Важнейшее свойство аминокислот – взаимодействие их между собой с образованием пептидов. Наибольшее значение имеют α-аминокислоты – представители аминокислот, в молекулах которых аминогруппа соединена с α-углеродным атомом:
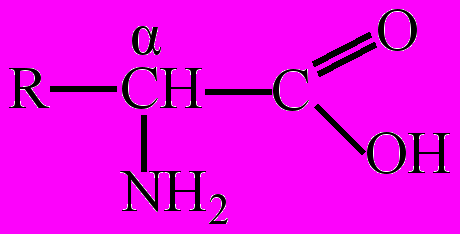 . В качестве радикала (R) могут быть: атом водорода (глицин), метил (α-аланин) и более сложные структуры.
. В качестве радикала (R) могут быть: атом водорода (глицин), метил (α-аланин) и более сложные структуры. Выделение α-аминокислот в особую группу из общего числа аминокислот связано с тем, что около 20 из них (по некоторым данным до 25) входят в состав белков, ферментов и других физиологически активных соединений, а также встречаются в свободном виде в клетках и тканях всех организмов. Для этих α-аминокислот (их называют еще протеиногенными) применяют, как правило, тривиальные названия.
Физические и химические свойства этих соединений аналогичны общим свойствам аминокислот. Важнейшее свойство α-аминокислот – способность соединятся между собой посредством пептидной связи с образованием пептидов (дипетидов, трипептидов, полипептидов), к которым и относятся соединения, играющие столь важную роль в живой природе.
Протеиногенные аминокислоты делятся на заменимые, которые могут синтезироваться в организме человека и животных (α-аланин, аспарагиновая кислота, аспарагин, гистидин, глицин, глутаминовая кислота, глутамин, пролин, серин, тирозин) и незаменимые, которые не могут синтезироваться в организме животных и человека, а должны поступать в организм в составе белков пищи (аргинин, валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин, цистеин). Важнейшими способами получения являются гидролиз белков (БЕЛОК + nH2O
 СМЕСЬ АМИНОКИСЛОТ), а также аммонолиз α-галогенкарбоновых кислот:
СМЕСЬ АМИНОКИСЛОТ), а также аммонолиз α-галогенкарбоновых кислот:
В промышленности для синтеза α-аминокислот применяются методы микробиотехнологии. Используют в качестве пищевых и кормовых добавок, для синтеза пептидов и других соединений, в составе лекарственных средств и т.д.
Белки – природные органические высокомолекулярные биополимеры, (полипептиды), макромолекулы которых состоят из остатков α-аминокислот, соединенных между собой пептидными связями (-СО-NH-). Условно к белкам относят полипептиды, содержащие в полипептидной цепи более 50 остатков α-аминокислот и имеющие молярную массу от 5000 до нескольких миллионов. В живой природе белки играют важнейшую роль, как в образовании структуры организмов, так и в их жизнедеятельности. Белковую природу имеют ферменты и гормоны. В состав белков входит около 53% углерода, 23% кислорода, 16% азота, 7% водорода, 1% серы.
Белки всех растений, животных и человека образованы всего двадцатью α-аминокислотами, которые соединяясь и комбинируясь между собой в различных сочетаниях обеспечивают все многообразие животного и растительного мира.
Выделяют четыре уровня организации структуры белковых макромолекул. Первичная структура белка определяется последователь-ностью соединения остатков α-аминокислот в полипептидной цепи, причем все цепи на одном конце содержат аминогруппу (N-конец), а на другом конце – карбоксильную группу (С-конец).
Вторичная структура белка соответствует закручиванию полипептидной цепи некоторых белков в виде спирали, которое возникает и поддерживается за счет водородных связей между атомами водорода аминогрупп одних остатков аминокислот и атомами кислорода карбонильных групп других остатков аминокислот.
Третичная структура белка возникает в результате строго определенной укладки спирали белка в пространстве, с образованием специфической трехмерной конфигурации. В образовании третичной структуры ведущую роль играют связи между атомами серы (дисульфидные мостики –S-S- между остатками цистеина); между карбоксильными группами и аминогруппами (ионные взаимодействия); а также за счет водородных связей и гидрофобных взаимодействий. Третичная структура белка в основном определяет специфическую активность белковой молекулы.
Выделяют также четвертичную структуру белка, когда несколько макромолекул белка на уровне третичной структуры (белковые субъединицы) объединяются между собой в ассоциаты теми же видами связями, что и при образовании третичной структуры, в еще более сложные ассоциации, например, гемоглобин – железосодержащий комплекс, состоящий из четырех макромолекул (субъединиц) белка. При нарушении структуры (денатурация белков) белки не могут уже выполнять жизненные функции.
По составу белки разделяют на простые (протеины) и сложные (протеиды). По форме некоторые белки напоминают клубок, их называют глобулярными (например, ферменты); макромолекулы других вытянуты в виде волокон, такие белки называют фибриллярными (из них построены соединительные ткани организма, белки волос и др.). При обычных условиях одни белки могут быть жидкими, другие – твердыми. Глобулярные белки растворимы в воде или образуют коллоидные растворы. Фибриллярные белки – в воде нерастворимы.
Белки не имеют точек плавления, так как при нагревании они сворачиваются (разрушается вторичная и третичная структуры) и разлагаются. Как и аминокислоты, белки обладают амфотерными свойствами.
Важнейшим свойством белков является их гидролиз – разрушение первичной структуры в результате действия ферментов, растворов кислот или щелочей с образованием полипетидов более простого состава вплоть до свободных α-аминокислот. Под действием этанола, ацетона, солей щелочных металлов и т.д. белки обратимо осаждаются (высаливаются) из водных растворов. При добавлении избытка воды к осадкам белка, они вновь могут переходить в раствор. Под действием солей тяжелых металлов (Hg2+, Cu2+, Pb2+ и др.), концентрированных кислот и щелочей белки осаждаются необратимо (происходит денатурация).
Качественными реакциями на белки являются биуретовая, ксантопротеиновая и др. реакции.
Опыт 1. Свойства аминокислот. Рассмотрите имеющихся в лаборатории образцы α-аминокислот; проверьте их растворимость в воде и органических растворителях. Установите с помощью универсального индикатора среду водных растворов и обсудите соответствие результатов опыта строению аминокислот. Опишите ваши наблюдения.
Опыты 2-3. Определение азота и серы в составе аминокислот и белков. а) Поместите в пробирку немного α-аминокислоты или белка куриного яйца, добавьте избыток концентрированного раствора гидроксида натрия, укрепите пробирку вертикально в штативе и нагревайте (осторожно!) при слабом кипении 1-2 минуты. Внесите в пары влажную красную лакмусовую бумажку; вследствие выделения аммиака, она синеет. б) Охладите смесь и добавьте в пробирку несколько капель раствора соли свинца (II); при наличии серы в составе α-аминокислоты или белка наблюдается выпадение в осадок сульфида свинца черного цвета.
Опыты 4-10. Свойства белков. а) Размешайте ложку белка куриного яйца в 100 мл воды. Рассмотрите полученный коллоидный раствор белка. Направьте на сосуд с раствором белка луч световой "лазерной" указки или детской игрушки и наблюдайте образование световой "дорожки" в растворе. Проверьте, дают ли подобный эффект Тиндаля бесцветные и окрашенные истинные растворы.
б) Наберите в пять пробирок по 2-3 мл раствора белка. Раствор в первой пробирке нагрейте до кипения. Наблюдайте свертывание (осаждение) белка. Слейте жидкость с осадка и добавьте к нему воды. Растворяется ли осажденный кипячением белок?
в) К раствору белка во второй пробирке добавьте несколько капель формалина.
г) В третью пробирку добавьте раствор соли свинца, меди или другого тяжелого металла. Опишите ваши наблюдения и сделайте выводы о воздействии добавляемых веществ на белки.
д) В четвертую пробирку прилейте 1 мл концентрированной азотной кислоты и слегка нагрейте. Белок свертывается и окрашивается в желтый цвет. Эта качественная реакция на белок называется ксантопротеиновой. Аналогичная реакция протекает, если белую шерстяную нить опустить в раствор азотной кислоты. Проверьте, дает ли хлопчатобумажная нить желтое окрашивание с азотной кислотой.
е) В пятую пробирку с раствором белка прилейте немного раствора щелочи, перемешайте смесь и добавьте несколько капель раствора медного купороса. Вследствие другой качественной цветной реакции (биуретовой) на белок жидкость окрашивается в фиолетовый или красно-фиолетовый цвет.
ж) Внесите в пламя горелки птичье перо или шерстяную нить. Обратите внимание на характер горения, на вид обуглившегося остатка и на запах при горении белковых веществ.
Вопросы и задания
1. Для косвенного доказательства содержания белка в мясе проведите следующий эксперимент. Поместите в пробирку 2-3 г мясного (без жира) фарша, закрепите пробирку вертикально с небольшим наклоном в штативе и нагрейте. Подержите (пинцет) над парами продуктов разложения мяса влажную фиолетовую лакмусовую бумажку. Через некоторое время она окрасится в синий цвет. Объясните сущность эксперимента.
2. Чтобы получить вкусный бульон при варке супа, повара обычно добавляют соль в конце приготовления блюда. Но чтобы получить сочное отварное мясо, его кладут в холодную подсоленную воду, и только затем приступают к варке. Как объяснить эти тонкости кухонного мастерства с точки зрения химии?
3. Немного мясного фарша (10-15 г) без жира поместите в колбу и залейте холодной водой и оставьте на 40-50 минут. Слейте (декантируйте) прозрачную жидкость с фарша в другую колбу и нагрейте. Наблюдайте за ходом эксперимента и отметьте момент появления хлопьев в растворе. Выскажите предположение о природе этих хлопьев. Может быть этот опыт поможет вам точнее ответить на предыдущий вопрос?
4. По известному старому способу определения свежести куриных яиц нужно растворить в воде объемом 0,5 л поваренную соль массой 50 г и опустить в раствор яйцо. Если оно погрузится на дно, то яйцо свежее. Когда яйцо плавает в толще раствора – оно сомнительной свежести. Если же яйцо всплывет, и часть его покажется над раствором, то оно "старше" двух месяцев. На чем, по вашему мнению, основан данный способ определения свежести яиц?
5. Найдите по справочнику данные о содержании белков в различных пищевых продуктах и подготовьте краткое сообщение на эту тему. Ответьте также на вопрос: может ли человек без вреда для здоровья отказаться от мясной пищи и полностью перейти на вегетарианский способ питания?.
6. Вновь выделите из схемы (см. Раздел 5.2. Углеводороды), отражающей генетические связи между классами органических веществ, те классы соединений, которые вы изучили к данному моменту. Составьте цепочки химических превращений этих веществ и запишите примеры уравнений соответствующих реакций.
