V. свойства органических соединений
| Вид материала | Документы |
- Программа элективного курса по химии «строение и свойства кислородсодержащих органических, 667.3kb.
- Kirgizistan-tüRKİye manas üNİversitesi ders biLGİ formu, 147.19kb.
- Тематический план лекций модуля 1 с органической химии для студентов 2 курса фармацевтического, 25.24kb.
- Календарно-тематический план лекций по биоорганической химии 1 курс (2 семестр) специальность, 65.41kb.
- Лекция Классификация и изомерия органических соединений, 296.86kb.
- Тематический план лекций и самостоятельной работы по органической химии (осенний семестр), 91.46kb.
- 10 класс. Тема урока: «Причины многообразия органических соединений» Тип урока, 145.21kb.
- Дробот Светлана Сергеевна конспект, 69.15kb.
- Дробот Светлана Сергеевна конспект, 57.86kb.
- План лекций по биоорганической химии для студентов 1 курса медицинского факультета, 26.83kb.
5.4. Фенолы
Фенолы – ароматические соединения, содержащие в бензольном ядре одну или несколько гидроксигрупп. В соответствии с числом гидроксигрупп различают одно,- двух-, трехатомные фенолы. Кроме гидроксигрупп в бензольном кольце могут быть и другие заместители:
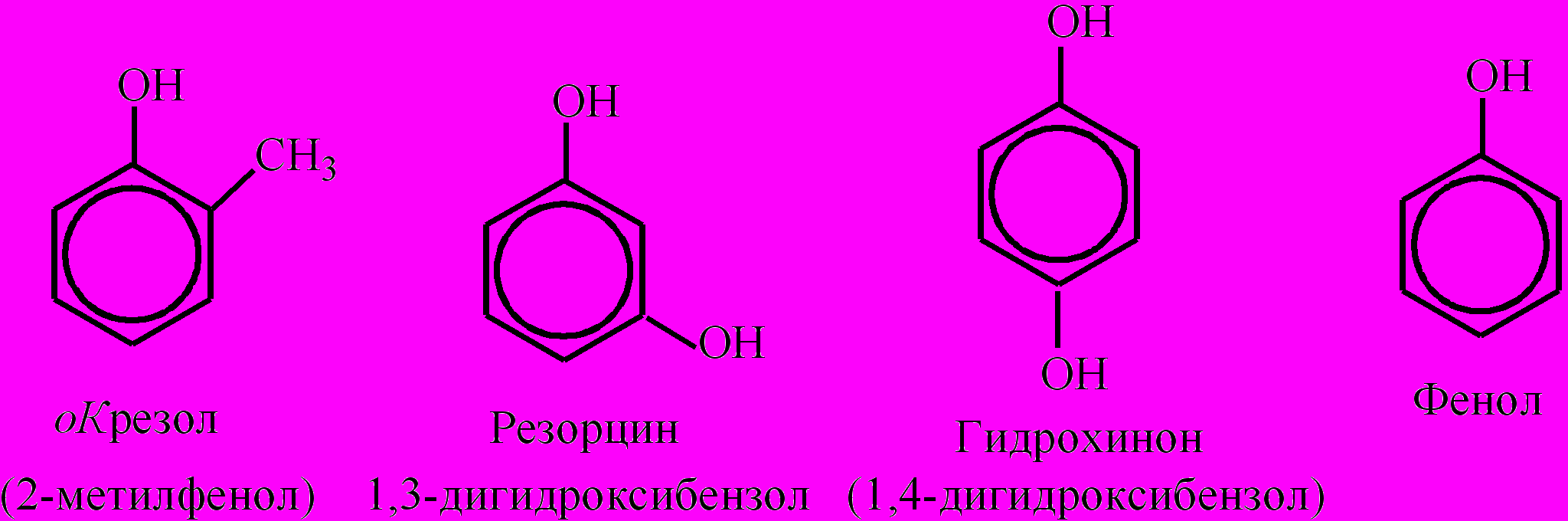
Фенолы обладают слабокислотными свойствами, которые выражаются в способности образовывать феноляты при взаимодействии с щелочами. Простейшим представителем является фенол (карболовая кислота, гидроксибензол) – бесцветное кристаллическое вещество с сильным неприятным характерным запахом, т. пл. 40,8 оС, т. кип. 181,84 оС. На воздухе кристаллы фенола вследствие окисления розовеют. На основе химического эксперимента очень важно показать учащимся, что в отличие от спиртов, гидроксигруппа фенола под влиянием бензольного ядра обладает кислотными свойствами, – реагирует не только с активными металлами, но и с растворами щелочей, образуя феноляты. С другой стороны, гидроксигруппа усиливает реакционную активность бензольного ядра, что проявляется в способности фенола реагировать с бромной водой при обычных условиях (реакция замещения). Внимание! Опыты с фенолом проводит только учитель с соблюдением всех правил техники безопасности.
Опыт 1. Физические свойства фенола. Наберите в пробирку (осторожно, не брать руками, работать в перчатках!) несколько кристалликов фенола. Одновременно установите его внешние признаки. Добавьте в пробирку немного (3-4 мл) воды и хорошо встряхните содержимое. После того, как взвесь отстоится, обратите внимание на ее расслоение: внизу – слой раствора воды в феноле, сверху – слой водного раствора фенола. Осторожно нагрейте пробирку со смесью, при этом фенол полностью растворяется в воде и раствор становится прозрачным и однородным. При охлаждении наблюдается обратный процесс.
Опыты 2-4. Фенол обладает свойствами слабой кислоты. а) К взвеси фенола в воде (опыт 1) добавьте по каплям при взбалтывании раствор щелочи. Образуется раствор фенолята соответствующего металла:
С6Н5ОН + NaOH С6Н5ОNa + H2O.
б) Полученный раствор разделите на две части. К одной порции раствора фенолята натрия добавьте по каплям раствор соляной кислоты; фенол вновь осаждается из раствора:
С6Н5ОNa + HCl С6Н5ОН + NaCl.
в) Через вторую порцию раствора пропустите ток углекислого газа. Также выпадает осадок фенола:
2С6Н5ОNa + H2O + CO2 2С6Н5ОН + Na2CO3.
Опишите наблюдения и сделайте выводы о свойствах фенола, связанных с влиянием бензольного ядра на подвижность водорода в гидроксильной группе фенола.
Опыт 5. Реакции замещения водорода в бензольном ядре фенола. Несколько кристалликов фенола полностью растворите в минимальном объеме воды. Добавьте к раствору несколько капель бромной воды. Наблюдайте образование осадка трибромфенола:
 .
.Проведите реакцию нитрования фенола в виртуальном режиме. Сделайте выводы о влиянии гидроксильной группы на химическую активность бензольного ядра и замещении водорода бромом в орто- и пара-положениях.
Опыт 6. Цветная реакция фенола. Приготовьте прозрачный раствор фенола в воде. Добавьте к нему несколько капель раствора (1%) хлорида железа (III). Смесь приобретает темно-фиолетовый цвет.
Вопросы и задания
1. Спирты и фенолы находят широкое применение в промышленности, сельском хозяйстве, медицине, быту. Составьте список наименований различных спиртов и фенолов, укажите их применение, а, главное, - их свойства, на которых основано практическое использование этих веществ.
2. Многие спирты и фенолы имеют тривиальные названия (древесный спирт, винный спирт, сивушные масла, глицерин, карболовая кислота, гидрохинон, резорцин, пирокатехин, пирогаллол и др.). Каково происхождение этих названий? Приведите формулы этих веществ и их названия по современной номенклатуре.
3. Название этиленгликоля по номенклатуре ИЮПАК – этандиол-1,2. Запишите структурную формулу этого вещества и составьте возможные формулы еще четырех его изомеров и дайте им названия.
4. Обратитесь к схеме, отражающей некоторые генетические связи между различными классами органических веществ (см. раздел 5.2. Углеводороды). Выделите из этой схемы цепочки химических превращений, с которыми вы уже познакомились на уроках химии. Запишите примеры соответствующих уравнений химических реакций.
5.5. Альдегиды. Карбоновые кислоты
Альдегиды
Альдегиды – класс органических веществ, молекулы которых содержат функциональную группу атомов
 , соединенную с радикалом, входят в группу карбонильных соединений. Название "альдегид" составлено из начальных букв слов "алкоголь" и "дегидрирование" и отражает один из способов получения альдегидов. По строению радикала альдегиды подразделяют на предельные (бутаналь, или масляный альдегид), непредельные (пропеналь, или акролеин), ароматические (бензальдегид) и др.
, соединенную с радикалом, входят в группу карбонильных соединений. Название "альдегид" составлено из начальных букв слов "алкоголь" и "дегидрирование" и отражает один из способов получения альдегидов. По строению радикала альдегиды подразделяют на предельные (бутаналь, или масляный альдегид), непредельные (пропеналь, или акролеин), ароматические (бензальдегид) и др. Общая формула предельных альдегидов:
 . Названия этих альдегидов по правилам ИЮПАК составляются из наименования соответствующего алкана с добавлением суффикса –аль, например, метаналь, этаналь, пропаналь, бутаналь и т.д. Широко используются в химии и тривиальные названия альдегидов, образованные из названий соответствующих карбоновых кислот: муравьиный альдегид, или формальдегид; уксусный альдегид; пропионовый альдегид; масляный альдегид и т.д. Для альдегидов характерны виды изомерии, обусловленные радикалом и межклассовая изомерия (изомерны кетонам).
. Названия этих альдегидов по правилам ИЮПАК составляются из наименования соответствующего алкана с добавлением суффикса –аль, например, метаналь, этаналь, пропаналь, бутаналь и т.д. Широко используются в химии и тривиальные названия альдегидов, образованные из названий соответствующих карбоновых кислот: муравьиный альдегид, или формальдегид; уксусный альдегид; пропионовый альдегид; масляный альдегид и т.д. Для альдегидов характерны виды изомерии, обусловленные радикалом и межклассовая изомерия (изомерны кетонам). При обычных условиях формальдегид – газ с резким запахом, следующие 11 членов гомологического ряда предельных альдегидов – жидкости, начиная с С12Н25СНО (тридеканаль) – твердые вещества. Метаналь, этаналь и пропаналь хорошо растворимы в воде.
Химические свойства обусловлены свойствами радикала и присутствием в составе молекулы альдегидной группы, в которой атом углерода находится в состоянии sp2-гибридизации, поэтому σ-связи группы находятся в одной плоскости, а наличие электроотрицательного атома кислорода приводит к сильной поляризации двойной связи С=О:
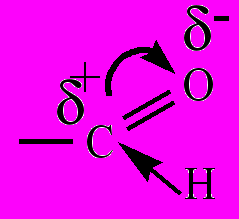 .
. Наиболее характерными для альдегидов являются реакции присоединения по карбонильной группе и реакции окисления связи С-Н альдегидной группы. Реакции нуклеофильного присоединения можно изобразить схемой:
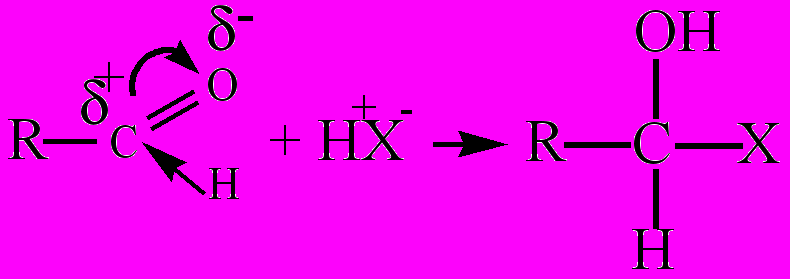 . Так, протекают процессы присоединения синильной кислоты с образованием циангидринов, присоединения спиртов с образованием полуацеталей и ацеталей, присоединения гидросульфитов с образованием гидросульфитных производных альдегидов и т.д. В результате восстановления (присоединение водорода в присутствии катализатора) альдегидов образуются спирты. Например, при восстановлении пропаналя получается пропанол-1:
. Так, протекают процессы присоединения синильной кислоты с образованием циангидринов, присоединения спиртов с образованием полуацеталей и ацеталей, присоединения гидросульфитов с образованием гидросульфитных производных альдегидов и т.д. В результате восстановления (присоединение водорода в присутствии катализатора) альдегидов образуются спирты. Например, при восстановлении пропаналя получается пропанол-1:СН3СН2СНО + H2
 СН3СН2СН2ОН.
СН3СН2СН2ОН.Окисление альдегидов по связи С-Н альдегидной группы соответствует схеме:
 . Реакции окисления (приводят к образованию соответствующих кислот) можно легко осуществить раствором KMnO4 в кислой среде, аммиачным раствором оксида серебра (реакция "серебряного зеркала"), свежеосажденным гидроксидом меди (II). В ходе последней реакции голубой осадок Cu(OH)2 восстанавливается вначале в нерастворимый гидроксид меди (I) желтого цвета, который затем разлагается на оксид меди (I) красного цвета и воду (реакция также является качественной на альдегиды):
. Реакции окисления (приводят к образованию соответствующих кислот) можно легко осуществить раствором KMnO4 в кислой среде, аммиачным раствором оксида серебра (реакция "серебряного зеркала"), свежеосажденным гидроксидом меди (II). В ходе последней реакции голубой осадок Cu(OH)2 восстанавливается вначале в нерастворимый гидроксид меди (I) желтого цвета, который затем разлагается на оксид меди (I) красного цвета и воду (реакция также является качественной на альдегиды):R-CH=O + Cu(OH)2
 R-COOH + 2CuOH¯ + H2O;
R-COOH + 2CuOH¯ + H2O;2CuOH
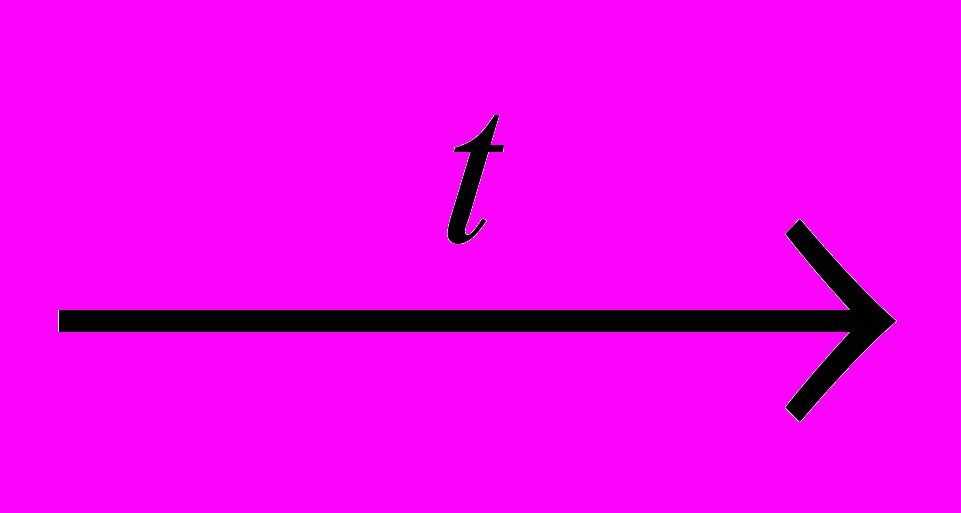 Cu2O +H2O.
Cu2O +H2O.Формальдегид в этих реакциях окисляется до CO2. При сгорании альдегидов (полное окисление) образуются CO2 и H2O. Кроме того, альдегиды вступают в реакции полимеризации и поликонденсации. Например, при длительном хранении формалина в нем образуется параформальдегид; реакцией поликонденсации формальдегида с фенолом получают фенолформальдегидные смолы. Альдегиды реагируют с галогенами, при этом на галоген замещаются только атомы водорода при соседнем с альдегидной группой атоме углерода (сказывается влияние альдегидной группы), например, при пропускании газообразного хлора через этаналь образуется трихлорэтаналь Cl3C-CHO.
Важнейшими способами получения альдегидов являются: каталитическое окисление алкенов кислородом воздуха; окисление спиртов различными окислителями (О2, KMnO4, K2Cr2O7 и др.): R-СН2 ОН + [О] ® R-СНО + H2O; каталитическое дегидрирование первичных спиртов:
R-СН2ОН
 R-СНО + H2.
R-СНО + H2.Формальдегид в промышленности получают каталитическим окислением метана при 500 оС; ацетальдегид – из ацетилена (реакция Кучерова). Применяют альдегиды в производстве и синтезе полимеров, карбоновых кислот, спиртов и многих других материалов и соединений.
Опыт 1. Физические свойства альдегидов. Демонстрируются образцы этаналя, формалина, параформа. Для ознакомления с запахом (осторожно!) формальдегида раздают (или обходят учащихся) в классе пробирки (или стакан) с каплей формалина.
Опыт 2. Получение альдегидов. Для получения ацетальдегида из этанола повторите опыты 10-11, описанные в разделе 5.3. Спирты. Для получения формальдегида (при наличии в лаборатории метанола), проведите аналогичную реакцию различными вариантами:
CH3OH + CuO Cu + HCHO↑ + H2O.
Опыт 3. Реакция серебряного зеркала. Для получения гидроксида диамминсеребра (упрощенно – раствор оксида серебра в аммиаке) налейте в чистую пробирку 3-5 мл раствора нитрата серебра (5%), затем по каплям добавьте разбавленный раствор аммиака до растворения первоначально образовавшегося осадка оксида серебра. К полученному раствору добавьте несколько капель раствора формальдегида, перемешайте и поместите пробирку в кипящую водяную баню или осторожно нагрейте. Уравнение реакции с участием формальдегида выглядит следующим образом:
2[Ag(NH3)2]ОН + НСНО
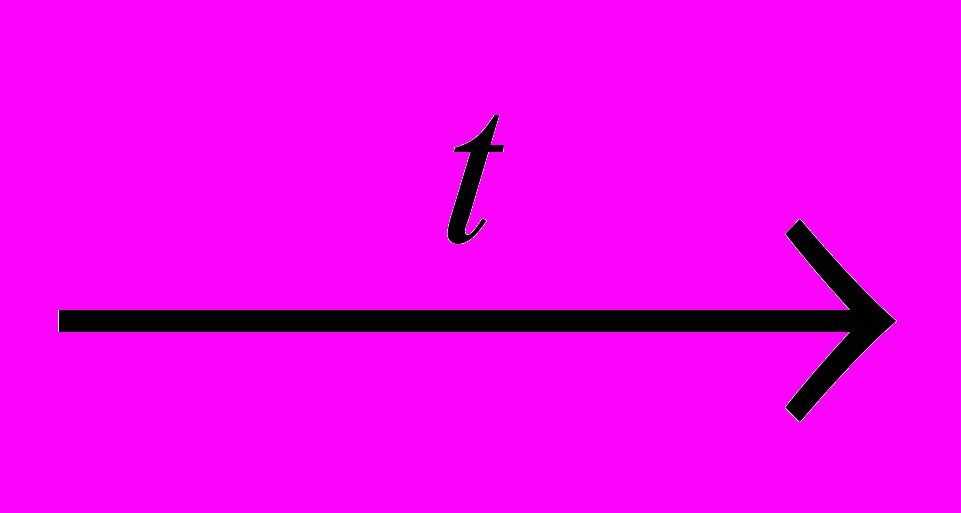 2Ag + НСООNH4 + 3NH3+H2O.
2Ag + НСООNH4 + 3NH3+H2O.В упрощенном общем виде уравнение можно записать так:
НСНО + Ag2O
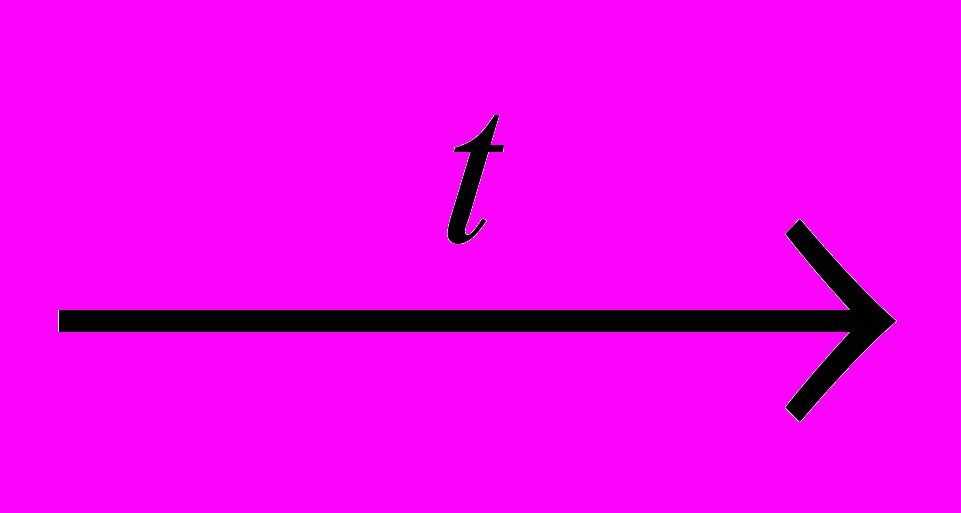 НСООН + 2Ag.
НСООН + 2Ag.Опыт 4. Окисление альдегидов гидроксидом меди (II). Налейте в пробирку 2-3 мл раствора щелочи (5%), добавьте несколько капель раствора соли меди (II), например, CuSO4. Щелочь должна быть в небольшом избытке. К суспензии выпавшего в осадок гидроксида меди добавьте 1 мл раствора альдегида. Нагрейте раствор, постепенно доводя его до кипения. Наблюдайте изменение окраски смеси в пробирке. Опишите ваши наблюдения и запишите уравнения реакций.
Опыт 5. Полимеризация формальдегида. Налейте в фарфоровую чашку 2-4 мл формалина и поставьте ее на кипящую водяную баню или осторожно нагрейте на слабом огне (в вытяжном шкафу) до получения сухого остатка параформальдегида (параформа):
n(СН2О)
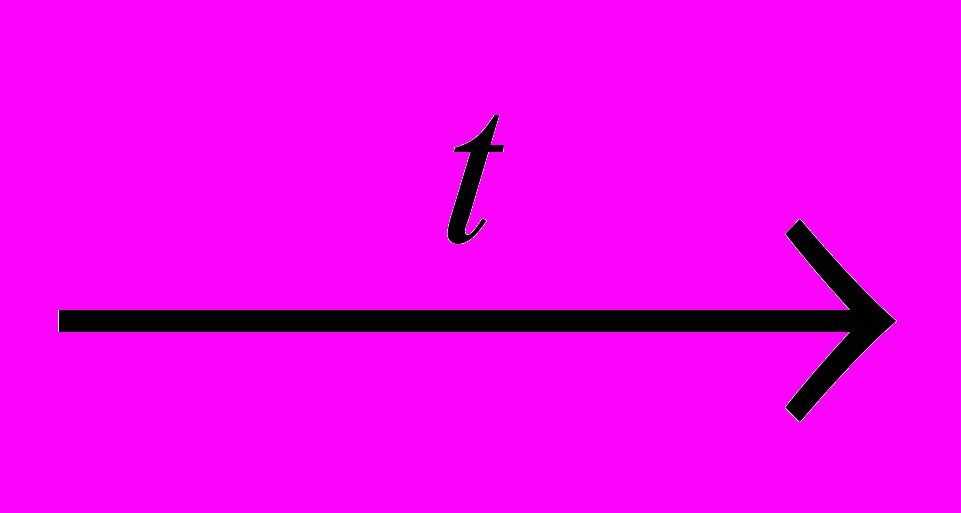 (СН2О)n.
(СН2О)n.Рассмотрите (не брать руками!) образец полученного полимера и опишите его внешние признаки.
Карбоновые кислоты
Карбоновые кислоты (органические кислоты) – класс органических веществ, содержащих одну или несколько карбоксильных групп, которые образованы из карбонильной (>С=О) и гидроксильной (-ОН) групп, отсюда и название – карб + оксил. В карбоксильной группе происходит смещение электронной плотности в сторону карбонильного атома кислорода, что в
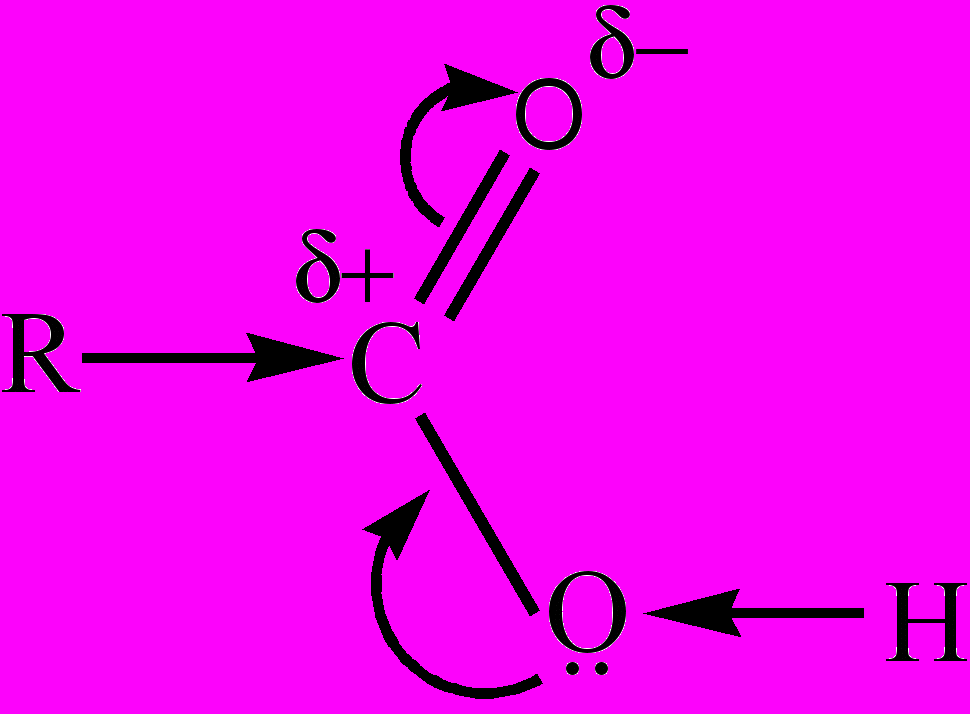
ызывает сильную поляризацию связи О-Н, в результате становится возможной кислотная диссоциация в водных растворах с образованием карбоксилат-анионов и катионов водорода:
RCOOH
 RСОО- + Н+.
RСОО- + Н+.В крбоксилат-анионе происходит делокализация π-связи карбонильной группы (С=О) и равномерное распределение отрицательного заряда между двумя атомами кислорода:
 . В связи с этим для карбоксила, в отличие от альдегидной группы, не характерны реакции присоединения.
. В связи с этим для карбоксила, в отличие от альдегидной группы, не характерны реакции присоединения.В зависимости от природы радикала, связанного с карбоксильной группой, карбоновые кислоты классифицируются на предельные (насыщенные), непредельные (ненасыщенные), ароматические и т.д., а в зависимости от числа карбоксильных групп в молекуле – на однооснóвные, двухоснóвные и т.д. Если в радикале карбоновой кислоты присутствует какая-либо другая функциональная группа (-ОН; -NH2; >С=О и т.д.), то получаются оксикислоты, аминокислоты, кетокислоты и др.
Карбоновые кислоты имеют часто исторические названия (муравьиная, уксусная, масляная кислота и т.д.). По международной номенклатуре названия составляют путем прибавления окончания -овая и слова кислота к названию углеводорода с таким же числом атомов углерода, что и в молекуле кислоты. Например, С3Н7СООН – бутановая кислота (масляная). Карбоновые кислоты обладают свойствами, характерными для слабых неорганических кислот – взаимодействуют с основаниями, металлами, оснóвными оксидами, солями.
Характерными свойствами карбоновых кислот как органических веществ является их способность реагировать со спиртами с образованием сложных эфиров (реакции этерификации). При взаимодействии с аммиаком или аминами карбоновые кислоты дают амиды кислот.
При замещении атомов водорода в углеводородном радикале кислоты на галогены (например, трихлоруксусная кислота – Cl3С-СООН), сила кислот возрастает. Низшие карбоновые кислоты – б
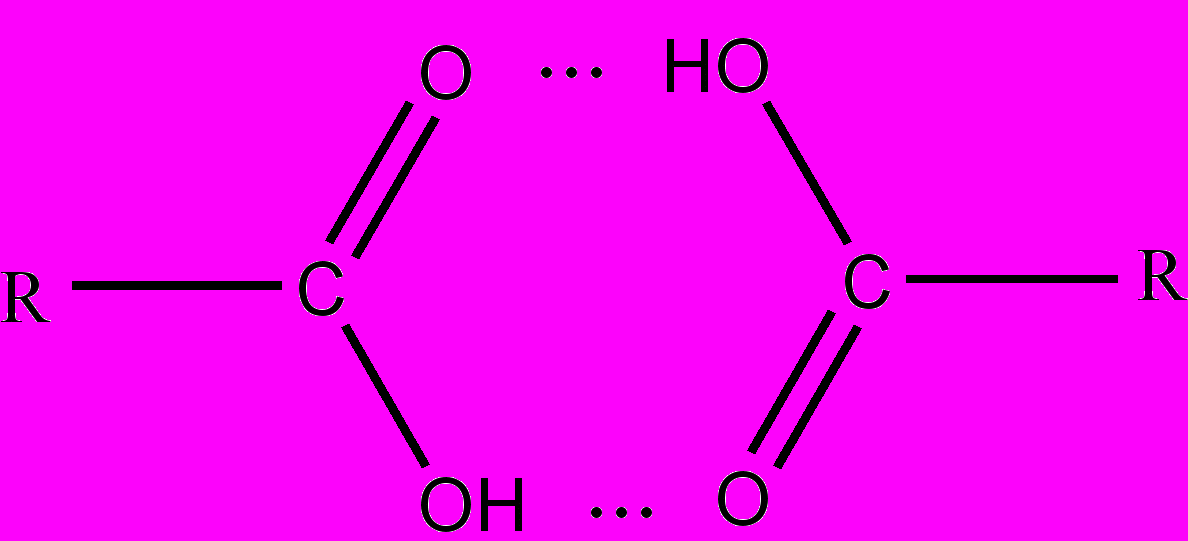 Водородные связи при
Водородные связи приобразовании димеров карбоновых кислот
есцветные летучие жидкости с резким запахом, хорошо растворимые в воде. С ростом молярной массы, растворимость их понижается. Высшие предельные, дикарбоновые и ароматические карбоновые кислоты – твердые вещества. Относительно высокая температура кипения низших карбоновых кислот (муравьиная, уксусная и др.) объясняется ассоциацией их молекул вследствие действия водородных связей в димеры. Получают карбоновые кислоты окислением альдегидов, спиртов, углеводородов (особенно легко окисляются гомологи бензола). Высшие карбоновые кислоты получают гидролизом жиров. Многие кислоты получают в промышленности специфическими методами, например, синтез пропионовой кислоты:
СН2=СН2 + СО + H2O СН3-СН2-СООН.
Опыт 1. Физические свойства карбоновых кислот. Рассмотрите в прозрачных бесцветных склянках образцы жидких и твердых карбоновых кислот, имеющихся в лаборатории. Для установления запаха капните по одной капле жидких кислот и поместите по небольшой порции (с горошину) твердых кислот в небольшие стаканчики и предложите учащимся определить их запах, одновременно записывая результаты в тетради. Проведите опыт по растворению небольших порций различных кислот в воде, зафиксируйте результаты. Пробирку с 2-3 мл химически чистой (ледяной) уксусной кислоты опустите в охлаждающую смесь (снег или лед + нитрат калия или мочевина). Покажите учащимся через некоторое время кристаллизацию этого вещества, которая происходит около 16 оС.
Опыт 2. Получение чистой уксусной кислоты. Если в лаборатории нет ледяной уксусной кислоты, ее можно получить перекристаллизацией (вымораживанием). Колбу с уксусной эссенцией (70-80%) охладите в охлаждающей смеси до кристаллизации большей части жидкости. Слейте жидкость (разбавленный раствор уксусной кислоты в воде) в отдельную склянку; кристаллы оставьте в теплом месте до их полного перехода в жидкость (концентрированный раствор уксусной кислоты). Операцию по замораживанию и размораживанию повторите несколько раз. С каждым разом кристаллы будут содержать все меньше воды. Измерьте ареометром плотность очередной порции растаявшей жидкости и установите по таблице концентрацию кислоты. Примечание. Помните об особой зависимости плотности уксусной кислоты от ее концентрации.
Опыты 3-9. Уксусная кислота обладает свойствами, характерными для типичных неорганических кислот. а) Налейте в пробирку немного концентрированной уксусной кислоты; проверьте фиолетовой лакмусовой бумагой реакцию среды. Добавьте в пробирку равный объем воды и повторите пробу лакмусовой бумагой. Добавьте в пробирку с раствором кислоты 2-3 капли раствора метилового оранжевого. Опишите ваши наблюдения и сделайте выводы на основе эксперимента.
б) В три пробирки наберите небольшие порции порошков магния, цинка и меди. Добавьте в каждую пробирку по 2-3 мл раствора (10%) уксусной кислоты. Наблюдайте ход реакций, запишите уравнения и сделайте выводы.
в) Наберите в пробирку немного оксида магния, цинка или меди; добавьте в пробирку 2-3 мл раствора (10%) уксусной кислоты. Наблюдайте ход реакции, запишите уравнение и сделайте выводы.
г) Получите в пробирке взвесь гидроксида меди (II); добавьте к ней немного раствора (10%) уксусной кислоты. Налейте в пробирку 2-3 мл разбавленного раствора (1%) щелочи; капните в раствор 2-3 капли раствора фенолфталеина. Прилейте небольшими порциями раствор (5%) уксусной кислоты.
д) Хорошие методические и познавательные результаты можно получить, если этот же опыт провести количественно для установления оснóвности уксусной кислоты (только один атом водорода в молекуле кислоты способен к диссоциации, то есть лишь один атом водорода из четырех придает веществу кислотные свойства). Приготовьте одинаковой концентрации растворы (1 моль/л) гидроксида натрия (4 г в 100 мл раствора) и уксусной кислоты (6 мл в 100 мл раствора). Налейте в колбочку 20 мл раствора кислоты, добавьте 3-4 капли раствора фенолфталеина. Титруйте с помощью бюретки раствор кислоты раствором щелочи при постоянном перемешивании до появления розовой неисчезающей окраски раствора. Отметьте, что на нейтрализацию кислоты потребовался равный объем раствора щелочи. Наблюдайте ход реакции, запишите уравнение и сделайте выводы.
е) Для примера взаимодействия карбоновых кислот с солями поместите в пробирку кусочек мела и добавьте 2-3 мл кислоты. Наблюдайте ход реакции, запишите уравнение и сделайте выводы.
ж) Наберите в пробирку немного ацетата натрия или другой соли уксусной кислоты. Добавьте в пробирку несколько капель концентрированной серной кислоты. Установите по запаху образование уксусной кислоты, запишите уравнение и сделайте общие выводы о свойствах уксусной кислоты как типичной неорганической кислоты.
Опыты 10-11. Свойства уксусной кислоты как органического соединения. а) Нагрейте в пробирку, установленную вертикально в штативе 2-3 мл чистой уксусной кислоты. Подожгите выделяющиеся пары длинной горящей лучинкой. Кислота кипит при 118 оС, пары горят слабо светящимся пламенем. Запишите уравнение реакции полного окисления уксусной кислоты.
б) Приготовьте смесь равных объемов этанола и концентрированной серной кислоты. К 2-3 мл этой смеси прилейте равный объем чистой уксусной кислоты. Нагрейте раствор на малом огне до кипения и продолжайте поддерживать слабое кипение 1-2 минуты. Перелейте содержимое пробирки в стакан с насыщенным раствором поваренной соли. Серная кислота и избыток спирта или кислоты растворятся в растворе соли, а этилацетат (уксусноэтиловый эфир) высаливается над раствором соли. Несколько капель верхнего слоя смеси перелейте в пустой стакан и ознакомьте учащихся с запахом эфира. Опишите наблюдения и запишите уравнение реакции. Аналогично проведите реакции этерификации уксусной кислоты с другими спиртами.
Опыты 12-13. Свойства муравьиной кислоты. Примечание. Реакции, описанные выше для уксусной кислоты можно так же провести и для муравьиной кислоты. Важно показать, кроме того, особые свойства муравьиной кислоты, обусловленные ее строением. а) Приготовьте в пробирке 2-3 мл аммиачного раствора оксида серебра (см. выше "Альдегиды"), прилейте 1 мл муравьиной кислоты и осторожно нагрейте. Учтите, что в данной реакции выделяющееся серебро часто выпадает не в виде зеркального налета на стенке сосуда, а в виде черного мелкодисперсного осадка.
б) Налейте в пробирку 2-3 мл разбавленного раствора KMnO4, подкислите его несколькими каплями серной кислоты и добавьте 1-2 мл муравьиной кислоты. Осторожно нагрейте смесь и наблюдайте обесцвечивание раствора, выделение газа. Природу этого газа можно установить, пропуская его через известковую воду. Запишите уравнение окисления муравьиной кислоты перманганатом калия.
Опыты 14-17. Свойства стеариновой кислоты. а) Нарежьте немного хозяйственного (желательно белого) мыла в виде мелких стружек и поместите в колбу. Прилейте 50-100 мл воды и нагрейте при перемешивании до получения насыщенного раствора. Слейте жидкость с остатка мыла и добавьте к ней немного серной кислоты до получения слабо кислого раствора. Запишите уравнение реакции:
2С17Н35СООNa + H2SO4 2С17Н35СООН + Na2SO4.
б) Стеариновая кислота, выпадая в осадок, собирается сверху раствора. После охлаждения смеси соберите кислоту, высушите препарат и используйте для других опытов, если в лаборатории отсутствует это вещество.
в) Установите опытным путем физические свойства стеариновой кислоты (агрегатное состояние, внешние признаки, растворимость в воде и относительную плотность).
г) Расплавьте немного кислоты в пробирке и (осторожно!) добавьте небольшой кусочек натрия. Наблюдайте выделение газа по уравнению реакции:
2С17Н35СООН + 2Na 2С17Н35СООNa + H2.
д) Растворите в гексане немного стеариновой кислоты, добавьте 2-3 капли раствора фенолфталеина. К смеси прибавляйте по каплям раствор (1%) щелочи. Первые порции щелочи не вызовут изменение окраски раствора, но после нейтрализации кислоты появляется розовое окрашивание:
С17Н35СООН + NaOH С17Н35СООNa + H2O.
Примечание. При изучении этой темы можно повторить некоторые опыты, иллюстрирующие свойства жесткой воды (см. раздел 4.3. Вода. Пероксид водорода).
Опыты 18-19. В молекуле олеиновой кислоты имеется двойная связь. а) Налейте в небольшую колбочку 3-5 мл олеиновой кислоты и добавьте несколько капель подкисленного раствора перманганата калия. б) К другой порции олеиновой кислоты добавьте несколько капель иодной воды. Наблюдайте обесцвечивание растворов и сделайте выводы.
Вопросы и задания
1. На основе уравнений реакций получения и свойств альдегидов и карбоновых кислот составьте расчетные задачи различных типов.
а) Определение массы, объема или количества некоторых участников реакции, если в условии приведены определенные данные по одному из веществ.
б) Определение массы или объема продукта реакции, если имеются данные об исходных веществах, одно из которых взято в избытке или содержит примеси.
в) Определение практического выхода продукта реакции, если известны выход продукта в процентах от теоретически возможного и определенные количественные данные по одному из исходных веществ.
г) Определение структурной формулы вещества, если известны количественные данные о продуктах реакции этого вещества.
д) Задачи с использованием газовых законов.
е) Задачи, в которых количественные данные о веществах даны в виде растворов с различными способами выражения их состава.
ж) Другие типы задач.
Передайте своим одноклассникам условия составленных задач для их решения; проверьте выполненные работы и выставьте соответствующие отметки.
2. С некоторыми карбоновыми кислотами человек знаком с глубокой древности, другие также открыты задолго до разработки теории строения органических веществ и утверждения современной номенклатуры (муравьиная, уксусная, масляная, стеариновая, олеиновая, щавелевая, лимонная, молочная, янтарная и многие другие). Приведите формулы этих веществ и их названия по современной номенклатуре. На основе изученного материала сделайте прогноз о физических и химических свойствах тех из них, которые в ваших учебниках не описаны. Запишите соответствующие уравнения реакций.
3. Обратитесь к схеме, отражающей некоторые генетические связи между различными классами органических веществ (см. раздел 5.2. Углеводороды). Выделите из этой схемы цепочки химических превращений, с которыми вы вновь познакомились на уроках химии. Запишите примеры соответствующих уравнений химических реакций.
