Лекция Классификация и изомерия органических соединений
| Вид материала | Лекция |
- План лекций по биоорганической химии для студентов 1 курса медицинского факультета, 26.83kb.
- А14 Теория строения органических соединений. Изомерия структурная и пространственная., 56.23kb.
- План Организационный момент 5 мин Проверка домашнего задания 25 мин Объяснение и закрепление, 94.14kb.
- Тематический план лекций модуля 1 с органической химии для студентов 2 курса фармацевтического, 25.24kb.
- Календарно-тематический план лекций по биоорганической химии 1 курс (2 семестр) специальность, 65.41kb.
- Тематический план лекций и самостоятельной работы по органической химии (осенний семестр), 91.46kb.
- 10 класс. Тема урока: «Причины многообразия органических соединений» Тип урока, 145.21kb.
- Дробот Светлана Сергеевна конспект, 69.15kb.
- План занятия №1 Классификация, номенклатура и пространственное строение органических, 96.42kb.
- Тематический план лабораторно-практических занятий по курсу «Биоорганическая химия», 104.14kb.
Лекция 2. Классификация и изомерия органических соединений
Особенности органических соединений
- Атомы углерода способны соединяться друг с другом, образуя цепи и кольца. Цепи могут быть как линейные, так и разветвленные. Отсюда многообразие органических соединений.
- В органических молекулах связь атомов ковалентная, т.е. образована парой электронов. Поэтому органические соединения, в основном, неэлектролиты. В воде они не диссоциируют так легко, как неорганические соединения.
- Особенности строения атома углерода (С).
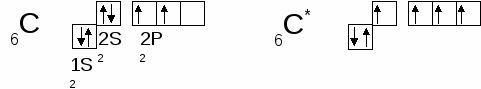
Атом углерода в возбужденном состоянии может образовывать 4 связи.
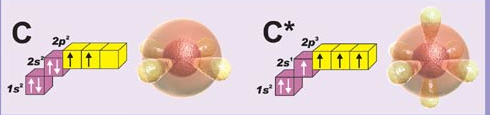
- При нагревании до 400-600оС органические соединения полностью разлагаются и обугливаются, а в присутствии О2 сгорают. Это объясняется небольшой прочностью связи между атомами углерода (355,6 кДж/моль).
- В органической химии вместо понятия степень окисления применяют понятие валентности, равной количеству связей, которое может образовать атом, т.е. валентность атома углерода в возбужденном состоянии равна 4.
Теория химического строения органических соединений
Теория химического строения в своей основе была создана в 60-х годах XIX века. Если в первой половине XIX века основная задача органической химии состояла в изучении состава и свойств природных соединений, а также в разработке способов рационального их использования, то далее, в связи с развитием промышленности и ростом городов, к органической химии стали предъявлять все больше требований: требовались красители, лекарства, новое освещение, новые методы переработки пищевых продуктов и т.д.
Развитие органической химии тормозилось отставанием теоретических представлений. Не было единой химической символики. Необходимы были новые теоретические воззрения для того, чтобы ответить на следующие вопросы:
- Почему только два элемента С и Н образуют такое многообразие соединений, как С2Н6, С2Н4, С6Н6, С2Н2 и т.д.?
- Почему органических соединений гораздо больше, чем неорганических, соответственно: несколько миллионов – несколько тысяч?
- Почему из формулы углеводорода нельзя определить валентность углерода? Например, в формуле СН4 валентность С = 4; в С2Н6 валентность С = 3; в С3Н8 валентность 8/3; в С2Н2 валентность С = 1 и т.д.
- Почему многие соединения, имея одну и ту же формулу, обладают различными свойствами? Например, глюкоза и фруктоза С6Н12О6 ; С2Н6О – этиловый спирт и диэтиловый эфир.
На все эти вопросы был дан ответ после разработки основополагающей теории строения органических веществ ( 1861 год, А.М.Бутлеров). Основная идея этой теории: химическая натура сложной частицы определяется натурой элементарных составных частей, их количеством и химическим строением. Другими словами, химические свойства молекулы определяются: а) свойствами составляющих её атомов; б) количеством атомов; в) химическим строением молекулы.
Основные положения этой теории:
- Атомы, образуя молекулу органического вещества, располагаются не беспорядочно, а в строгой и определенной последовательности. Между атомами углерода возникает ковалентная связь. Она может быть одинарной (σ-связь), двойной (1σ и 1π – связи), тройной (1σ и 2π – связи). Ковалентная связь характеризуется: длиной, энергией, полярностью связи. Между атомами С и Н тоже возникает σ-связь. К цепи, состоящей из двух атомов углерода, может присоединиться третий, четвертый атом и т.д., т.е. образуются углеродные цепи, причем их направленность в пространстве определяется направленностью электронного облака. Цепи могут быть линейные, разветвленные и циклические. Во всех этих цепях атом углерода четырехвалентен.
- Свойства вещества зависит не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т.е. от химического строения молекулы. Согласно этому положению теории, было обнаружено много органических веществ, обладающих одинаковым составом, но разными свойствами. Это явление, открытое в 1830 году, было названо изомерией, а вещества с одинаковым составом – изомерами.
- Атомы или группы атомов, образуя молекулу, взаимно влияют друг на друга, от чего зависит реакционная способность молекулы. Такое влияние особенно велико, если атомы непосредственно связаны друг с другом. Влияние существует и в том случае, если связь осуществляется через какой-то другой элемент. В этом случае важно учитывать такое явление, как перераспределение в молекуле электронной плотности ( индуктивный эффект, эффект сопряжения).
- Зная свойства вещества, можно установить его строение, и, наоборот, химическое строение вещества определяет его свойства.
Значение теории Бутлерова:
- Теория позволила с помощью химических методов установить соединения (связи) атомов в молекулах.
- Она дала возможность предвидеть свойства органических соединений, синтезировать новые вещества.
- С помощью теории химического строения удалось научно объяснить накопившиеся факты в органической химии (например, существование изомеров, гомологов и др.).
- Она позволила установить зависимость химических свойств от строения и взаимного влияния атомов в молекулах, выявила в той или иной степени реакционную способность веществ, направление реакции.
- Теория дала возможность объяснить многообразие органических веществ.
- Она внесла новые элементы в атомно-молекулярное учение: порядок расположения атомов в молекулах, взаимное влияние атомов. Тем самым атомно-молекулярное учение получило свое дальнейшее развитие, что имело большое значение для химии.
Формулы (способы изображения органических соединений)
- Эмпирическая молекулярная формула C2H6

- Электронная молекулярная формула
- С
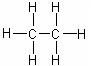

труктурная молекулярная формула
- Г
 рафическая молекулярная формула
рафическая молекулярная формула
- Краткая структурная молекулярная формула СН3-(СН2)5-СН3
Классификация и изомерия органических соединений
Органические соединения принято классифицировать:
- по типу углеродного скелета;
- по функциональным группам.
При классификации по типу углеродного скелета органические соединения разделяют на:
а) ациклические, содержащие незамкнутую цепь атомов углерода. Они, в свою очередь, делятся на предельные, где все связи между атомами углерода являются насыщенными, и непредельные: этиленовые (содержат одну двойную связь), диеновые (содержат две двойные связи), ацетиленовые (содержат тройные, связи);
б
 ) карбоциклические, содержащие замкнутую цепь только из атомов углерода:
) карбоциклические, содержащие замкнутую цепь только из атомов углерода:
в
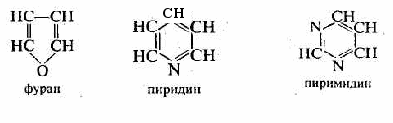 ) гетероциклические, содержащие замкнутую цепь не только из атомов углерода:
) гетероциклические, содержащие замкнутую цепь не только из атомов углерода:Отдельно следует остановиться на названиях углеводородных заместителей.
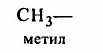
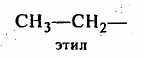
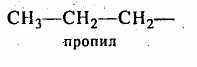
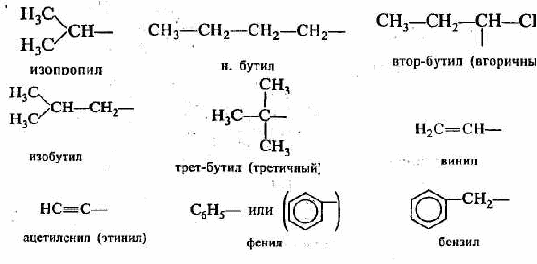
│
СН3-СН2-СН-СН3
втор-бутил (вторичный бутил)
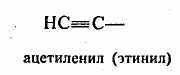 Из приведенных названий становится ясно, что радикалы-заместители делятся на первичные, вторичные и третичные в зависимости от того, с каким количеством атомов углерода связан тот углеродный атом, от которого отходит свободная связь.
Из приведенных названий становится ясно, что радикалы-заместители делятся на первичные, вторичные и третичные в зависимости от того, с каким количеством атомов углерода связан тот углеродный атом, от которого отходит свободная связь.Второй вид классификации — по функциональным группам. В этом случае можно каждое органическое соединение представить в виде формулы R—X, где R — радикал, содержащий только атомы углерода и водорода; X — функциональная группа.
1. Галогенопроизводные (R—Г):
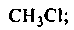
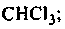
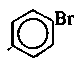
хлорметан трихлорметан – хлороформ бромбензол
2. Спирты (R—ОН), которые могут быть:
а) одноатомными:
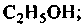
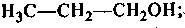
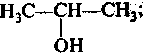
этанол пропанол-1 пропанол-2
б) двух- и трехатомными:
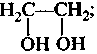
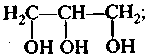
этандиол-1,2 пропантриол-1,2,3
(этиленгликоль) (глицерин)
в) многоатомными:
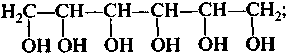
гексангексаол-1,2,3,4,5,6
(гексит)
г) ароматическими:
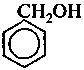
бензиловый спирт
в которых гидроксильная группа размещается в боковой цепи.
Отдельно стоят фенолы, т. е. такие производные бензола, где один или более атомов водорода цикла замещены гидроксильной группой.

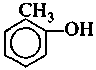
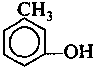
оксибензол 2-мстил-1-оксибензол 3-метил-1 -оксибензол
(фенол) (о-крезол) (м-крезол)

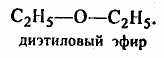
3. Простые эфиры (R1—O—R2):
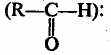 4. Альдегиды
4. Альдегиды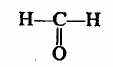
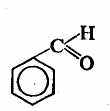
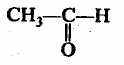
метаналь
этаналь
безальдегид
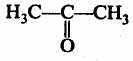
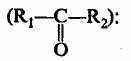
5
пропанон (ацетон)
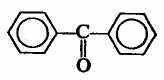
. Кетоны
дифенилкетон
Нетрудно заметить, что кетон, в котором один из радикалов R=Н, является альдегидом, т.е. альдегиды и кетоны относятся к группе карбонильных соединений.
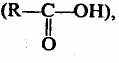
6. Карбоновые кислоты
о
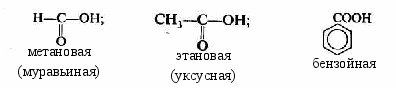 дноосновные:
дноосновные:двухосновные:
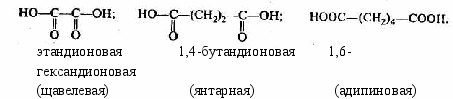
непредельные:
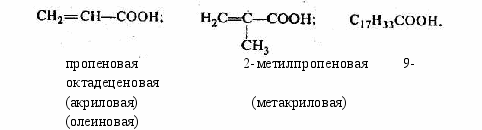
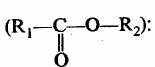
7. Сложные эфиры
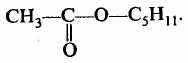
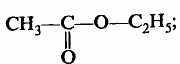
этилэтаноат (этилацетат)
пентилэтаноат (амилацетат)
В этот класс входят жиры — сложные эфиры, образованные трехатомным спиртом (глицерином) и некоторыми высшими (жирными) кислотами предельного и непредельного ряда (стеариновой С17Н35СООН, пальмитиновой C15H31COOH, олеиновой С17Н33СООН, линолевой С17Н31СООН).
- Н
 итросоединения (R—NO2):
итросоединения (R—NO2):
- А
 мины
мины
С
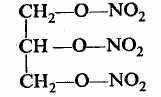 ледует отметить, что в нитросоединениях и аминах атом азота напрямую соединен с атомом углерода. Что же касается такого соединения, как нитроглицерин, то оно является не нитросоединением, а сложным эфиром глицерина и азотной кислоты:
ледует отметить, что в нитросоединениях и аминах атом азота напрямую соединен с атомом углерода. Что же касается такого соединения, как нитроглицерин, то оно является не нитросоединением, а сложным эфиром глицерина и азотной кислоты:Классы 1-9 характерны тем, что они монофункциональны (т. е. в них содержатся только одинаковые функциональные группы). Существуют также полифункциональные соединения. Например:
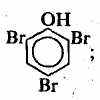
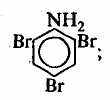
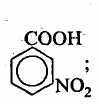
2,4,6-трибромфенол 2,4,6-триброманилин м-нитробензойная
кислота
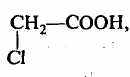
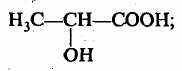
2-оксипропановая 2-хлортэтановая
(молочная) кислота (монохлоруксусная) кислота
Как было указано выше, способность атомов углерода к образованию четырех ковалентных связей с соседними атомами определяет возможности существования изомеров - разных соединений одного и того же молекулярного состава. Можно выделить следующие виды изомерии.
Структурная изомерия
- Межклассовая изомерия (когда одной и той же формуле C2H5O2N соответствуют вещества, принадлежащие к различным классам), например:
C
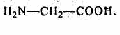 H3CH2NO2
H3CH2NO2 нитроэтан и
глицин
Другими примерами могут послужить:
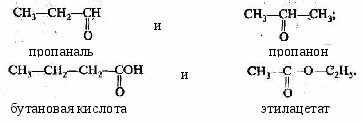
- И
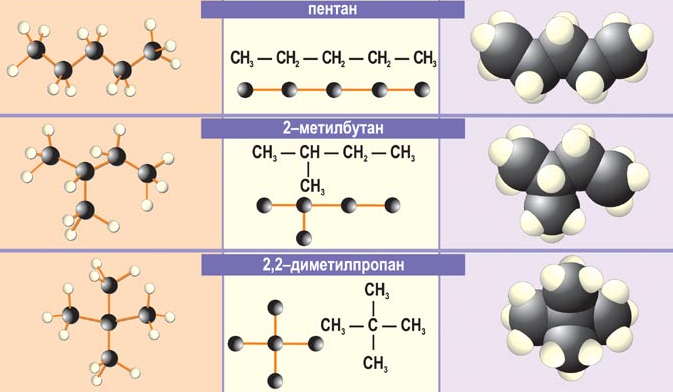
 зомерия углеродного скелета:
зомерия углеродного скелета:
- Изомерия положения, заключающаяся в различном расположении:
- к
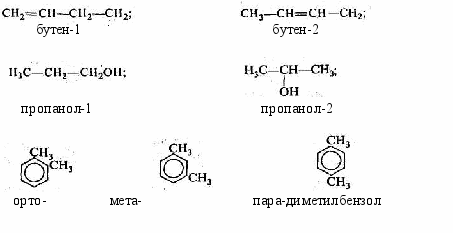 ратной связи:
ратной связи:
- функциональной группы:
- радикалов-заместителей в цикле:
Пространственная или стереоизомерия
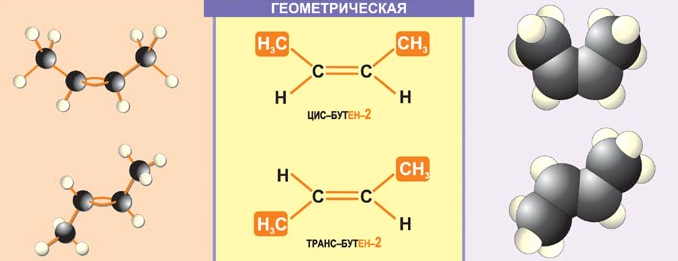
Геометрическая изомерия, характерная для соединений, содержащих двойную связь или замкнутый цикл из атомов углерода. В таких молекулах можно провести условную плоскость по σ-связям таким образом, что заместители, расположенные у разных атомов углерода, могут оказаться как по одну (цис-изомер), так и по разные стороны от этой плоскости (транс-изомер):
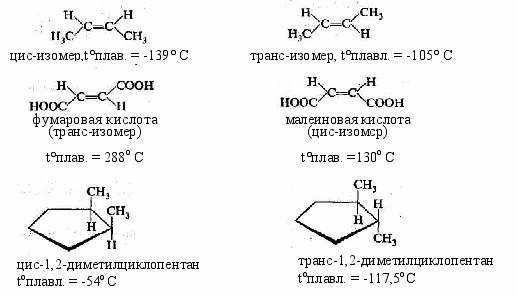
или:
- Оптическая изомерия, в которой изомеры имеют совершенно одинаковые физические и химические свойства, поворачивают плоскость поляризации света на равный угол, но (!) в противоположных направлениях. Так, например, 2-оксипропановая (молочная) кислота имеет два изомера:
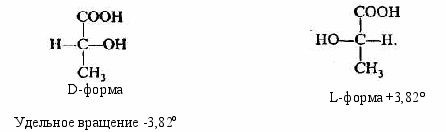
Такие изомеры являются зеркальным отражением друг друга и при вращении молекулы не могут быть совмещены. Необходимо обратить внимание на то, что центральный атом углерода в этих молекулах окружен четырьмя разными заместителями. Такой атом углерода называется асимметрическим, и наличие его в молекуле является непременным признаком того, что для этой молекулы существует оптический изомер.
И, наконец, еще один вид изомерии, который можно назвать динамической изомерией,— таутомерия. В этом случае вещества при установившемся равновесии представляют собой смеси двух (или более) взаимопревращающихся изомеров — таутомеров. Наиболее известным примером является кето-енольная таутомерия в реакции Кучерова (гидратация ацетилена):
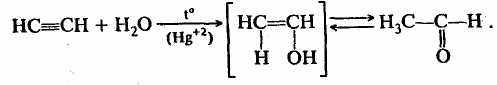
виниловый спирт этаналь
(енольная форма) (кетоформа)


Информация, которую нужно запомнить:
1. Существование соединений с одинаковым молекулярным составом, но с разным строением называется изомерией, а сами вещества – изомерами.
2. Существуют следующие виды изомерии:
а) структурная изомерия – обусловлена порядком соединения атомов; внутри одного класса – положением заместителя; бывает межгрупповая изомерия;
б) изомерия положения кратной связи;
в) в соединениях с двойной связью возможна цис- и транс- изомерия. Цис- и транс-изомерия существует и в замещенных циклоалканах;
г) зеркальная изомерия – энантиомерия; д) динамическая изомерия – таутомерия.
