Молекулярно-генетическая диагностика и дифференцированная терапия гистиоцитарных пролиферативных заболеваний у детей 14. 01. 08 педиатрия 14. 01. 21 гематология и переливание крови
| Вид материала | Автореферат |
СодержаниеГистиоцитоз из клеток Лангерганса Результаты молекулярно-генетического исследования Результаты терапии |
- Молекулярно-генетическая природа первичных гемофагоцитарных лимфогистиоцитозов в россии, 381.26kb.
- Аллогенная трансплантация гемопоэтических стволовых клеток в лечении врожденных и приобретенных, 1375.99kb.
- Факторы риска и контроль вирусных инфекций после трансплантации гемопоэтических стволовых, 767.07kb.
- Красняков Владимир Кириллович Совершенствование донорства крови и ее компонентов, 921.41kb.
- Прямое переливание крови (методические рекомендации), 154.15kb.
- Оптимизация инновационных технологий трансфузионного пособия пациентам регионального, 1245.79kb.
- Неопухолевые лимфаденопатии. 14. 00. 29 гематология и переливание крови, 1061.02kb.
- Обеспечение качества получения и клинического применения компонентов крови в субъекте, 404.49kb.
- кальцинированный аортальный стеноз-состояние системного гемостаза и реологических, 538.36kb.
- Иммуногематологическая оценка методов гемокомпонентной терапии у онкологических больных, 340.82kb.
Обсуждение
Представленные данные подтверждают, что соматические мутации в генах PTPN11, NRAS, CBL и KRAS, выявляются у 70% пациентов с ЮММЛ. Анализ клинических характеристик показал, что пациенты с мутациями PTPN11 достоверно старше пациентов с мутациями RAS, кроме того, у пациентов с мутациями NRAS, CBL и KRAS содержание фетального гемоглобина существенно ниже в сравнении с группой PTPN11. Различия в прочих клинических и лабораторных характеристиках, даже при выявленной статистической достоверности, не имеют клинического значения. Таким образом, конкретный молекулярный механизм патологической активации сигнального пути, ассоциированного с RAS онкогеном при ЮММЛ, возможно определяет некоторые биологические особенности и характеристики клинико-лабораторной презентации заболевания. На основании проведенного исследования предложен алгоритм клинико-лабораторной диагностики ЮММЛ. Рис. 19. Идентификация генетического субварианта ЮММЛ позволяет верифицировать диагноз, использовать мутантный ген в качестве мишени для оценки динамики заболевания во время лечения, проводить клинические исследования в биологически гомогенной выборке.
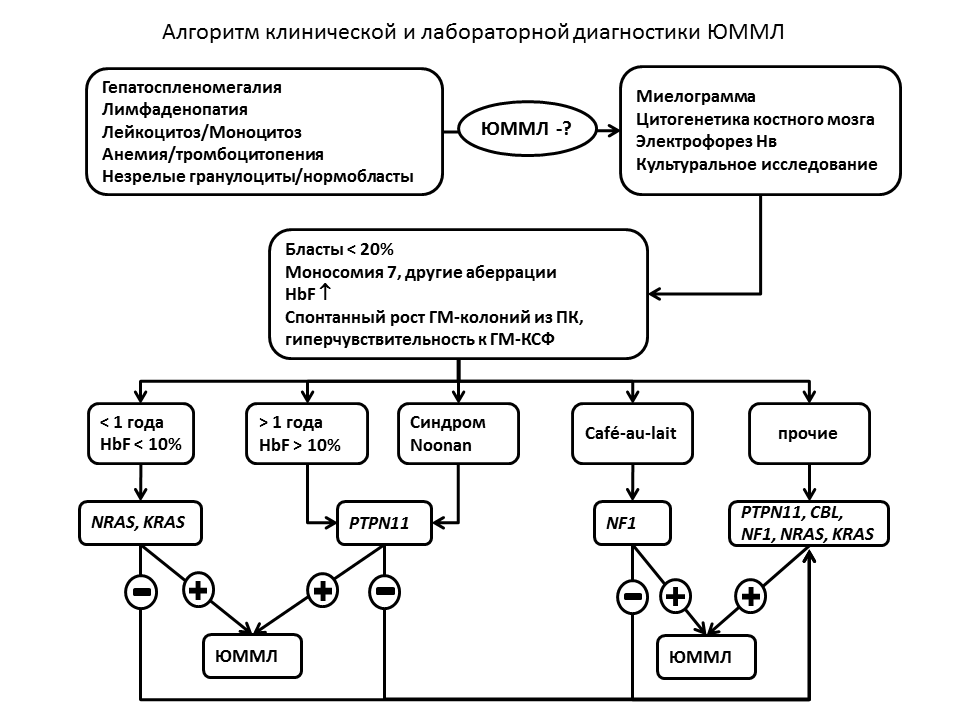 |
| Рисунок 19. Алгоритм клинико-лабораторной диагностики ЮММЛ |
.
На ограниченном материале сделано наблюдение, что мутации в гене NRAS встречаются во всех исследованных фракциях миелоидных и лимфоидных клеток, что косвенно указывает на примитивные стволовые клетки как на вероятную мишень трансформирующего события при ЮММЛ. Другим важным наблюдением явилась демонстрация персистенции мутантного клона у пациентов, находящихся в статусе полного клинико-гематологического ответа после прекращения ДТ. Это наблюдение косвенно свидетельствует о том, что мутации NRAS не являются единственным событием, необходимым для реализации клинического фенотипа ЮММЛ, и что существуют, вероятно, дополнительные генетические и эпигенетические модифицирующие события. На примере двух пациентов показано, что персистенция мутантных клонов может стать основой развития отсроченных онкологических (Т-ОЛЛ) и аутоиммунных гематологических (ТТП) расстройств и, таким образом, ответ на ДТ не может считаться эквивалентом выздоровления, независимо от его продолжительности.
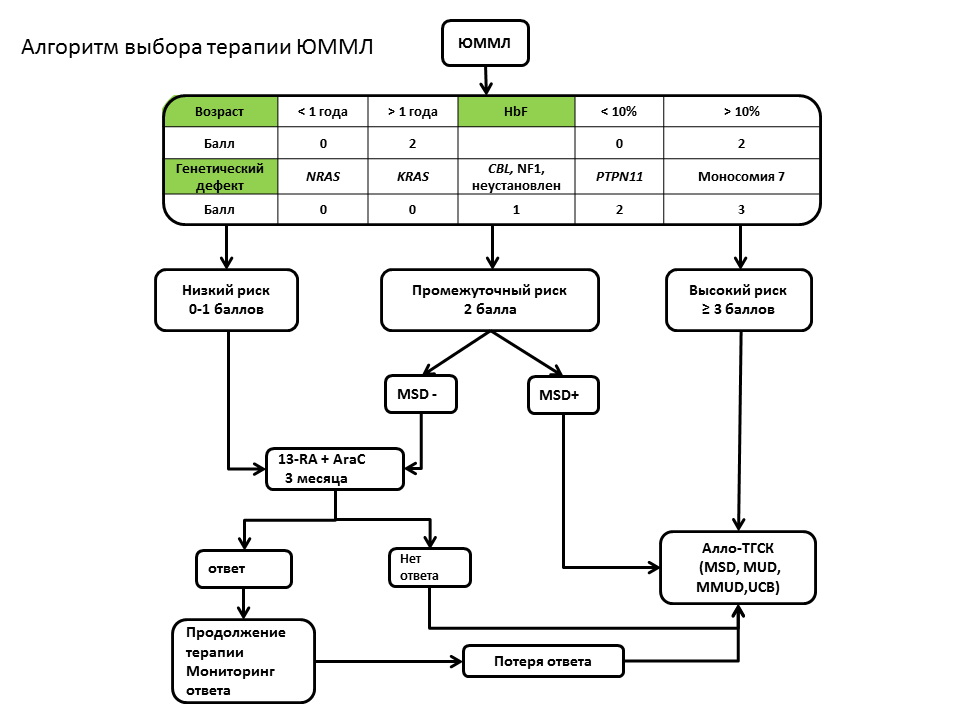 |
| Рисунок 20. Алгоритм выбора терапии и клиническая стратификация пациентов с ЮММЛ. |
При анализе нетрансплантационных подходов показано, что ДТ c использованием 13-RA и AraC способна индуцировать длительные клинико-гематологические ответы у части пациентов. С ответом на ДТ коррелировал возраст манифестации заболевания и содержание фетального гемоглобина. Доля пациентов с мутациями NRAS, CBL и KRAS была достоверно выше среди пациентов, ответивших на ДТ. Развитие поздних злокачественных и аутоиммунных заболеваний качественно отличает ремиссии после ТГСК и после ДТ, тем не менее, амбулаторный режим применения ДТ и высокое качество жизни пациентов позволяют рассматривать ДТ как ценную терапевтическую опцию для соответствующей подгруппы пациентов. Показано, что ВХТ может индуцировать лишь кратковременные клинико-гематологические ответы у части пациентов. Анализ долгосрочных результатов терапии показал, что единственным методом, позволяющим излечить пациентов с ЮММЛ, остается аллогенная ТГСК. Выполнение ТГСК в нашем исследовании было ассоциировано с относительно высоким риском трансплантационной смертности. Несмотря на использование интенсивных режимов кондиционирования, вероятность рецидива ЮММЛ после ТГСК составила 35%. Эффективность посттрансплантационной иммунотерапии на этапе развернутого рецидива ограничена, равно как и эффективность повторных ТГСК, в то время как опыт успешного иммунологического вмешательства у пациента с нарастающим смешанным химеризмом в CD34+ фракции указывает на потенциал упреждающей иммунотерапии. На основании проведенного анализа однозначно утверждать о преимуществе определенного состава кондиционирования и типа донора не представляется возможным, однако существует тренд в пользу MSD и MUD, в сравнении с MMRD и UCB. Применение Flu в качестве базового иммуносупрессивного препарата не оказало негативного влияния на результаты ТГСК в сравнении со стандартным режимом, включающим Cy. Общие результаты терапии пациентов с ЮММЛ не могут считаться удовлетворительными, очевидной необходимостью является внедрение новых лекарственных препаратов, обеспечивающих контроль миелопролиферации, и новых, более эффективных и безопасных методов ТГСК. В этой связи представляется этически оправданным включение всех пациентов с ЮММЛ в исследования II-III фазы новых медикаментозных и немедикаментозных методов лечения. На основании проведенного анализа предложена новая стратификация на группы риска и алгоритм выбора терапии. Рис. 20.
Гистиоцитоз из клеток Лангерганса
Клинико-лабораторная характеристика группы пациентов с ГКЛ
В анализ результатов терапии включены 11 пациентов с МоноС, 7 пациентов с МСОР- и 30 пациентов с МСОР+. Исходная клинико-лабораторная характеристика 48 пациентов с ГКЛ, включенных в анализ результатов терапии, представлена в табл. 15 и 16.
Результаты молекулярно-генетического исследования
Из 37 исследованных образцов в 9 (24,3%) была выявлена мутация V600E BRAF. Рис. 21.
Клинико-генетическое сопоставление
Клиническая характеристика пациентов, включенных в молекулярно-генетическое исследование, представлена в табл.17. Существенной корреляции клинических характеристик и мутации V600E BRAF выявлено не было.
| Таблица 15. ГКЛ: исходная характеристика, n = 48 (анализ результатов терапии) | ||||||
| | МСОР+ n = 30 | МСОР- n = 7 | МоноС n = 11 | |||
| | медиана | разброс | медиана | разброс | медиана | разброс |
| Возраст манифестации, месяцев | 8,5 | 0-16,7 лет | 20 | 5-7лет | 27 | 2-12 лет |
| Возраст диагноз, месяцев | 20 | 2,8-17 лет | 36 | 20-8,7 лет | 33 | 12-12 лет |
| Интервал манифестация - диагноз, месяцев | 4,7 | 0,2 - 30 | 8 | 1,5 - 30 | 4,8 | 1-11 |
| Число пораженных органов, n | 5 | 2-8 | 2 | 2-3 | | |
| | n | % | n | % | n | % |
| Пол, м:ж | 17:13 | 56:44 | 7:0 | 100:0 | 5:6 | 44 |
| Скелет | 12 | 40 | 6 | 85 | 10 | 91 |
| Кожа | 27 | 90 | 5 | 71 | 1 | 9 |
| Лимфоузлы | 9 | 30 | - | - | - | - |
| Несахарный диабет | 3 | 10 | 4 | 57 | - | - |
| Наружный отит | 12 | 40 | - | - | - | - |
| Печень | 27 | 90 | - | - | - | - |
| Селезенка | 27 | 90 | - | - | - | - |
| Легкие | 15 | 50 | - | - | - | - |
| Кроветворение | 22 | 73 | - | - | - | - |
| Щитовидная железа | 1 | 3,3 | - | - | - | - |
| Слюнные железы | 1 | 3,3 | 1 | 14 | - | - |
| ЦНС | 2 | 6,6 | - | - | - | - |
| ЖКТ | 3 | 10 | - | - | - | - |
| Таблица 16. Характеристика пациентов с МСОР+ ГКЛ, n = 30 | |||
| | Медиана | Минимум | Максимум |
| Гепатомегалия, см | 6 | 2 | 10 |
| Спленомегалия, см | 7 | 0,5 | 12 |
| Лейкоциты, х109/л | 5,3 | 0,7 | 16,2 |
| Гранулоциты, х109/л | 3,3 | 0,1 | 14,2 |
| Гемоглобин, г/л | 80 | 53 | 149 |
| Тромбоциты, х109/л | 65 | 2,0 | 687 |
| Альбумин, г/л | 27 | 18 | 48 |
| ЩФ, МЕ/л | 286 | 40 | 3770 |
| АЛТ, МЕ/л | 25 | 4 | 251 |
| АСТ, МЕ/л | 26 | 5 | 326 |
| Билирубин, мкмоль/л | 16 | 4 | 236 |
| Фибриноген, г/л | 2,7 | 1,15 | 4,7 |
| АЧТВ, секунд | 34 | 15 | 180 |
| ПИ, % | 87 | 28 | 96 |
| Число вовлеченных органов, n | 5 | 2 | 8 |
| Возраст манифестации, месяцев | 8,5 | 0,0 | 200,5 |
| Возраст начала терапии, месяцев | 19,9 | 3,4 | 206,2 |
| Интервал манифестация -терапия, месяцев | 4,6 | 0,1 | 30,2 |
 |  |
 | 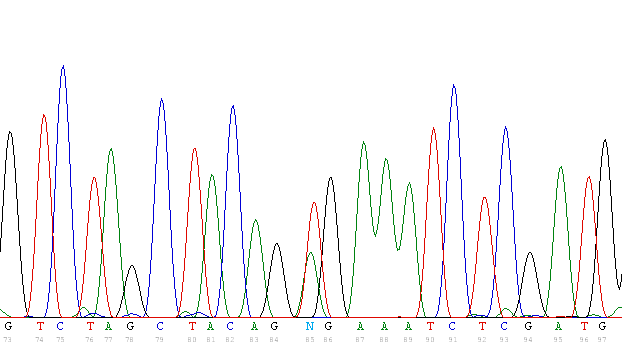 |
| Рисунок 21. Мутация V600E BRAF в образце пациента с ГКЛ. | |
Результаты терапии
18-летняя рОВ во всей группе пациентов с ГКЛ составила 82±5%. рБСВ во всей группе пациентов с ГКЛ составила 49±9%. Рис.22
| Таблица 17. Сравнение клинических характеристик в зависимости от наличия мутации BRAF V600E. | |||||
| | BRAF V600E - (n -21) | BRAF V600E+ (n-9) | р | ||
| | n | % | n | % | |
| МСОР+ | 7 | 33 | 4 | 44 | 0,68 |
| МСОР- | 3 | 14 | 3 | 33 | 0,32 |
| МоноС | 11 | 52 | 2 | 22 | 0,23 |
| скелет | 11 | 52 | 3 | 33 | 0,44 |
| кожа | 7 | 33 | 4 | 33 | 1 |
| л/у | 5 | 24 | 4 | 33 | 0,39 |
| печень | 5 | 24 | 4 | 33 | 0,39 |
| гемопоэз | 2 | 10 | 4 | 33 | 0,049 |
| легкие | 3 | 14 | 2 | 22 | 0,62 |
| селезенка | 5 | 24 | 4 | 44 | 0,39 |
| НД | 2 | 10 | 0 | 0 | 1 |
| жив | 16 | 80 | 8 | 88 | 1 |
| возраст манифестации, мес (медиана, разброс) | 16,5 | 1-110 | 28 | 0-153 | 0,98 |
