Молекулярно-генетическая диагностика и дифференцированная терапия гистиоцитарных пролиферативных заболеваний у детей 14. 01. 08 педиатрия 14. 01. 21 гематология и переливание крови
| Вид материала | Автореферат |
СодержаниеСтатистический анализ Результаты исследования Результаты молекулярно-генетического исследования Клинико-генетическое сопоставление Результаты терапии |
- Молекулярно-генетическая природа первичных гемофагоцитарных лимфогистиоцитозов в россии, 381.26kb.
- Аллогенная трансплантация гемопоэтических стволовых клеток в лечении врожденных и приобретенных, 1375.99kb.
- Факторы риска и контроль вирусных инфекций после трансплантации гемопоэтических стволовых, 767.07kb.
- Красняков Владимир Кириллович Совершенствование донорства крови и ее компонентов, 921.41kb.
- Прямое переливание крови (методические рекомендации), 154.15kb.
- Оптимизация инновационных технологий трансфузионного пособия пациентам регионального, 1245.79kb.
- Неопухолевые лимфаденопатии. 14. 00. 29 гематология и переливание крови, 1061.02kb.
- Обеспечение качества получения и клинического применения компонентов крови в субъекте, 404.49kb.
- кальцинированный аортальный стеноз-состояние системного гемостаза и реологических, 538.36kb.
- Иммуногематологическая оценка методов гемокомпонентной терапии у онкологических больных, 340.82kb.
| Таблица 4 Характеристики и процедуры ТГСК в группе пациентов с ювенильным миеломоноцитарным лейкозом | ||||||||||
| | Донор1 | Источник ГСК2 | Доза NC, х108/кг | Кондиционирование5 | Проф РТПХ6 | | ||||
| 3.jmml | UCB | 2xПК | 2,5 | Treo 42 г/м2 | Mel 100 мг/м2 | Flu150 | Atgam90 | | Tacro 0,015 мг/кг | MMF 30 мг/кг |
| 13.jmml | UСB | 2xПК | 1,6 | Bu 20 мг/кг | | Cy120 мг/кг | Thy 10 мг/кг | | Tacro 0,015 мг/кг | MMF 30 мг/кг |
| 4.jmml | MUD | КМ | nd | Bu 16 мг/кг | Mel 100 мг/м2 | - | Thy7 мг/кг | | Tacro 0,015 мг/кг | Prn 1 мг/кг |
| 17.jmml | MUD | СКПК | 10 | Bu 16 мг/кг | Mel 140 мг/м2 | Cy120 мг/кг | Atg-F 40 мг/кг | | CsA 1 мг/кг | MMF 30 мг/кг |
| 29.jmml | MUD | КМ | 10 | Bu *19 мг/кг | Mel 140 мг/м2 | Flu150 мг/м2 | Thy 10 мг/кг | | Tacro 0,015 мг/кг | MMF 30 мг/кг |
| 43.jmml | MUD | СКПК | 22 | Bu 16 мг/кг | Mel 140 мг/м2 | Cy120 мг/кг | Atgam 90 мг/кг | | CsA 1 мг/кг | MMF 30 мг/кг |
| 18.jmml | MUD | КМ | 6 | Bu 16 мг/кг | Mel 140 мг/м2 | Flu150 мг/м2 | Thy 10 мг/кг | | Tacro 0,015 мг/кг | MMF 30 мг/кг |
| 1.jmml | MUD | СКПК | 5 | Bu 16 мг/кг | Mel 140 мг/м2 | Flu150 мг/м2 | Atgam 90 мг/кг | | Tacro 0,015 мг/кг | MMF 30 мг/кг |
| 35.jmml | MMRD | СКПК* | 11 | Bu *19 мг/кг | Mel 140 мг/м2 | Flu150 мг/м2 | Thy 5 мг/кг | | CsA 1 мг/кг | |
| 9.jmml | MMRD | СКПК* | 3,2 | Bu 16 мг/кг | Mel 100 мг/м2 | Flu150 мг/м2 | Atgam 60 мг/кг | AraC 10 г/м2 + Mit 30мг/м2 | CsA 1 мг/кг | |
| 52.jmml | MMRD | СКПК* | 2,3 | Bu 16 мг/кг | Mel 100 мг/м2 | Flu150 мг/м2 | Thy 6 мг/кг | AraC 10 г/м2 + Mit 30мг/м2 | | |
| 47.jmml | MMRD | КМ | 5,6 | Bu *19 мг/кг | Mel 140 мг/м2 | Flu150 мг/м2 | Thy 5 мг/кг | | CsA 1 мг/кг | MMF 30 мг/кг |
| 6.jmml | MSD | КМ | 7,8 | Bu 16 мг/кг | Mel 140 мг/м2 | Cy120 мг/кг | | | CsA 1 мг/кг | MMF 30 мг/кг |
| 48.jmml | MSD | ПК | 0,05 | Bu 16 мг/кг | Mel 140 мг/м2 | Cy120 мг/кг | | | CsA 1 мг/кг | |
| 57.jmml | MSD | КМ | 3,1 | Treo 42 г/м2 | Mel 100 мг/м2 | Flu150 мг/м2 | | | CsA 1 мг/кг | |
| 31.jmml | MSD | КМ | 12 | Bu 16 мг/кг | Mel 140 мг/м2 | Flu150 мг/м2 | | | CsA 1 мг/кг | |
| 46.jmml | MSD | СКПК | 19 | Bu 16 мг/кг | VP-16 500 мг/м2 | Cy120 мг/кг | | | CsA 1 мг/кг | MTX6 |
| 1 UCB - неродственная пуповинная кровь, MSD – совместимый сиблинг, MUD – неродственный совместимый донор, MMRD – родственный частично совместимый донор 4 ПК – пуповинная кровь, КМ – костный мозг, СКПК - стволовые клетки периферической крови, * - селекция CD34+ клеток 5 Treo – треосульфан, Mel – мельфалан, Flu – флударабин, Bu – бусульфан,Thymo – тимоглобулин, Cy– циклофосфамид, Atg-F – АТГ-Фрезениус, VP-16 – этопозид, AraC – цитозина арабинозид, Mit - митоксантрон, Bu* – бусульфан для внутривенного введения, Atgam – атгам. 6 Tacro – такролимус, CsA – циклоспорин А, доза 1 мг/кг/сутки, MMF – мофетила микофенолят, MTX – метотрексат, доза 15 мг/м2 день +3, 10 мг/м2 – день +6, +11. | ||||||||||
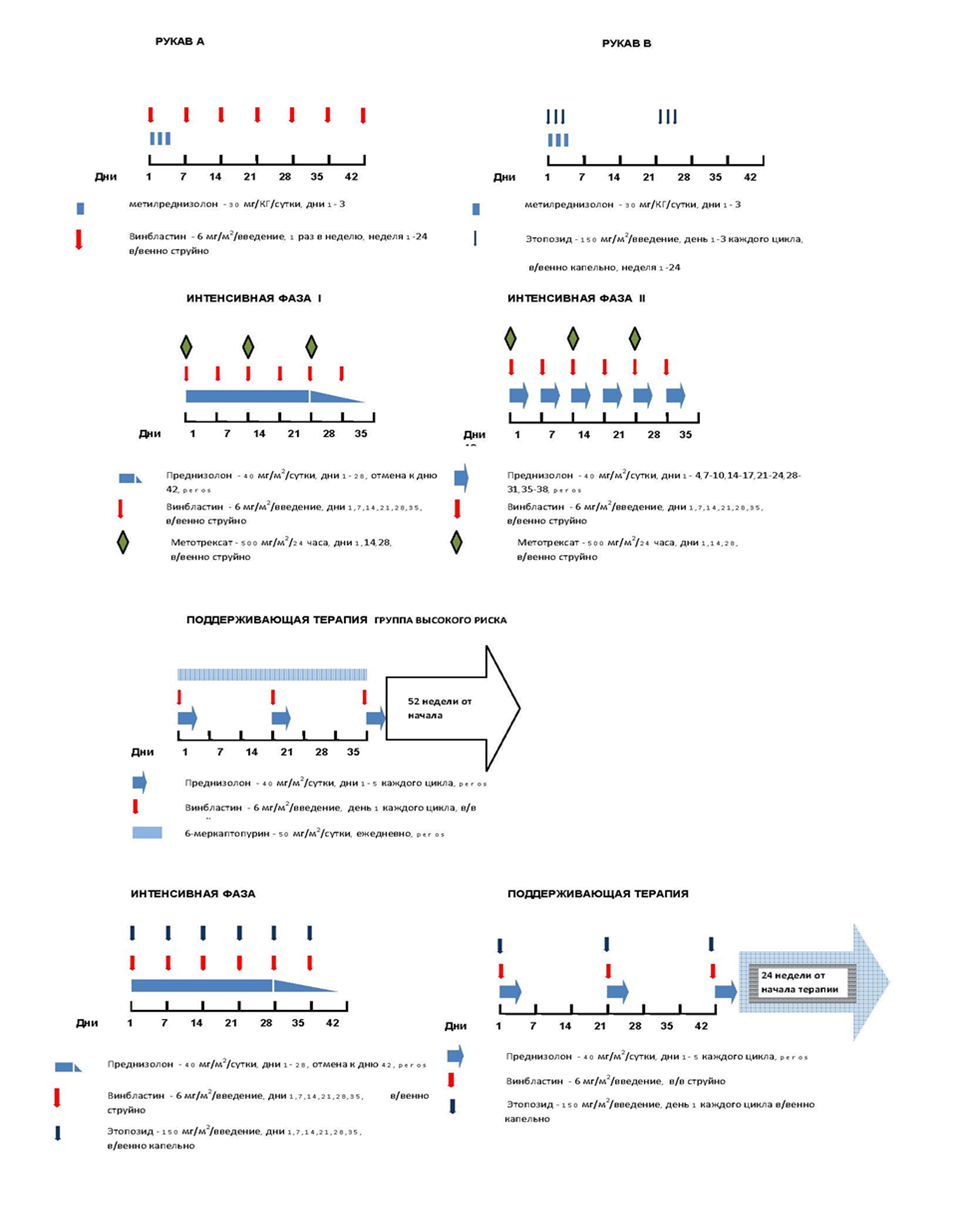 |
| Рисунок 2 Схема терапии ГКЛ в соответствии с протоколами LCH-I, LCH-II, LCH-III |
 |
| Рисунок 3 Терапевтическая схема пилотного протокола для пациентов с МСОР+ ГКЛ |
Статистический анализ выполнен в программе Statistica 7.0, StatSoft и в программе InStat, GraphPad. Функция выживаемости и кумулятивная вероятность наступления анализируемого события рассчитана по методу Kaplan-Meier. Пациенты, живущие в ремиссии на момент анализа данных, цензурированы 01.01.2011. Сравнение медиан выполнено при помощи теста Mann-Whitney, сравнение разности долей, расчет относительного риска – при помощи точного теста Fisher. При анализе факторов прогноза сравнение функции выживаемости выполнялось при помощи log-rank теста. При анализе метрических переменных формировали две группы по отношению к медиане (1 - , 2 - >). Статистически значимыми считались различия при p < 0,05.
Результаты исследования
Клинико-лабораторная характеристика группы пациентов с ПГЛГ
Исходная клинико-лабораторная характеристика 34 пациентов с клиническим диагнозом ПГЛГ представлена в табл. 6.
| Таблица 6 Клиническая характеристика группы пациентов с ПГЛГ | ||
| | Все, n = 34 | |
| медиана | разброс | |
| Возраст манифестации | 9,6 | 0,5-116 |
| Возраст диагноза | 14,7 | 1 |
| Интервал диагноз-манифестация | 1,6 | 0,3-134 |
| OS, месяцев | 90,4 | 0,4-171 |
| Пол, м:ж | 22:10 | |
| | n | % |
| Гемофагоцитоз | 14 | 43 |
| ЦНС-поражение | 26 | 81 |
| | ||
| Полный ответ на ИСТ | 7 | 27 |
| Частичный ответ на ИСТ | 14 | 54 |
| Рефрактерность | 5 | 19 |
| ТГСК | 12 | 37,5 |
Результаты молекулярно-генетического исследования
В результате исследования выявлен 1 пациент с компаунд-гетерозиготной мутацией в гене PRF1 ранее описанная миссенс-мутация c.916G>T (p.306Gly>Cys), приводящая к изменению аминокислотной последовательности в области MAC домена, и ранее не описанная нонсенс-мутация c.1283G>A (p.428 Trp>Stop), приводящая к образованию преждевременного стоп-кодона в области, кодирующей С2 домен белка. Последовательность гена UNC13D проанализирована у 25 пациентов. Выявлено 10 пациентов с би-аллельными мутациями в гене UNC13D. Из них 1 пациент с гомозиготной мутацией и 9 – компаунд-гетерозиготы. У 3 пациентов выявлены мутации в гене UNC13D в гетерозиготном состоянии. Среди выявленных мутаций 9 впервые описаны в данной работе. У одного пациента была выявлена не описанная ранее мутация c.675_679del во втором экзоне гена STX11 у пациента GL9 гомозиготном состоянии. Обнаруженная мутация приводит к делеции трех аминокислот, вставке одной новой, исчезновению стоп-кодона и, предположительно, к образованию более длинной мРНК (p.H225_L227delinsHFsX127). При исследовании кодирующих последовательностей гена RAB27A не было выявлено ни одной мутации. При исследовании кодирующих последовательностей гена STXBP не было выявлено ни одной мутации. При исследовании кодирующей последовательности гена SH2D1A были обнаружены две мутации c.164G>T (p.55Arg>Leu) CD014961 у пациента GL14 и c.245_246insA (p.N82KFsX21) CI034488 у пациента GL34. При исследовании данной группы пациентов в гене BIRC4 мутации выявлены не были. Таким образом, наиболее распространенным генетическим вариантом ПГЛГ в группе российских пациентов является FHL3. Если исключить из анализа пациентов с верифицированным Х-ЛПС, то относительная частота пациентов с мутациями в гене UNC13D составляет 54%, PRF1 – 4 %, STX – 4%. Рис. 4. Все выявленные мутации суммированы в табл.7. При исследовании кодирующей последовательности гена UNC13D выявлены две повторяющиеся мутации (делеция c.2346_2349del - на четырех хромосомах, инсерция c.3037insG – на пяти хромосомах). Показано, что хромосомы, несущие мутацию c.2346_2349del, имеют общий гаплотип D17S1839-D17S1603-D17S785: 1-2-3. Для всех хромосом с мутацией c.3037insG также был выявлен общий гаплотип D17S1301-D17S1839-D17S1603: 2-6-7. Можно предположить, что данные гаплотипы являются сохранившимися частями гаплотипов хромосом, на которых исходно в популяции возникли мутации
Клинико-генетическое сопоставление
Результаты сравнения исходных клинических и лабораторных показателей в группе пациетов с мутациями в UNC13D в сравнении с другими и неустановленными вариантами ПГЛГ представлены в табл. 8. Существенных различий в клинико-лабораторной презентации и исходе заболевания в исследованных группах не выявлено. Рис. 5.
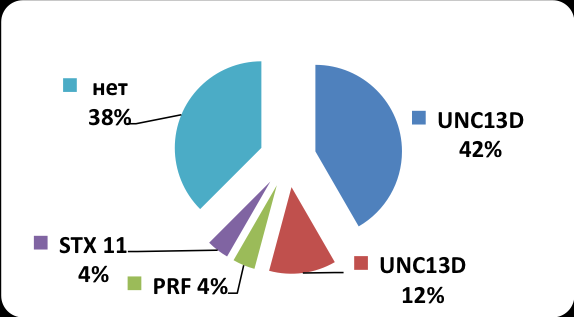 |
| Рисунок 4 Частотное распределение генетических вариантов ПГЛГ в группе российских пациентов |
Результаты терапии
Иммуносупрессивная терапия. Из 32 пациентов с ПГЛГ 2 не получили ИСТ и умерли от прогрессии заболевания. В 3 случаях ответ на терапию не подлежал оценке в связи с ранней смертью пациентов. Из 27 пациентов 6 (22%) не ответили на терапию, 7 (26%) достигли статуса ПО и 14 (52%) достигли статуса ЧО. Одна пациентка остается в ремиссии заболевания на сроке 40 месяцев от начала терапии и 15 месяцев от окончания. Реактивация заболевания развилась у 20 (95%) пациентов с медианой 5 месяцев, из них у 5 после окончания терапии, у 16 во время терапии первой линии. ИСТ второй линии получили 26 пациентов. ТГСК была выполнена 12 пациентам.
| Таблица 7 Результаты генетического обследования группы российских пациентов ПГЛГ | |||||
| Пациент | Ген | Выявленные мутации | Изменение аминокислотной последовательности | Ссылки | экзон/ интрон |
| GL16 | PRF1 | c.916G>T c.1283G>A | p.G306C p.W428X | Trizzino et al 2008 Trizzino et al 2008 | экзон 3 экзон 3 |
| GL1 | UNC13D | c.2346_2349del c.3037insG | p.R782SFsX11 p.D1013GFsX11 | E Rudd et al 2008 новая | экзон 24 экзон 31 |
| GL2 | UNC13D | c.3037insG c.3173T>C | p.D1013GFsX11 p.L1058P | новая новая | экзон 31 экзон 32 |
| GL3 | UNC13D | c.627delT c.1828insA | p.T209TFsX40 p.R610HFsX6 | E Rudd et al 2008 новая | экзон 8 экзон 20 |
| GL4 | UNC13D | c.322-1G>A CD042833 c.3037insG | Splice error p.D1013GFsX11 | Santoro et al 2006 новая | интрон 4 экзон 31 |
| GL5 | UNC13D | c.2216_2239del c.2346_2349del | p.N739_S747delinsS p.R782SFsX11 | новая E Rudd et al 2008 | экзон 23 экзон 24 |
| GL17 | UNC13D | c.3037insG c.3037insG | p. D1013GFsX11 p.D1013GFsX11 | новая новая | экзон 31 экзон 31 |
| GL19 | UNC13D | c.1592G>A c.2346_2349del | p.W531X p.R782SFsX11 | новая E Rudd et al 2008 | экзон 18 экзон 24 |
| GL27 | UNC13D | c.1055+5G>A c.2867C>T | Splice error p.956Pro>Leu | новая новая | интрон 12 экзон 30 |
| GL32 | UNC13D | c.919C>T c.2216- 2239del | p.307Gln>Stop p.N739_S747delinsS | новая новая | экзон 11 экзон 23 |
| GL33 | UNC13D | c.2346-2349 del c.3011T>C | p.R782SFsX11 p.1004Asp>Gly | E Rudd et al 2008 новая | экзон 24 экзон 31 |
| GL8* | UNC13D | c.2782C>T N | p.R928C no | E Rudd et al 2008 нет | экзон 29 нет |
| GL15* | UNC13D | c.2782C>T N | p.R928C no | E Rudd et al 2008 нет | экзон 29 нет |
| GL18* | UNC13D | c.1828insA N | p. R610HFsX6 no | новая нет | экзон 20 нет |
| GL9 | STX11 | c.675_679del c.675_679del | p.H225_L227delinsHFsX127 p.H225_L227delinsHFsX127 | новая новая | экзон 2 экзон 2 |
| GL14 | SH2D1A | c.164G>T CD014961 геми | p.R55L | Dutz et al 2001 | экзон 2 |
| GL34 | SH2D1A | c.245_246insA CI034488 геми | p.N82KFsX21 | Halasa et al 2003 | экзон 3 |
| * пациенты с одной выявленной мутацией | |||||
