Молекулярно-генетическая диагностика и дифференцированная терапия гистиоцитарных пролиферативных заболеваний у детей 14. 01. 08 педиатрия 14. 01. 21 гематология и переливание крови
| Вид материала | Автореферат |
- Молекулярно-генетическая природа первичных гемофагоцитарных лимфогистиоцитозов в россии, 381.26kb.
- Аллогенная трансплантация гемопоэтических стволовых клеток в лечении врожденных и приобретенных, 1375.99kb.
- Факторы риска и контроль вирусных инфекций после трансплантации гемопоэтических стволовых, 767.07kb.
- Красняков Владимир Кириллович Совершенствование донорства крови и ее компонентов, 921.41kb.
- Прямое переливание крови (методические рекомендации), 154.15kb.
- Оптимизация инновационных технологий трансфузионного пособия пациентам регионального, 1245.79kb.
- Неопухолевые лимфаденопатии. 14. 00. 29 гематология и переливание крови, 1061.02kb.
- Обеспечение качества получения и клинического применения компонентов крови в субъекте, 404.49kb.
- кальцинированный аортальный стеноз-состояние системного гемостаза и реологических, 538.36kb.
- Иммуногематологическая оценка методов гемокомпонентной терапии у онкологических больных, 340.82kb.
Трансплантация гемопоэтических стволовых клеток. Всего выполнено 13 ТГСК у 12 пациентов, 12 первичная и 1 повторная.
Приживление и химеризм
Приживление трансплантата зарегистрировано у всех пациентов. Медиана интервала времени до приживления составила 17 дней (11–28 дней). У 1 пациента (№6) развилось раннее отторжение трансплантата. Стойкое первичное приживление трансплантата достигнуто у 11 (91,2%) из 12 пациентов. Анализ гемопоэтического химеризма выполнен у 10 из 12 пациентов, из них у 9 (90%) пациентов констатирован стойкий полный донорский химеризм, у 1 (10%) пациента после немиелоаблативного кондиционирования – стабильный смешанный химеризм (10% собственных клеток реципиента).
| Таблица 8 Клинико-генетическое сопоставление ПГЛГ | ||||
| UNC13D, n = 15 | PRF1, STX, неуточненные, n = 17 | p = | ||
| медиана | разброс | медиана | разброс | |
| 4,2 | 1-116 | 14,3 | 0,7-104 | 0,7724 |
| 186 | 1,9-148 | 17,2 | 1-186 | 0,7346 |
| 1,38 | 0,3-55 | 1,6 | 0,5-134 | 0,5873 |
| 7,8 | 0,8-94 | 12,8 | 0,4-171 | 0,2191 |
| 9:6 | | 13:4 | | 0,4501 |
| n | % | n | % | |
| 10 | 64 | 4 | 25 | 0,099 |
| 12 | 81 | 14 | 81 | 1,0 |
| | ||||
| 3 | 23 | 4 | 30 | 1,0 |
| 8 | 62 | 6 | 46 | 0,6951 |
| 2 | 15 | 3 | 23 | 1,0 |
| 6 | 46 | 6 | 35 | 1,0 |
Инфекционные осложнения и висцеральная токсичность. Цитомегаловирусная (ЦМВ) - виремия была выявлена у 8 (72,7%) из 11 пациентов, упреждающая терапия ЦМВ-реактивации ганцикловиром была эффективна у 7 пациентов. Реактивация инфекции вирусом Эпштейн-Барр (ЭБВ) была выявлена у 1 (12,5%) из 8 пациентов, терапия ритуксимабом (4 введения по 375 мг/м2) оказалось неэффективной. ВОБ печени не выявлена ни у одного пациента.
РТПХ. Острая РТПХ II–IV степени была зарегистрирована у 7 (70%) из 10 пациентов, III–IV степени – у 3 (30%) пациентов. Хроническая экстенсивная РТПХ развилась у 1 пациента, лимитированная – у 2 пациентов.
Анализ летальности. В посттрансплантационном периоде умерли 7 (58,3%) из 12 пациентов. Причиной смерти 1 пациента (№5) явилось основное заболевание. Шесть пациентов умерли от токсичности, ассоциированной с процедурой ТГСК, из них 1 пациент (№2) от РТПХ и инвазивного микоза, 1 пациент (№4) от острого повреждения легких, 1 пациент (№6) от ЭБВ-ассоциированного посттрансплантационного лимфопролиферативного заболевания (ПТЛЗ), 1 пациент (№7) от септического шока, 1 пациент (№9) от острой печеночной недостаточности, обусловленной реактивацией вирусного гепатита В на фоне цирроза печени, 1 пациент (№10) от идиопатического пневмонита. Трансплантационная смертность (рTRM) составила, таким образом, 54 ± 15% (рис. 2). Летальность в первые 100 дней после ТГСК составила 3 из 12 (25%). При использовании режимов кондиционирования со сниженной интенсивностью умерли 3 из 4 пациентов.
Общая выживаемость. На момент анализа данных 5 пациентов живы и находятся в ремиссии при длительности от 1,9 месяца до 13,6 лет (162,6 месяца), медиана 6,6 лет. 5-летняя рОВ составила 37 ± 14%. Рис. 6
Общий анализ результатов терапии
Медиана наблюдения 32 пациентов с ПГЛГ составила 9 (0,3-171) месяцев. На момент анализа результатов терапии были живы 6 пациентов. 5-летняя pОВ составила 12 ± 7 % . Рис.7 При анализе потенциальных факторов прогноза исследованы следующие показатели: пол, возраст на момент начала заболевания, ответ на ИСТ первой линии, генетический вариант ПГЛГ, выполнение ТГСК. Показано, что единственным фактором, достоверно влияющим на ОВ, явилась ТГСК, рОВ = 30±16% vs 0%, log-rank p = 0,0005. Рис. 8.
Обсуждение
Представленные результаты демонстрируют, что генетическая структура ПГЛГ в России уникальна и характеризуется преобладанием генетического субварианта FHL3. Несмотря на то, что исследование не является популяционным с точки зрения формирования выборки, анализируемая группа пациентов является наиболее крупной в стране и может считаться репрезентативной. Доминирование мутаций в гене UNC13D обусловлено, по крайней мере частично, «эффектом основателя», то есть закрепленим и распространеним в популяции двух мутаций, делеции c.2346_2349del и инсерции c.3037insG. Эти мутации составляют 48% от всех выявленных генетических дефектов в гене UNC13D и 34% от всех идентифицированных мутаций. Выявление в популяции пациентов с клиническим диагнозом ПГЛГ двух больных с Х-ЛПС подчеркивает необходимость включения Х-ЛПС в дифференциальный диагноз у всех пациентов мужского пола с ПГЛГ. Результаты генетического исследования позволяют предложить исследование частых мутаций в гене UNC13D в качестве первого этапа молекулярной диагностики ПГЛГ. С целью оптимизации расходов на поисковую молекулярную диагностику необходимо внедрение проточной цитометрии в качестве этапа комплексной клинико-лабораторной диагностики ПГЛГ в соответствии с разработанным алгоритмом. Рис. 9. При отсутствии возможности функционального анализа, вторым этапом молекулярно-генетической диагностики должно стать прямое секвенирование всех экзонов гена UNC13D, далее – исследование других генов. Анализ результатов терапии показал, что контроль заболевания, достигаемый ИСТ, является кратковременным и не обеспечивает долгосрочной выживаемости и что ТГСК является единственным методом терапии, способным обеспечить выздоровление пациентов с ПГЛГ.
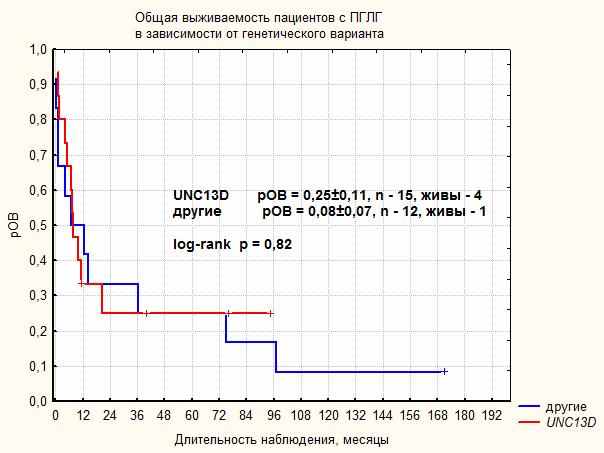 |
| Рисунок 5 Сравнениее общей выживаемости в зависимости от генетического варианта ПГЛГ |
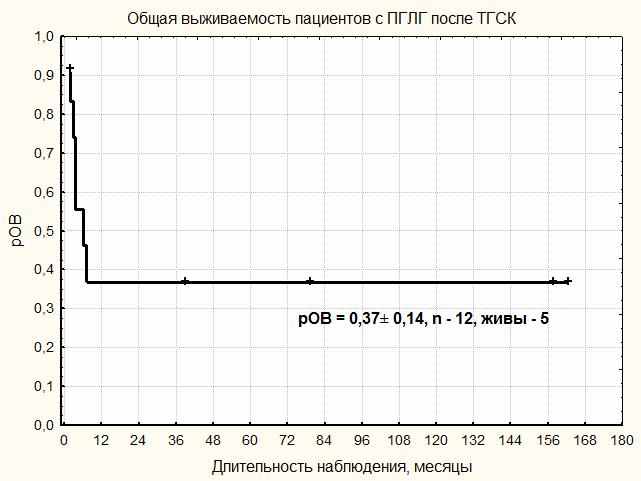 |
| Рисунок 6 Общая выживаемость пациентов с ПГЛГ после ТГСК |
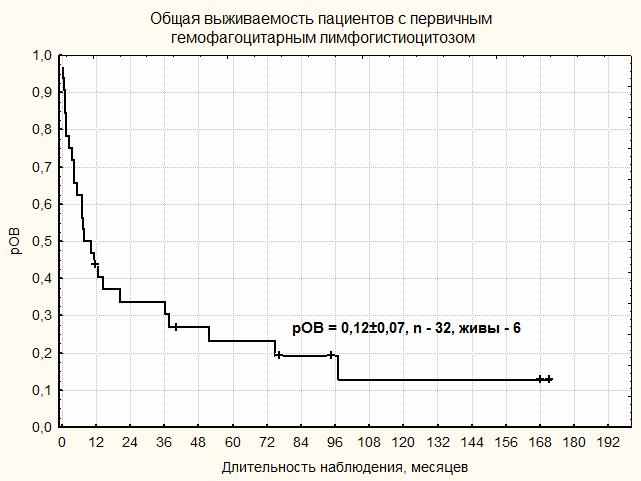 | |
| Рисунок 7. Общая выживаемость пациентов с ПГЛГ | |
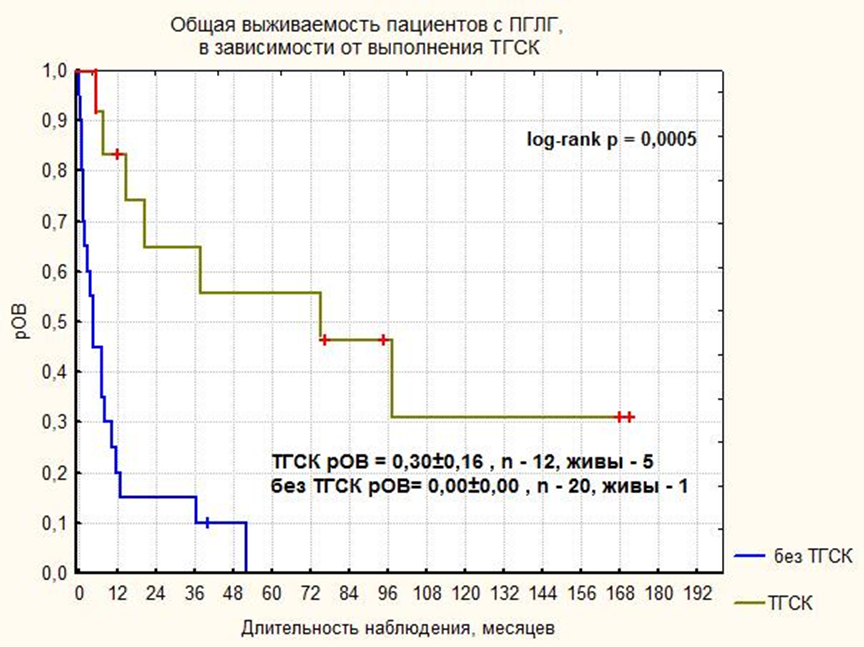 | |
| Рисунок 8. Общая выживаемость пациентов с ПГЛГ в зависимости от ТГСК | |
| | |
Сравнение результатов ТГСК в группе российских пациентов с опубликованными результатами зарубежных исследований подтверждает, что трансплантационная смертность является основным препятствием к успеху ТГСК. Высокая токсичность обусловлена, вероятно, кумулятивным воспалительным повреждением органов при повторных реактивациях ПГЛГ и инфекционными осложнениями длительной иммуносупрессии. Показатель рОВ во всей группе пациентов с ПГЛГ отражает готовность отечественной педиатрической и гематологической службы к решению задачи своевременной диагностики и эффективной терапии пациентов с ПГЛГ. Только 7 из 32 пациентов генетический диагноз установлен при жизни. Неправильный инициальный клинический диагноз был установлен 16 (50%) пациентам. Доля пациентов с ПГЛГ, которым была выполнена ТГСК составила лишь 37,5%. Медиана длительности интервала от установления диагноза до ТГСК составила 14,6 месяцев (2,9-109), для сравнения – в зарубежных исследованиях - медиана 3,5-9 месяцев. Ни один пациент не получил ТГСК в первой ремиссии. Активность заболевания сохранялась на момент ТГСК у 66% пациентов. На основании представленных данных с целью улучшения результатов терапии разработан алгоритм ведения пациентов с клиническим диагнозом ПГЛГ. Рис. 10. Мы полагаем, что наиболее принципиальной позицией является выполнение ТГСК на сроке не позднее 4 месяцев от установления диагноза. Указанный срок обоснован балансом между средним временем поиска неродственного донора и медианой интервала до реактивации заболевания.
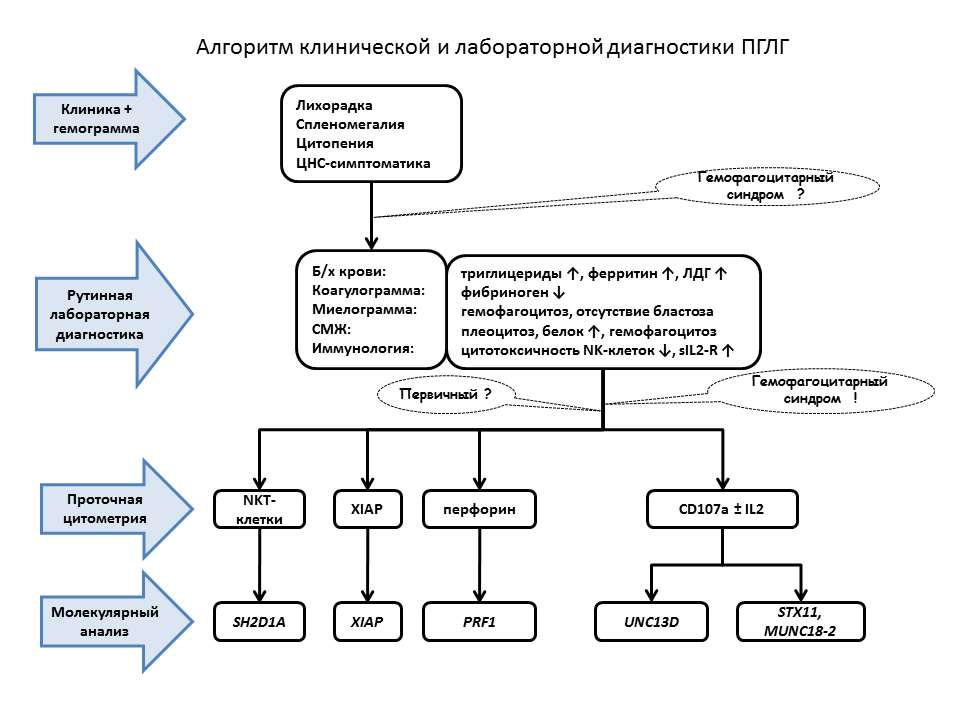 |
| Рисунок 9. Алгоритм клинической и лабораторной диагностики ПГЛГ |
Ювенильный миеломоноцитарный лейкоз
Клинико-лабораторная характеристика группы пациентов с ЮММЛ
Исходная общая и клинико-лабораторная характеристика 61 пациента с ЮММЛ представлена в табл. 9 и 10
Результаты молекулярно-генетического исследования Для молекулярно-генетического исследования были доступны 44 образца биоматериала, в 7 случаях амплификация целевых фрагментов была неэффективна, в 13 были выявлены мутации в гене PTPN11, в 5 - в гене CBL, в 5 – в гене NRAS, в 4 - в гене KRAS, в 10 образцах изменения нуклеотидной последовательности не выявлены, из них в 3 случаях установлен клинический диагноз «нейрофиброматоз I типа». Распределение генетических вариантов в группе пациентов с ЮММЛ представлено на рис. 11.
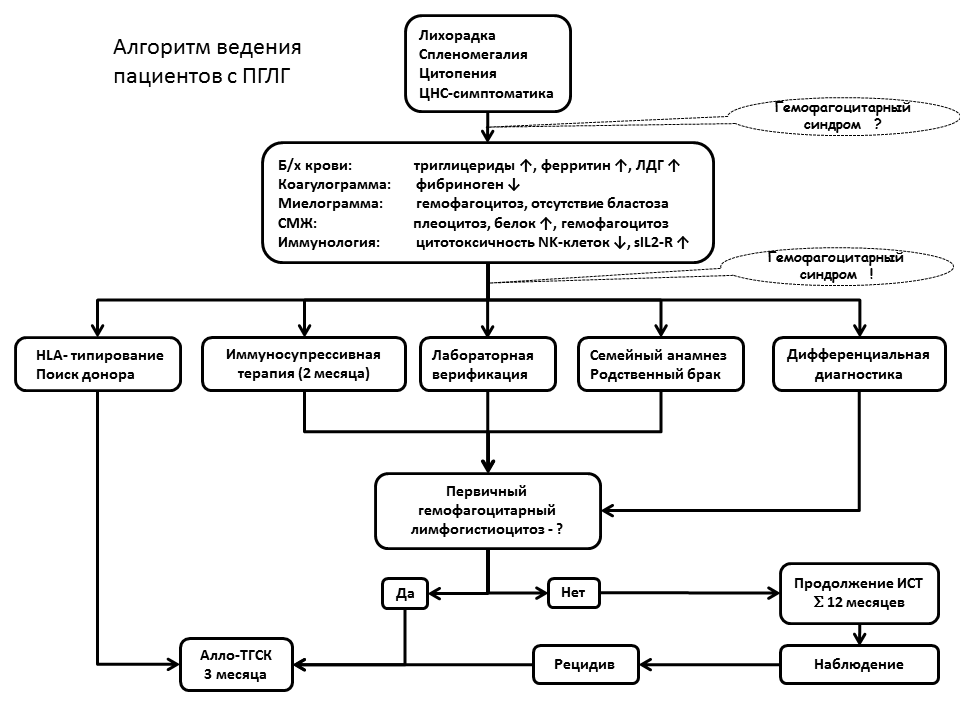 |
| Рисунок 10. Алгоритм диагностики и выбора терапии у пациентов с ПГЛГ |
Детальная информация о выявленных мутациях представлена в табл. 11. Все выявленные мутации описаны при ЮММЛ и других опухолях гемопоэтического происхождения. При анализе линейного распределения выявленных мутаций показано, что мутации выявляются во всех исследованных линиях дифференцировки миелоидных и лимфоидных клеток. Рис. 12
Клинико-генетическое сопоставление
Результаты сравнения исходных клинических и лабораторных показателей в группах с различным генетическим субвариантом ЮММЛ представлены в табл. 12 . Показано, что клинико-лабораторная презентация различных генетических вариантов практически идентична. Исключением являются возраст манифестации заболевания: медиана 24 месяца в группе PTPN11 в сравнении с 6,7 месяцев в группе RAS, p = 0,0252, и содержание HbF: 21% в группе PTPN11 в сравнении с 4,6% в группе RAS, p = 0,0008, и 5,5% в группе CBL, p = 0,0059. Показано, что возраст манифестации 1 год и содержание фетального гемоглобина 10% могут быть использованы как пороговые значения для предсказания генетического варианта ЮММЛ табл. 13.
| Таблица 9. Общая исходная характеристика ЮММЛ | | |||
| | Данные доступны, n | n | % | |
| Пол, м:ж | 61 | 39:22 | 36:64 | |
| Гепатомегалия | 61 | 61 | 100 | |
| Спленомегалия | 61 | 61 | 100 | |
| Лимфаденопатия | 60 | 57 | 95 | |
| Сыпь | 60 | 36 | 60 | |
| Нейрофиброматоз I типа | 61 | 6 | 10 | |
| ГМ-колонии | 43 | 31 | 72 | |
| Нормобласты, кровь | 60 | 36 | 60 | |
| Аномалии кариотипа | 33 | 12 | 36 | |
| Терапия | | |||
| ДТ (13-RA) | 61 | 32 | 52 | |
| ВХТ | 61 | 18 | 29 | |
| Без терапии | 61 | 7 | 11 | |
| Другая | 61 | 4 | 6 | |
| ТГСК | 61 | 21 | 34 | |
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| | ||||
| Таблица 10. ЮММЛ: исходная клинико-лабораторная характеристика, n = 61 | ||||
| | n | медиана | минимум | максимум |
| Возраст манифестации, месяцев | 61 | 12,2 | 0,5 | 97 |
| Возраст диагноза, месяцев | 61 | 20,3 | 1,1 | 102,5 |
| Гепатомегалия, см | 60 | 5 | 2 | 12 |
| Спленомегалия, см | 61 | 7 | 3 | 17 |
| Лейкоциты, х109/л | 61 | 32 | 4,2 | 132 |
| Моноциты, х109/л | 61 | 5,2 | 1,0 | 33,8 |
| Тромбоциты, х109/л | 61 | 39 | 4 | 377 |
| Бласты, кровь, % | 61 | 2 | 0 | 50 |
| Незрелые гранулоциты, кровь, % | 60 | 9 | 0 | 42 |
| Гемоглобин F, % | 48 | 9,5 | 0 | 87 |
| ЛДГ, МЕ/л | 52 | 498 | 120 | 1977 |
| Бласты, к/м, % | 61 | 6,2 | 0,8 | 20 |
Результаты терапии
Дифференцировочная терапия Тридцать два пациента получили ДТ в качестве терапии первой линии, 2 пациента были потеряны из-под наблюдения, 3 не подлежали оценке. Из 27 пациентов клинически значимый ответ был получен у 12 (44%) пациентов (ПО -2, ЧО - 10). У 11 пациентов, ответивших на ДТ, достигнутый ответ сохранился до окончания наблюдения (n = 8) или до выполнения ТГСК (n = 3). Трем пациентам, находящимся в статусе ЧО, была выполнена ТГСК от MUD (n = 2) или MSD (n = 1). У 1 пациента (22.jmml), находившегося в статусе ПО, через 8 лет от окончания ДТ развился Т-линейный острый лимфобластный лейкоз. У 1 пациента (50.jmml), находившегося в статусе ПО, через 2 года от окончания ДТ развилась аутоиммунная ТТП.
 |
| Рисунок 11. Генетическая структура ЮММЛ |
| Таблица 11. Соматические мутации, выявленные у пациентов с ЮММЛ | ||||
| образец | ген | экзон | ДНК | Белок |
| 18.jmml.11 | CBL | 8 | T1111C | Tyr371His |
| 20.jmml.49 | | 8 | T1111C | Tyr371His |
| 22.jmml.46 | 8 | T1111C | Tyr371His | |
| 33.jmml.50 | 8 | G1151A | Cys384Tyr | |
| 38.jmml.16 | 8 | T1111C | Tyr371His | |
| 1.jmml.31 | KRAS | 2 | G38A | Gly13Asp |
| 7.jmml.52 | | 2 | G35A | Gly12Asp |
| 52.jmml.44 | 2 | G37T | Gly13Cys | |
| 43.jmml.3 | 3 | A182T | Glu61Leu | |
| 3.jmml.30 | NRAS | 2 | G38A | Gly13Asp |
| 29.jmml.9 | | 2 | G35A | Gly12Asp |
| 49.jmml.36 | 2 | G38A | Gly13Asp | |
| 53.jmml.24 | 2 | G36A | Gly12Asp | |
| 59.jmml.33 | 2 | G34T | Gly12Cys | |
| 6.jmml.2 | PTPN11 | 3 | G226A | Glu76Lys |
| 9.jmml.7 | | 3 | G181T | Asp61Tyr |
| 13.jmml.4 | 3 | A227G | GLu76Gly | |
| 15.jmml.17 | 13 | G1508С | Gly503Ala | |
| 25.jmml.25 | 3 | G181T | Asp61Tyr | |
| 28.jmml.19 | 13 | G1508T | Gly503Val | |
| 31.jmml.6 | 3 | A227T | Glu76Val | |
| 44.jmml.14 | 3 | C218T | Ala73Val | |
| 45.jmml.13 | 3 | A227G | Glu76Val | |
| 46.jmml.15 | 3 | A227C | Glu76Ala | |
| 47.jmml.29 | 3 | G226C | Glu76Gln | |
| 58.jmml.51 | 3 | G205A | Glu69Lys | |
| 60.jmml.18 | 13 | G1508T | Gly503Val | |
Пятнадцать пациентов не ответили на ДТ (СЗ – 8, ПЗ - 7), из них 6 в дальнейшем получили ВХТ и ТГСК, 2 – ТГСК, 4 – ВХТ, 3 – только ДТ. Исходные характеристики пациентов с разным ответом на ДТ представлены в таблице 14. Сравнение исходных характеристик показало, что в группе ДТ-R (ответившие на ДТ) медиана возраста манифестации и содержания HbF достоверно ниже, чем в группе ДТ-NR (не ответившие на ДТ). Генетический анализ показал, что в группе ДТ-R относительно преобладают пациенты с дефектами CBL и RAS в сравнении с PTPN11. Всего в группе ДТ умерли 19 (59%) пациентов, 14 от прогрессии заболевания, 5 от осложнений ТГСК. Среди пациентов, не ответивших на ДТ, 11 умерли, 9 от прогрессии заболевания, 2 от осложнений ТГСК. Четыре (26%) живы, 2 из них после успешной ТГСК, 2 – в статусе СЗ получают ДТ. Среди пациентов, ответивших на ДТ, 3 умерли от токсичности ТГСК, 9 (75%) живы и находятся в статусе ПО (n - 2) или ЧО (n - 7), из них 7 продолжают получать ДТ. 5-летняя рОВ в группе ДТ составила 38 ±11%. 5-летняя рОВ пациентов, ответивших на ДТ, составила 75±15% в сравнении с 5-летней рОВ = 9±8% пациентов, не ответивших на ДТ, log-rank p = 0,0005. Рис. 13.
| Таблица 13. Корреляция возраста, HbF и генетического варианта | ||||||||
| Возраст | HbF | Группа | Все, n | Молекулярный анализ, n | PTPN11 | RAS | CBL | |
| <1 года | <10% | 1 | 16 | 11 | 0 | 6 (54%) | 2 | |
| >10% | | 4 | 4 | 2 | 1 | 0 | ||
| Нет данных | | 10 | 8 | 2 | 1 | 1 | ||
| >1 года | <10% | | 10 | 8 | 2 | 1 | 2 | |
| >10% | 2 | 18 | 9 | 7 (77%) | 0 | 0 | ||
| Нет данных | | 3 | 0 | 0 | 0 | 0 | ||
| | ||||||||
| RAS (%) | 1 vs. 2 | P = 0,0141 | | | | |||
| PTPN11 (%) | P = 0,0005 | | | | ||||
При молекулярно-генетическом анализе пациентов с идентифицированным генетическим дефектом показано, что у пациентов, находящихся в статусе ПО, в динамике персистирует мутантный клон рис. 14.
Высокодозная химиотерапия. Восемнадцать пациентов получили в качестве терапии первой линии ВХТ. Медиана числа курсов ВХТ составила 2,5 (1-5). Один пациент умер от сепсиса до оценки ответа на терапию. Из 17 пациентов у 9 (53%) был зарегистрирован ответ на терапию (ЧО
| консенсус | ….CA GGT GGT GTT GGG…. |
| 2005 год | |
| Цельная кровь | 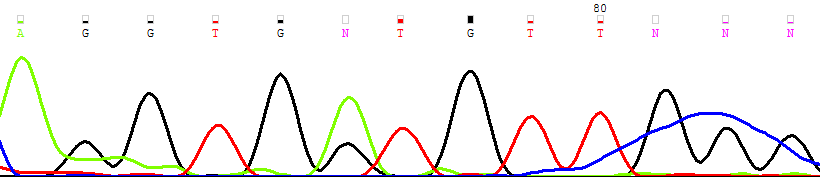 |
| 2010 год | |
| Цельная кровь | 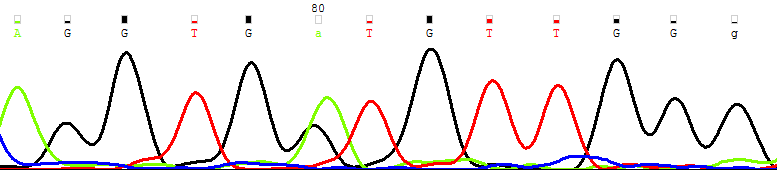 |
| CD19+ | 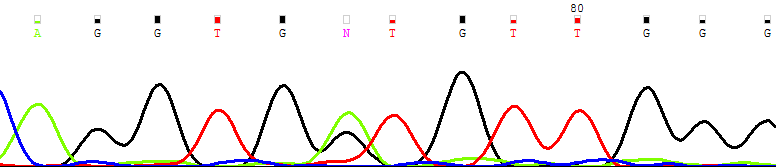 |
| CD15+ | 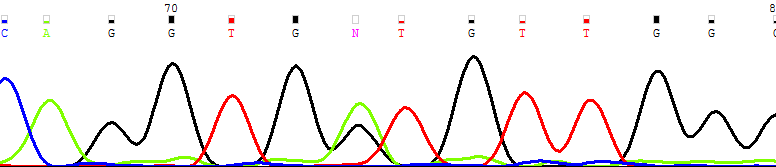 |
| CD3+ | 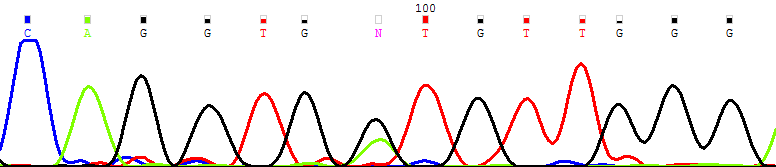 |
| CD34+ | 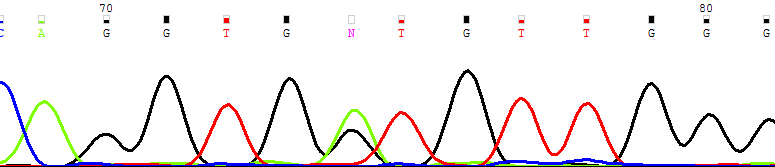 |
| CD14+ | 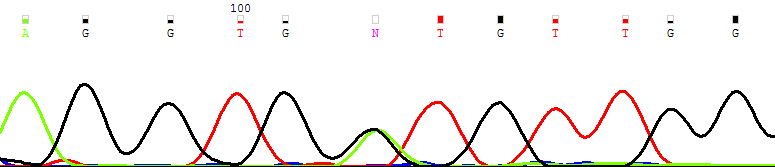 |
| буккальный эпителий |  |
| мать, цельная кровь | 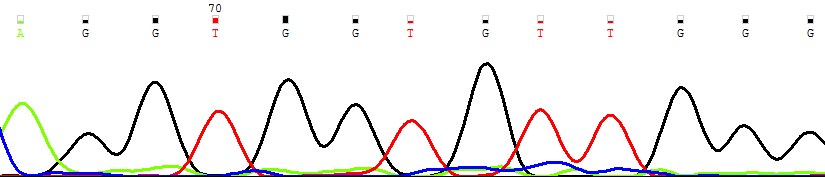 |
| отец, цельная кровь | 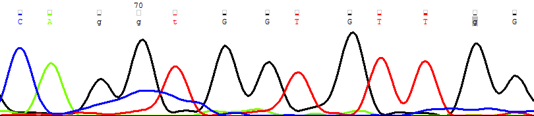 |
| Рисунок 12. Персистенция мутантного клона (NRAS G38A → Gly13Asp) в основных фракциях лимфоцитов и миелоидных клеток костного мозга | |
