I электрохимия
| Вид материала | Лабораторная работа |
- «Электрохимия, гальванотехника и обработка поверхности», посвященная 200-летию со дня, 94.6kb.
- Закономерности процесса фосфатирования магний-литиевых сплавов 02. 00. 05 электрохимия, 368.63kb.
- Рабочая учебная программа дисциплины Теоретическая электрохимия Направление подготовки, 468.83kb.
- Исследование влияния морфологии и химического состава поверхности ионообменных мембран, 332.73kb.
- Рабочая программа по дисциплине опд. Р. 01 «Электрохимическая синергетика», 157.53kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- Рабочая программа для подготовки инженеров по специальности 250300 "Технология электрохимических, 128.05kb.
- Электрохимические и физико-химические аспекты фиторемедиации сточных и промывных вод,, 396.8kb.
- Халькогенсодержащие органические соединения для преобразователей энергии и информации., 961.61kb.
Глава I
электрохимия
Лабораторная работа 1
Определение константы диссоциации уксусной кислоты
Краткая теория:
Проводники I рода – металлы и их расплавы в которых электричество переносится электронами.
Проводники II рода – растворы и расплавы электролитов с ионным типом проводимости.
Электролиты – вещества, которые в растворе или расплаве распадаются на ионы – электрически заряженные частицы, способные к самостоятельному существованию в этих средах.
Сильные электролиты - вещества, практически полностью диссоциирующие при растворении в воде (NaCl, HCl, HNO3 и т. д.).
Слабые электролиты диссоциируют на ионы частично (органические кислоты, вода, аммиак, сероводород). Полнота диссоциации слабого электролита количественно характеризуется степенью диссоциации α – отношение числа молекул, распавшихся на ионы (Nр), к общему числу молекул этого электролита, введенных в раствор (Nо):
α =Np/No (1.1)
Степень диссоциации α выражают в долях единицы или в процентах. Степень диссоциации электролита зависит от концентрации, температуры раствора, характера растворителя, присутствия в растворе одноименных ионов.
Зависимость между степенью диссоциации α, концентрацией С и константой диссоциации КД электролита выражается законом разведения Оствальда:
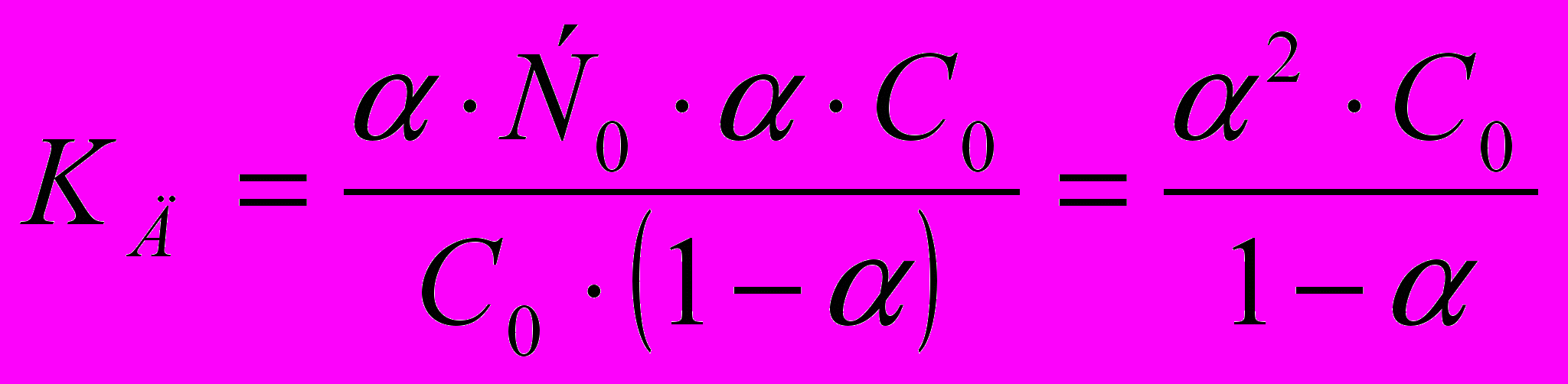 (1.2)
(1.2)где Со – концентрация кислоты до диссоциации, α – степень диссоциации кислоты в растворе.
Для уксусной кислоты КД = 1,85∙10-5.
Для очень слабого электролита α<<1, и тогда величиной α в знаменателе можно пренебречь (закон разбавления Оствальда):
КД ≈ Со α2 или
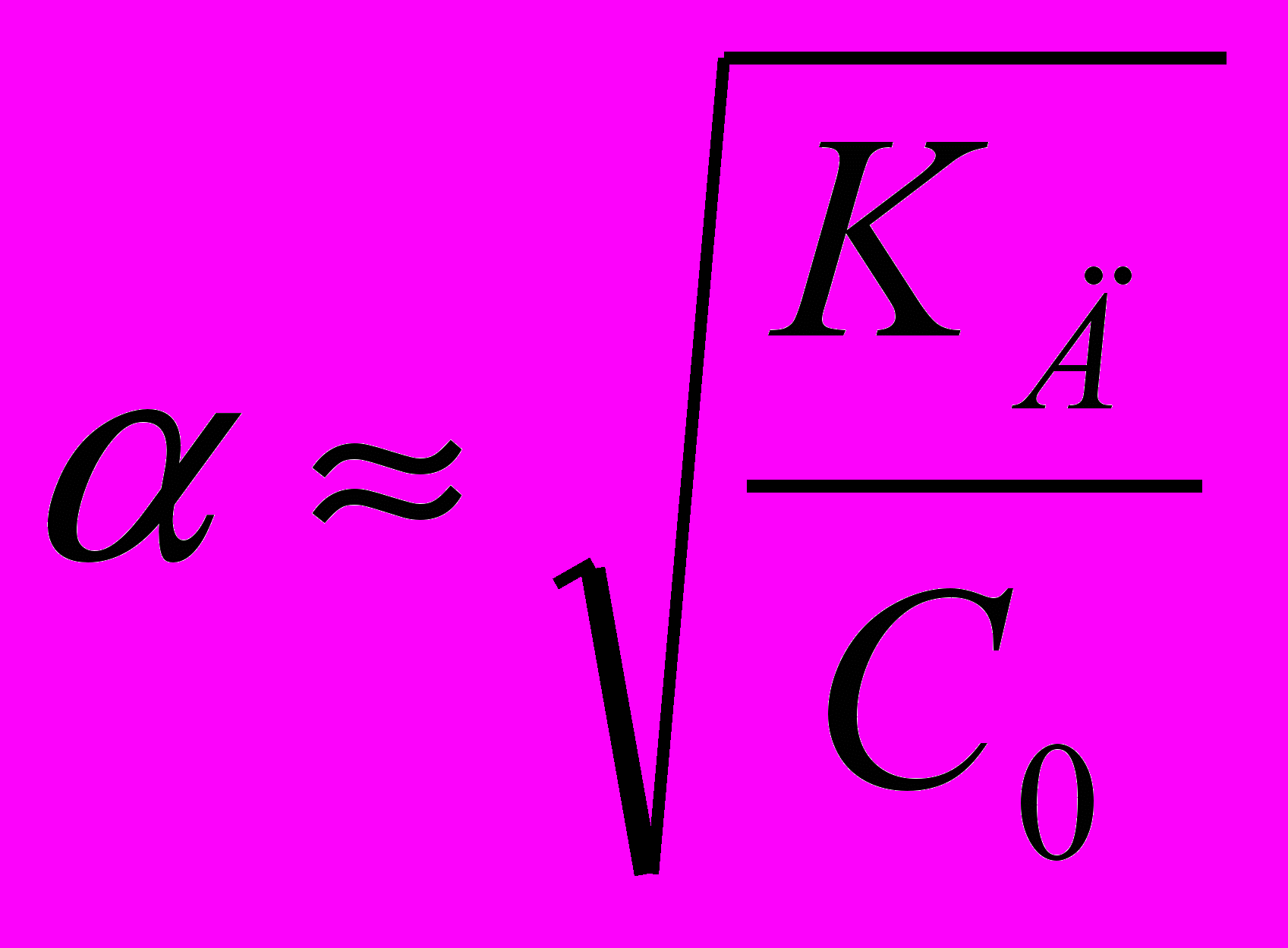 (1.3)
(1.3)Электрический ток есть упорядоченное перемещение заряженных частиц.
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см2:
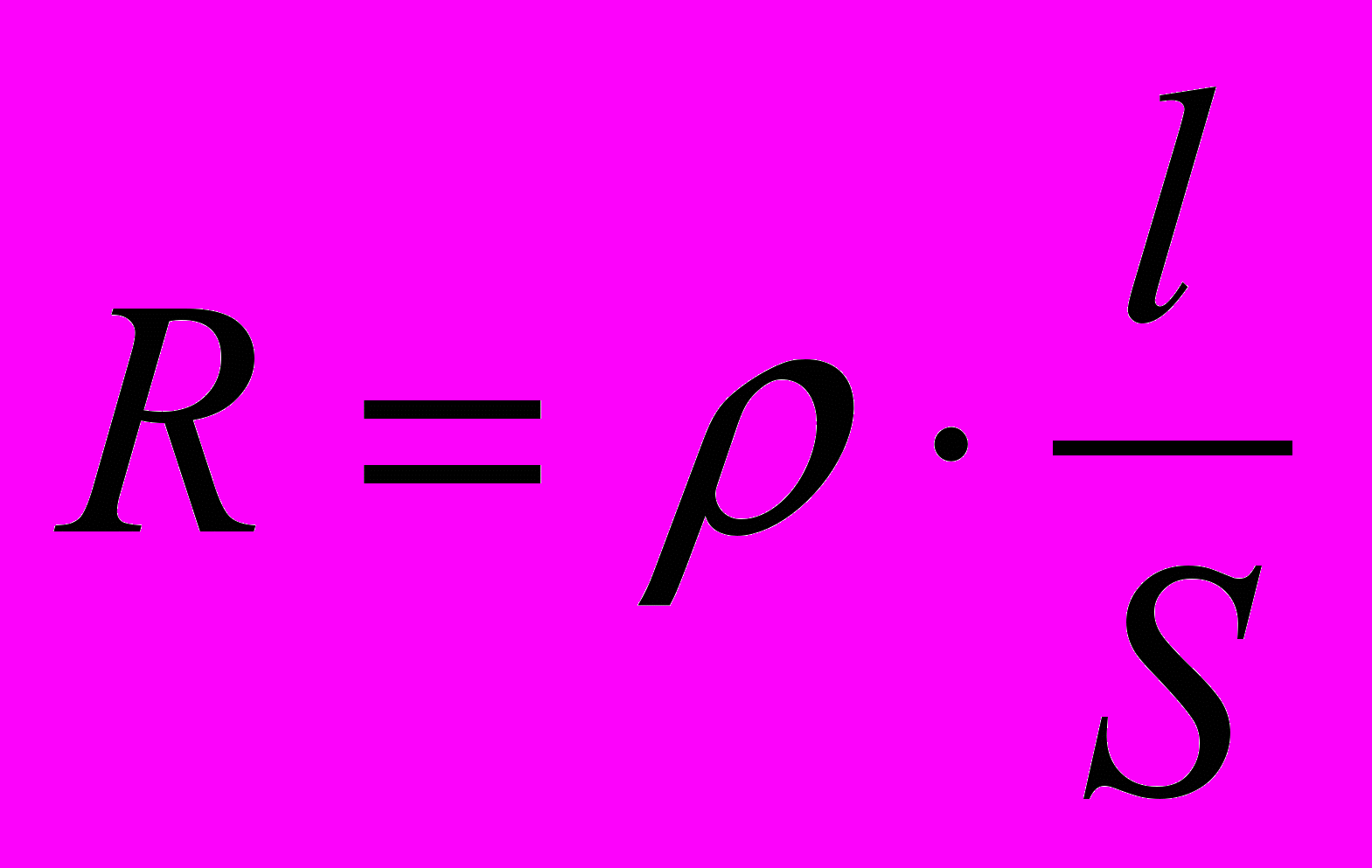 (1.4)
(1.4)где ρ – удельное сопротивление, (Ом∙м).
Величина W, обратное сопротивлению, называется электропроводностью - количественной меры способности раствора электролита проводить электрический ток и зависит от геометрических параметров проводника:
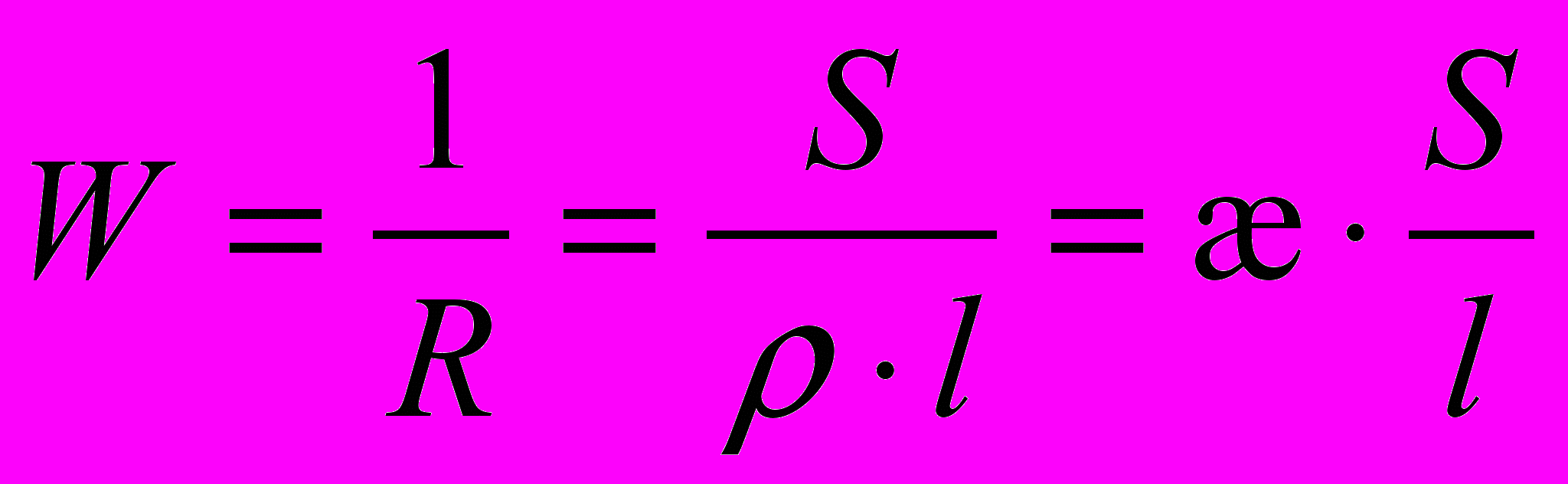 (1.5)
(1.5)где æ – удельная электропроводность, количественная характеристика способности проводников проводить электрический ток (Ом-1∙см-1) или (См∙м-1) (См – сименс). При l = 1 см и S = 1 см2 æ = W. Физический смысл удельной электропроводности – это электропроводность проводника длиной 1 см с площадью поперечного сечения 1 см2.
Мольная электропроводность (эквивалентная электропроводность) λ – это электропроводность объема раствора, содержащего 1 моль (или 1 грамм-эквивалент) растворенного вещества и заключенного между электродами, находящимися на расстоянии 1см.
Размерность λ – (Ом-1∙см2∙моль-1) или (Ом-1∙см2∙г-экв-1).
λ = æ∙υ (1.6)
где υ – разведение раствора, величина обратная концентрации,
(см3 ∙моль-1):
υ =1000/C (1.7)
Разведение, при котором достигается максимальное значение молярной электропроводности, условно называется бесконечным, а соответствующая ему электропроводность λ∞ называется молярной электропроводностью при бесконечном разведении. Величину λ∞ рассчитывают по значениям λ∞ для сильных электролитов, содержащих соответствующие ионы:
λ∞(CH3COOH) = λ∞(CH3COONa) + λ∞(HCl) - λ∞(NaCl) (1.8)
Электропроводность электролита складывается из электропроводности катиона и аниона. Поэтому можно рассматривать λ∞, как свойство суммарное (аддитивное):
λ∞ = λ+ + λ- (1.9)
Уравнение (1.9) является выражением закона Кольрауша: мольная электропроводность раствора электролита при бесконечном разведении равна сумме подвижностей ионов:
λ+ = Fu+ – подвижность катиона, (м2 ∙Ом-1 ∙моль-1);
λ- = Fu- – подвижность аниона, (м2 ∙Ом-1 ∙моль-1);
F – число Фарадея 9684·104 (Кл/моль),
u+ и u- – абсолютные подвижности катиона и аниона,(м2∙В-1∙с-1).
Зная значения молярной электропроводности при данном и при бесконечном разведениях можно вычислить степень диссоциации по формуле Аррениуса:
α = λ/ λ∞ (1.10)
Цель работы: С помощью измерения удельной электропроводности растворов уксусной кислоты в интервале концентраций 0,0125 М 0,1 М, рассчитать мольную электропроводность, степень и константу диссоциации уксусной кислоты. Сделать заключение о применимости закона действия масс и других законов, справедливых для разбавленных растворов, для описания свойств раствора изученного слабого электролита уксусной кислоты.
Оборудование: Портативный измеритель электропроводности и температуры для стандартных измерений, мерные цилиндры и стаканы для растворов уксусной кислоты и дистиллированной воды.
Реактивы: 0,1 M СН3СООН, дистиллированная вода.
Порядок работы:
- Измерить температуру воздуха в лаборатории и записать в тетрадь.
- Промыть электрод с ячейкой дистиллированной водой и раствором уксусной кислоты концентрации 0,1 моль л–1.
- С помощью мерного цилиндра налить в стакан 50 мл раствора уксусной кислоты концентрации 0,1 моль л–1.
- Опустить электрод с ячейкой в стакан с уксусной кислотой и измерить удельную электропроводность раствора.
- Отлить из стакана 25 мл раствора кислоты и добавить в стакан 25 мл дистиллированной воды (получили раствор с концентрацией 0,05 моль л–1). Тщательно перемешать раствор, измерить его удельную электропроводность.
- Отлить из стакана 25 мл раствора, добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,025 моль л–1). Вновь измерить удельную электропроводность раствора.
- Отлить из стакана 25 мл раствора, добавить 25 мл дистиллированной воды (получили раствор с концентрацией 0,0125 моль л–1). Вновь измерить удельную электропроводность раствора
- Результаты измерений и расчетов записать в таблицу 1.
Таблица 1.
t = °С
| C моль л1 | V см3 моль1 | æ Ом1 см1 | Ом1 см2 моль1 | | К | __ К |
| 0,1 | | | | | | |
| 0,05 | | | | | | |
| 0,025 | | | | | | |
| 0,0125 | | | | | | |
- Рассчитать значения:
V = 1000/С,
= æ/С,
= /,
= (Н+) + (СН3СНОО-),
К = С 2/(1).
Величину рассчитать, используя подвижности анионов и катионов при измеренной температуре. (Приложение 5).
- Результаты работы представить в виде графиков зависимостей:
а) удельной электропроводности от разведения æ = f (V);
б) мольной электропроводности от разведения = f (V);
в) степени диссоциации от разведения = f (V).
Вопросы и задачи к работе 1
- Привести примеры проводников первого и второго рода. Причина диссоциации электролитов на ионы в дипольном растворителе. Что является носителем заряда в этих проводниках?
- Перечислить факторы, влияющие на величину емкости сопротивления ячейки.
- Понятия: электропроводность, удельная электропроводность, молярная электропроводность. Дайте размерности этих величин.
- Как изменяется степень диссоциации слабого электролита с ростом концентрации его раствора?
- От каких факторов зависит электропроводность растворов электролитов?
- Объяснить причины изменения удельной электропроводности растворов сильных и слабых электролитов при изменении их концентрации.
- Объяснить причины изменения мольной электропроводности растворов сильных и слабых электролитов при изменении их концентрации.
- Сформулировать закон Кольрауша о независимой подвижности ионов. Записать математическое выражение этого закона и указать его практическое значение.
- Сформулируйте закон разведения Оствальда и запишите математическое выражение этого закона.
- В чем заключается физический смысл разведения?
- Что называется степенью диссоциации? Какие факторы влияют на степень диссоциации?
- Что называется константой диссоциации? Написать выражения для констант диссоциации для НCOOH, H2CO3 по первой и второй ступеням.
- Какая взаимосвязь существует между степенью и константой диссоциации слабых электролитов?
- Каково соотношение между абсолютной скоростью движения ионов и подвижностью?
- Рассчитать мольную электропроводность CH3COOK при бесконечном разведении, если подвижности ионов CH3COO и К+ равны 40,9 Ом1 см2 моль1 и 75,3 Ом1 см2 моль1, соответственно.
- Вычислить предельную молярную электрическую проводимость CaCl2 при 25°С, если подвижности ионов Ca+2 и Cl- соответственно равны 119 Ом1 см2 моль1 и 76,3 Ом1 см2 моль1.
- Рассчитать концентрацию раствора электролита, если его разведение 50000 см3 моль1.
- Показать расчетом, какой из растворов электролитов KOH, KBr, HBr одинаковой концентрации имеет наибольшую мольную электропроводность.
- Рассчитать степень диссоциации раствора муравьиной кислоты концентрации 0,05 М, если константа ее диссоциации равна 1,8104. Считать, что степень диссоциации много меньше единицы.
- Степень диссоциации муравьиной кислоты равна 0,3. Рассчитать мольную электропроводность муравьиной кислоты, если подвижности ионов НСОО и Н+ равны 56,4 Ом1 см2 моль1и 350 Ом1 см2 моль1, соответственно.
- Абсолютные скорости движения ионов К+ и ОН при 298 К равны 7,62104 см2 В1 с1 и 20,5 104 см2 В1 с1, соответственно. Рассчитать мольную электропроводность гидроксида калия при бесконечном разведении.
- Рассчитать удельную электрическую проводимость в 0,001 М растворе HCl, если абсолютные скорости H+ и Cl- равны 32,4104 см2 В1 с1 и 6,8104 см2 В1 с1.
- Молярная электрическая проводимость 0,1 М раствора AgNO3 равна 94,3 См см2/моль. Определите удельную электрическую проводимость этого же раствора, если расстояние между электродами равно 3 см и поверхность каждого электрода 7 см2.
- Для предельно разбавленных растворов KBr, K2SO4 и LiSO4 молярная электрическая проводимость соответственно равна 151,6; 307,7; 237,2 См см2/моль. Вычислите молярную электрическую проводимость для предельно разбавленного раствора LiBr.
- Эквивалентная электропроводность бесконечно разбавленных растворов KCl, KNO3, и AgNO3 при 25°С равна, соответственно, 149,9, 145,0 и 133,4 См см2/моль. Какова эквивалентная электропроводность бесконечно разбавленного раствора AgCl при 25°С?
- Рассчитайте удельную электрическую проводимость 0,16 М раствора пропионовой кислоты при 298 К, если Кд(С2Н5СООН)=1,3410-5.
- Вычислите предельную молярную электрическую проводимость бензойной кислоты, если предельная молярная электрическая проводимость электролитов NaBr, HBr, и C6H5COONa соответственно равны: 128,5 Ом1 см2 моль1, 428,2 Ом1 см2 моль1 и 82,5 Ом1 см2 моль1.
- Молярная электрическая проводимость раствора муравьиной кислоты при 25°С и разведении 1024 л/моль равна 143,5 Ом1 см2 моль1, а при бесконечном разведении – 406,5 Ом1 см2 моль1. Определите константу диссоциации кислоты.
- Вычислите степень и константу диссоциации масляной кислоты, если удельная электрическая проводимость раствора масляной кислоты с концентрацией 0,0156 моль/л равна 1,8110-4 Ом-1см-1.
- Вычислите молярную электрическую проводимость хлорида бария в 10%-ном водном растворе (плотность 1,092 г/мл). Удельная электрическая проводимость этого раствора равна 0,0073 Ом-1см-1.
- Удельная электрическая проводимость раствора, в 1,5 л которого находится 4,43 г хлоруксусной кислоты, равна 2,4110-3 См/см. Определите степень и константу диссоциации хлоруксусной кислоты в данном растворе.
- Водный раствор, содержащий массовую долю CaCl2, равную 5%, имеет при 298 К плотность ρ=1,039 г/см3 и удельную электрическую проводимость 6,4310-2 См/см. Определите молярную электрическую проводимость.
- Молярная электрическая проводимость раствора с массовой долей 38% H2SO4 равна 140 Ом1 см2 моль1 при 293 К. Определить удельную электрическую проводимость указанного раствора, если его плотность 1,286 г/см.
- При 295 К удельная электрическая проводимость раствора, содержащего 10% SrCl2, равна 8,8610-2 См/см, а плотность раствора равна 1,0925 г/см3. Определите молярную электрическую проводимость данного раствора.
- Удельная электропроводность 5%-го раствора Mg(NO3)2 при 18°С равна 4,38 См/м, а его плотность – 1,038 г/см3. Рассчитайте эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg+2 и NO3- при 18°С равна 44,6 и 62,6 Ом1 см2 моль1.
- Удельная электропроводность 4%-го водного раствора H2SO4 при 18°С равна 0,168 См/см, а плотность раствора – 1,026 г/см3. Рассчитайте эквивалентную электропроводность раствора.
- Эквивалентная электропроводность водного раствора сильного электролита при 25°С равна 109,9 См см2 моль1 при концентрации 6,210-3 моль/л и 106,1 См см2 моль1 при концентрации 1,510-2 моль/л. Какова эквивалентная электропроводность раствора при бесконечном разбавлении?
- Эквивалентная электропроводность водного раствора слабой одноосновной кислоты при 25°С равна 16,0 См см2 моль1 при концентрации 1,010-2 моль/л и 48,4 См см2 моль1 при концентрации 1,010-3 моль/л. Рассчитайте эквивалентную электропроводность раствора при бесконечном разбавлении и константу диссоциации кислоты.
- Константа диссоциации гидроксида аммония равна 1,7910-5. Рассчитайте концентрацию NH4OH, при которой степень диссоциации равна 0,01, и эквивалентную электропроводность раствора при этой концентрации.
- Константа диссоциации масляной кислоты C3H7COOH равна 1,7410-5. Эквивалентная электропроводность раствора при разведении 1024 л/моль равна 41,3 См см2 моль1. Рассчитайте степень диссоциации кислоты и концентрацию ионов водорода в этом растворе, а также эквивалентную электропроводность раствора при бесконечном разведении.
- Эквивалентная электропроводность раствора гидроксида этиламмония C2H5NH3OH при бесконечном разведении равна 232,6 См см2 моль1. Рассчитайте константу диссоциации гидроксида этиламмония раствора, степень диссоциации и концентрацию ионов гидроксила в растворе при разведении 16 л/моль, если удельная электропроводность раствора при данном разведении равна 1,31210-5 См см-1.
Лабораторная работа 2
Кондуктометрическое титрование
Краткая теория:
Измерение электропроводности растворов называют кондуктометрией или кондуктометрическим титрованием. Кондуктометрию используют не только для определения степени и константы диссоциации электролитов, но и для определения концентрации электролитов в растворах, их растворимости, основности кислот. Кондуктометрическое титрование применяется при исследовании мутных или окрашенных растворов, исключающих возможность применения индикаторов. Метод основан на присутствии в растворах кислот (или оснований) высокоподвижных ионов Н+ (или ОН-), что обуславливает хорошую электропроводность. Аномально высокие подвижности гидроксония и гидроксила объясняются особым механизмом переноса электрического заряда этими ионами, называемым эстафетным:

При титровании происходит реакция нейтрализации, и вместо этих ионов в растворе накапливаются ионы солей, обладающие меньшей подвижностью. В тот момент, когда вся кислота (или основание) будет нейтрализована эквивалентным количеством основания (или кислоты), электропроводность раствора будет минимальной. Добавление избытка основания (или кислоты) приводит вновь к появлению высокоподвижных ионов ОН- (или Н+), и электропроводность начинает резко возрастать.
Зависимость электропроводности раствора ( W) титруемого вещества от объема (V) (количества) добавленного титранта называется – кривой кондуктометрического титрования (рис.1).
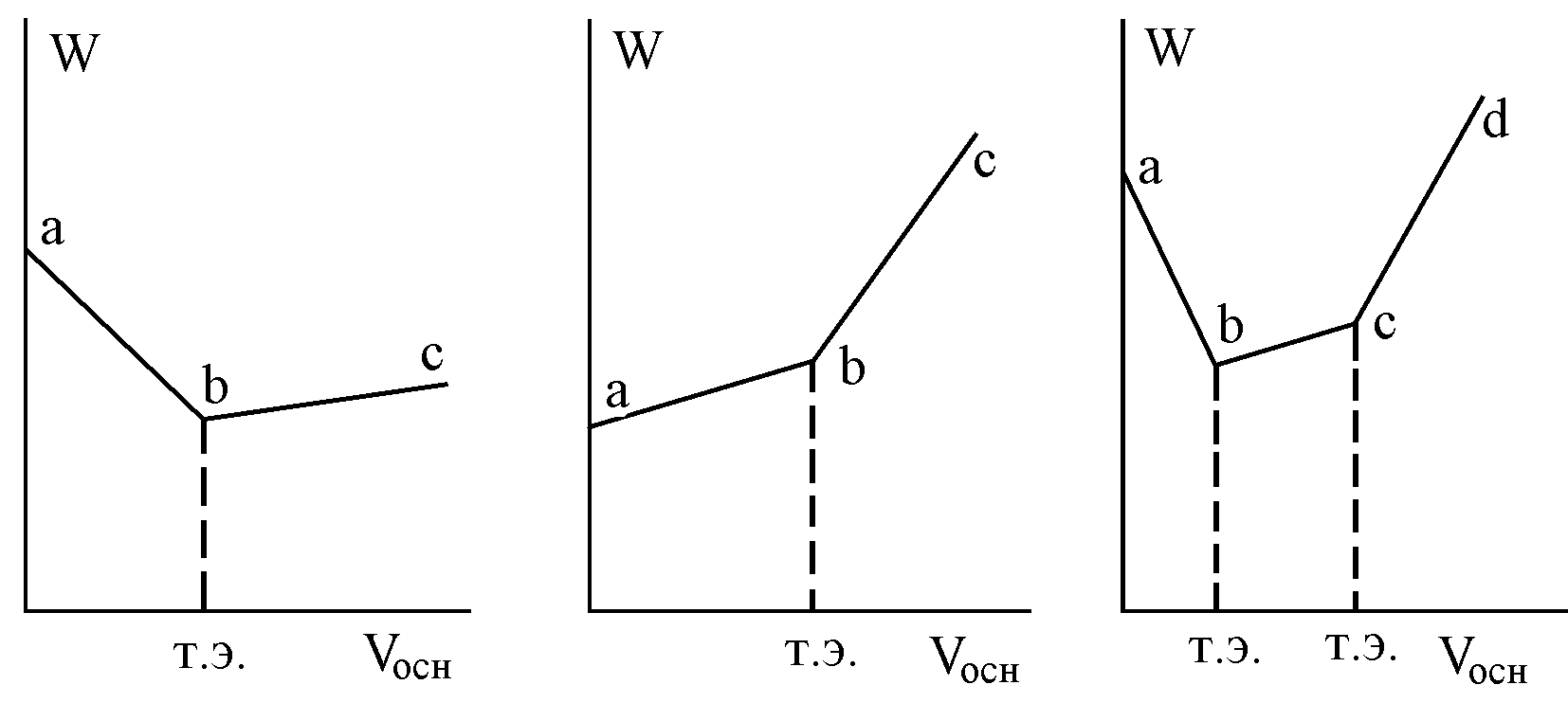
а) б) в)
Рис.1. Кривые кондуктометрического титрования:
сильной кислоты (а) сильным основанием,
слабой кислоты (б) сильным основанием
смеси сильной и слабой кислот (в) сильным основанием
На кривой кондуктометрического титрования точке эквивалентности соответствует излом, и выполняется закон эквивалентных отношений:
Ск ∙Vк = Cщ ∙Vэ (1.11)
где Ск и Cщ – концентрации кислоты и щелочи, Vк – объем кислоты, взятый для титрования, а Vэ – эквивалентный объем щелочи, найденный из графика.
Цель работы: Определить концентрацию раствора сильной кислоты методом кондуктометрического титрования.
Оборудование: Портативный измеритель электропроводности и температуры для стандартных измерений, штатив с бюреткой, мерный цилиндр, стакан.
Реактивы: Раствор гидроксида калия концентрации 0,05 М, раствор соляной кислоты неизвестной концентрации, дистиллированная вода.
Порядок работы:
- Промыть стакан и электрод с ячейкой дистиллированной водой.
- С помощью мерного цилиндра налить в стакан 50 мл раствора соляной кислоты неизвестной концентрации.
- Опустить в стакан электрод с ячейкой и поместить стакан под слив бюретки с раствором щелочи.
- Измерить электропроводность раствора соляной кислоты в стакане, результат записать в таблицу 2.
- Добавить в стакан 1 мл раствора щелочи, перемешать раствор и измерить его электропроводность. Добавление по 1 мл щелочи и измерение электропроводности раствора проводить до тех пор, пока не получите 4–5 возрастающих значений электропроводности раствора. Все результаты записать в таблицу 2.
- По окончании работы выключить прибор и привести в порядок рабочее место.
Таблица 2.
| Vщ мл | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| W Ом1 | | | | | | | | | | | | | | | |
- По результатам измерений построить кривую кондуктометрического титрования зависимость электропроводности раствора W от объема добавленной щелочи Vщ.
- По графику определить точку эквивалентности Vэ, опустив перпендикуляр на ось абсцисс из точки пересечения двух ветвей кривой кондуктометрического титрования.
- Рассчитать концентрацию соляной кислоты по формуле:
Ск = Cщ (Vэ / Vк),
где Cк – искомая концентрация соляной кислоты;
Cщ – концентрация щелочи (0,05 М);
Vк – объем взятого для титрования раствора кислоты (50 мл);
Vэ – эквивалентный объем щелочи, найденный по графику.
Вопросы и задачи к работе 2
- В чем заключается сущность кондуктометрии? Для каких целей используют этот метод в медико-биологических исследованиях?
- Как определяют точку эквивалентности при кондуктометрическом титровании?
- Когда заканчивают кондуктометрическое титрование?
- Начертить кривую кондуктометрического титрования раствора пропионовой кислоты раствором щёлочи. Объяснить ход кривой и указать ионы, которые участвуют в электропроводности на всех участках этой кривой.
- Изобразить на графике зависимость электропроводности раствора едкого натра при титровании его раствором азотной кислоты. Указать ионы, которые участвуют в электропроводности на всех участках этой зависимости.
- Начертить кривую кондуктометрического титрования раствора соляной и уксусной кислот раствором щелочи. Объяснить ход кривой.
- Начертить кривую кондуктометрического титрования раствора соляной кислоты раствором щёлочи. Указать ионы, которые участвуют в электропроводности на всех участках этой кривой.
- Начертить кривую кондуктометрического титрования смеси NH3 и KOH раствором сильной кислоты.
- Почему электропроводность сильных кислот и щелочей значительно выше, чем электропроводность их солей?
- Чем объясняется аномально высокая подвижность ионов Н+ и ОН?
- Записать закон эквивалентных соотношений.
- В чем заключается преимущество кондуктометрического титрования по сравнению с титрованием с индикаторами?
- Какой из растворов электролитов (принять, что их концентрации одинаковые) имеет наибольшую электропроводность: KBr, HBr, H2CO3, KOH? Ответ аргументировать.
