I электрохимия
| Вид материала | Лабораторная работа |
- «Электрохимия, гальванотехника и обработка поверхности», посвященная 200-летию со дня, 94.6kb.
- Закономерности процесса фосфатирования магний-литиевых сплавов 02. 00. 05 электрохимия, 368.63kb.
- Рабочая учебная программа дисциплины Теоретическая электрохимия Направление подготовки, 468.83kb.
- Исследование влияния морфологии и химического состава поверхности ионообменных мембран, 332.73kb.
- Рабочая программа по дисциплине опд. Р. 01 «Электрохимическая синергетика», 157.53kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- Рабочая программа для подготовки инженеров по специальности 250300 "Технология электрохимических, 128.05kb.
- Электрохимические и физико-химические аспекты фиторемедиации сточных и промывных вод,, 396.8kb.
- Халькогенсодержащие органические соединения для преобразователей энергии и информации., 961.61kb.
Глава IV
коллоидные системы
Лабораторная работа 7
Получение коллоидных растворов
Краткая теория:
Коллоидной системой (золем) называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределёнными в объёме другой однородной фазы. Это ультрамикрогетерогенные системы, состоящие из частиц дисперсной фазы – совокупности раздробленных частиц, размер которых лежит в пределах 10-9 м – 10-5 м, и непрерывной дисперсионной среды, в которой распределены эти частицы.
Раздробленность дисперсной фазы характеризуется степенью дисперсности δ, которая является величиной, обратной среднему диаметру (м-1):
 (4.1)
(4.1)Удельная поверхность – это отношение общей площади поверхности дисперсной фазы Sд.ф. к её общему объёму или к её массе:
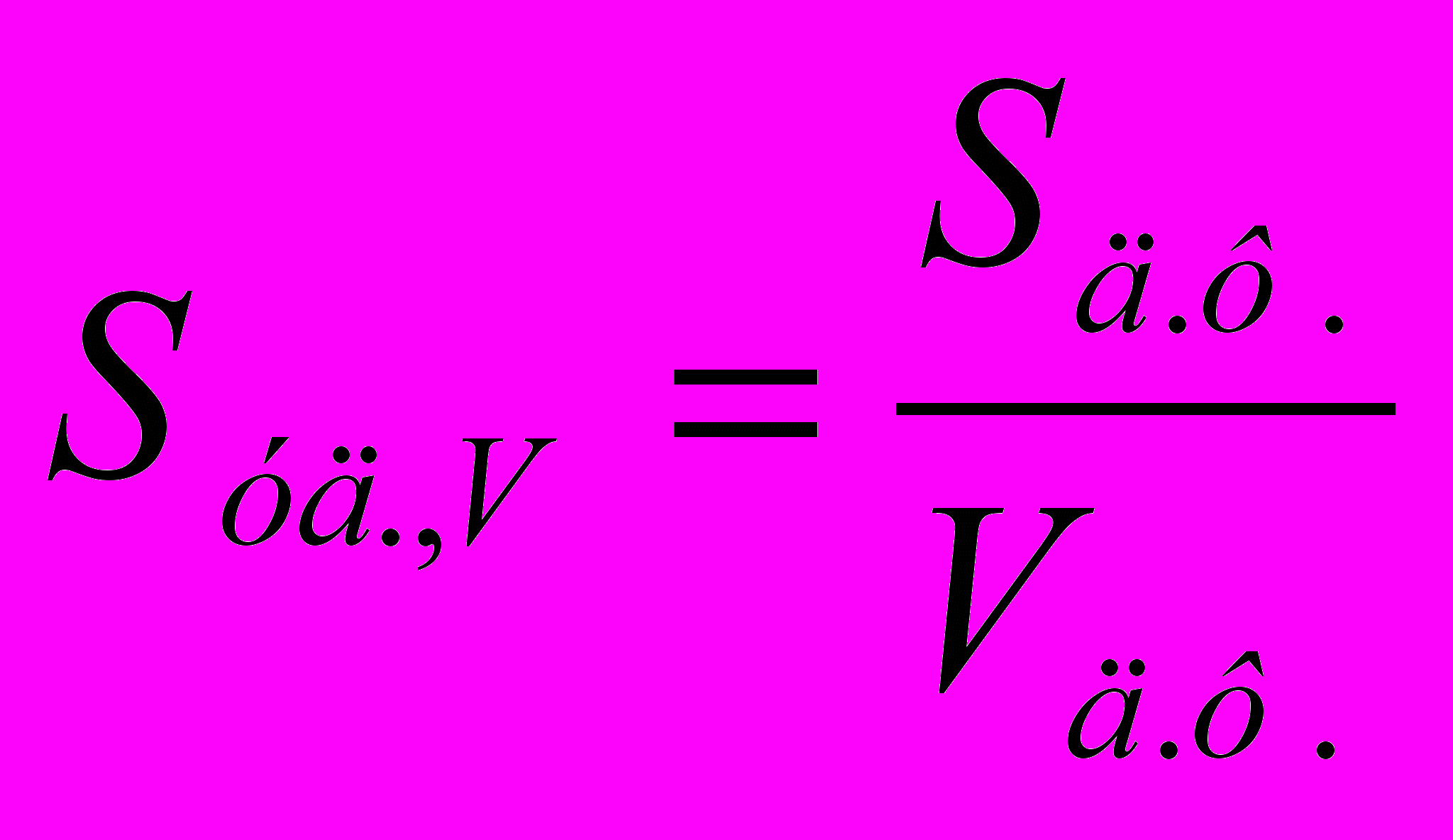 , м-1 или
, м-1 или 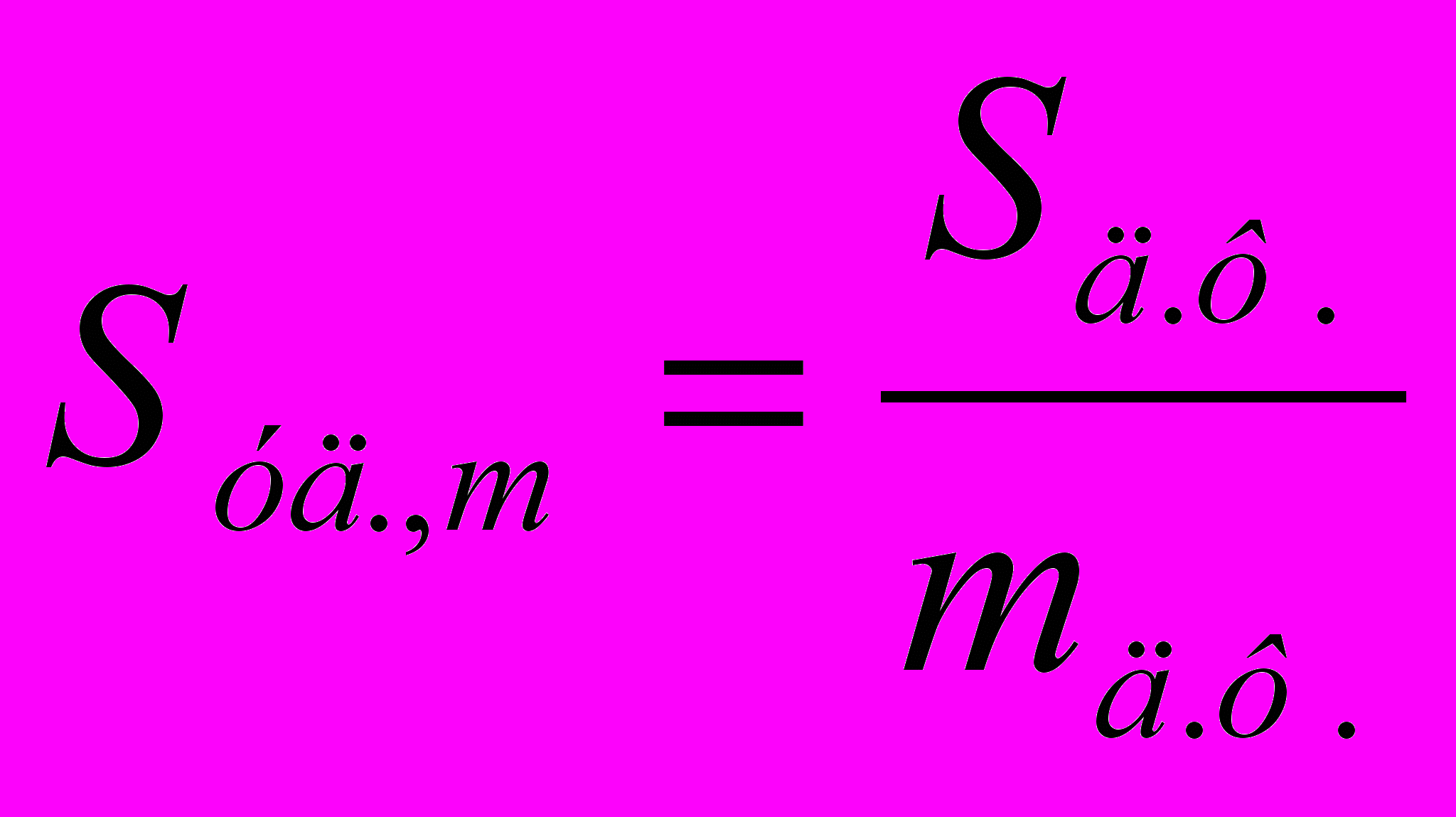 , м2/г (4.2)
, м2/г (4.2)Коллоидное состояние вещества имеет два основных признака – дисперсность и гетерогенность.
Для получения коллоидных растворов необходимо:
- достичь коллоидной степени дисперсности;
- подобрать дисперсионную среду, в которой нерастворимо вещество дисперсный фазы;
- подобрать третий компонент – стабилизатор, сообщающий коллоидной системе устойчивость. В качестве стабилизаторов используют вещества, препятствующие агрегации (слипанию) коллоидных частиц в более крупные и выпадению их в осадок (небольшой избыток одного из реагентов, из которых получается вещество дисперсной фазы; ПАВ; белки; полисахариды).
В основе классификаций лежат различные свойства дисперсных систем: размер частиц дисперсной фазы, агрегатное состояние дисперсной фазы и дисперсионной среды, характер взаимодействия дисперсной фазы с дисперсионной средой, структурно-механические и др. свойства.
Классификация по агрегатному состоянию фаз.
| Агрегатное состояние дисперсной фазы | Агрегатное состояние дисперсионной среды | Условное обозначение, ф/с | Название системы | Примеры |
| ж | г | ж/г | аэрозоли | Туман, слоистые облака |
| тв | г | тв/г | Дымы, пыли, перистые облака | |
| г | ж | г/ж | газовые эмульсии, пены | Газированная вода, мыльная пена, лечебный кислородный коктейль, пивная пена |
| ж | ж | ж/ж | эмульсии | Молоко, масло сливочное, маргарин, кремы и т.д. |
| тв | ж | тв/ж | лиозоли, суспензии | Естественные водоёмы, краски, красители для ткани |
| г | тв | г/тв | твёрдые пены | Пемза, твёрдые пены, пенопласт, активированный уголь, пенобетон, хлеб, пористые тела в газе |
| ж | тв | ж/тв | твёрдые эмульсии | Вода в парафине, природные минералы с жидкими включениями, древесина |
| тв | тв | тв/тв | твёрдые золи | Сталь, чугун, цветные стёкла, драгоценные камни |
Дисперсной системы, у которой и дисперсная фаза и дисперсионная среда являются газами, не существует, так как газы неограничено растворимы друг в друге.
Методы получения коллоидных систем
Коллоидные системы занимают промежуточное положение между грубодисперсными и молекулярными системами, поэтому получать их можно либо дроблением более крупных частиц (диспергированием), либо объёдинением молекул или ионов в агрегаты коллоидных размеров (конденсацией) с применением физических и химических методов.
1. Методы диспергирования.
1.1) Физическое диспергирование:
а) механическое измельчение с использованием шаровых и коллоидных мельниц;
б) электрическое распыление веществ - используют для получения золей металлов;
в) диспергирование ультразвуком - используют для получения золей из двух несмешивающихся жидкостей.
Чтобы не дать образовавшимся частицам слипаться, все выше описанные способы диспергирования проводят в присутствии дисперсионной среды и стабилизатора.
1.2) Химическое диспергирование (пептизация): перевод в коллоидное состояние свежеприготовленного осадка с помощью пептизатора.
2. Методы конденсации.
Методы конденсации связаны с выделением новой фазы из гомогенной системы.
2.1) Физическая конденсация:
а) метод замены растворителя;
б) метод конденсации из паров.
2.2) Химическая конденсация: любая химическая реакция, в результате которой образуется плохо растворимое соединение (реакция гидролиза, восстановления, окисления, нейтрализации и т.д.).
Оптические свойства дисперсных систем.
При падении света на дисперсную систему могут наблюдаться следующие явления:
- прохождение света частицами дисперсной фазы (наблюдается для прозрачных систем, в которых частицы много меньше длины волны падающего света (r<<λ));
- преломление света частицами дисперсной фазы (если эти частицы прозрачны);
- отражение света частицами дисперсной фазы (если частицы непрозрачны); Преломление и отражение света наблюдается для систем, в которых частицы много больше длины волны падающего света (r>>λ). Визуально это явление выражается в мутности этих систем.
- рассеяние света; наблюдается для систем, в которых частицы дисперсной фазы меньше, но соизмеримы с длиной волны падающего света (r ≈ 0,1 λ);
- адсорбция (поглощение) света дисперсной фазой с превращением световой энергии в тепловую.
В коллоидных растворах наблюдается рассеяние света, т.к. частицы дисперсной фазы меньше, но соизмеримы с длиной волны падающего света (r ≈ 0,1 λ). В проходящем свете коллоидные системы прозрачны, а при боковом освещении рассеивают падающий на них свет, поэтому пучок света в коллоидной системе виден как яркий светящийся конус (конус Тиндаля – по имени ученого, впервые подробно исследовавшего это явление). Теорию светорассеяния создал английский физик Рэлей. Он вывел уравнение, связывающее интенсивность рассеянного света I с интенсивностью падающего света I0, длиной волны падающего света λ и размерами частиц дисперсной фазы r:
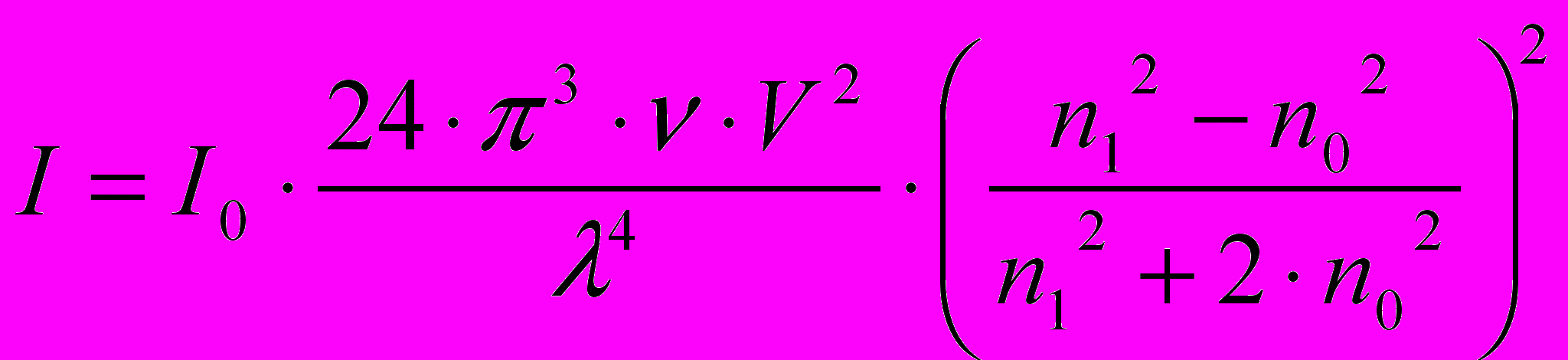 или
или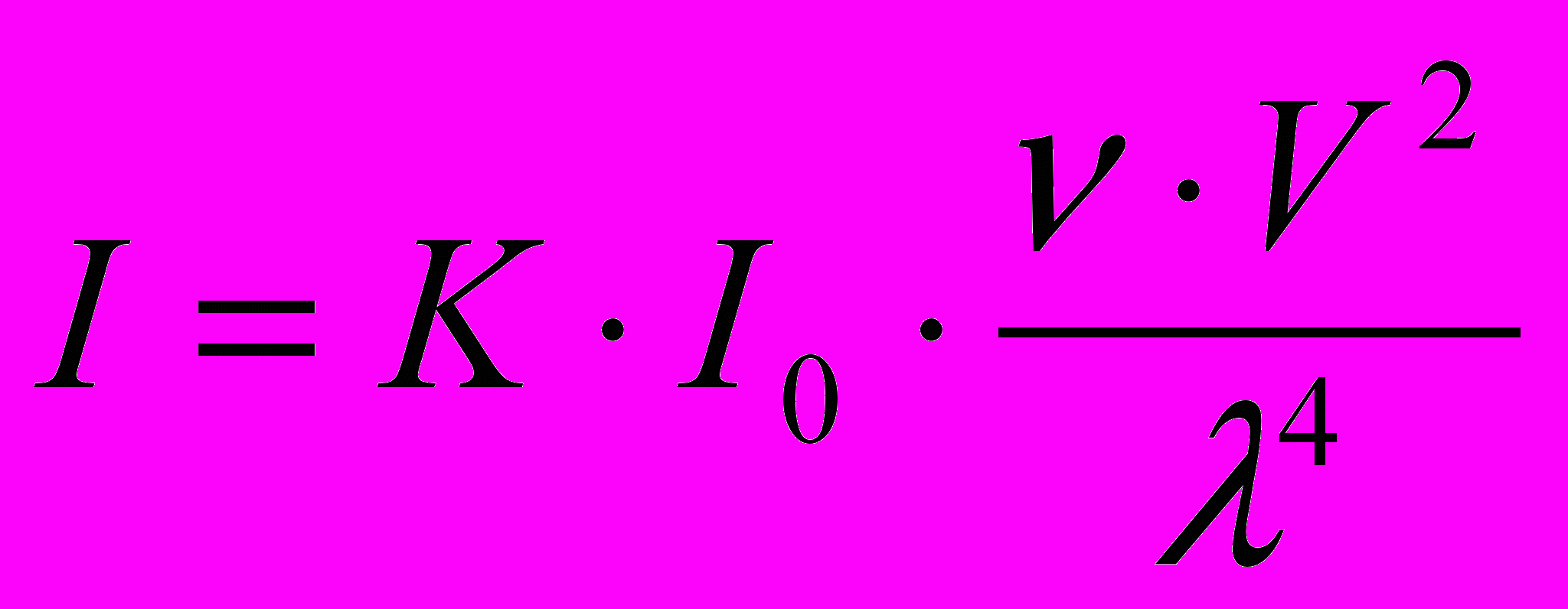 (4.3)
(4.3)где V – объём одной частицы, ν – частичная концентрация (число частиц в единице объёма), λ – длина волны, n1, n0 – показатели преломления частиц и среды, соответственно.
Уравнение Релея выполняется при следующих условиях:
- частицы малы (r≤λ) и имеют сферическую форму;
- частицы не проводят электрический ток (т.е. являются неметаллическими);
- частицы не поглощают свет, т.е. являются бесцветными;
- коллоидный раствор является разбавленным в такой степени, что расстояние между частицами больше длины волны падающего света.
Все металлические золи уравнению Рэлея не починяются, так как их частицы сильно поглощают свет.
Коллоидный раствор в проходящем и рассеянном (отраженном) свете имеет различную окраску. Это явление называется опалесценцией. В случае окрашенных растворов происходит наложение собственной окраски и окраски, вызванной опалесценцией (явление дихроизма света).
Строение мицеллы
Мицеллой лиофобной системы называется гетерогенная микросистема, которая состоит из микрокристалла дисперсной фазы, окруженного сольватированными ионами стабилизатора.
Потенциалопределяющими называются ионы, адсорбирующиеся на поверхности частички твёрдой фазы (агрегата) и придающие ей заряд. Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы.
Противоионы – ионы, группирующиеся вблизи ядра мицеллы.
Расположение противоионов в дисперсионной среде определяется двумя противоположными факторами: тепловым движением (диффузией) и электростатическим притяжением

 Мицелла
Мицелла 
 Коллоидная частица
Коллоидная частица 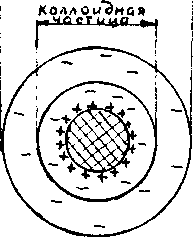

Диффузный слой
Адсорбционны
слой
П
 ротивоионы входящие в состав плотного адсорбционного слоя, называются «связанными» и вместе с ядром составляют коллоидную частицу или гранулу. Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов.
ротивоионы входящие в состав плотного адсорбционного слоя, называются «связанными» и вместе с ядром составляют коллоидную частицу или гранулу. Коллоидная частица (гранула) имеет заряд, знак которого обусловлен знаком заряда потенциалопределяющих ионов.Противоионы, образущие диффузный слой - «подвижные» или «свободные».
Рассмотрим структуру мицеллы золя йодистого серебра, полученного обменной реакцией между йодистым калием и азотнокислым серебром при избытке йодистого калия. В этом случае строение образующихся мицелл отражает следующая реакция и схема:
KJ + AgNO3 (изб) = AgI↓ + KNO3
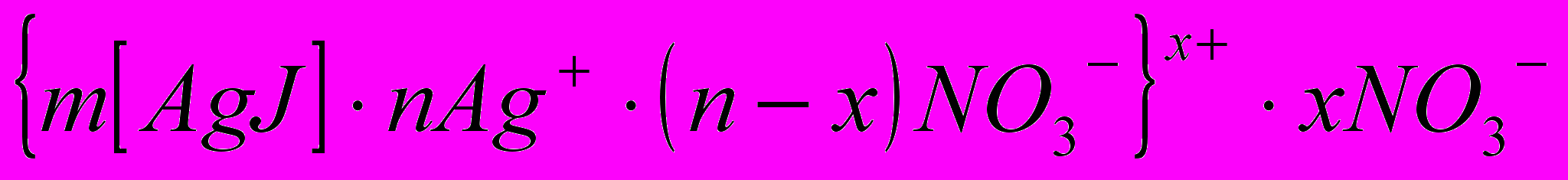

а
 грегат адсорбционный слой диффузный
грегат адсорбционный слой диффузныйслой
 коллоидная частица
коллоидная частицамицелла
Правила построения мицеллы
- Агрегатом является получающийся в ходе реакции осадок.
- Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
- Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
- Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
Цель работы: Получение коллоидных растворов различными методами и изучение их оптических свойств.
Оборудование: Стеклянные конические колбочки, прибор с направленным источником света.
Реактивы: Растворы йодистого калия 0,05 Н и азотнокислого серебра 0,05 Н, 2% спиртовой раствор канифоли, 1,5% раствор перманганата калия, 1% раствор гипосульфита, 20% раствор жёлтой кровяной соли, насыщенный раствор хлорного железа, 0,1 Н раствор щавелевой кислоты, дистиллированная вода, фильтровальная бумага.
Порядок работы:
- Метод химической конденсации.
- Получение золя иодида серебра (метод обменной реакции).
а) в коническую колбочку налить 8 мл раствора азотнокислого серебра AgNO3 и 10 мл раствора йодистого калия KJ. Записать реакцию, протекающую в колбе. Написать формулу образовавшейся мицеллы. Записать окраску золя в отражённом и проходящем свете. Наблюдать конус Тиндаля при попадании на раствор узкого направленного пучка свете.
б) в коническую колбочку налить 10 мл раствора азотнокислого серебра AgNO3 и 8 мл раствора йодистого калия KJ. Записать реакцию, протекающую в колбе. Написать формулу образовавшейся мицеллы. Записать окраску золя в отражённом и проходящем свете. Наблюдать конус Тиндаля при попадании на раствор узкого направленного пучка свете.
- Получение золя канифоли (метод замены растворителя).
В коническую колбу с 50 мл дистиллированной воды прилить 5 мл 2% спиртового раствора канифоли и встряхнуть. Записать наблюдаемую окраску получившегося золя в отражённом и проходящем свете. Убедиться в наличие конуса Тиндаля при попадании на раствор узкого направленного пучка свете. Отметить, что остатки спирта являются стабилизатором данной коллоидной системы.
- Получение золя двуокиси марганца (метод ОВР).
В колбу налить 5 мл 1,5% раствора перманганата калия KMnO4 и добавить 50 мл дистиллированной воды. К полученному раствору по каплям добавить 1 мл 1% раствора гипосульфита Na2S2O3. Наблюдать образование вишнёво-красного золя двуокиси марганца. Записать реакцию, протекающую в колбе. Написать формулу мицеллы золя. Записать окраску золя в отражённом и проходящем свете. Наблюдать конус Тиндаля при попадании на раствор узкого направленного пучка свете.
- Метод химического диспергирование (пептизация).
- Получение золя берлинской лазури.
В коническую колбу налить 1,5 мл 20 % раствора жёлтой кровяной соли K4[Fe(CN)6] и 0,5 мл насыщенного раствора хлорного железа FeCl3. Выпавший осадок берлинской лазури Fe4[Fe(CN)6]3 перенести на фильтр, промыть дистиллированной водой и залить на фильтре 0,1 Н раствором щавелевой кислоты (СООН)2. В результате пептизации осадка через фильтр в колбочку проходит синий золь берлинской лазури. Записать реакцию, протекающую в колбе. Написать формулу мицеллы золя. Записать окраску золя в отражённом и проходящем свете. Наблюдать конус Тиндаля при попадании на раствор узкого направленного пучка свете.
Вопросы и задачи к работе 7
- Предмет коллоидной химии. Признаки коллоидного состояния Определение коллоидной системы.
- Диспергационные способы получения коллоидных систем. Привести примеры.
- Конденсационные способы получения коллоидных систем. Привести примеры.
- Какие условия необходимы для образования коллоидного раствора?
- Строение мицеллы. Какие ионы могут быть потенциалоопределяющими?
- Три вида классификации коллоидных систем.
- Аэрозоли, лиозоли, пирозоли.
- Написать формулу мицеллы золя As2S3, если стабилизатором является раствор H2S, который диссоциирует по первой ступени.
- Напишите формулу мицеллы золя, полученного методом обменной реакции: Na2CO3 + MgCl2 MgCO3↓ + NaCl в избытке Na2CO3.
- Напишите формулу мицеллы золя серы, получаемого по реакции
2H2S(aq) + SO2(g) = 3S + 2H2O
с учетом того, что стабилизатор H2S – двухосновная кислота. Укажите строение мицеллы.
- Напишите формулу мицеллы золя сульфида цинка, полученного в реакции сульфата цинка и сульфида аммония при избытке
а) сульфата цинка,
б) сульфида аммония.
- Напишите формулу мицеллы золя сульфата бария, полученного в реакции нейтрализации между серной кислотой и гидроксидом бария в
а) избытки кислоты,
б) избытки основания.
Укажите строение мицелл.
- Каково строение мицеллы золя берлинской лазури, полученного пептизацией осадка щавелевой кислотой? Как определить заряд коллоидной частицы.
- Написать формулу мицеллы золя Au, если стабилизатором является раствор AuCl3.
- Напишите мицеллу золя берлинской лазури, полученного в реакции ионного обмена из К4Fe(CN)6 и FeCl3 при избытке К4Fe(CN)6.
- Напишите формулы мицелл сульфида цинка, образующихся при получении золя по следующей реакции:
ZnSO4 + (NH4)2S → ZnS + (NH4)2SO4
а) в случае избытка сульфата цинка;
б) в случае избытка сульфида аммония.
- Напишите формулу мицеллы золя иодида серебра, полученного добавлением 40 мл раствора AgNO3 с концентрацией 0,02 моль/л к 50 мл раствора KJ с концентрацией 0,001 моль/л. Каким методом получен золь?
- Каково строение мицеллы для золя йодида серебра, полученного добавлением к 30 мл раствора йодида калия (с концентрацией 0,006 моль/л) 40 мл раствора с концентрацией AgNO3, равной 0,004 моль/л.
- Смешали равные объемы 1%-ных растворов хлорида кальция и серной кислоты (плотности принять равными 1 г/мл). Напишите формулы мицеллы образовавшегося золя сульфата кальция.
- Какой объем раствора нитрата серебра с концентрацией 0,001 моль/л следует добавить к 10 мл раствора хлорида натрия с С(NaCl) = 0,002 моль/л, чтобы получить золь, гранулы которого заряжены положительно? Напишите схему строения мицеллы золя.
- Какой минимальный объем сульфида аммония с концентрацией 0,001 моль/л следует добавить к 15 мл раствора хлорида марганца (II) с концентрацией 0,003 моль/л для того, чтобы получить золь с отрицательно заряженными частицами?
- Гранула берлинской лазури Fe4[Fe(CN)6]3 в электрическом поле перемещается к аноду. Какое вещество служит стабилизатором? Напишите формулу мицеллы.
- Золь кремниевой кислоты получили при взаимодействии растворов К2SiO3 и НС1. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду?
- Какой объем 0,001 М раствора FеС13 надо добавить к 0,03 л 0,002 М раствора AgNO3, чтобы частицы золя хлорида серебра в электрическом поле двигались к аноду? Напишите формулу мицеллы золя.
Лабораторная работа 8
Коллоидная защита
Краткая теория:
Свойства коллоидных систем
1. Молекулярно-кинетические свойства коллоидных систем.
1. Для коллоидных систем характерно броуновское движение – непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров.
2. Результатом броуновского движения коллоидных частиц является диффузия – самопроизвольно протекающий процесс выравнивания концентрации частиц. Для количественного описания диффузии используется закон Фика:
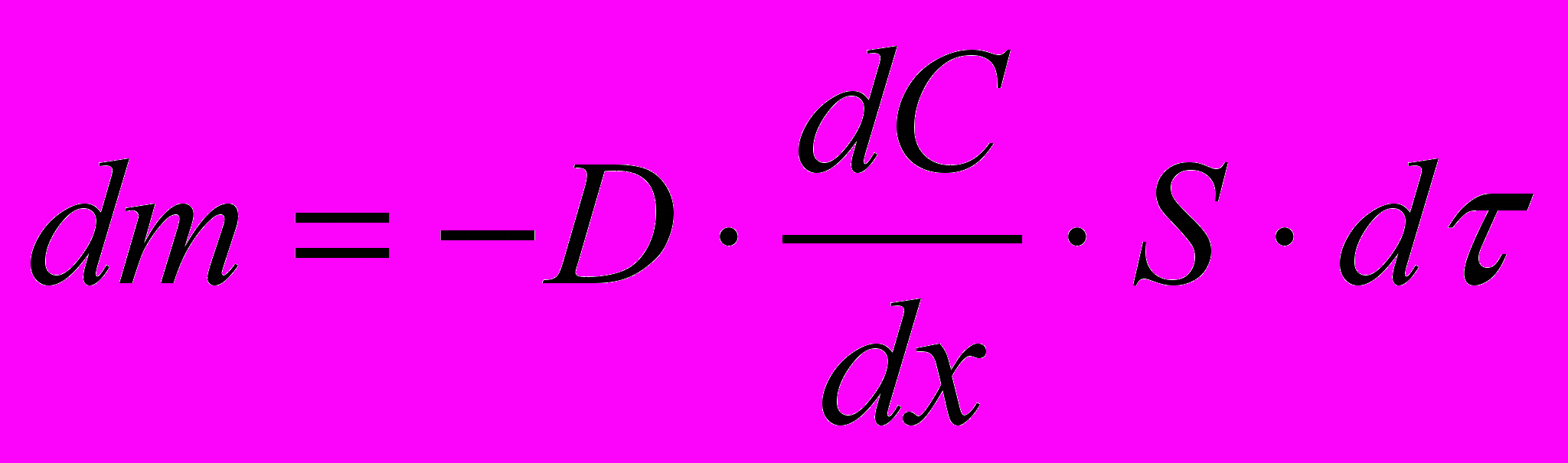 (4.4)
(4.4)где m – количество продиффундировавшего вещества;
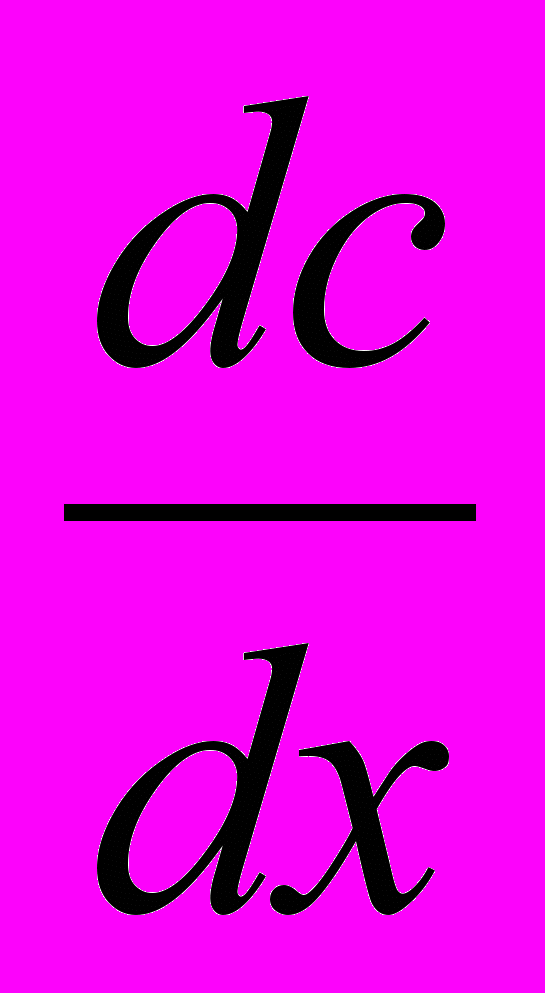 - градиент концентрации; S – площадь, через которую происходит диффузия; τ – продолжительность диффузии; D – коэффициент диффузии равный количеству вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице.
- градиент концентрации; S – площадь, через которую происходит диффузия; τ – продолжительность диффузии; D – коэффициент диффузии равный количеству вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице.Уравнение Эйнштейна-Смолуховского:
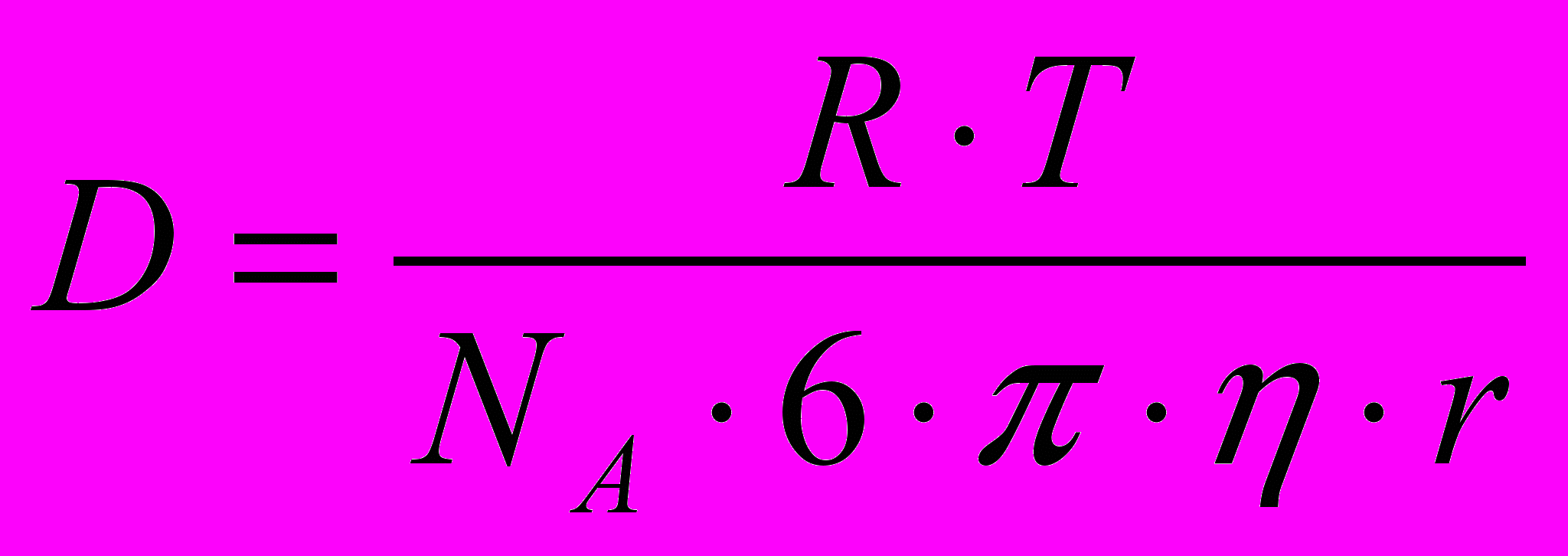 (4.5)
(4.5)где D - коэффициент диффузии, Т - абсолютная температура, η –вязкость дисперсионной среды, r - радиус частиц дисперсной фазы.
3. Для коллоидных систем характерно осмотическое давление. Оно может быть найдено по уравнению:
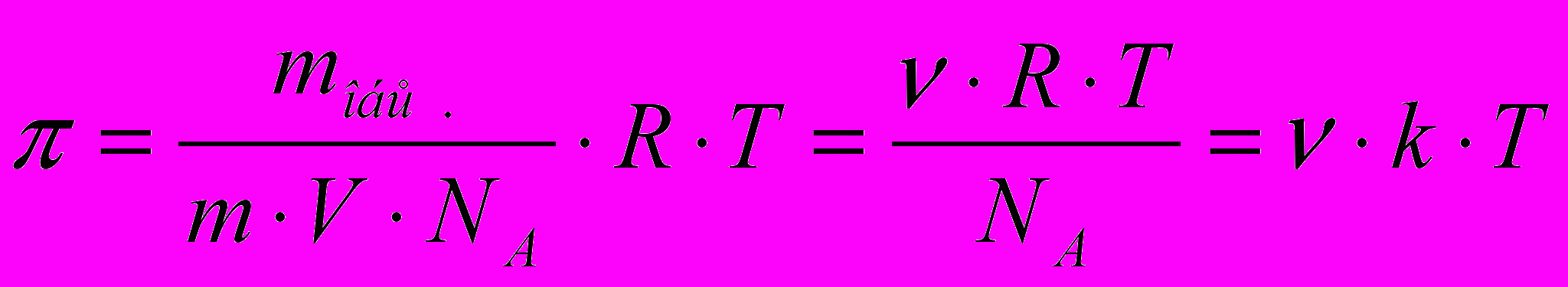 (4.6)
(4.6)где mобщ – масса растворённого вещества; m – масса одной частицы; V – объём системы; NA – число Авогадро; Т – абсолютная температура; ν – частичная концентрация; k – постоянная Больцмана.
2. Устойчивость коллоидных систем
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц во всём объёме дисперсионной среды.
Существует два вида относительной устойчивости дисперсных систем: седиментационная и агрегативная.
Седиментационная устойчивость – способность системы противостоять действию силы тяжести. Седиментация – это оседание частиц в растворе под действием силы тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять свои размеры.
3. Коагуляция коллоидных систем
Коагуляция – это разрушение коллоидной системы под воздействием различных факторов и выражается в слипании частиц дисперсной фазы с последующим выпадение их в осадок.
Коагуляция бывает скрытая (не видимая невооружённым глазом) и явная (изменение окраски раствора, помутнение, выпедение осадка).
Коагуляцию вызывают следующие способы:
- Физические: изменении концентрации, температура, механическое перемешивание, действие света и ультразвука, длительное стационарное хранение (поэтому коллоидные системы должны быть свежеприготовленными, храниться в тёмной посуде и в неподвижном помещении).
- Химические: добавление любого электролита к любой коллоидной системе.
Коагулирующим ионом электролита является ион, одноимённо заряженный с противоионом.
Все электролиты по своему строению делятся на индифферентны (не содержат таких ионов, которые были бы способны к специфической адсорбции на частицах по правилу Панета-Фаянса, т.е. не имеют ионов подобных ионам агрегата) и неиндифферентные (содержат ионы подобные ионам агрегата).
Коагулирующее действие электролитов характеризуется порогом коагуляции – наименьшее количество добавленного электролита, вызывающее коагуляцию 10 мл золя, а его концентрация называется – пороговой концентрацией.
Порог коагуляции можно рассчитать, зная концентрацию электролита-коагулятора С, объём добавленного электролита V, и объём золя Vзоля (обычно 10 мл):
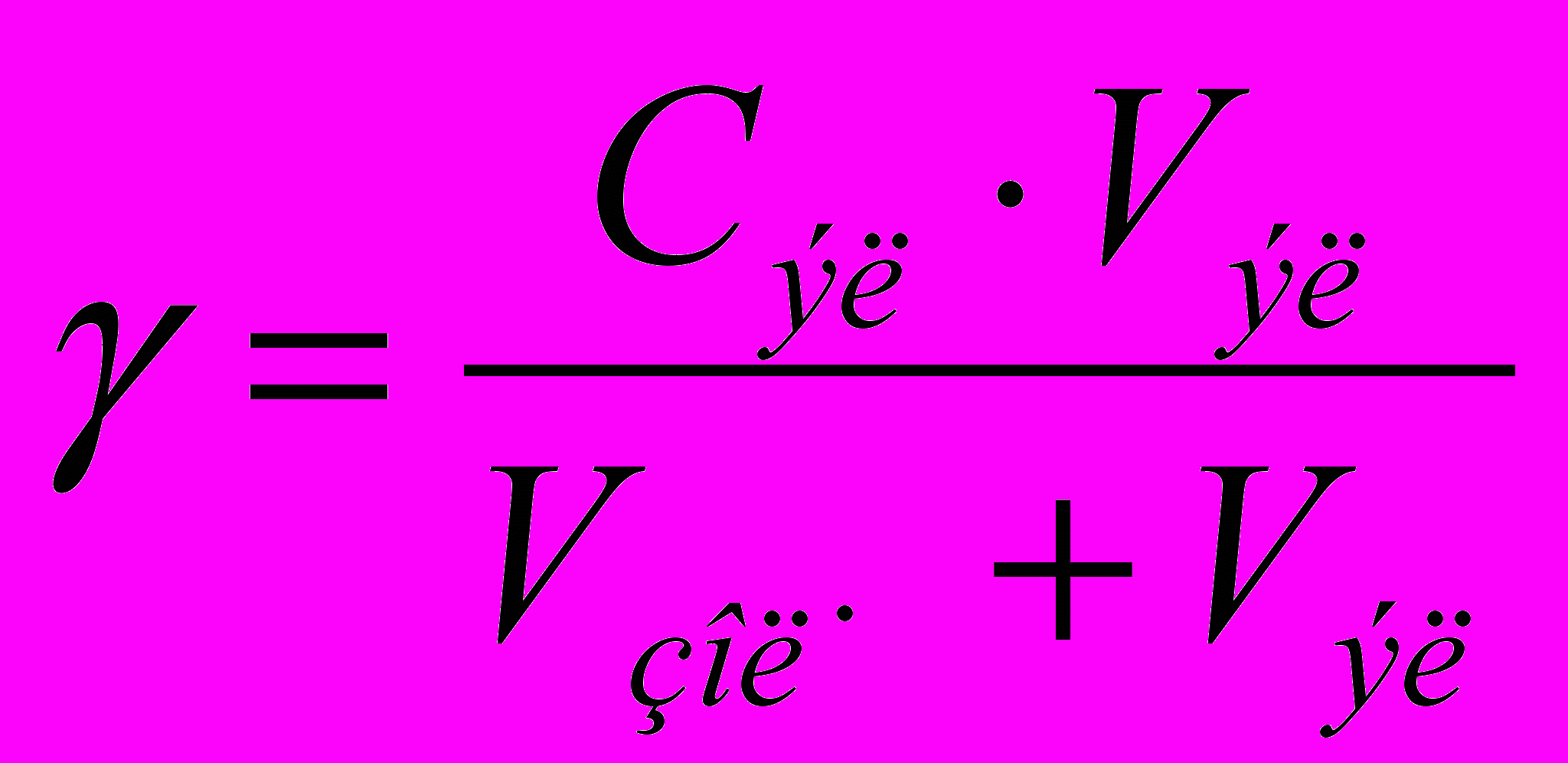 (4.7)
(4.7)Величина, обратная порогу коагуляции (
 ), называется коагулирующей способностью электролита. Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
), называется коагулирующей способностью электролита. Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита.Порог коагуляции зависит от валентности коагулирующего иона и описывается правилом Шульца-Гарди или правилом значности:
γ3 : γ2 : γ1 = 1:11:729 (4.8)
т.е. чем меньше валентность коагулирующего иона, тем выше порог коагуляции и тем больше потребуется электролита для коагуляции коллоидной системы. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус.
Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке:
Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+
Этот ряд называется лиотропным.
Начавшуюся коагуляцию остановить невозможно, но можно коллоидную систему заранее защитить, добавив в неё защитное вещество (растворы желатины, танина и других высокомолекулярных соединений). Их защитное действие выражается в повышении порога коагуляции. Оно связано с адсорбцией их молекул на поверхности коллоидных частиц. Образующийся на поверхности коллоидных частиц защитный слой препятствует их слипанию. Показателем защитного действия (защитным числом) называется минимальное количество мг сухого вещества, которое необходимо для защиты 10 мл золя при добавлении к нему электролита в количестве, равном порогу коагуляции.
4. Пептизация коллоидных систем
Пептизация или дезагрегация – перевод свежевыпавшего осадка в коллоидное состояние. Пептизация тем более вероятна, чем меньше времени прошло с момента коагуляции. Вызвать пептизацию можно отмыванием коагулята от избытка электролита водой, либо добавлением электролита, содержащего потенциалобразующие ионы, за счёт адсорбции которых повышается поверхностный заряд частиц.
Цель работы: Определить защитное число желатины для золя гидрата окиси железа («железное число»).
Оборудование: Штатив с бюретками, набор из 10 пробирок, мерный цилиндр, коническая колба, химические стаканы.
Реактивы: Насыщенный раствор хлорного железа, 0,002Н раствор сернокислого натрия, свежеприготовленный 0,1% раствор желатины, дистиллированная вода, бумажные фильтры.
Порядок работы:
- Получение золя гидрата окиси железа методом гидролиза.
В конической колбе нагреть до кипения 300 мл дистиллированной воды. В кипящую воду влить 3 мл насыщенного раствора хлорного железа и прокипятить полученную смесь 2-3 минуты. Образовавшийся красновато-коричневый золь гидрата окиси железа охладить до комнатной температуры. Записать протекающую в колбе реакцию. Написать формулу образовавшейся мицеллы.
Мицелла золя зависит от условий его приготовления. В случае неполного гидролиза:
2FeCl3 + 4H2O = Fe(OH)3↓ + FeOCl + 5HCl
образуется оксохлорид железа FeOCl, который принято считать стабилизатором, а кипячение способствует удалению паров HCl. При полном гидролизе:
FeCl3 + 3H2O = Fe(OH)3↓ + 3HCl
Протекающем в избытке FeCl3, стабилизатором является само хлорное железо.
- Определение порога коагуляции золя гидрата окиси железа.
а) В две пробирки с помощью мерного цилиндра налить по 10 мл полученного золя гидрата окиси железа. В одну (рабочую) добавить 0,5 мл 0,002-нормального раствора сернокислого натрия. Сравнить две пробирки (рабочую и контрольную) на чёрном фоне на проходящий свет. Наличие помутнения (коагуляции) отметить в таблице 8 знаком «+», отсутствие - знаком «-». Если помутнение не наблюдается, то в рабочую пробирку добавить ещё 0,5 мл сернокислого натрия. Снова произвести сравнение. Результаты записать в таблицу 8. Добавление сернокислого натрия по 0,5 мл в рабочую пробирку производить до помутнения
б) В четыре новых рабочих пробирки с помощью мерного цилиндра налить по 10 мл золя гидрата окиси железа. В первую добавить сернокислого натрия на 0,1 мл больше, чем было добавлено для получения последнего «-» в пункте а). Сравнить контрольную и первую рабочую пробирки, как было описано выше. Наличие помутнения (коагуляции) отметить в таблице 8 знаком «+», отсутствие - знаком «-». Если помутнение не наблюдается, то во вторую рабочую пробирку с золем добавить сернокислого натрия на 0,1 мл больше, чем было добавлено в первую. Снова сравнить контрольную и вторую рабочую пробирки. Опыт производить до тех пор, пока не будут обнаружены первые признаки помутнения.
в) Определить порог коагуляции как минимальное количество мл 0,002-нормального раствора сернокислого натрия, вызывающее коагуляция 10 мл золя гидрата окиси железа, с точностью до 0,1 мл.
Таблица 8.
| № пробирки с золем | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Кол-во добавленного коагулятора, мл | | | | | | | | |
| Помутнение золя | | | | | | | | |
- Определение защитного числа.
а) В качестве защитного раствора использовать свежеприготовленный 0,1% раствор желатины. Налить в несколько пробирок (5-6) с помощью мерного цилиндра по 10 мл золя гидрата окиси железа. В первую пробирку с золем добавить из бюретки 1 мл 0,1% раствора желатины. Встряхнуть пробирку, дать ей постоять 40 секунд и прилить коагулятор в количестве, равном порогу коагуляции (нашли в пункте 2б). Если через 2-3 минуты раствор в пробирке остался прозрачным (т.е. желатина защитила раствор и коагуляция не произошла), то в следующую пробирку с золем добавить 0,5 мл раствора желатины. Если же раствор в пробирке помутнел (сравнение рабочей и контрольной пробирок описано в пункте 2а), то в следующую пробирку надо добавить 1,5 мл раствора желатины. Полученные результаты записать в таблицу 9: помутнение золя – «+», отсутствие помутнения – «-».
б) Налить в четыре новых пробирки по 10 мл золя гидрата окиси железа. Далее добавляемый объём желатины последовательно меняется от последнего «-» до первого «+» с шагом 0,1 мл. Объём добавляемого после желатина коагулятора всегда равен точному порогу коагуляции. Опыт ведут до получения первых признаков защиты золя гидрата окиси железа. Результаты наблюдений записать в таблицу 9.
в) По полученным результатам вычисляют защитное число, как число мг сухой желатины, защищающее 10 мл золя гидрата окиси железа от коагуляции при добавлении раствора электролита (коагулятора) в количестве, равном порогу коагуляции.
Таблица 9.
| № пробирки с золем | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Кол-во добавленного раствора желатины, мл | | | | | | | | |
| Кол-во добавленного коагулятора, мл | | | | | | | | |
| Помутнение золя | | | | | | | | |
Вопросы и задачи к работе 8
- Молекулярно-кинетические свойства коллоидных систем. Их отличия от истинных растворов.
- Как образуется двойной электрический слой и каково его строение? Что такое адсорбционный слой, диффузионный слой?
- Оптические свойства коллоидных систем. Закон светорассеяния Рэлея. Условия применимости. Явление опалесценции, конус Тиндаля. Что такое мутность? Сравните размеры частиц двух коллоидных растворов одинаковой объемной концентрации, если мутности () отличаться в 25 раз (2/1 = 25).
- Как изменится интенсивность рассеянного дисперсией света, если длина волны света увеличится с 430 нм до 600 нм?
- Каково соотношение радиусов частиц двух дисперсий с одинаковой численной концентрацией, если мутности, определенные в одинаковых условиях, отличаются в 1000 раз (2/1 = 1000). Объясните явление опалесценции.
- Коагуляция: определение; факторы, её вызывающие; коагулирующий ион; порог коагуляции; пороговая концентрация; правило значности (правило Шульца-Гарди); защитные вещества; защитное число.
- Индифферентные и неиндифферентные электролиты. Привести примеры для золей, полученных в лабораторном практикуме.
- Как влияет добавление электролита на электрокинетический потенциал коллоидной системы?
- Пептизация: определение; способы проведения.
- Определите, к какому электроду при электрофорезе должны перемещаться частицы золя, полученного по реакции при небольшом избытке H2S:
2H3AsO3 + 3H2S → As2O3 + 6H2O.
- Приведите пример неиндифферентного электролита к золю СаСO3 с положительным зарядом противоионов.
- К какому электроду двигаются при электрофорезе коллоидные частицы золя Fe(OH)3, полученного полным и неполным гидролизом FeCl3. Какие мицеллы?
- Порог коагуляции (γ). Как отличается коагулирующая способность (1/γ) сульфат, и фосфат ионов. Приведите примеры золей, коагуляцию которых они вызывают?
- К одинаковым образцам золей йодистого серебра с положительным зарядом коллоидных частиц добавили растворы Na2SO4, KCl, AlPO4 одинаковой концентрации. Указать, раствора, какого из перечисленных веществ потребуется меньше по объёму, а какого больше для коагуляции золя. Какой из ионов этого электролита вызовет коагуляцию золя?
- К одинаковым образцам золей SiO2 с отрицательным зарядом коллоидных частиц добавили растворы Na2SO4, NaCl, KCl, BaCl2, Al2(SO4)3 одинаковой концентрации. Указать, раствора, какого из перечисленных веществ потребуется меньше по объёму (ответ аргументировать). Какой из ионов этого электролита вызовет коагуляцию золя?
- Золь кремниевой кислоты получили при взаимодействии растворов K2SiO3 и HCl. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду?
- Золь гидроксида железа (ΙΙΙ), получаемый неполным гидролизом хлорного железа, коагулируют растворами сульфата натрия, хлорида натрия, хлорида бария. Какой электролит окажет наиболее значительное коагулирующее действие?
- Для защиты 5 мл золя гидроокиси железа от коагуляции электролитом потребовалось 3 мл 0,01% раствора желатины. Рассчитайте защитное число желатины, выразив его в г сухой желатины на 10 мл золя.
- Порог коагуляции золя гидроокиси железа фосфат-ионами равен 0,37 ммоль/л. Какой объём 5% раствора фосфата натрия (плотность 1.05 г/мл) потребуется для коагуляции 250 мл золя?
- Коагуляция 1010-6 м3 золя иодида серебра наступает при добавлении 0,510-6 м3 водного раствора BaCl2 с концентрацией С=0,05 кмоль/м3. Рассчитайте порог коагуляции BaCl2 для данного золя, выразив его в киломолях на кубический метр золя.
- Для защиты 510-6 м3 золя гидроокиси железа от коагуляции потребовалось ввести 310-6 м3 0,01%-процентного раствора желатины. Рассчитайте защитное число желатины, выразив его в килограммах сухой желатины на кубический метр золя.
- Сколько кубических метров раствора Al2(SO4)3 концентрации 0,01 кмоль/м3 потребуется для коагуляции 10-3 м3 гидрозоля As2S3. Порог коагуляции электролита относительно этого золя γ=9,610-5 кмоль/м3.
- Пороги коагуляции некоторого золя электролитами KNO3, MgCl2, NaBr равны соответственно 50,0; 0,8; 49,0 ммоль/л. Как относятся между собой величины коагулирующих способностей этих веществ? Укажите коагулирующие ионы. Каков знак заряда коллоидной частицы?
- Коагуляция 4 л золя гидроксида железа (III) наступила при добавлении 0,91 мл 10%-ного раствора сульфата магния (плотность 1,1 г/мл). Вычислите порог коагуляции золя сульфат-ионами.
- Порог коагуляции золя гидроксида алюминия дихромат-ионами равен 0,63 ммоль/л. Какой объём 10%-ного раствора дихромата калия (плотность 1,07 г/мл) требуется для коагуляции 1,5 л золя?
- К 100 мл 0,03%-ного раствора NaCl (плотность 1 г/мл) добавили 250 мл 0,001 М раствора AgNO3. Напишите формулу мицеллы золя. Какой из перечисленных электролитов вызовет коагуляцию этого золя с наименьшим порогом коагуляции: КС1, Ba(NO3)2, MgSO4, A1C13?
- Порог коагуляции золя сульфатом магния меньше, чем нитратом бария. Как заряжены частицы золя? Что можно сказать о пороге коагуляции этого же золя фосфатом калия?
- Коагуляция 1,5 л золя сульфида золота наступила при добавлении 570 мл раствора хлорида натрия с концентрацией 0,2 моль/л. Вычислите порог коагуляции золя ионами натрия.
- Порог коагуляции золя гидроксида железа фосфат-ионами равен 0,37 ммоль/л. Какой объем 5%-ного раствора фосфата натрия (плотность 1,05 г/мл) требуется для коагуляции 750 мл золя?
- Явная коагуляция 2 л золя гидроксида алюминия наступила при добавлении 10,6 мл раствора K4[Fe(CN)6] с концентрацией 0,01 моль/л. Вычислите порог коагуляции золя гексацианоферрат-ионами; напишите формулу мицеллы золя гидроксида алюминия.
- Порог коагуляции золя сульфида золота ионами кальция равен 0,69 ммоль/л. Какой объем раствора хлорида кальция с концентрацией 0,5 моль/л требуется для коагуляции 100 мл золя?
- Коагуляция 10 мл золя гидроокиси железа наступает при добавлении 1,5 мл раствора NaCl с концентрацией 0,25 моль/л и 0,6 мл Na2SO4 (0,05 моль/л). Рассчитайте пороги коагуляции и проверьте выполнимость правила значности. Какой ион является коагулирующим и почему?
- Из электролитов (KCl, Na2SO4, AlCl3, Na3PO4, CaCl2) выберите электролит с наилучшим коагулирующим действием для коагуляции золя с отрицательно заряженными частицами.
- Сравните пороги коагуляции золя сульфида мышьяка, если для коагуляции 10 мл золя потребовалось 1,2 мл 0,5 М раствора KCl, 0,4 мл 0,04 М раствора CaCl2 и 0,1 мл 0,1 М раствора AlCl3. Выполняется ли правило значности?
- Если выполняется правило значности и коагуляция 5 мл золя наступает при добавлении 2 мл 0,5 М раствора KCl, то при каком объеме электролита будет коагуляция 0,1 М раствором СаСl2 и 0,05 М раствором AlCl3?
- Для коагуляции золя AgJ, полученного в избытке AgNO3, выберите наилучший электролит (NaCl, AlCl3, Na3PO4, Na2SO4).
ПРИЛОЖЕНИЯ
Приложение 1.
Способы выражения концентрации.
- Мольная доля отношение количества вещества (моль) к сумме количеств всех компонентов в растворе (моль).
- Массовая доля вещества в растворе отношение массы растворенного вещества к массе раствора.
- Процентная концентрация массовая доля вещества, выраженная в процентах масса вещества (г) в 100 г раствора.
- Мольная концентрация (моль л1) отношение количества вещества, содержащегося в растворе, к объему этого раствора. При одинаковой мольной концентрации равные объемы растворов различных веществ содержат одинаковое количество веществ.
- Моляльная концентрация (моляльность) (моль кг1) отношение количества вещества к массе растворителя.
- Титр (г мл 1) масса растворенного вещества в 1 мл раствора.
- Моль – количество вещества, содержащее столько же структурных элементов (атомов, молекул, ионов, формульных единиц, электронов), сколько атомов содержится в углероде–12 массой 0,012 кг.
Приложение 2.
Подвижности ионов Н+ и СН3СОО при бесконечном разведении, cм2Ом1моль1
| t, oC | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| (H+) | 315 | 320 | 325 | 330 | 335 | 340 | 345 |
| (CH3COO) | 35,0 | 35,9 | 36,7 | 37,5 | 38,4 | 39,2 | 40,0 |
