I электрохимия
| Вид материала | Лабораторная работа |
- «Электрохимия, гальванотехника и обработка поверхности», посвященная 200-летию со дня, 94.6kb.
- Закономерности процесса фосфатирования магний-литиевых сплавов 02. 00. 05 электрохимия, 368.63kb.
- Рабочая учебная программа дисциплины Теоретическая электрохимия Направление подготовки, 468.83kb.
- Исследование влияния морфологии и химического состава поверхности ионообменных мембран, 332.73kb.
- Рабочая программа по дисциплине опд. Р. 01 «Электрохимическая синергетика», 157.53kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- Рабочая программа для подготовки инженеров по специальности 250300 "Технология электрохимических, 128.05kb.
- Электрохимические и физико-химические аспекты фиторемедиации сточных и промывных вод,, 396.8kb.
- Халькогенсодержащие органические соединения для преобразователей энергии и информации., 961.61kb.
Электродные потенциалы
и электродвижущие силы.
буферные системы
Лабораторная работа 3
Измерение ЭДС медно-цинкового гальванического элемента
и концентрационного элемента
Краткая теория:
При соприкосновении двух химически или физически разнородных материалов (металл 1 (проводник I рода) — металл 2 (проводник I рода), металл (проводник I рода) — раствор соли металла (проводник II рода), раствор электролита 1 (проводник II рода) — раствор электролита 2 (проводник II рода) и т.д.) между ними возникает двойной электрический слой (ДЭС). ДЭС является результатом упорядоченного распределения противоположно заряженных частиц на границе раздела фаз. Образование ДЭС приводит к скачку потенциала j, который в условиях термодинамического равновесия металл (проводник I рода) — раствор соли металла (проводник II рода), называется гальвани-потенциалом.
Система, состоящая из металла, погруженного в раствор соли, содержащей катионы этого металла, называется электродом или полуэлементом.
Схему электрода можно представить следующим образом:
Меn+│Ме
φ>0, если на электроде протекает реакция восстановления
Меn+ + ne– Û Ме0,
φ<0, если на электроде протекает реакция окисления
Me0 Û Меn+ + ne–
Электродным потенциалом металла
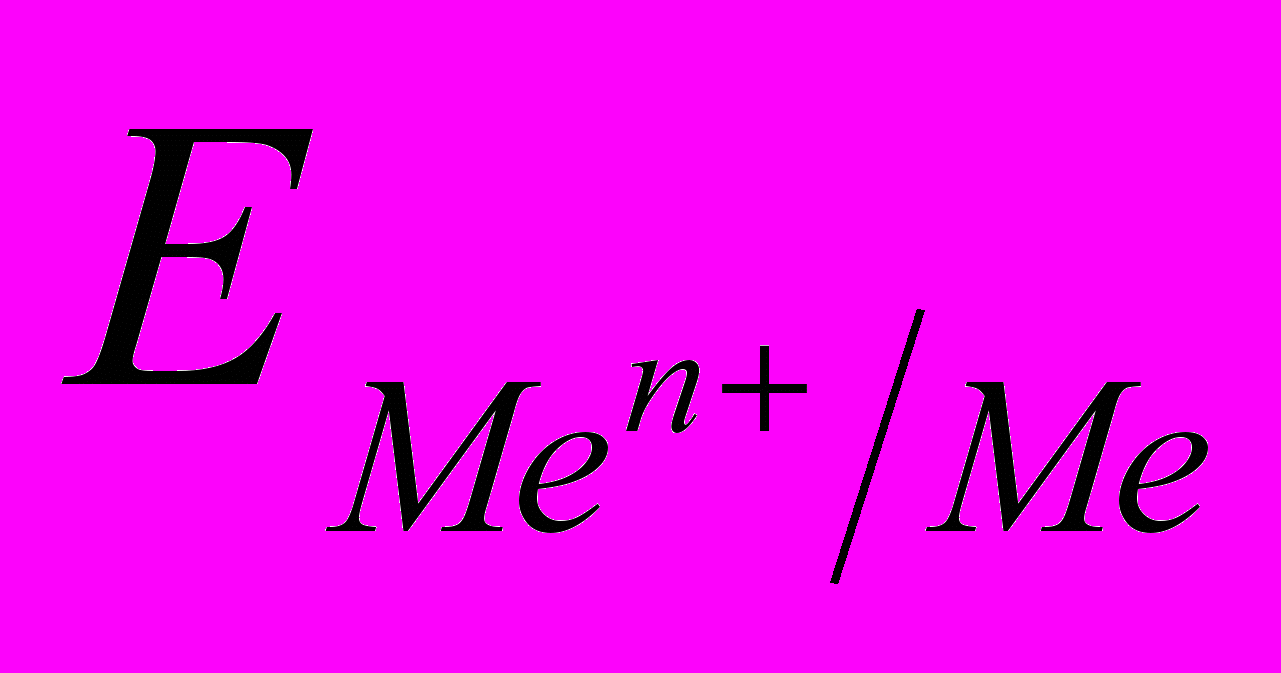 называется равновесная разность потенциалов, возникающая на границе фаз проводник I рода/проводник II рода и измеренная относительно стандартного водородного электрода. Зависимость электродного потенциала металла от его природы, концентрации металла в растворе и температуры выражается уравнением Нернста, которое для электродной реакции имеет вид:
называется равновесная разность потенциалов, возникающая на границе фаз проводник I рода/проводник II рода и измеренная относительно стандартного водородного электрода. Зависимость электродного потенциала металла от его природы, концентрации металла в растворе и температуры выражается уравнением Нернста, которое для электродной реакции имеет вид: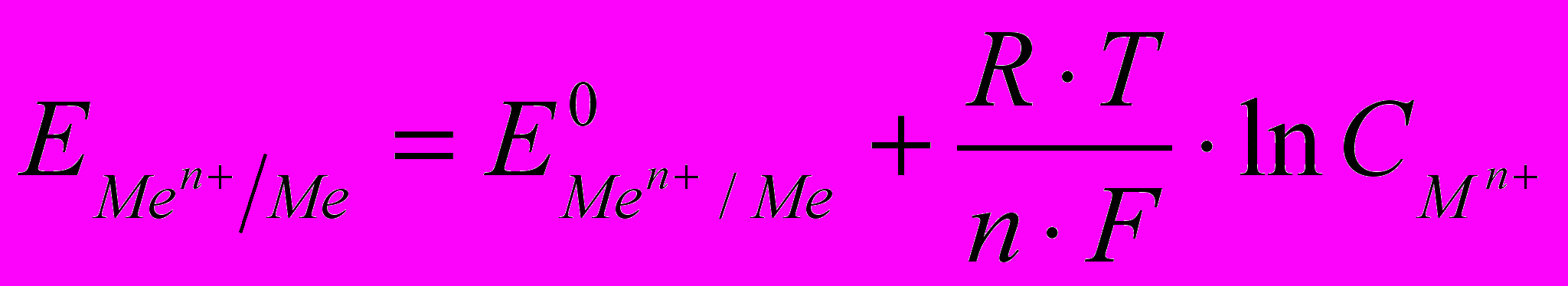 (2.1)
(2.1)где
 стандартный электродный потенциал металла (равновесная разность потенциалов между металлом и раствором при активности катионов металла в растворе 1 мольл1); F число Фарадея (96500 Клмоль1); R универсальная газовая постоянная (8,31 Джмоль1град1); n число электронов, участвующих в электродной реакции;
стандартный электродный потенциал металла (равновесная разность потенциалов между металлом и раствором при активности катионов металла в растворе 1 мольл1); F число Фарадея (96500 Клмоль1); R универсальная газовая постоянная (8,31 Джмоль1град1); n число электронов, участвующих в электродной реакции; 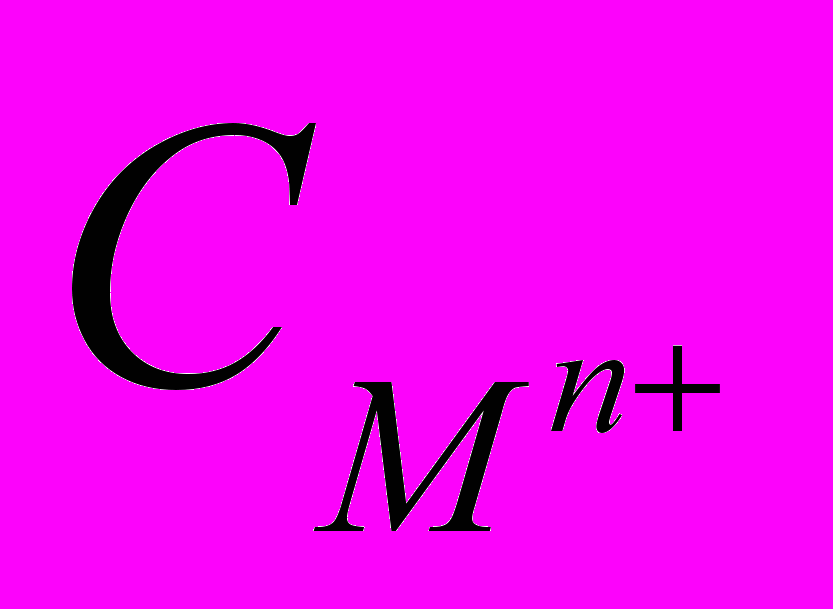 - концентрации металла в растворе.
- концентрации металла в растворе.Гальванический элемент – устройство, состоящее из двух или более электродов, в котором химическая энергия окислительно-восстановительной реакции (ОВР) переходит в полезную электрическую энергию (например, в виде свечения лампы накаливания) при условии пространственного разделения процессов окисления и восстановления. Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления – катодом.
Э.Д.С. (Е) – это электродвижущая сила, которая численно равна максимальной работе по перемещению заряда по замкнутой цепи.
Правила ИЮПАК для записи гальванических элементов и реакций, протекающих в них.
- В гальваническом элементе работа производится, поэтому ЭДС элемента считается величиной положительной.
- Величина ЭДС гальванической цепи Е определяется алгебраической суммой скачков потенциала на границах раздела всех фаз, но так как на аноде протекает окисление, то ЭДС рассчитывают, вычитая из числового значения потенциала катода (правого электрода) значение потенциала анода (левого электрода) – правило правого полюса. Поэтому, схему элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительный (протекает процесс восстановления).
- Границу раздела между проводником I рода и проводником II рода обозначают одной чертой.
- Границу между двумя проводниками II рода изображают пунктирной чертой.
- Электролитный мостик на границе двух проводников II рода обозначают двумя пунктирными чертами.
- Компоненты одной фазы записывают через запятую.
- Уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме ( Ox), а справа - в восстановленной (Red).
Схема медно-цинкового электрохимического элемента (элемента Даниэля - Якоби) (рис.2):

Рис.2. Гальванический элемент
() Cu│Zn│ZnSO4 ¦ KCl ¦ СuSO4 │Cu (+)
На поверхности медного электрода протекает восстановление ионов меди
Cu2+ + 2e Cu,
а на поверхности цинкового окисление металлического цинка:
Zn 2e Zn2+.
Складывая, получим суммарное химическое превращение:
Zn + Cu+ Zn2+ + Cu.
Э.Д.С. медно-цинкового гальванического элемента равна
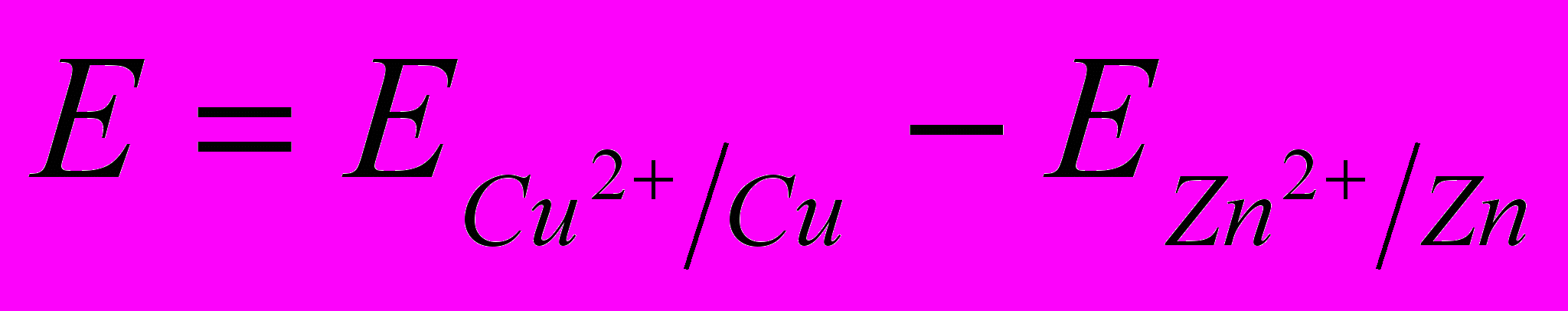
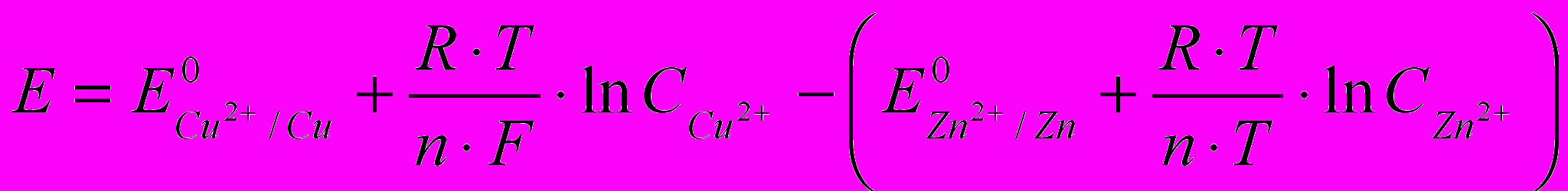
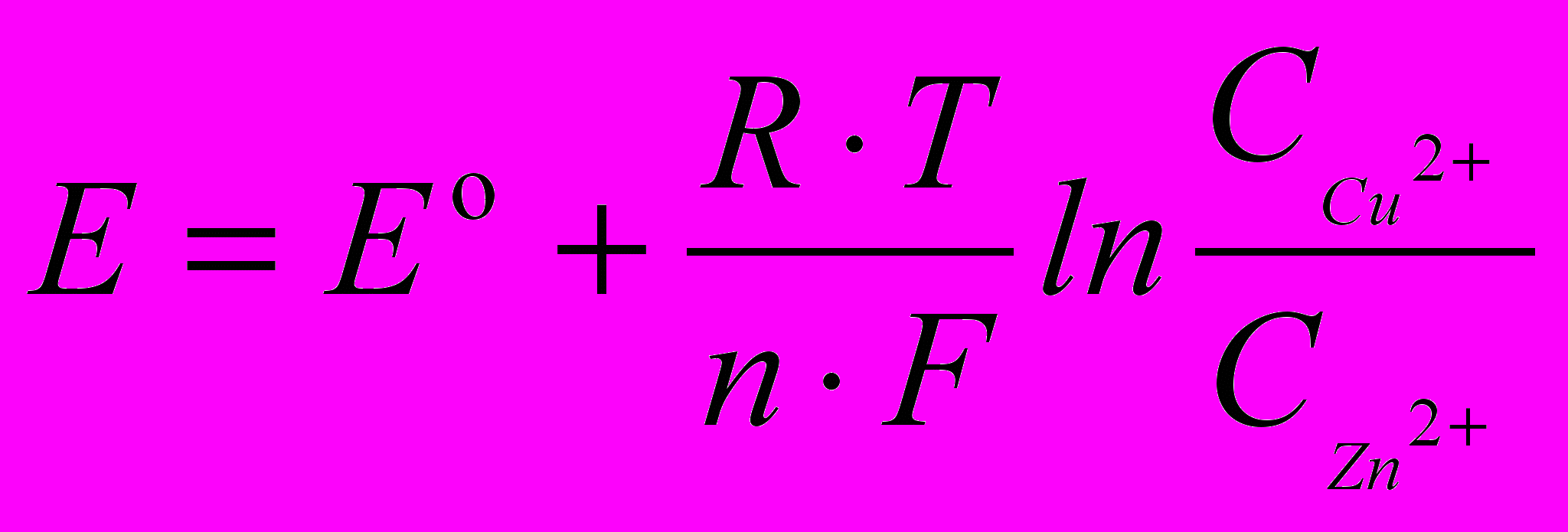 , (2.2)
, (2.2)Гальванический элемент, составленный из двух полуэлементов, отличающихся друг от друга только концентрацией электролитов, называется концентрационным гальваническим элементом. Э.Д.С. такого концентрационного гальванического элемента равна:
E = Еправ Елев.
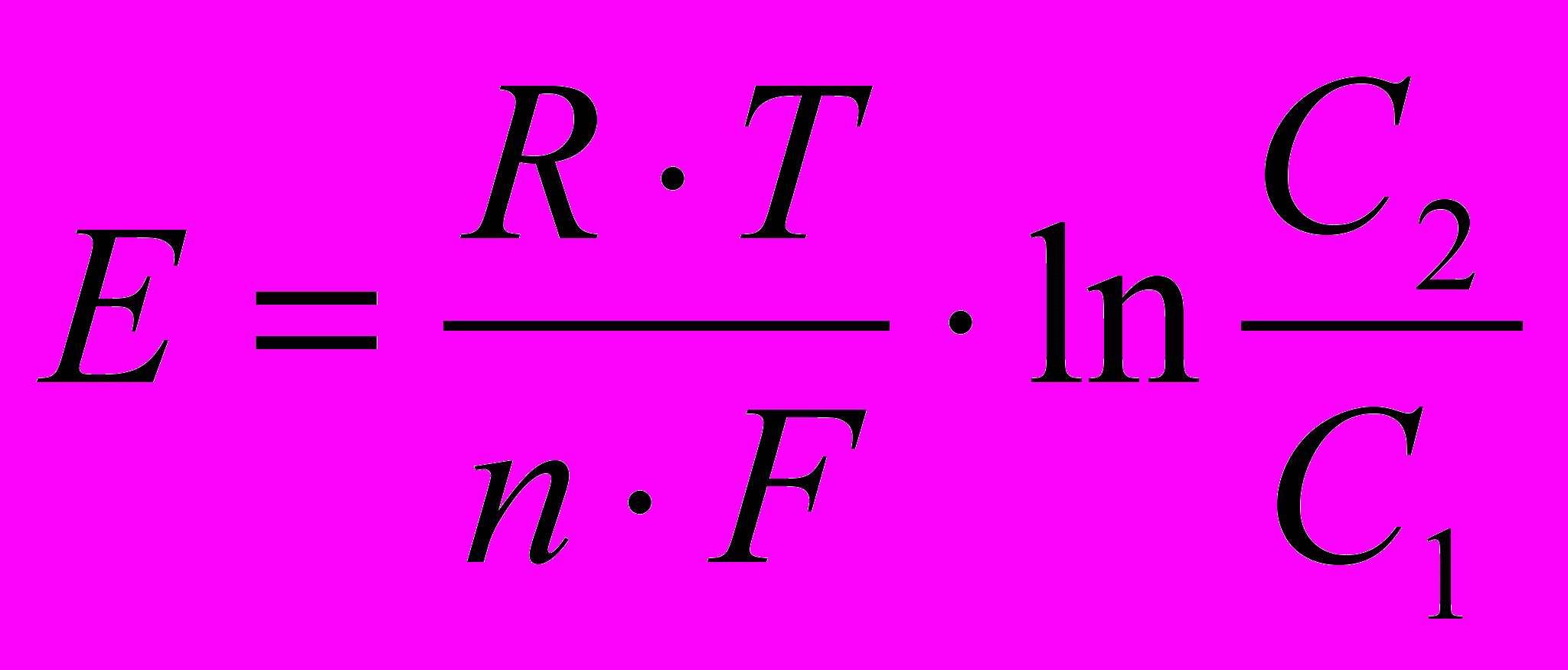 (2.3)
(2.3)Для измерения электродных потенциалов используют два основных вида электродов: электроды сравнения и электроды для определения рН растворов электролитов.
- Электроды сравнения имеют хорошо воспроизводимый и сохраняющийся на протяжении всего опыта скачок потенциала. К ним относятся стандартный водородный и хлорсеребряный электроды.
а) Электродный потенциал стандартного водородного электрода описывается уравнением Нернста:
 (2.4)
(2.4)где Eo стандартный потенциал водородного электрода; P давление газообразного водорода, равное 1 атм; СН+ концентрация Н+ в растворе, равная 1 моль л1.
б) Электродный потенциал хлорсеребряного электрода равен:
ЕAgCl = 0,2224 0,00065 (t 25) [В] (2.5)
- Для измерения рН растворов могут быть использованы хингидронный и стеклянный.
а) Хингидронный электрод используют для определения концентрации ионов водорода в щелочной среде. Его потенциал рассчитывают по уравнению:
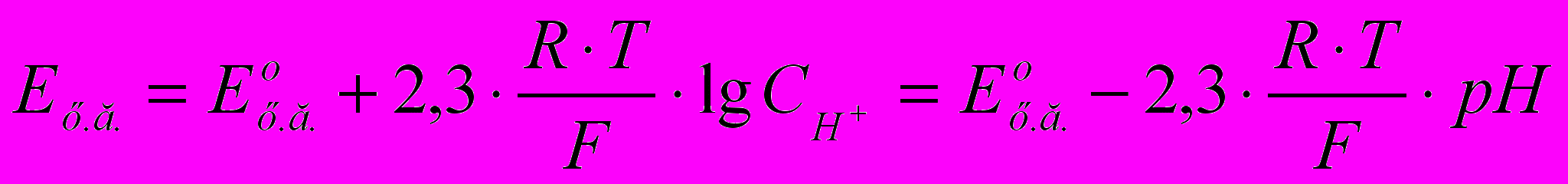 (2.6)
(2.6)Ех.г.=0,7177-0,00074t (2.7)
Уравнение (2.7) справедливо в интервале температур от 0 до 40°С.
б) Стеклянный электрод используют для определения концентрации ионов водорода в кислой среде. Его электродный потенциал рассчитывают по формуле:
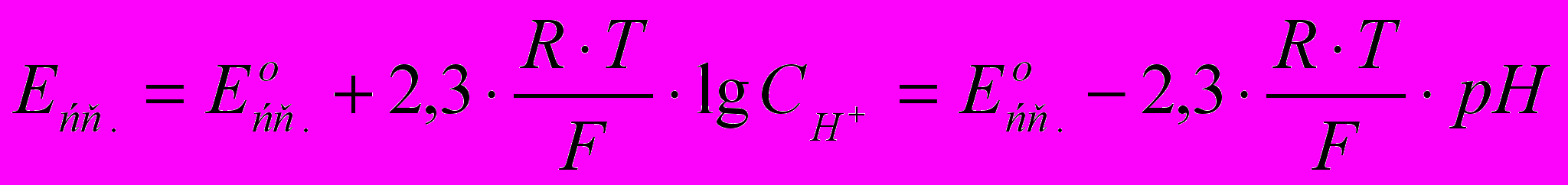 (2.8)
(2.8)Цель работы: Измерить ЭДС медно-цинкового гальванического элемента с помощью потенциометра (иономера). Полученные значения ЭДС сопоставить с величинами, рассчитанными по формулам.
Оборудование: Электрохимическая (гальваническая) ячейка, электроды медный и цинковый, потенциометр (иономер) для стандартных измерений.
Реактивы: Растворы: CuSO4 концентраций 0,01, 0,1 и 0,5 М; ZnSO4 концентраций 0,01, 0,1 и 0,5 М; насыщенный раствор KCl, дистиллированная вода.
Порядок работы:
- Измерение ЭДС медно-цинкового гальванического элемента потенциометром.
- Составить медно-цинковый гальванический элемент (рис.1):
() Zn ZnSO4 CuSO4 Cu (+)
Концентрации растворов электролитов: С(CuSO4) = 0,1 моль л1 и С(ZnSO4) = 0,5 моль л1.
- Подключить медно-цинковый элемент к потенциометру (иономеру): медный электрод гальванического элемента подключить к клемме "+" потенциометра, цинковый к "".
- Измерить ЭДС элемента потенциометром (иономером), пользуясь инструкцией к прибору. Результаты измерений записать в таблицу 3.
- Рассчитать значение ЭДС медно-цинкового элемента.
- Повторить измерения с п.1 по п. 4 для растворов электролитов: С(CuSO4) = 0,5 моль л1 и С(ZnSO4) = 0,1 моль л1.
Таблица 3.
| Номера опытов | Электроды | Электролиты | С, моль л1 | Еизмер., В | Ерасчёт., В | |
| 1 | а | Cu | CuSO4 | 0,1 | | |
| Zn | ZnSO4 | 0,5 | ||||
| б | Cu | CuSO4 | 0,5 | | | |
| Zn | ZnSO4 | 0,1 | ||||
| 2 | а | Cu | CuSO4 | 0,01 | | |
| Cu | CuSO4 | 0,5 | ||||
| б | Zn | ZnSO4 | 0,01 | | | |
| Zn | ZnSO4 | 0,5 | ||||
- Измерение ЭДС концентрационного элемента.
- Составить одну из указанных цепей:
() Zn ZnSO4 ZnSO4 Zn (+) или () Cu CuSO4 CuSO4 Cu (+)
С1 С2 С1 С2
Концентрации электролитов: С1 = 0,01 моль л1, С2 = 0,5 моль л1.
- Подключить концентрационный элемент к потенциометру (иономеру) и измерить его ЭДС. Результаты измерений записать в таблицу 3.
- Сравнить полученное значение с ЭДС концентрационного элемента, рассчитанной по уравнению 2.3.
Вопросы и задачи к работе 3
- Механизм возникновения скачка потенциала на границе раздела металл жидкость. Запишите какие скачки потенциалов возникают на всех границах раздела фаз.
- Что называется гальвани-потенциалом? Мерой чего служит его величина?
- Гальвани-потенциал, электродный потенциал, стандартный электродный потенциал. Факторы, влияющие на величину электродного потенциала.
- Устройство гальванического элемента. Показать, какие скачки потенциалов возникают на границах раздела фаз в медно-цинковом гальваническом элементе. Какие из них дают максимальный вклад в величину ЭДС элемента?
- Уравнение Нернста, понятие стандартного электродного потенциала.
- От чего зависит величина стандартной ЭДС электрохимического элемента?
- Водородный электрод: схема, строение, уравнение реакции, особенности.
- Стандартные электродные потенциалы литиевого Li и серебряного Ag электродов соответственно равны –3,02 В и +0,799 В. Определить стандартную ЭДС элемента, составленного из этих электродов.
- Составьте схему гальванического элемента из медного и цинкового электродов, погружённых в 1 М растворы солей этих металлов. Рассчитайте ЭДС этого элемента. Напишите уравнения электродных процессов. Изменится ли ЭДС, если взять 0,001 М растворы солей?
- От каких параметров зависит ЭДС концентрационного элемента?
- ЭДС двух концентрационных элементов равны 0,75 В и 0,30 В, соответственно. Показать расчетом, в каком из элементов больше отношение концентраций растворов?
- Для гальванического элемента
Pt | Сr3+,Сr2+ || Со3+,Со2+ | Pt
вычислить стандартную ЭДС Е°, если Е°(Cr3+,Сr2+|Pt)=-0,41 В, Е°(Co3+,Сo2+|Pt)=1,82 В. Написать уравнение реакции, протекающей в элементе. Рассчитать электродные потенциалы и величину ЭДС элемента, если С(Cr3+)=0,005; С(Cr2+)=0,05; С(Со2+)=0,1; С(Co3+)=0,1.
- Гальванический элемент представлен схемой:
() Mg Mg2+ Co2+ Co (+)
Mg2+ Mg Ео = 2,363 В
Co2+ Co Ео = 0,277 В
Рассчитать стандартное значение ЭДС этого элемента. Написать электродные реакции.
- Концентрации растворов в концентрационном элементе 0,150 и 0,005 моль л1. Рассчитать ЭДС элемента. Т = 300 К, F = 96500 Кл моль1, n = 2, R = 8.31 Дж моль1град1.
- Вычислите ЭДС элемента:
Pt /Ti+4, Ti+3 // Sn+4, Sn+2/ Pt
C1 C2 C3 C4
C1=C2=C3=C4=1. Значения стандартных потенциалов для электродов Ti+4, Ti+3 и Sn+4, Sn+2 соответственно равны 0,04 и 0,15 В.
- Определите ЭДС при 298К для элемента:
Pt,H2 / H+ // C6H4(OH)2, C6H4O, H+/Pt
Стандартный электродный потенциал хингидронного электрода равен 0,6994 В.
- Стандартные электродные потенциалы некоторых металлов приведены ниже:
Са2+ + 2е Са0 Е0 = 2,870 В
Сu2+ + 2е Cu0 Е0 = 0,337 В
Mn2+ + 2e Mn0 Е0 = 1,180 В
Какой из перечисленных металлов легче переходит в раствор?
- Рассчитайте, чему равен потенциал цинкового электрода, опущенного в раствор с концентрацией ZnSO4, равной 0,001 М, Т=298 К.
- Потенциал медного электрода, помещённого в раствор его соли, составил +0,32 В. Вычислить концентрацию ионов меди.
- Потенциал марганцевого электрода, помещённого в раствор его соли, составил -1,2 В. Вычислить концентрацию ионов марганца.
- Вычислите концентрацию ионов водорода в растворе, в котором потенциал водородного электрода равен -82 мВ.
- Вычислить концентрацию ионов Со2+ в растворе CoCl2 при 298 К, если потенциал кобальтового электрода в указанном растворе равен -0,308 В относительно стандартного водородного электрода, а стандартный потенциал этого электрода равен -0,277 В.
- Вычислить концентрацию ионов Hg2+ в растворе, при котором потенциал электрода Hg2+/Hg+ по отношению к стандартному водородному электроду равен нулю. Стандартный электродный потенциал Hg2+/Hg+ равен 0,796 В.
- Вычислите ЭДС серебряно-кадмиевого гальванического элемента, в котором концентрации ионов Ag+ и Cd2+ соответственно равны 0,1 и 0,005 моль/л. Составьте схему гальванического элемента и напишите уравнения реакции, протекающей при его работе.
- Вычислите концентрацию ионов водорода в растворе, в котором потенциал водородного электрода равен -82 мВ.
- Гальванический элемент составлен из двух водородных электродов, погружённых в растворы ацетата натрия и хлорида аммония с концентрациями по 1,0 моль/л. Вычислите ЭДС цепи при 298 К.
Лабораторная работа 4
Определение редокс-потенциала
Краткая теория:
Система, содержащая в одной фазе окисленную и восстановленную форму одного и того же вещества или нескольких веществ, называется окислительно-восстановительной или редокс системой.
В момент динамического равновесия на поверхности электрода из инертного металла, помещенного в редокс-систему, возникнет равновесный потенциал, который называют окислительно-восстановительным (ОВ) или редокс – потенциалом Еr, который рассчитывается по уравнению Нернста:
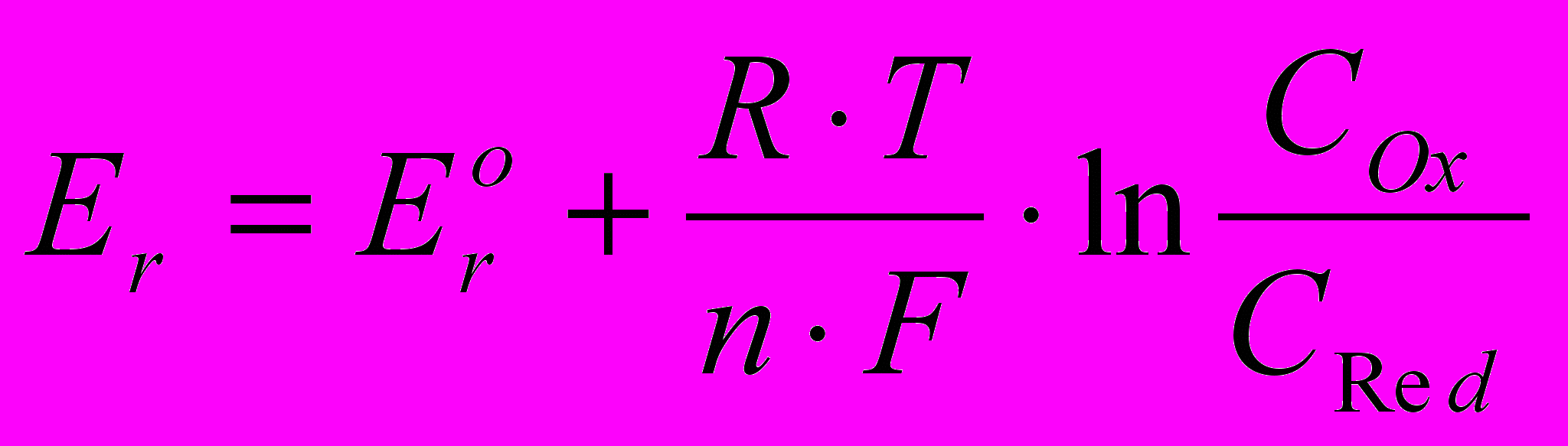 (2.9)
(2.9)где Er стандартный редокс-потенциал; n число электронов, передаваемых с донора (Red) на акцептор (Ох) в элементарном акте; CОх и CRed концентрации окисленной и восстановленной форм, соответственно.
Цель работы: Измерить редокс-потенциал нескольких смесей различного состава, приготовленных из растворов солей K3[Fe(CN)6] (красная кровяная соль) и K4[Fe(CN)6] (жёлтая кровяная соль). Построить график зависимости редокс-потенциала этой системы от логарифма соотношений концентраций окисленной и восстановленной форм железа.
Оборудование: Штатив с бюретками, потенциометр (иономер), электроды: платиновый (измерительный) и хлорсеребряный (сравнения), химические стаканы.
Реактивы: Растворы красной K3[Fe(CN)6] и желтой K4[Fe(CN)6] кровяных солей одинаковой концентрации 0,01 мольл1, раствор KCl (2 мольл1), дистиллированная вода, бумажные фильтры.
Порядок работы:
- Составить смеси растворов красной и желтой кровяных солей в соответствии с таблицей 4.
- Измерить потенциометром ЭДС элемента:
() Ag AgCl, КClнасыщ K3[Fe(CN)6], K4[Fe(CN)6] Pt (+)
для каждого соотношения концентраций окисленной и восстановленной форм железа.
- Рассчитать величину редокс-потенциала Еr по формуле:
Еr = E + ECl¯, Ag/Ag,
где Еr редокс-потенциал, В,
Е измеренное потенциометром значение ЭДС, В,
ECl¯, Ag/Ag потенциал насыщенного хлорсеребряного электрода, величина которого для данной температуры (в °С) рассчитывается по формуле:
ECl¯, Ag/Ag = 0.2224 – 0.00065 (t – 25).
Таблица 4.
| Объем, мл | Cох /Cred | lg (Cох /Cred) | E, B | Er, B | ||
| K3[Fe(CN)6] | K4[Fe(CN)6] | КС1 | ||||
| 20 | 2 | 10 | | | | |
| 16 | 6 | 10 | | | | |
| 11 | 11 | 10 | | | | |
| 6 | 16 | 10 | | | | |
| 2 | 20 | 10 | | | | |
- Построить график зависимости Еr от lg (Cox/Cгеd). По оси ординат отложить значения Еr, начиная с 0,3 В (масштаб: 0.1 В – 2 см), а по оси абсцисс – значения lg (Cox/Cгеd), (масштаб: 1 ед. – 5 см).
- Рассчитать из графика:
а) тангенс угла наклона построенной прямой,
б) величину Еоr.
- Сравнить полученные значения с теоретическими:
а) с тангенсом угла наклона, рассчитанным по уравнению: RТ/nF = 0,059/n,
б) со стандартным редокс-потенциалом Еоr.
- Объяснить расхождения между практическими и теоретическими значениями этих величин.
Вопросы и задачи к работе 4
- Привести примеры окислительно-восстановительных систем; написать уравнения электрохимических реакций.
- Что представляет собой окислительно-восстановительный электрод?
- Какие электроды используют в качестве электродов сравнения?
- Хлорсеребряный электрод: схема, строение, уравнение реакции, особенности.
- Зависит ли потенциал редокс-электрода от температуры?
- С какой целью во все исследуемые редокс-системы вводится раствор хлорида калия?
- Каким металлом можно заменить платину в редокс-электроде?
- Привести примеры редокс-систем. Какова функция платинового электрода в этих системах?
- Потенциал редокс-электрода в системе Cr2O72-/Cr3+ равен 1,96 В, Ео (Cr2O72-/Cr3+) = 1,33 В. Определить отношение концентраций окисленной и восстановленной форм ионов хрома в этой системе.
- Рассчитайте величину потенциала окислительно-восстановительного электрода Pt/Fe3+,Fe2+, если концентрации FeCl3 и FeCl2 соответственно равны 0,05 М и 0,85 М.
- В какой из приведённых ниже систем возникает окислительно-восстановительный потенциал: а) Cu/Cu+2; б) Ag,AgCl/HCl; в) Pt/Cu+2,Cu+; г) Pt,H2/HCl. Рассчитайте Red-Ox потенциал этой системы при 25°С, если отношение концентраций окисленной и восстановленных форм равно 3?
- Какие электроды можно использовать для измерения рН? Какой из приведённых ниже процессов протекает на поверхности стеклянного электрода?
Н+ + ē = 1/2Н2, Н+ + ОН- = Н2О
Н+р-р ↔ Н+пов-сть, Н+р-р + ē = Нпов-сть
- Дан электрод Pt/Sn4+,Sn2+. Концентрации равны С(SnCl4)=0,01 М, C(SnCl2)=0,001 М. Определите тип электрода и его потенциал.
- Чему равно отношение концентраций ионов Tl3+ и Tl+, если потенциал электрода Tl3+,Tl+/Pt равен нулю, а стандартный потенциал этого электрода по отношению к стандартному водородному электроду равен +1,25 В.
- Определите при 298 В ЭДС элемента:
H2,Pt / CH3COOH(aq )/ HCOOH(aq) / Pt,H2
С1=110-4 М С2=1 М
Константа диссоциации муравьиной кислоты 1,8110-4, уксусной - 1,8110-5. Укажите знаки электродов элемента. Давление газообразного водорода в обоих электродах одинаково.
- Определите знаки электродов амальгамного концентрационного элемента:
Cd(Hg) / CdSO4 / Cd(Hg)
С1 С2
Рассчитайте ЭДС этого элемента при 298 К, если С1=4,310-2 моль/л и С2=4,310-3 моль/л.
- Вычислите теоретическое значение редокс-потенциала для системы, содержащей по 10 мл гексацианоферрата (III) и гексацианоферрата (II) калия с концентрациями 0,01 моль/л и 0,05 моль/л.
- В растворе концентрация гексацинохромат (III)-ионов в 3 раза превышает концентрацию гексацинохромат (II)-ионов. Чему равен редокс-потенциал этой системы?
Лабораторная работа 5
Определение рН и буферной емкости ацетатной буферной системы
Краткая теория:
Буферные системы – это растворы, которые сохраняют концентрацию водородных ионов (рН) в системе постоянной при добавлении небольших количеств кислот или щелочей, а так же при разведении.
Водородный показатель рН – отрицательный десятичный логарифм концентрации (активности) ионов водорода:
рН = – lg [Н+], (2.10)
В протолитических буферных растворах компонентами являются донор протона и акцептор протона, представляющие собой сопряженную кислотно-основную пару.
Кислотными буферными системами называются растворы, содержащие слабую кислоту (донор протона) и соль этой кислоты (акцептор протона). Например, ацетатный буферный раствор (CH3COO-, CH3COOH) или гидрокарбонатный буферный раствор (HCO3-, H2CO3). рН кислотной буферной системы можно рассчитать по уравнению:
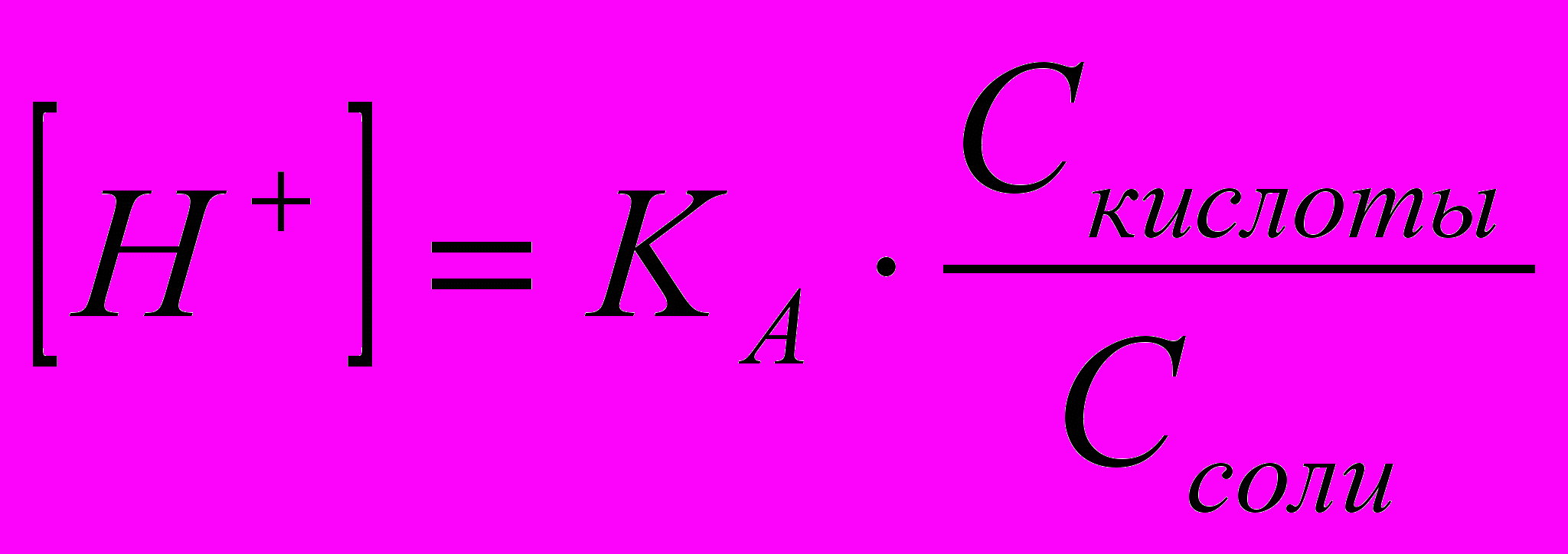 ,
,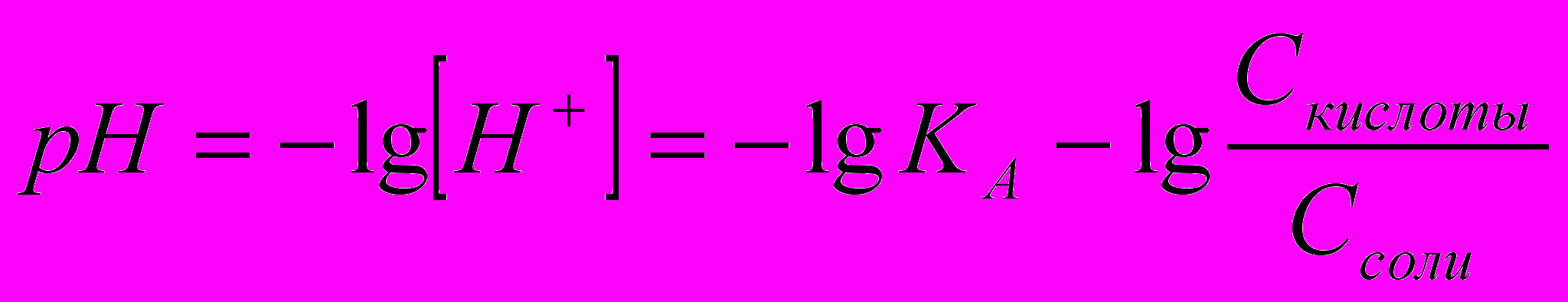 (2.11)
(2.11)где КА – константа диссоциации слабой кислоты.
Основными буферными растворами называются растворы, содержащие слабое основание (акцептор протона) и соль этого основания (донор протона). Примером основного буферного раствора является водный раствор, содержащий систему из слабого основания NH3∙H2O и его соли NH4Cl.
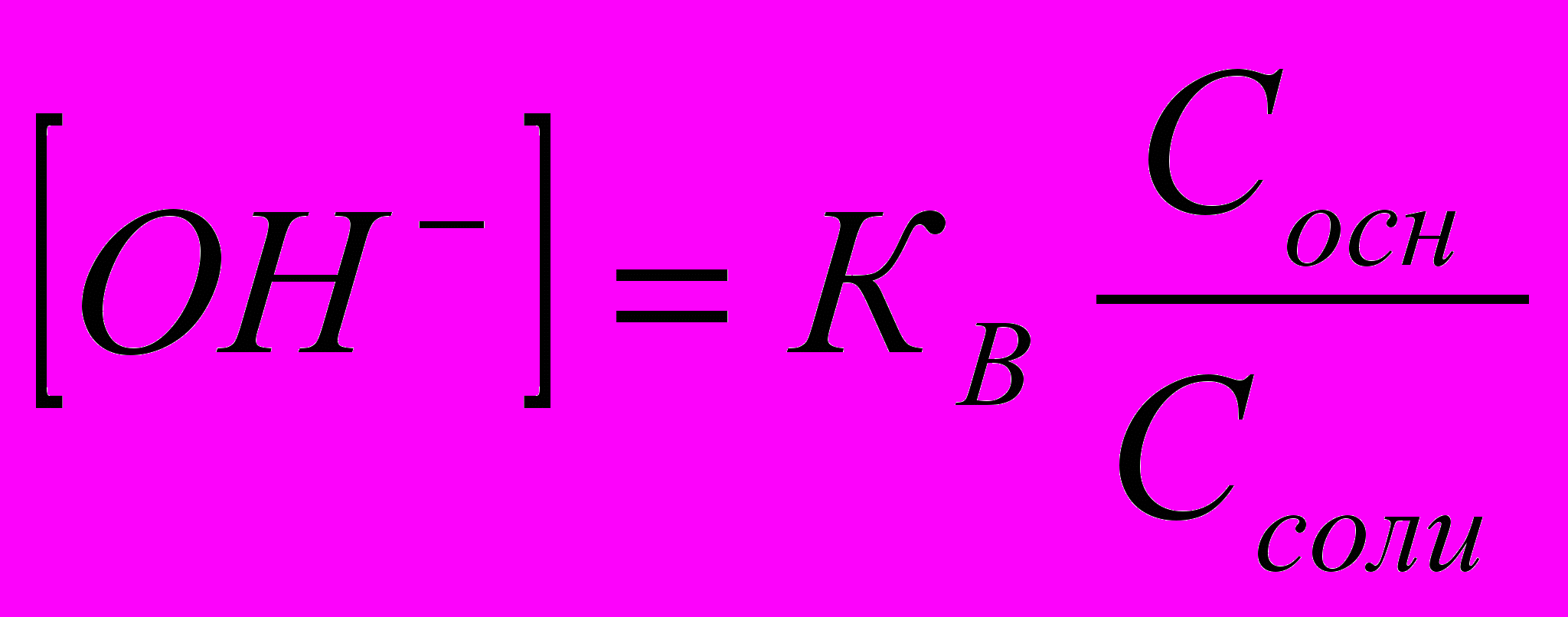 ,
,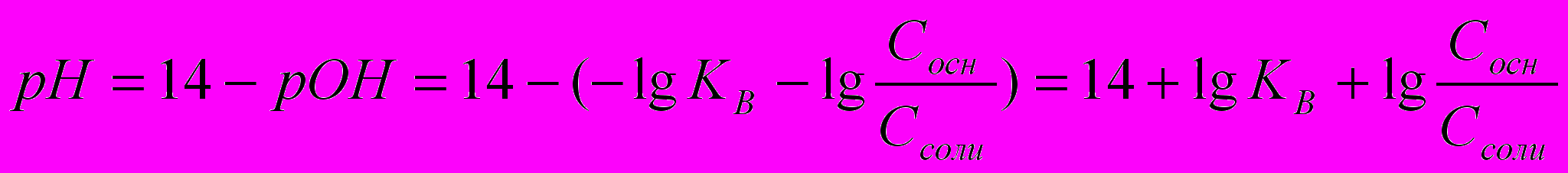 (2.12)
(2.12)Механизм буферного действия.
- При разбавлении буферных растворов концентрации всех компонентов уменьшаются, величина константы диссоциации не изменяется, поэтому рН тоже не изменяется.
- При добавлении небольших количеств сильной кислоты или щелочи в буферный раствор происходит связывание добавляемых ионов Н+ или ОН- соответствующими компонентами буферной системы с образованием малодиссоциирующих соединений.
Н+ + CH3COO- → CH3COOH
OH- + CH3COOH → CH3COO- + H2O
Защитные свойства буферных растворов сохраняются до тех пор, пока концентрации компонентов, связывающих Н+ или ОН-, будут больше концентрации добавляемых ионов.
Способность буферной системы противодействовать смещению реакции среды называется буферной ёмкостью. Величину буферной емкости системы по кислоте или по щелочи рассчитывают по формуле:
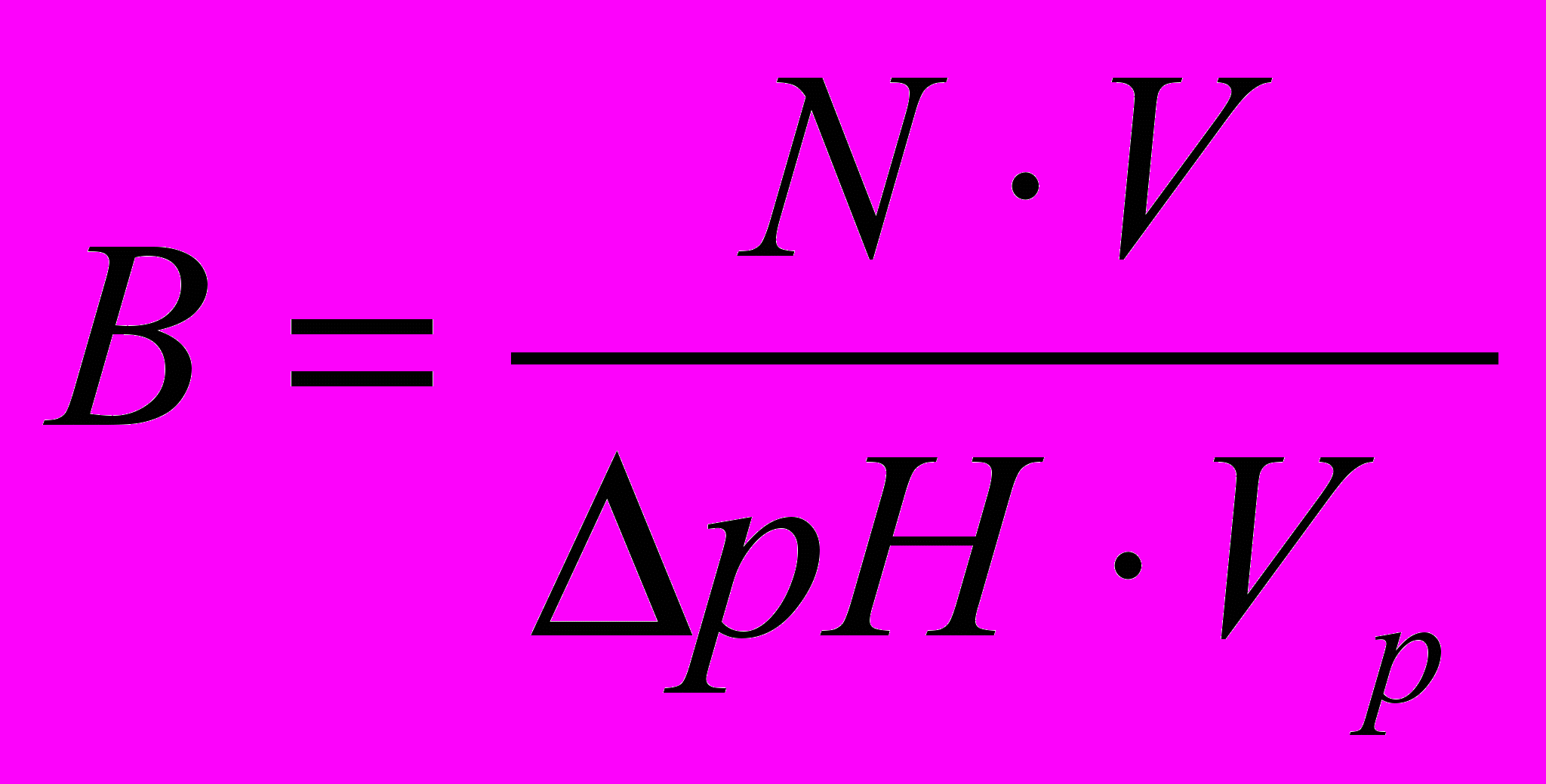 , (2.13)
, (2.13)где N – концентрация (мольл1) добавленной кислоты (щелочи); V – объем (л) кислоты (щелочи); рН – абсолютная величина изменения рН буферной системы в результате добавления кислоты (щелочи); Vр – объем буферной смеси (л).
Цель работы: Приготовление ацетатных буферных систем различного состава и измерение их рН. Изучение влияния разбавления и добавления сильных кислот и щелочей на рН этих систем. Расчет буферной емкости ацетатной буферной системы.
Оборудование: Штатив с бюретками, стаканы 50 мл, потенциометр (рН-метр или иономер) с электродной системой (измерительный электрод стеклянный, электрод сравнения - хлорсеребряный).
Реактивы: Растворы CH3COOH (0,1 М), CH3COONa (0,1 М), HCl (0,1 М), NaOH (0,1 М), NaCl (3%, физ. раствор), дистиллированная вода, фильтровальная бумага.
Порядок работы:
- Приготовить смеси растворов CH3COOH и CH3COONa в соответствии с табл.5. Измерить рН этих смесей, записать результаты в строке рН1.
- В строке 8 табл.5 записать результаты измерения рН2 после разбавления буферных смесей, добавления к ним кислоты и щелочи.
- Измерить рН физиологического раствора, результат записать в строке рН1, после добавления кислоты или щелочи в строке рН2 табл.5.
- Рассчитать значения рН исходных буферных смесей по уравнению и сравнить с измеренными значениями:
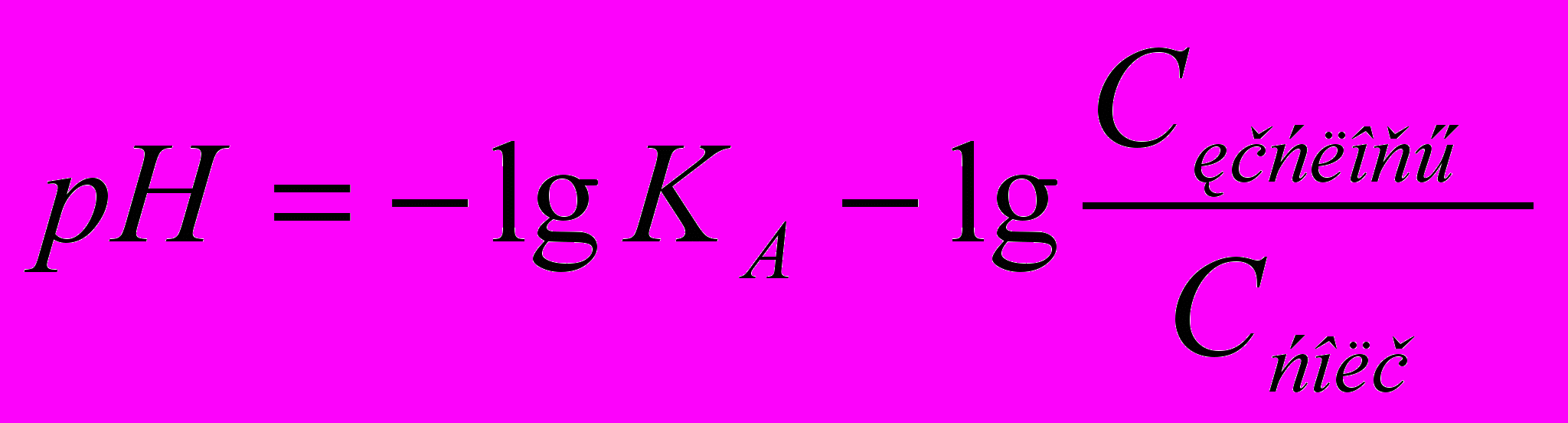 ,
,где К – константа диссоциации слабой кислоты.
- Рассчитать значения буферной емкости изученных смесей:
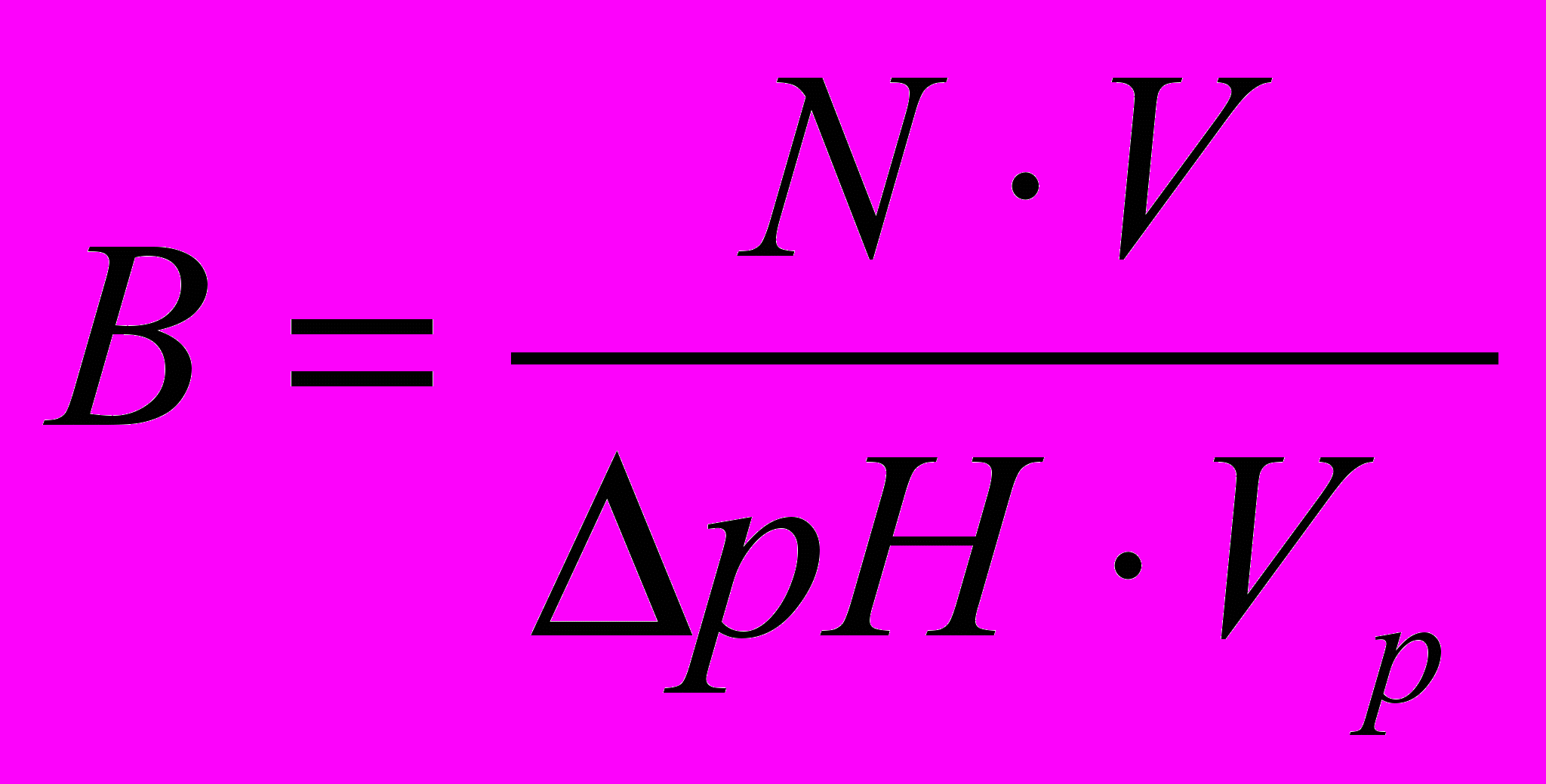 ,
,где N – концентрация (моль л1) добавленной кислоты или щёлочи,
V – объём (л) добавленной кислоты или щёлочи,
∆рН – изменение рН буферной системы в результате добавления кислоты или щёлочи,
VР – объём буферной смеси (л).
- Написать уравнения химических реакций, протекающих при разбавлении ацетатной буферной системы и при добавлении к ней сильной кислоты и щелочи.
Таблица 5.
| №№ п/п | Объем раствора мл | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1. | CH3COONa | 15 | 15 | 15 | 27 | 27 | 3 | 3 | | |
| 2. | CH3COOH | 15 | 15 | 15 | 3 | 3 | 27 | 27 | | |
| 3. | Физ. раствор | | | | | | | | 30 | 30 |
| 4. | рН1 | | | | | | | | | |
| 5. | Вода | 15 | | | | | | | | |
| 6. | HCl | | | 3 | | 3 | | 3 | | 3 |
| 7. | NaOH | | 3 | | 3 | | 3 | | 3 | |
| 8. | рН2 | | | | | | | | | |
| 9. | рН вычислен. | | | | | | | | | |
| 10. | Буф. емкость | | | | | | | | | |
Вопросы и задачи к работе 5
- Что называется буферной системой? В чём заключается буферное действие?
- Какие электроды используются для измерения рН?
- Стеклянный электрод: схема, строение, особенности. Написать уравнение электродной реакции в стеклянном электроде. От чего зависит электродный потенциал этого электрода? На какой границе раздела в стеклянном электроде возникает потенциал, зависящий от рН раствора?
- Записать гальванические цепи, с помощью которых можно определить рН раствора.
- Из каких компонентов состоит ацетатный буферный раствор, какая реакция произойдет при добавлении к нему едкого натра? Как при этом изменится рН?
- Показать механизм буферного действия ацетатной буферной системы при добавлении к ней раствора соляной кислоты. Как изменится рН после добавления HCl?
- Указать состав аммиачной буферной системы. Как изменится рН этой системы при добавлении к ней едкого натра?
- Показать механизм буферного действия аммиачной буферной системы при добавлении к ней соляной кислоты?
- Разберите на примере фосфатного буфера механизм его действия при добавлении небольших количеств HCl и КОН?
- Привести примеры систем, обладающих буферным действием, в живом организме.
- Отношение концентраций гидроксида и хлорида аммония в аммиачной буферной системе равно 6. Константа диссоциации гидроксида аммония 1,77105. Определить рН системы.
- Что называется буферной емкостью? Как рассчитать буферную ёмкость по кислоте и по основанию? От каких факторов она зависит?
- Для определения рН желчи из желчного пузыря была составлена цепь из водородного и хлорсеребряного электродов, ЭДС которой оказалась равной 0,577 В. Потенциал хлорсеребряного электрода равен 0,282 В. Измерение проводили при 25оС, концентрация электролита в электроде сравнения 1 мольл1. Определить рН желчи.
- Рассчитайте рН раствора, если потенциал хингидронного электрода при 298 К был равен 0,456 В, а стандартный электродный потенциал равен 0,699 В.
- Определите рН желудочного сока человека, если молярная электрическая проводимость его при 37°С равна 370 См см2 моль1, а удельное сопротивление 0,9 Ом м.
- Раствор с концентрацией уксусной кислоты 0,001 М имеет удельную электрическую проводимость 4,110-3См/м. Рассчитайте рН этот раствора и Кд уксусной кислоты, если известно, что (Na+)=44,4 См см2 моль1, (Н+)=315 См см2 моль1, ∞(СН3СООNa)=78,1 См см2 моль1.
- ЭДС элемента
Pt,H2 /H+ // KCl(aq) /Hg2Cl2,Hg
Р=1 С=1 М
при 298 К равна 0,829 В. Каков рН этого раствора? Потенциал нормального каломельного электрода равен 0,828 В.
- ЭДС цепи, составленной из насыщенного каломельного электрода и водородного электрода, заполненного исследуемым раствором, при 298 К равна 0,562 В. Потенциал насыщенного каломельного электрода относительно водородного электрода равен 0,242 В. Вычислите рН раствора.
- ЭДС элемента
Pt / H2 / HCl / AgCl / Ag
при 25°С равна 0,322 В. Чему равен рН раствора HCl?
- Рассчитайте ЭДС элемента
Pt, H2 / уксусная кислота // муравьиная кислота /H2, Pt
С1=1 М С2=1 М
при 25°С, если константы диссоциации уксусной и муравьиной кислот равны К1=1,7510-5 и К2=1,7710-4, соответственно.
- Эквивалентная электропроводность 1,5910-4 моль/л раствора уксусной кислоты при 25°С равна 12,77 См см2 моль1. Рассчитайте константу диссоциации кислоты и рН раствора.
