I электрохимия
| Вид материала | Лабораторная работа |
- «Электрохимия, гальванотехника и обработка поверхности», посвященная 200-летию со дня, 94.6kb.
- Закономерности процесса фосфатирования магний-литиевых сплавов 02. 00. 05 электрохимия, 368.63kb.
- Рабочая учебная программа дисциплины Теоретическая электрохимия Направление подготовки, 468.83kb.
- Исследование влияния морфологии и химического состава поверхности ионообменных мембран, 332.73kb.
- Рабочая программа по дисциплине опд. Р. 01 «Электрохимическая синергетика», 157.53kb.
- Рабочая программа по Теоретической электрохимии для специальности 250300 Технология, 375.63kb.
- Рабочая программа для подготовки инженеров по специальности 250300 "Технология электрохимических, 128.05kb.
- Электрохимические и физико-химические аспекты фиторемедиации сточных и промывных вод,, 396.8kb.
- Халькогенсодержащие органические соединения для преобразователей энергии и информации., 961.61kb.
поверхностное натяжение и адсорбция
Лабораторная работа 6
Изучение адсорбции ПАВ на границе водный раствор - воздух
Краткая теория:
П
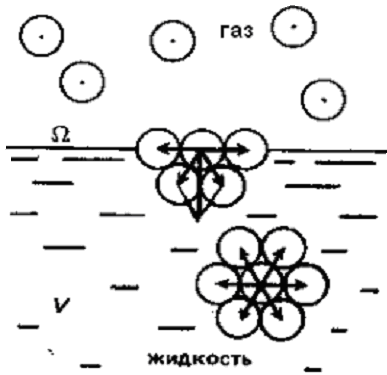 оверхностное натяжение s есть величина, измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя. Оно численно равно работе, которую необходимо совершить против сил межмолекулярного взаимодействия для образования единицы поверхности раздела фаз при постоянной температуре (рис.3).
оверхностное натяжение s есть величина, измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя. Оно численно равно работе, которую необходимо совершить против сил межмолекулярного взаимодействия для образования единицы поверхности раздела фаз при постоянной температуре (рис.3).Рис.3.
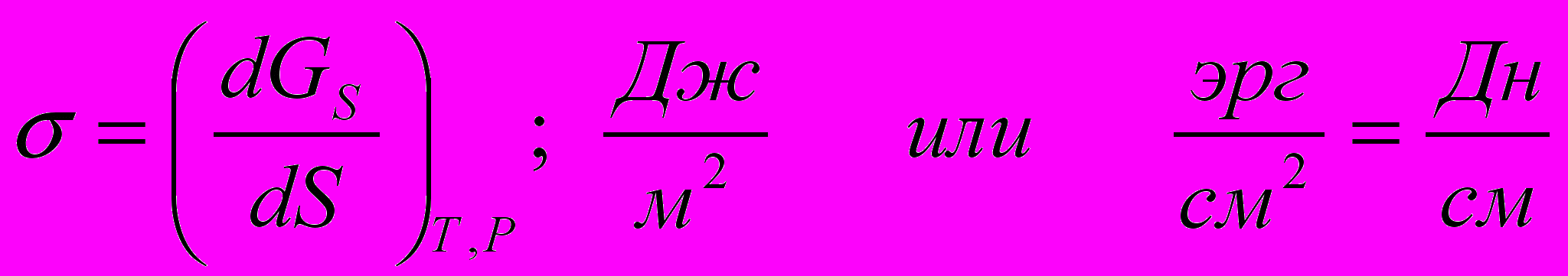 (3.1)
(3.1)Концентрирование вещества на поверхности раздела фаз называется адсорбцией. Жидкость или твёрдое тело, на поверхности которого происходит адсорбция называется адсорбентом, а вещество, образующее поверхностный слой (адсорбирующийся газ или растворённое вещество) – адсорбатом.
Адсорбция по Гиббсу – это избыток адсорбата в адсорбционном слое, выражается в моль/см2.
Связь между адсорбцией по Гиббсу и поверхностным натяжением описывается уравнением Гиббса:
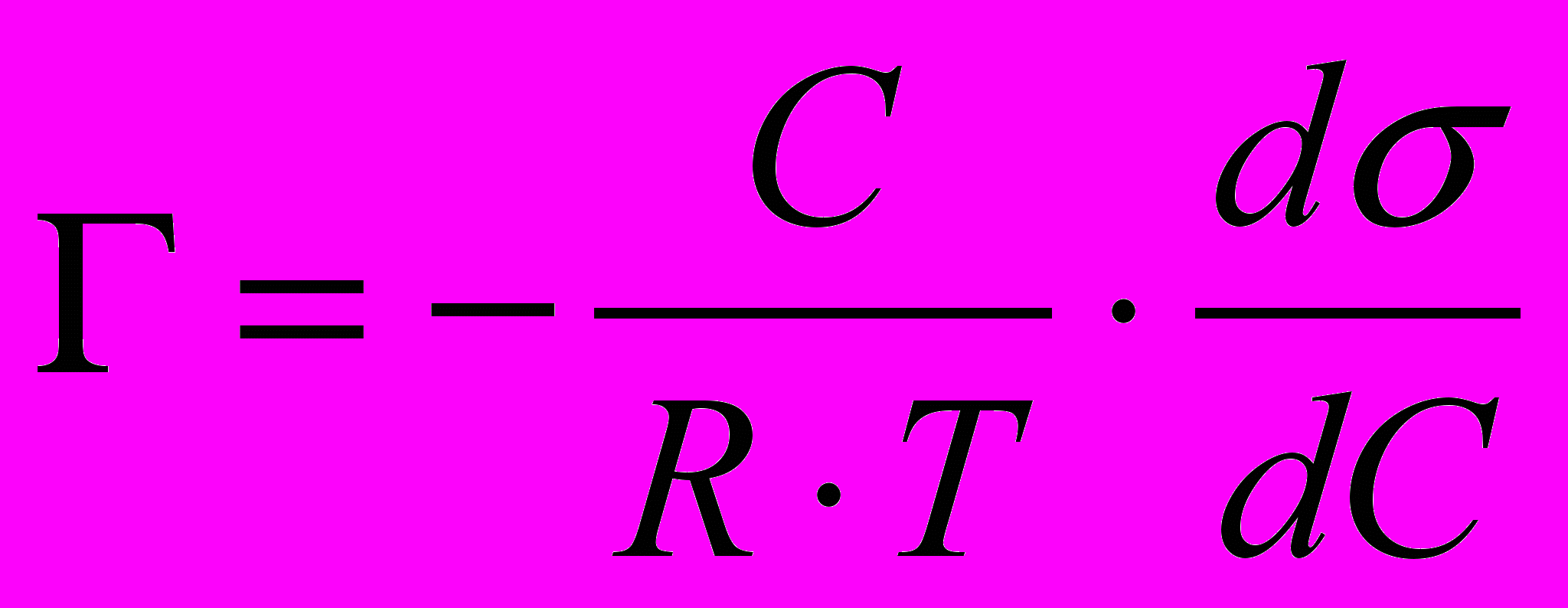 для растворённых веществ (3.2)
для растворённых веществ (3.2)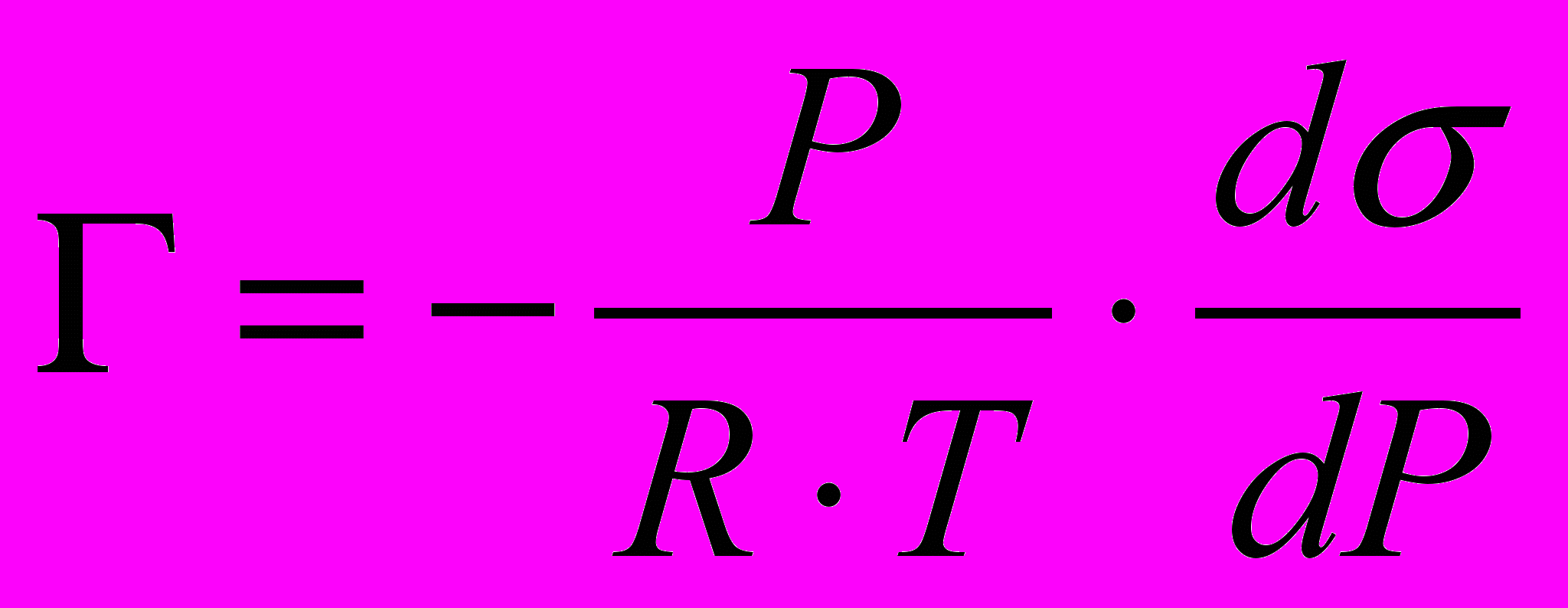 для адсорбции газов или паров (3.3)
для адсорбции газов или паров (3.3)где С – объёмная концентрация растворённого вещества в моль/л, Р – парциальное давление адсорбирующегося газа в атм., К – универсальная газовая постоянная равная 8,31107 эргмоль-1град-1, Т – абсолютная температура в К,
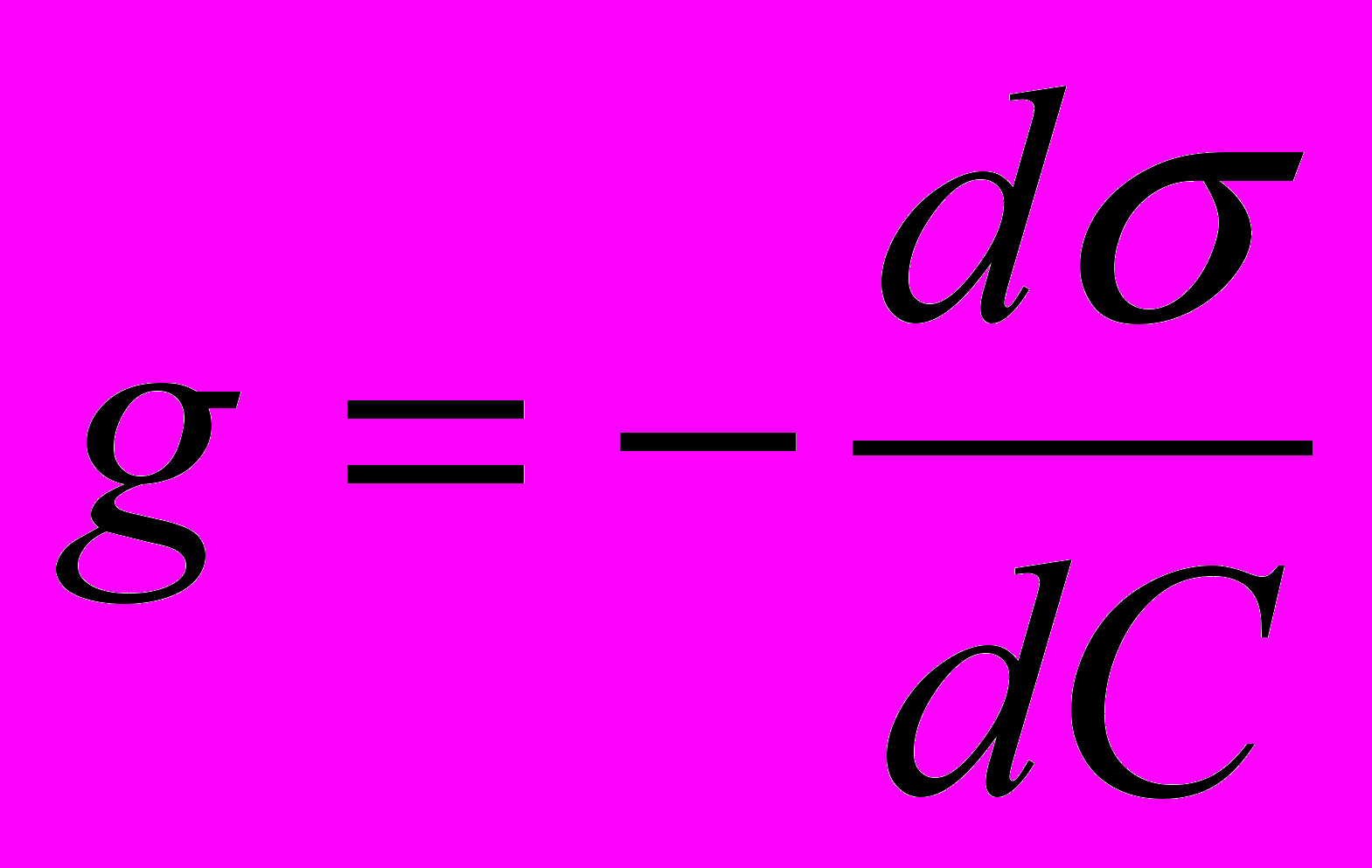 - поверхностная активность.
- поверхностная активность.Зависимость адсорбции Г от равновесной концентрации С или давления Р при постоянной температуре называется изотермой адсорбции.
Все вещества по их воздействию на поверхностное натяжение воды можно разделить на три группы (рис.4):
1. Поверхностно-активные вещества (ПАВ) - понижают поверхностное натяжение растворителя (sр.р
2. Поверхностно-инактивные вещества (ПИВ) - незначительно повышают поверхностное натяжение растворителя (sр.р >s0), g<0 (неорганические кислоты, основания, соли, глицерин, a-аминокислоты и др).
3. Поверхностно-неактивные вещества (ПНВ) - практически не изменяют поверхностного натяжения растворителя (sр.р =s0), g=0 (по отношению к воде веществами являются сахароза и ряд других).

Рис.4. Изотермы поверхностного натяжения и
адсорбции растворов ПАВ (3), ПНВ (2) и ПИВ (1)
Правило Дюкло – Траубе: в любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу СН2 увеличивает поверхностную активность в 3 – 3,5 раза:
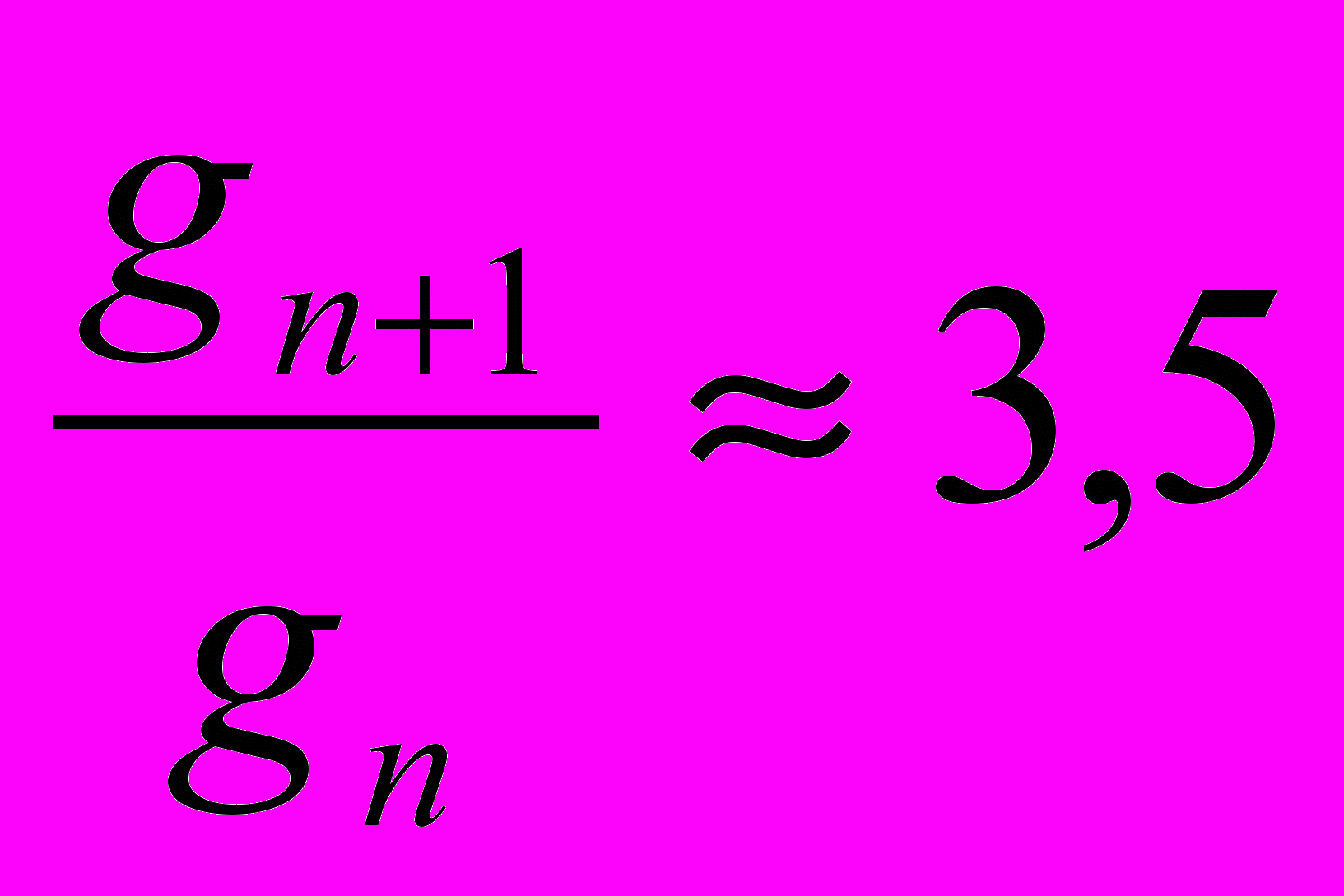 (3.4)
(3.4)Поверхностное натяжение жидкостей определяют с помощью прибора Ребиндера (рис.4).
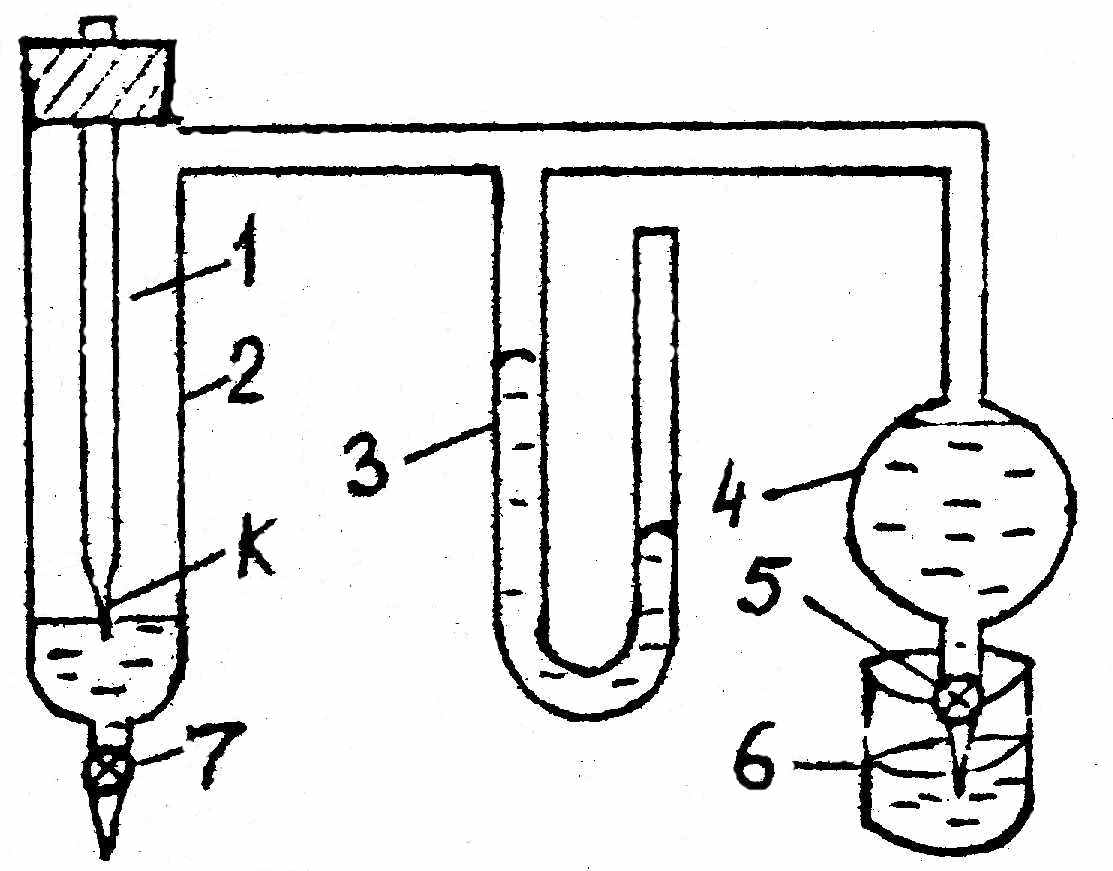
Рис.4. Прибор для определения поверхностного натяжения
где 1 – трубка с капилляром К, который погружается в жидкость не более чем на 1 мм; 2 – пробирка с исследуемой жидкостью, заканчивающаяся зажимом 7; 3 – манометр; 4 – аспиратор с водой; заканчивающийся зажимом 5; 6 – сливной стакан.
Для двух жидкостей с различными значениями поверхностного натяжения существует зависимость:
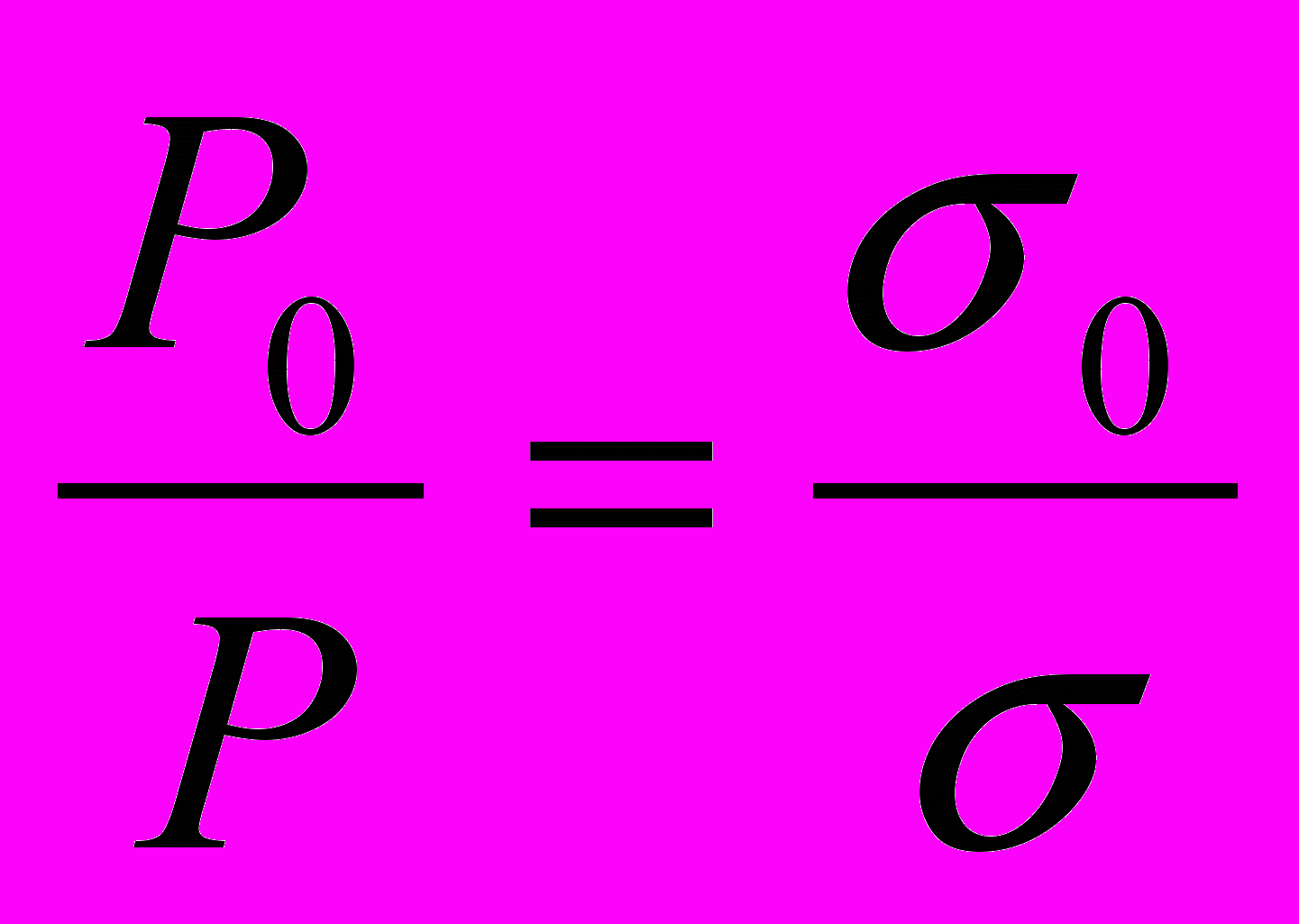 (3.5)
(3.5)где σ0 – поверхностное натяжение воды (растворителя) в дн/см, σ – поверхностное натяжение добавленного вещества (ПАВ, ПИВ, ПНВ) в дн/см, Р0 и Р – соответствующие им избытки давления над внешним давлением при проскоке пузырька.
Цель работы: По результатам определения поверхностного натяжения раствора ПАВ построить изотерму адсорбции ПАВ на поверхности воды.
Оборудование: Прибор для определения поверхностного натяжения, два химических стаканчика, штатив.
Реактивы: Поверхностно-активное вещество, дистиллированная вода, фильтровальная бумага.
Порядок работы:
- Получить у лаборанта прибор для определения поверхностного натяжения. (см. рис. 4) Проверить, достаточно ли плотно закрываются пробками пробирка 2 и аспиратор 4, а также, хорошо ли заполнен манометр (уровень воды в нём должен составлять три четверти от его высоты, и в воде не должно быть пузырьков воздуха).
- Закрепить прибор в штативе и тщательно промыть пробирку 2 и трубку 1 дистиллированной водой.
- С помощью воронки залить дистиллированную воду в аспиратор 4 и плотно закрыть его пробкой.
- В чистую пробирку 2 налить немного дистиллированной воды и плотно закрыть пробирку со вставленной в неё трубкой с капилляром. При этом конец капилляра должен быть погружён в воду на 1 мм.
- При медленном выливании воды из аспиратора 4 через зажим 5 убедиться в том, что на конце капилляра образуются пузырьки воздуха, которые проскакивают через жидкость в пробирке 2. При этом разность Р между атмосферным давлением и давлением внутри прибора максимальна.
- Определить максимальный h1 и минимальный h2 уровень воды в коленах манометра при проскоке пузырьков через жидкость. Эти измерения произвести не менее трёх раз и записать их в таблицу 6. Из этих данных найти средние значения ħ1 и ħ2 и максимальную разность давлений Р0 по формуле:
Р0 = ħ1 - ħ2 мм вод.ст.
- Через нижнюю трубку вылить воду из пробирки 2, выдуть воду из капилляра К и осушить его с помощью фильтровальной бумаги. Промыть пробирку 2 и капилляр К исследуемым раствором ПАВ, затем налить его в пробирку 2 и измерить давление Р, при котором отрывается пузырёк воздуха, как это делалось для воды.
Концентрации растворов ПАВ, поверхностные натяжения которых надо определить, указаны в таблице 6.
Измерения начинать с наиболее разбавленного раствора и закончить наиболее концентрированным. Тогда изменение концентрации раствора ПАВ за счёт оставшихся в растворе капель жидкости будет минимальным. Рассчитать максимальную разность давлений Р для всех концентраций растворов ПАВ по формуле:
Р = ħ1 - ħ2 мм вод.ст.
Результаты измерений и расчётов записать в таблицу 6.
- Используя формулу:
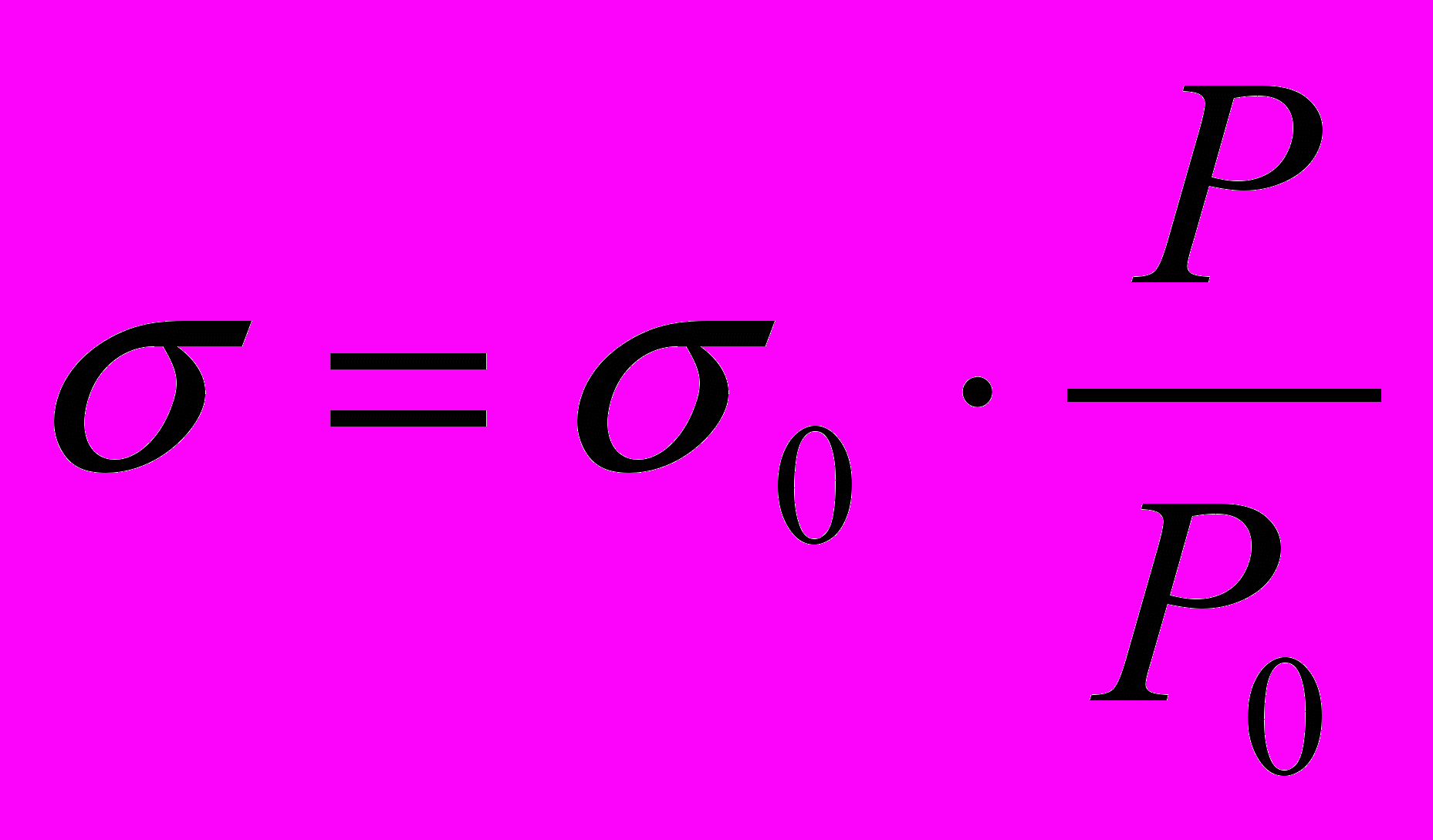 (3.6)
(3.6)где Р0 – давление, полученное для воды,
σ0 – поверхностное натяжение воды,
Р – давление для раствора ПАВ данной концентрации,
определить поверхностные натяжения σ растворов ПАВ и записать их значения в таблицу 6.
Таблица 6.
t = °С
| Концентрация ПАВ, моль л–1 | h1, мм | h2, мм | Р, мм вод.ст. | σ, дн/см |
| 0 | | | | |
| 0,05 | | | | |
| 0,1 | | | | |
| 0,2 | | | | |
| 0,3 | | | | |
| 0,5 | | | | |
- Построить изотерму поверхностного натяжения – график зависимости σ раствора ПАВ от его концентрации, как показано на рис.2 в масштабе: по оси σ 10 эрг/см2 – 5 см, а по оси С 0,05 моль/л – 1 см.
- Из изотермы поверхностного натяжения рассчитать величины поверхностных активностей ∆σ/∆С для шести указанных в таблице концентраций ПАВ и записать полученные значения в таблицу 6а.
- Рассчитать величины адсорбции ПАВ в зависимости от его концентрации в растворе по формуле:
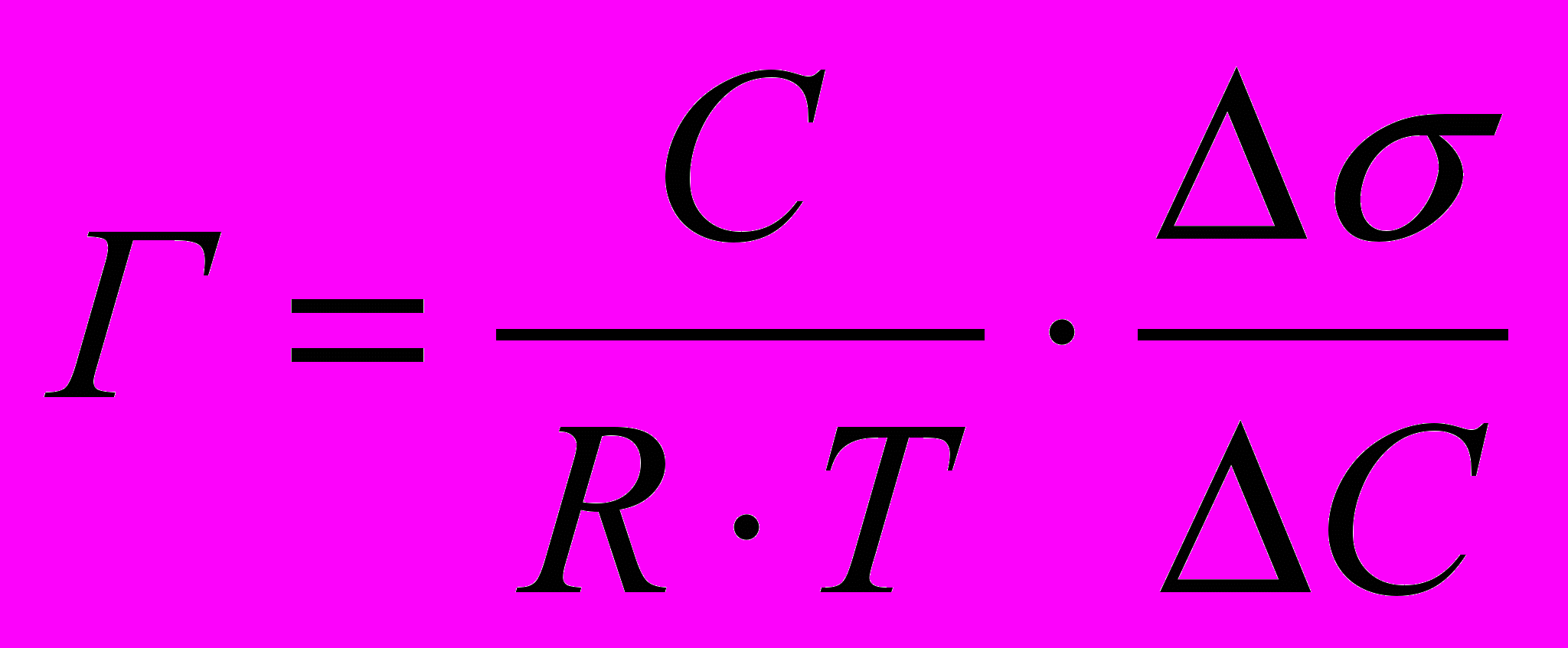 ,
,используя значения ∆σ/∆С записать результаты расчёта в таблицу 6а и построить изотерму адсорбции ПАВ на поверхности воды. Для этого на оси абсцисс отложить концентрацию раствора С, а на оси ординат – адсорбцию Г.
Таблица 6а.
-
С, моль/л
Г, моль/см2
0,05
0,1
0,2
0,3
0,4
0,5
Вопросы и задачи к работе 6
- Причины возникновения адсорбции. Определение адсорбата, адсорбента и изотермы адсорбции.
- Физические и химические силы, вызывающие адсорбцию.
- В чём отличие физической адсорбции от химической?
- Теория адсорбции Лэнгмюра. Теория адсорбции БЭТ. Их различия.
- Адсорбция по Гиббсу. Определение поверхностного натяжения на границе двух фаз. Его роль в определении адсорбции. Какова его размерность? Как зависит поверхностное натяжение от температуры?
- Уравнение Гиббса для адсорбции. Поясните значение входящих в него величин.
- ПАВ, ПИВ, ПНВ. Какие вещества входят в каждую категорию? Объяснить расположение молекул на поверхности воды для каждой группы веществ. Графики поверхностного натяжения и адсорбции.
- Что принято считать мерой поверхностной активности? Как зависит поверхностная активность вещества от его молекулярной массы? Сформулируйте правило Траубе.
- Каким образом в приборе Ребиндера создаётся перепад давления? Почему нельзя допускать попадания жидкости в соединительные трубки прибора?
- Почему в приборе Ребиндера капилляр должен только касаться поверхности исследуемой жидкости, а не быть погружённым в неё? Почему определение поверхностного натяжения исследуемых растворов проводят в порядке возрастания концентраций?
- Указать, какие из перечисленных ниже веществ уменьшают, какие увеличивают, а какие не изменяют поверхностное натяжение воды: C3H7OH, KOH, C6H12O6(фруктоза), NaCl, H2SO4, CH3COONa, Na2SO4, HCOOH, C6H12O6(глюкоза).
- Приведите два способа уменьшения поверхностного натяжения воды.
- Представьте на одном графике изотермы адсорбции масляной, уксусной и пропионовой кислот из водных растворов.
- Рассчитайте поверхностную активность раствора ПАВ с концентрацией 0,075 М при 298 К, если адсорбция равна 710-10 моль/см2 (R=8.31107 эрг/моль).
- Рассчитать величину адсорбции на границе раздела жидкость – газ в растворе концентрации 0,2 моль/л при температуре 27оС, если поверхностная активность равна (-50) единиц, R = 8.31107 эрг/(мольК). Указать, к какому типу – поверхностно-активное, поверхностно-инактивное или поверхностно-нейтральное – следует отнести растворённое вещество?
- Определите тип адсорбции при растворении в воде серной кислоты, если концентрация серной кислоты в воде 2,33 моль/л, поверхностное натяжение раствора 75,20 Дн/см, поверхностное натяжение воды 73,05 Дн/см, t=18°С.
- Определите тип адсорбции при растворении в воде ацетона, если концентрация ацетона в воде 29 г/л, поверхностное натяжение раствора 59,4 Дн/см, поверхностное натяжение воды 73,49 Дн/см, t=15°С.
- Сравните поверхностную активность пропионовой и масляной кислот в водных растворах в данном интервале концентраций, если известно:
Кислота
С, моль/л
σ, Дн/см
пропионовая
0,0312
69,5
0,0625
67,7
масляная
0,0312
65,8
0,0625
60,4
- Сравните поверхностную активность метилпропанола и метилбутанола в водных растворах в данном интервале концентраций, если известно:
Кислота
С, моль/л
σ, Дн/см
метилпропанол
0,125
52,8
0,250
44,1
метилбутанол
0,125
47,6
0,250
23,7
- Поверхностное натяжение водного раствора, содержащего поверхностно-активное вещество (ПАВ) в концентрации 0,056 моль/л, при 293 К равно 4,33 Дн/см. Вычислите величину адсорбции ПАВ из раствора с концентрацией 0,028 моль/л при 293 К.
- С увеличением концентрации раствора изомасляной кислоты с 0,125 моль/л до 0,250 моль/л его поверхностное натяжение снизилось с 55,1 Дн/см до 47,9 Дн/см, а у раствора изовалериановой кислоты – с 43,2 Дн/см до 35,0 Дн/см. Сравните величины адсорбции веществ в данном интервале концентраций.
- Вычислите, во сколько раз изменится величина адсорбции масляной кислоты из водного раствора с ростом концентрации по экспериментальным данным (Т=298 К):
| С102, моль/л | 0,78 | 1,56 | 12,5 | 25,0 |
| σ, Дн/см | 70,0 | 69,1 | 55,1 | 47,9 |
