Рабочая программа по дисциплине «химия» составлена по кредитно-модульно-рейтинговому принципу для направлений (специальностей)
| Вид материала | Рабочая программа |
- Рабочая программа по дисциплине специализации "Хемометрика" для специальности 020101, 126.88kb.
- Рабочая программа по дисциплине ‹‹Научные основы школьного курса химии›› для направления, 267.3kb.
- Рабочая программа По дисциплине «Химия» По направлению 069500, 368.84kb.
- Рабочая программа дисциплина ‹‹Неорганическая химия›› опд. Ф. 02 Специальность 020101, 343.5kb.
- Учебно-методический комплекс дисциплины Рабочая программа составлена на основании, 555.63kb.
- Рабочая программа по дисциплине «Экономика» для всех специальностей (специализации), 244.35kb.
- Рабочая программа дисциплины численное решение прикладных метрологических задач Рекомендована, 307.2kb.
- Рабочая программа по безопасности жизнедеятельности для специальности 080109 «Бухгалтерский, 348.76kb.
- Рабочая программа по дисциплине специализации «Электрохимические методы анализа» для, 142.82kb.
- Рабочая программа по дисциплине «Философия» для студентов очной формы обучения всех, 246.47kb.
5 УЧЕБНАЯ И ПРОИЗВОДСТВЕННАЯ ПРАКТИКИ, НИР
Учебным планом не предусмотрено.
6 ИНТЕРАКТИВНЫЕ ФОРМЫ ОРГАНИЗАЦИИ ИЗУЧЕНИЯ ДИСЦИПЛИНЫ
Учебным планом не предусмотрено.
7 МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ К ТЕСТОВОМУ КОНТРОЛЮ ЗНАНИЙ СТУДЕНТОВ
7.1. Вопросы или контрольные задания к модулю № 1 (темы 1 - 3)
1. Сформулировать закон сохранения массы веществ. Привести примеры подтверждающие данный закон.
2. Сформулировать закон постоянства состава. Привести примеры веществ подчиняющиеся и неподчиняющиеся данному закону.
3. Определить эквиваленты и эквивалентные массы следующих веществ: кадмия, магния, цинка, карбоната натрия, карбоната кальция, серной кислоты, соляной кислоты, гидроксида калия и гидроксида алюминия.
4. Охарактеризовать различные классы неорганических веществ: соли (средние, кислые, основные, комплексные, двойные и смешанные).
5. Охарактеризовать различные классы неорганических веществ: простые вещества (металлы и неметаллы), оксиды и пероксиды, кислоты, гидроксиды и щелочи.
6. Привести примеры определения аналитического сигнала в различных методах анализа веществ (гравиметрическом, титриметрическом, электрохимическом и тому подобное).
7. Указать, какие ионы и какими способами можно определить при химико-аналитическом анализе природной воды.
8. Привести несколько примеров химических свойств металлов: калия, лития, кальция, цинка, алюминия, железа, серебра и золота.
9. Назвать соли азотной, серной, соляной, сероводородной и фосфорной кислот. Привести примеры соответствующих солей.
10. Какой из металлов Cu, Bi, Mg будет растворяться в разбавленной серной кислоте? Почему? Написать уравнение химической реакции.
11. Как называется CaO и Ca(OH)2 в технике? Как их получают? Где применяют?
12. Написать уравнения химических реакций, при которых происходят следующие превращения: Ba Ba(Cl)2 Ba(OH)2 BaSO4.
13. Что такое металлическая связь? Чем обусловлены общие свойства металлов?
14. Написать электронные формулы атомов химических элементов с номерами 9 и 28. К какому электронному семейству относятся эти элементы?
15. Сформулировать периодический закон Д.И. Менделеева. Объяснить философский смысл периодической системы химических элементов Д.И. Менделеева.
16. Расположить химические элементы в порядке возрастания неметаллических свойств: 1) бром, 2) хлор, 3) йод, 4) астат, 5) фтор. Мотивировать ответ.
17. Привести схему титровальной установки. Указать и описать все позиции данной установки.
18. Описать три основных вида химической связи. Привести примеры соответствующих химических соединений.
19. Показать химические свойства нескольких металлов. Привести молекулярные и электронные уравнения происходящих химических реакций.
20. На примере молекулы азота показать образование -связи и -связи.
7.2. Вопросы или контрольные задания к модулю № 2 (темы 4 - 6)
1. Привести несколько примеров комплексных соединений (солей). Указать центральный атом (комплексообразователь), внутреннюю и внешнюю сферы и координационное число. Указать значения всех зарядов.
2. Привести примеры нескольких комплексных соединений (солей) с различными комплексообразователями и лигандами. Назвать указанные соли.
3. Сформулировать закон Гесса и его следствие. Привести пример термохимического расчета на примере любой реакции.
4. Привести по несколько примеров экзотермических и эндотермических реакций.
5. Как и почему изменяется энтальпия при эндотермической реакции?
6. Как и почему изменяется энтальпия при экзотермической реакции?
7. Что такое осмос и где он применяется?
8. Как и почему изменяется энтропия при растворении, при плавлении, при кристаллизации, при конденсации и при испарении?
9. Привести примеры цепных реакций: ядерной и фотохимической.
10. Привести пример реакции образования озона посредством цепной фотохимической реакции, которая происходит в верхних слоях атмосферы (озоносфере).
11. Сформулировать принцип Ле Шателье. Привести примеры, подтверждающие данный принцип.
12. Каким образом и почему влияет температура веществ на скорость химических реакций?
13. Каким образом и почему влияет концентрация реагирующих веществ на скорость химических реакций?
14. Какие факторы влияют на скорость химической реакции? Перечислить их и привести соответствующие примеры.
15. Сформулировать закон действия масс. Что представляет собой константа скорости химической реакции?
16. Привести примеры катализаторов и области их применения.
17. Привести примеры ингибиторов и области их применения.
18. Что такое катализ? Где он применяется?
19. Какие термодинамические величины известны? Что они обозначают, в чем измеряются, и что характеризуют?
20. Привести пример нескольких комплексных соединений (солей) и указать их константы нестойкости и устойчивости.
7.3. Вопросы или контрольные задания к модулю № 3 (темы 7 - 10)
1. Какое покрытие называется анодным и катодным? Какое покрытие более эффективно защищает от коррозии? Привести пример коррозии при нарушении покрытия оцинкованного железа.
2. Какой металл Zn или Cu может быть протектором для защиты от коррозии стальных конструкций? Мотивировать ответ.
3. Какие факторы влияют на скорость коррозии? Перечислить основные методы борьбы с коррозией металлов.
4. Какой металл Zn, Cu, Au или Hg может быть протектором для защиты от коррозии стальных (железных) конструкций? Мотивировать ответ.
5. Какие реакции называются окислительно-восстановительными? Указать, какие элементы являются окислителями, а какие восстановителями в следующих химических реакциях: а) NaBr + Cl2 → NaCl + Br2; б) Mg + H2SO4 → MgSO4 + H2.
6. Цинковые и железные пластинки, соединенные проводником, внесли в раствор серной кислоты. Какой металл будет растворяться? Почему? Выразить этот процесс химическим уравнением.
7. Каким образом классифицируются дисперсные и коллоидные системы по агрегатному состоянию дисперсной фазы и дисперсионной среды. Привести примеры соответствующих систем.
8. Какова будет массовая доля хлорида калия в растворе при растворении 30,0 г KCl в 80,0 г воды?
9. Какова будет объемная доля метилового спирта в растворе при растворении 50,0 мл метанола в 120,0 мл воды?
10. Какова будет эквивалентная доля хлорида меди (II) в растворе при растворении 200,0 г CuCl2 в 750,0 мл воды?
11. При гидролизе какой соли раствор имеет щелочную среду: CuSO4; K2CO3; Al(NO3)3? Почему? Напишите химическое уравнение гидролиза этой соли. Чему равен водородный показатель раствора этой соли?
12. На какие типы подразделяется жесткость воды? Какие соли обуславливают жесткость воды? Перечислить методы и способы умягчения воды.
13. Какая величина водородного показателя в кислой, нейтральной и щелочной средах? Какие вещества называются индикаторами? Привести примеры индикаторов.
14. Составить молекулярные, полные и сокращенные ионно-молекулярные уравнения химических реакций взаимодействия в растворах между: а) Na2CO3 + HCl; б) CH3COONa + HCl.
15. Привести примеры нескольких органических соединений и указать их химические свойства. Назвать эти соединения. Привести схемы химических реакций, характеризующие указанные свойства.
16. Привести схемы химических реакций получения полиэтилена, полипропилена и фенолформальдегидной смолы.
17. Привести примеры нескольких полимеров. Указать их физические и химические свойства и области применения.
18. Получить полиэтилен и полипропилен с помощью реакции полимеризации.
19. Что такое золь и гель? Как происходит превращение золя в гель? Что представляет собой процесс гелеобразования или желатинирования?
20. Привести математические формулы количественного выражения состава растворов.
8. ВНЕАУДИТОРНАЯ САМОСТОЯТЕЛЬНАЯ РАБОТА СТУДЕНТОВ И
ПОДГОТОВКА К ЭКЗАМЕНУ
| № | Наименование | Всего, час. |
| 1. | Подготовка к лекциям | 8,6 |
| 2. | Подготовка к лабораторным занятиям | 2,4 |
| 3. | Подготовка к практическим занятиям | - |
| 4. | Подготовка к семинарским занятиям | - |
| 5. | Плановая работа | - |
| 6. | Индивидуальная работа | 43 |
| 7. | Подготовка к экзамену | 36 |
| ИТОГО | 90 | |
9 МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ДИСЦИПЛИНЫ
| № п/п | Наименование дисциплины в соответствии с учебным планом | Наименование специализированных аудиторий, кабинетов, лабораторий и прочих с перечнем основного оборудования |
| 1 | 2 | 3 |
| 1. | Химия | Лаборатория «Общая и неорганическая химия» (Аудитория № 302) Химическая посуда и оборудование, химические реактивы и материалы, технохимические и аналитические весы, титровальная установка, муфельная печь, сушильный шкаф, дистиллятор, бидистиллятор, вакуумный насос, электроплитка, прибор для определения электропроводности растворов и блок питания постоянного тока, вытяжной шкаф, раковина, диспергатор (дробилка, мельница), шкаф для химической посуды, шкаф для реактивов, лабораторные столы с полками, стулья, плакаты, доска. |
| 2. | Химия | Лаборатория «Специальные разделы химии» (Аудитория № 303) Титровальная установка, химическая посуда и оборудование, химические реактивы и материалы, электроплитка, сушильный шкаф, вытяжной шкаф, рН-метр (микровольтметр), фотоэлектроколориметр, прибор для определения температуры вспышки, центрифуга, источник питания постоянного тока, гальванометр, термопара, раковина, лабораторные столы с полками, стулья, плакаты, доска. |
| 3. | Химия | Лаборатория «Научно-исследовательская лаборатория» (Аудитория № 304) Лабораторной стол, письменный стол, стулья, шкаф, раковина, химическая посуда и оборудование, химические реактивы и материалы, аналитические весы, установка для определения адсорбционной способности веществ, блок питания, технохимические весы, поляризационный микроскоп, набор инструментов. |
| 4. | Химия | Аудитория «Лекционная» (Аудитория № 314) Доска, кафедра (трибуна), столы, скамьи, стулья, периодическая система химических элементов Д.И. Менделеева, плакаты. |
10 КАЛЕНДАРНЫЙ ПЛАН (РЕЙТИНГ-ПЛАН)
| | По дисциплине: ХИМИЯ | Самостоятельная работа: домашняя 11 час. индивидуальная 43 час. плановая - час. экзамен 36 час. | Срок контроля | ||||
| Зачет – более 50 баллов | Для студентов специальности (направления): 140400.62 «Электроэнергетика и электротехника» (ЭЭ) | Лекции 36 час. Лабораторные работы 18 час. | |||||
| Незачет – менее 50 баллов | На осенний (весенний) семестр 2011 / 2012 учебного года | Практические занятия - час. Семинар - час. | |||||
| | Лектор: Молчанов Сергей Валентинович старший преподаватель кафедры «ЕНД» | ИТОГО: 144 час. | |||||
| Название модуля | Лекции Тема Балл | Лабораторные работы №№ Балл | Практические занятия Балл | Самостоятельная работа Балл | Рубежный контроль | Максимальный балл модуля | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Модуль 1 Введение. Строение атома, химическая связь и законы. | 1. Введение. Стехиометрия. Основные законы химии. Аналитическая химия. 2. Строение атома. Периодическая система элементов Д.И. Менделеева. 3. Химическая связь и валентность элементов. Строение простейших молекул. Балл: 10 | Лабораторная работа № 1 Лабораторная работа № 2 Лабораторная работа № 3 Балл: 5 | - | Балл: 5 | Аттестация Отчет по лабораторным работам | 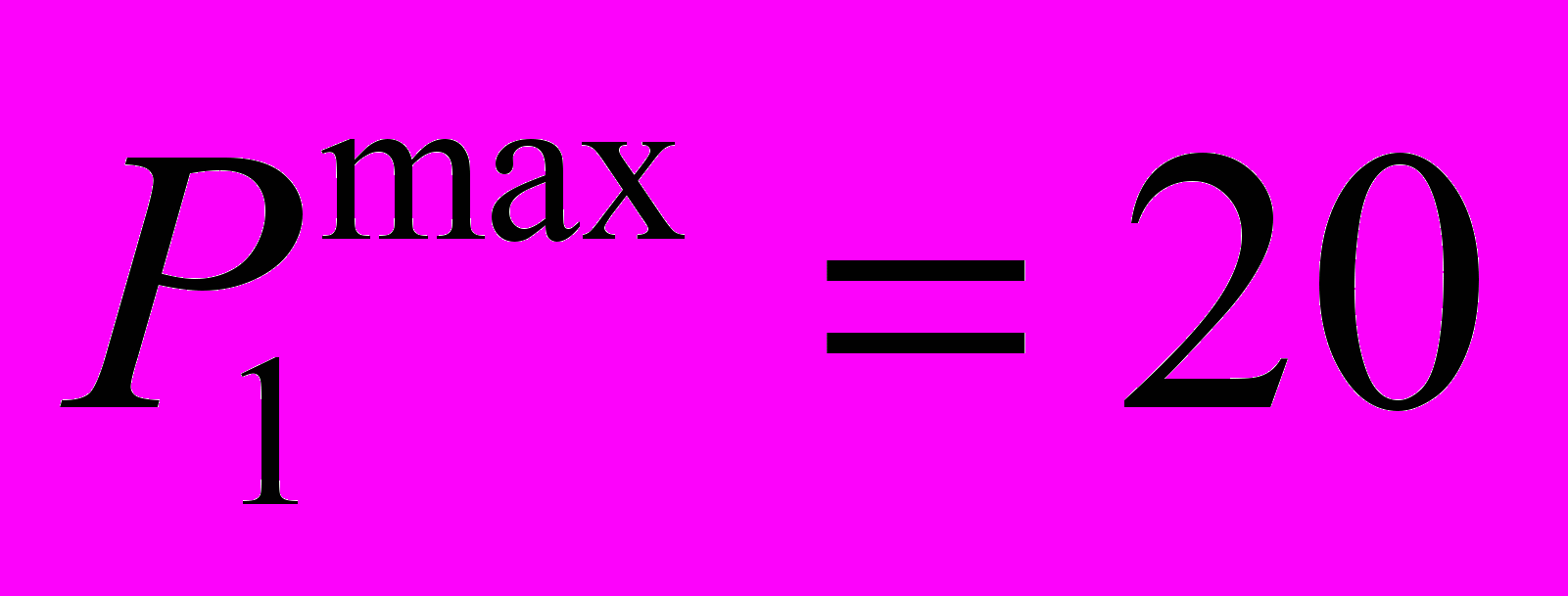 | 6-я неделя |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Модуль 2 Химическая кинетика, термодинамика и равновесия. | 1. Комплексные соединения. Комплементарность. Теория комплексов. 2. Термохимия. Химическая термодинамика. Осмос и осмотическое давление. 3. Химическая кинетика. Скорость. Химическое и фазовое равновесие. Балл: 10 | Лабораторная работа № 4 Лабораторная работа № 5 Лабораторная работа № 6 Балл: 5 | - | Балл: 5 | Аттестация Отчет по лабораторным работам | 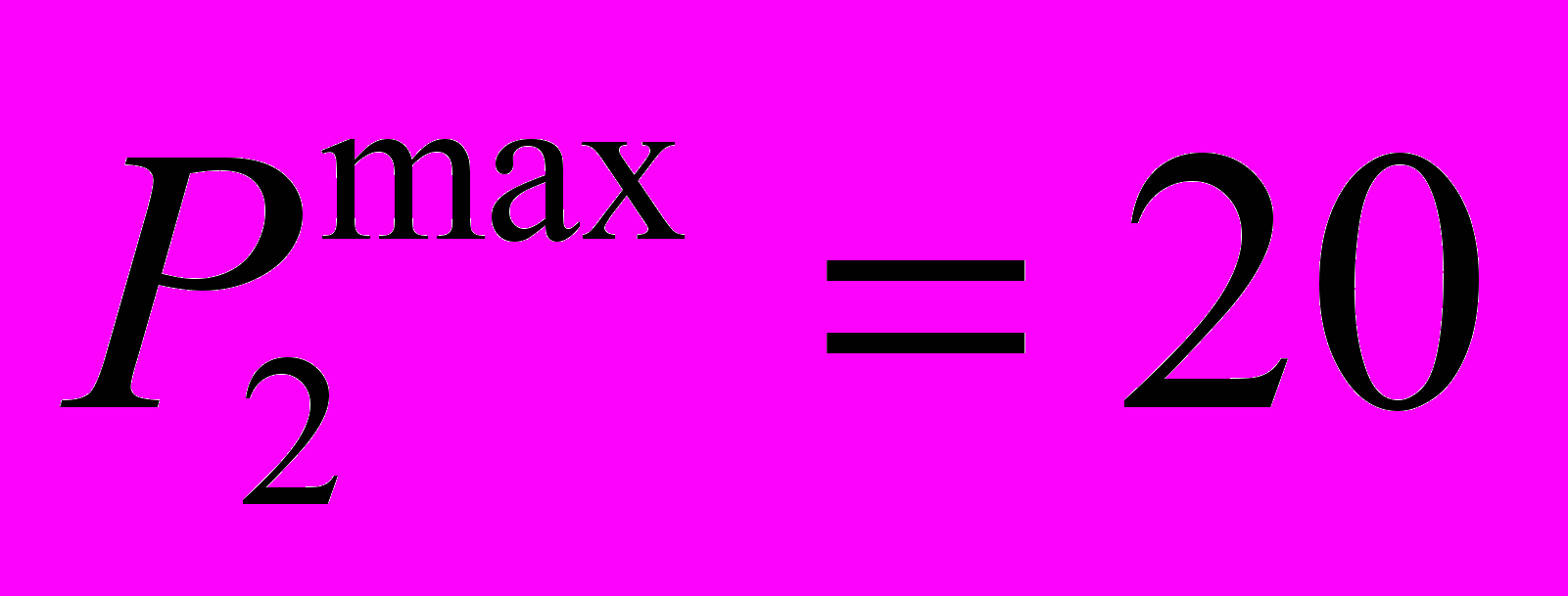 | 12-я неделя |
| Модуль 3 Химические, дисперсные и электрохимические системы. | 1. Органическая химия. Высокомолекулярные соединения (полимеры). 2. Окислительно-восстановительные процессы. Электрохимические системы. 3. Дисперсность. Дисперсные системы и коллоидные растворы. Золи и гели. 4. Растворы. Растворение. Растворимость. Электролиты и неэлетктролиты. Балл: 10 | Лабораторная работа № 7 Лабораторная работа № 8 Лабораторная работа № 9 Лабораторная работа № 10 Балл: 5 | - | Балл: 5 | Аттестация Отчет по лабораторным работам | 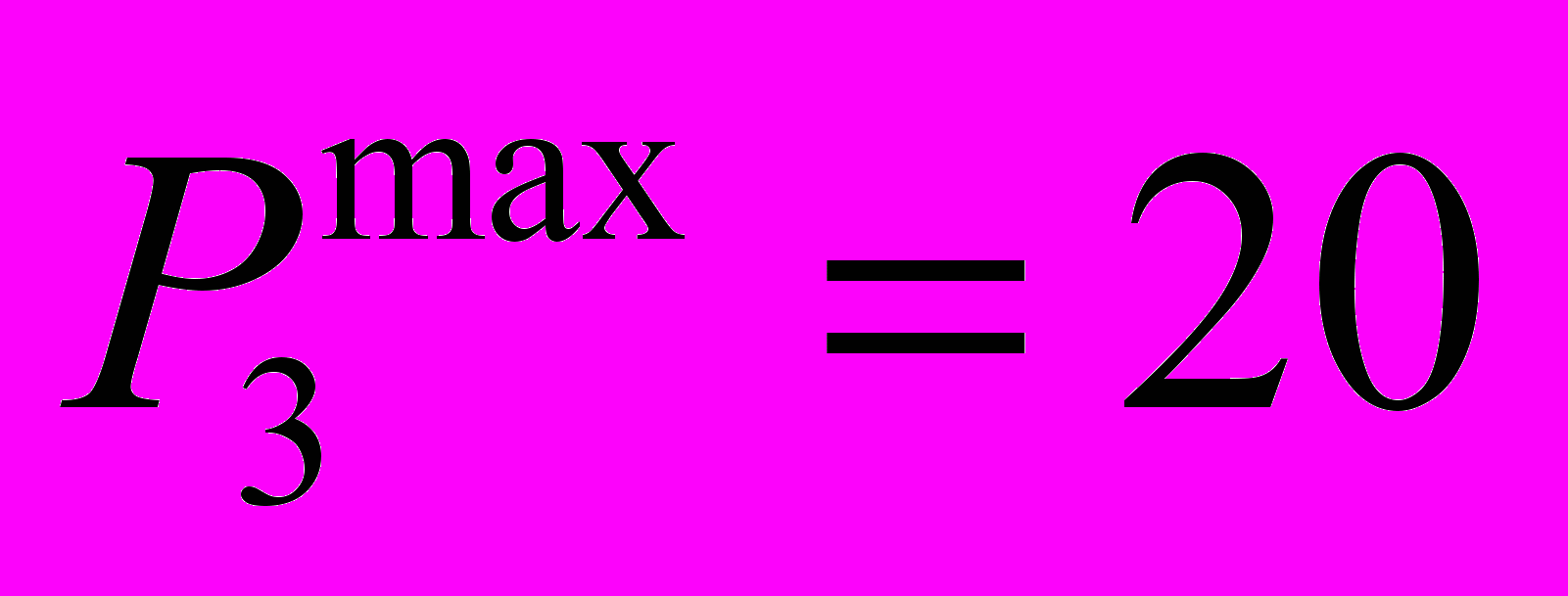 | 18-я неделя |
| Экзамен | | | | | Экзамен (1 семестр) | 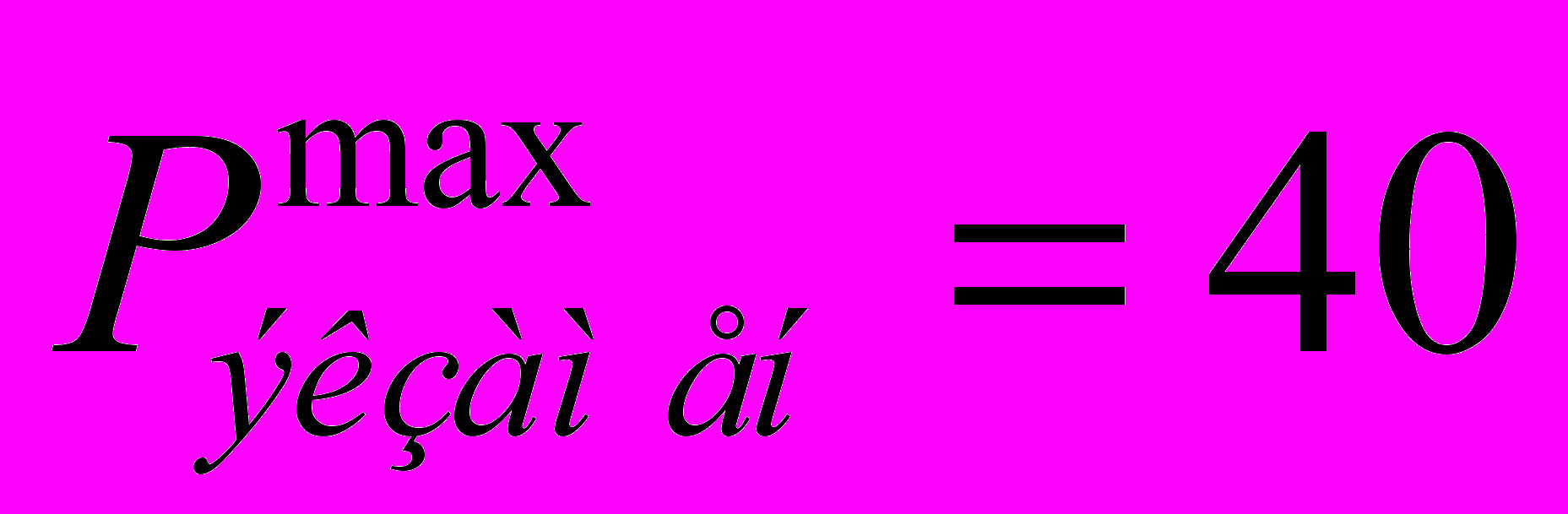 | |
| Всего по дисциплине 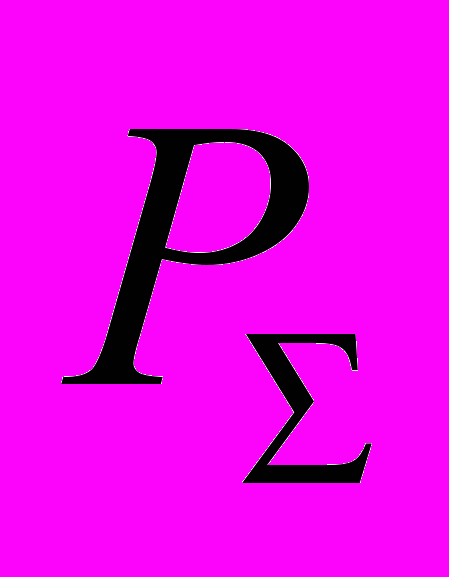 | | | | | | 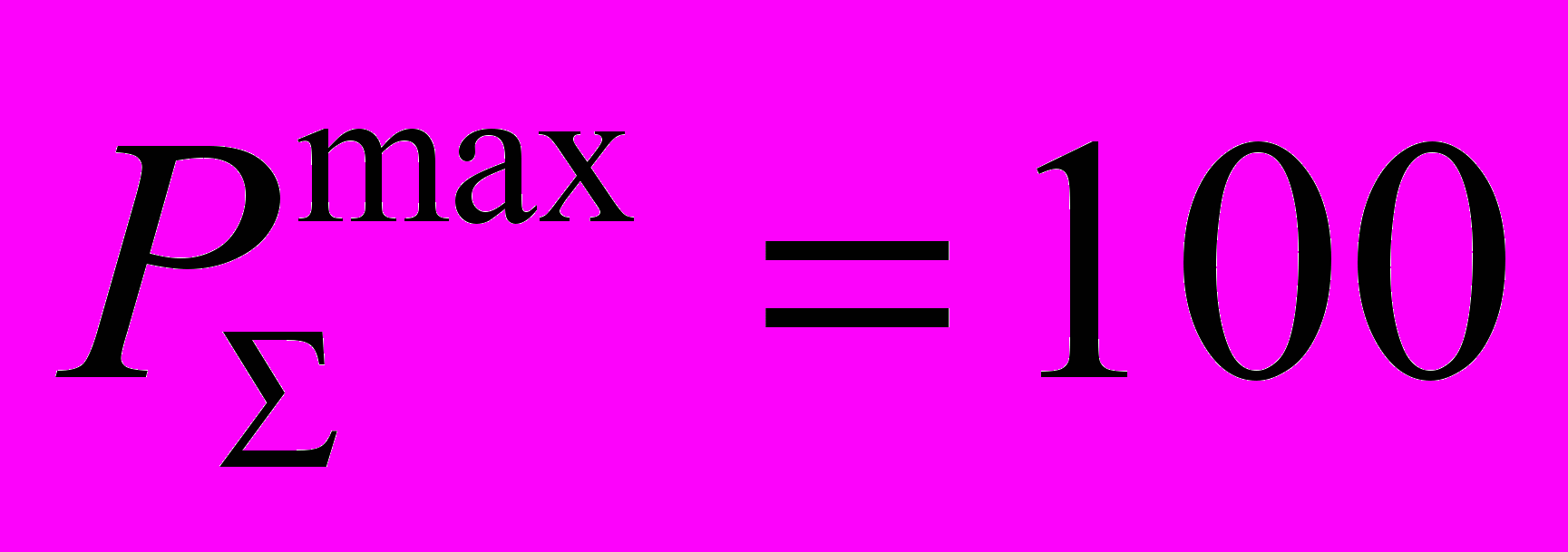 | |
