Биологические и эпидемиологические эффекты облучения в малых дозах
| Вид материала | Документы |
- Эффекты облучения в твердых телах, 247.82kb.
- Алкоголь… Практически все мы употребляем алкоголь, кто-то очень редко, исключительно, 78.97kb.
- Статья Общие положения > Настоящие Требования к выдаче Свидетельства о допуске к работам, 138.38kb.
- Трии, служит тезис о принципиальной допустимости, приемлемости, а порой даже благотворности,, 411.15kb.
- Курсовая работа тема: «Алкалоиды и история их открытия», 101.03kb.
- Некоторые нерешенные вопросы в исследовании сенсорной системы у человека и ее обусловленности, 144.69kb.
- Тверской Государственный Университет Химико-Биолого-Географический факультет Кафедра, 103.37kb.
- Травы Гекаты в роли целителей, 2705.54kb.
- Дозы излучения и единицы измерения, 180.6kb.
- Болезнь, характеризующаяся непреодолимым влечением к наркотикам (напр., морфину), вызывающим, 19.62kb.
Нестабильность генома после облучения в МАЛЫХ дозах: связь с клеточным стрессом и ЗНАЧЕНИЕ для Радиационной защиты {48}
Carmel Mothersill, Colin Seymour
Центр радиационных исследований, Технологический институт, Дублин, Ирландия
Mothersill C., Seymour C. Genomic instability after low dose irradiation: relationship to cell stress and implications for radiation protection. In: “The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health”, ed. by WONUC. 2000. Elsevier Science B.V. P. 59–63.
Carmel Mothersill, Colin Seymour
Radiation Science Centre, Dublin Institute of Technology, Kevin Street, Dublin 8, Ireland; Phone : 353 1 4024665 - Fax : 353 I 4756793, Email: cmothersill@rsc.iol.ie
РЕЗЮМЕ
Радиационно-индуцированная нестабильность генома является эффектом низких доз излучения, причем того порядка величин, который имеет место в результате воздействий окружающей среды.
Реальность нестабильности генома была подтверждена в нескольких ведущих лабораториях Европы, США и Японии98. Неизвестно, значимо ли указанное явление для радиационной защиты. Этот вопрос требует исследования. В особенности необходимо рассмотреть аккумулированные риски от радиации и других индукторов клеточного стресса, низкие уровни которых имеются в окружающей среде.
1. ОТСРОЧЕННЫЕ ЭФФЕКТЫ РАДИАЦИИ В НИЗКИХ ДОЗАХ
За последние 10–15 лет стало очевидно, что малые дозы радиации могут приводить к едва уловимым эффектам в клетках, переживших облучение, которые могут быть важными для многих и многих клеточных поколений. Эти эффекты показаны на клетках человека в культуре, где отмечены многочисленные мутации и избыточная клеточная гибель по крайней мере для 50-ти поколений, происходящих от исходно облученной родительской популяции. Характеристикой этого типа повреждений является то, что оно проявляется в потомстве клеток, которые, как казалось вначале, пережили облучение. Из исследований на людях и животных известно также, что некоторые генетические подтипы более восприимчивы к нестабильности генома, чем другие.
2. МЕХАНИЗМЫ ИНДУКЦИИ НЕСТАБИЛЬНОСТИ
Механизм развития нестабильности неизвестен, но он может быть связан с окислительным стрессом, индуцированным исходным радиационным воздействием, что затем дает возможность выжившим клеткам легче выдерживать мутации.
Что является ясным из всех работ в данной области, включая наши, так это то, что летальные или нелетальные мутации не клонируются и случайны. Это означает, что они не индуцируются как отдельное мутационное событие в родительской клетке во время облучения. Если бы они были той же самой мутацией, то наблюдались бы для всех клеток-потомков. В действительности же получается следующее: дочерние клетки облученной популяции имеют увеличенную вероятность возникновения различных мутаций в ДНК. Некоторые из них летальны, некоторые нелетальны, а некоторые происходят в онкогенах, участвующих в канцерогенезе. Этот последний тип мутаций наиболее важен для области радиационной защиты.
3. СВЯЗЬ С РАКОМ
Рак — наиболее волнующее последствие облучения людей в малых дозах. Болезнь, как известно, развивается из-за накопления многочисленных мутаций в клетках; она связана с селекцией мутировавших клеток, направленной на повышение их жизнеспособности (прогрессия). Эффект радиации в малых дозах, который предрасполагает к мутациям, может, теоретически, вносить вклад в инициирование радиационного канцерогенеза, причем на любой стадии прогрессии, даже если рак начался из-за другой причины типа курения. Таким образом, воздействие низкой дозы не только содействует развитию раковых образований99, но и способно ускорять их прогрессию.
Мы можем предсказать, что облучение населения в малых дозах способно крайне увеличить проявление всех заболеваний, где участвуют мутации, включая рак {49}. При этом [частота] какого-либо (any) заболевания не будет увеличиваться статистически значимо, но общая стабильность, или устойчивость населения уменьшится {50}. [Частота] раковых образований всех типов может повыситься {51}, а уже инициированные другими факторами загрязнения или курением раки станут прогрессировать быстрее. Быстрая прогрессия у населения может объяснить, почему настолько трудно получить ясное свидетельство того факта, что нестабильность генома непосредственно участвует в радиационном канцерогенезе. Ясно, что необходимо большее количество работ, чтобы определить степень какого-либо риска, связанного с этим феноменом, и исследовать соответствующие механизмы так, чтобы должный расчет мог быть признан значимым и было выделено направление, нацеленное на защиту людей от нестабильности генома. В особенности — на защиту их генетически чувствительных подтипов.
4. ХАРАКТЕРИСТИКА РАДИАЦИОННО-ИНДУЦИРО-ВАННОЙ НЕСТАБИЛЬНОСТИ ГЕНОМА
4.1. Цитогенетические повреждения
Описаны многие проявления нестабильности генома. Эффект характеризуется появлением у потомства [клеток] повреждений de novo, которые часто являются летальными, и, поэтому, не могут переноситься выжившими клетками. Неклонируемость — то есть, возникновение de novo различных хромосомных аномалий только у некоторых из клонов — потомков облученного прародителя, — является особенностью указанной нестабильности. Так как нестабильность не клонируется, а аберрации летальны, трудно объяснить эффект через репарацию или через какой-либо другой дефект, который несет клетка после облучения, поскольку он должен проявиться у всех клонов — потомков облученной клетки, а не только у некоторых из них. В клонах должны отсутствовать потомки, происходящие от клеток, которые не перенесли дефектов в репарации во время облучения.
4.2. Летальные мутации
Другое конечное событие (endpoint) для нестабильности генома — возникновение нелетальных мутаций (главным образом точковых или незначительных изменений генома; причем с высокой частотой) в потомстве клеток после воздействия ионизирующего излучения, УФ и химических агентов. Такие повреждения в перечисленных случаях снова не клонируются и широко распространены. Это конечное событие является наиболее важным применительно к канцерогенезу и к оценкам риска, что отмечено ниже. Третий тип конечного события — летальные мутации, упоминаемые как «отсроченная летальность» или «задержка репродуктивной гибели». Обнаружено, что этот эффект также появляется с высокой частотой и не клонируется. «Летальные мутации» сначала были зарегистрированы как постоянное сокращение эффективности деления клеток, оставшихся в живых после облучения. Отсроченный апоптоз, видимо, является существенной причиной отсроченной гибели. Концептуальная проблема с летальными мутациями в контексте нестабильности генома состоит в том, что, если клетка гибнет, эффект не имеет никакого последствия для канцерогенеза.
Главная цель настоящей работы заключается в разработке представления, согласно которому гибель генетически нестабильных клеток может, фактически, быть активным и тщательно управляемым механизмом защиты, избавляющим ткань от потенциально выживающих потомков. Даже если «летальные мутации» являются только гибельным концом спектра отсроченных клеточных мутаций, важно определить их количество и зависимость от дозы, или же временную связь с нелетальным и потенциально канцерогенным набором отсроченных мутаций или нестабильностью хромосом.
4.3. Связь с другими агентами, повреждающими ДНК
Описанные выше конечные события (endpoints) обнаружены для нескольких поколений после облучения или воздействия других ДНК-тропных агентов, типа тяжелых металлов, прооксидантов и UVA100. Выход варьирует и зависит от линии клеток или же от их генотипа. Многие эксперименты не выявили никакой зависимости «Доза — эффект», то есть, эффект был максимально выражен при самой низкой использованной дозе {52}.
Накопление данных для различных клеточных линий и генетических штаммов все еще находится на ранней стадии и проводится несколькими лабораториями. В результате отсутствует единая идея относительно факторов, лежащих в основе полученных изменений. Ясно, однако, что в некоторых ситуациях эффект наблюдается как «постоянное» изменение, заканчивающееся постоянным выходом дефектных клеток на удваивающуюся клеточную популяцию (в одном случае в нашей собственной лаборатории по крайней мере для 400 поколений), в то время как в других ситуациях выход дефектных клеток достигает максимума и, затем, постепенно исчезает примерно к 50-й генерации. Для практических биологических сроков маловероятно, что многие клетки в теле должны были бы подвергнуться более чем 50-ти удвоениям, поэтому изменения, по-видимому, могут быть расценены как биологически (или эффективно) постоянные.
В ограниченном числе случаев, когда некоторые линии клеток исследовались в той же самой лаборатории, эти различия оказались реальными, причем не из-за методики или экспериментальных вариаций. Тот факт, что фенотип индуцируется как «постоянное изменение» многими агентами, включая радиацию в очень низких дозах, настоятельно указывает на участие процессов трансдукции сигнала. Это подтверждается тем, что нестабильность генома может быть индуцирована в клетках, которые даже не были непосредственно облучены («эффект свидетеля» — «bystander effect»). Данное заключение имеет серьезное значения для нашего взгляда на риск не только от радиации, но и от комбинаций радиации с химическими агентами окружающей среды.
5. ЗНАЧЕНИЕ ДЛЯ ОЦЕНКИ РИСКА
Нестабильность генома для оценки риска нуждается в срочном исследовании.
1. В настоящее время мы знаем, что радиация стимулирует нестабильность генома.
2. Требуемая доза индукции очень низка, менее 300–500 мЗв для редкоионизирующего излучения и менее 100 мЗв для плотноионизирующего {53}.
3. Не имеется увеличения эффекта с повышением дозы, так что эффект гораздо более существенен при низких, чем при более высоких дозах {54}.
4. Мы знаем также, что, поскольку рак является мультистадийным процессом, требующим нескольких мутаций для образования опухоли, то любой процесс, который повышает частоту мутаций клеточной популяции, должен, по определению, увеличить риск появления канцерогенной мутации.
5. Мы знаем, что при тех заболеваниях, где нестабильность генома — часть патогенного синдрома (синдром Блума, анемия Фанкони), частота канцерогенеза высока.
6. Исходя из экспериментов на клетках человека и мышей in vitro и опытов на мышах in vivo мы имеем свидетельства того, что существует генетическое основание нестабильности и, поэтому, полагаем, что некоторые люди будут, возможно, более генетически нестабильными, чем другие.
7. Мы не знаем, как радиация стимулирует нестабильность. Такое знание позволило бы нам предотвратить эту индукция и оказать помощь системе радиационной защиты, которая должна быть озабочена нестабильностью.
8. Мы не знаем, существует ли естественный механизм для контроля или предотвращения появления клеток, несущих нестабильность. Имеется свидетельство того, что «летальные мутации» фактически могут быть защитными с точки зрения очистки тканей от клеток, несущих нестабильность. Необходимо исследование этого, а также расшифровка механизмов, лежащих в основе контроля выживаемости и пострадиационной гибели.
9. Мы не знаем того, что лежит в основе генетического основания нестабильности. Особенно важно определить, характерна ли она для различных субпопуляций людей и может ли она быть идентифицирована простыми скрининговыми тестами. Эта информация обеспечила бы возможные направления для защиты популяций, подвергавшихся [неблагоприятным] воздействиям.
10. Мы не знаем, имеется ли нижний порог дозы для нестабильности генома. Самые низкие исследованные дозы показали, в большинстве случаев, максимальный эффект. Эти дозы находятся на уровне верхней границы естественного фона окружающей среды {55}. Что будет при еще более низких дозах? {56} Концепция «Фоновый уровень мутаций» здесь не применяется, так как облучение, вероятно, повышает фоновую или спонтанную скорость мутирования для целой клеточной популяции столь долго, сколь это определялось!
11. Мы не знаем, как другие мутагены (например, химические) влияют на нестабильную клеточную популяцию. Разумно ожидать повышения мутационного уровня после химического воздействия, если население уже имеет более высокую восприимчивость к индукции мутаций. Это могло бы объяснить, почему исследование в одной области показывают очевидность «радиационно-индуцированного рака», в то время как исследования в другой области не выявляют подобной картины. Радиация может увеличить мутагенность другого фактора. Знание механизмов и взаимодействий различных агентов помогло бы развитию логической и эффективной стратегии защиты.
ЛИТЕРАТУРА
1. Cheng, K.C. and Loeb, L.A., (1997), Genomic Stability and Instability: a working Paradigm, in Genetic Instability and Tumourigenesis, ed M.B. Kasten, Springer, Berlin, Heidelberg, New York.
2. Morgan, WF, Day, JP, Kaplan, MI, McGee, EM, and Limoli, CL, (1996), Review Genomic instability induced by ionising radiation, Radiat. Res., 146: 247-258.
3. Mothersill C., and Seymour C. B., (1997), Lethal mutations and genomic instability. (Review) Int. J. Radiat. Biol. 71: 751-758.
4. Mothersill, C., and Seymour, C.B., (1998), Mechanisms and implications of genomic instability and other delayed effects of radiation, (Review), Mutagenesis, (in press)
5. Colucci, S., Mothersill, C., Harney, J., Gamble, C., Seymour, C.B., and Arrand, J.E. ( 1997) Induction of multiple PCR-SSCPE mobility shifts in p53 exons in cultures of normal human urothelium exposed to low-dose gamma radiation. Int. J. Radiat. Biol. 72: (1) 21-31.
6. Kadhim, M., Macdonald, D.A., Goodhead, S.A., Lorimore, S.A., Marsden, S.J., and Wright, E.G., (1992), Tramsmission of chromosomal instability after plutonium alpha-particle irradiation. Nature (London), 355: 738-740.
7. Little, J.B., Gorgojo, L., and Vetrovs, H., (1990), Delayed appearance of lethal and specific gene mutations in irradiated mammalian cells, Int. J. Radiat. Oncol. Biol. Phys., 19: 1425-1429.
8. Little, J.B., Nagasawa, H., Pfenning, T., Vetrovs, H., (1997), Radiation-induced genomic instability: delayed mutagenic and cytogenetic effects of x-rays and alpha particles. Radiat. Res, 148: 299-307.
9. Loeb, L.A., (1991), Mutator phenotype may be required for multistage carcinogenesis. Cancer Res., 51: 3075-3079.
10. Lorimore, S. A., Kadhim, M. A., Pocock, D. A., Papworth, D., Stevens, D. L., Goodhead, D. T., and Wright, E. G.(1998). Chromosomal instability in the descendants of unirradiated surviving cells after a-particle irradiation. Proceedings of the National Academy of Sciences USA 95, 5730-5733.
11. Lyng, F.M., O'Reilly, S., Seymour, C.B. and Mothersill, C.E., (1996), Morphological evidence of radiation induced delayed apoptosis in the distant progeny of irradiated cells, Radiat. Environ. Biophys. 35: 273-283.
12. Martins, M.B., Sabatier, L., Ricoul, M., Pinton, A., and Dutrillaux, B., (1993), Specific chromosome instability induced by heavy ions: a step towards transformation of human fibroblasts? Mut. Res., 285: 229-237.
13. Mendonca, M.S., Antonio, R.J., and Redpath, J.L., (1993), Delayed heritable damage and epigenetics in radiation-induced neoplastic transformation of human hybrid cells, Radiat. Res., 134: 209-216.
14. Mothersill, C. Crean, M., Lyons, M., McSweeney, J., Mooney, R., O'Reilly, J. and Seymour, C.B. Induction of delayed effects in the progeny of human cells surviving exposure to environmental mutagens, Mutagenesis, in press.
15. Sabatier, L., Dutrillaux, B., and Martin, M.B., (1992), Chromosomal Instability, Nature (London), 357: 548.
16. Seymour, C.B., Mothersill, C. and Alper, T., (1986), High yields of lethal mutations in somatic mammalian cells that survive ionizing radiation. Int. J. Radiat. Biol., 50: 167-69.
17. Seymour, C. B. and Mothersill, C. (1992), All colonies of CHO cells surviving gamma radiation contain mutated cells, Mutat. Research, 267: pp 19-30.
18. Watson, G.E., Lorimore, S.A., Glutton, S.M., Kadhim, M.A., and Wright, E.G., (1997), Genetic factors influencing a-particle-induced chromosomal instability. Int. J. Radiat. Biol., 71: 497-503.
РАДИОАДАПТИВНЫЙ ОТВЕТ ЛИМФОЦИТОВ ЧЕЛОВЕКА {57}
Roland H. Weissenbok, Siegfried Pfandler and Carl M. Fleck
Атомный институт Австрийского университета; Венский технический университет
Weissenbok R.H., Pfandler S., Fleck C.M. Radioadaptive response in human lymphocytes. In: “The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health”, ed. by WONUC. 2000. Elsevier Science B.V. P. 112–120.
Roland H. Weissenbok, Siegfried Pfandler and Carl M. Fleck
Atomic Institute of the Austrian Universities, Technical University of Vienna, Stadionallee 2, 1020 Vienna, Austria; phone: +43-1-58801-14169, e-mail: rweissen@ati.ac.at
РЕЗЮМЕ
Если лимфоциты человека подвергают вначале воздействию низкой дозы ионизирующей радиации («адаптирующая доза»), а затем, через несколькими часов, высокой дозы («повреждающая доза»101, то неблагоприятные генетические эффекты могут быть менее значительными, чем в клетках, облученных только в повреждающей, высокой дозе. Однако из-за низкой статистической надежности данных, все еще нет заключения, действительно ли радиоадаптивный ответ является всеобщим явлением и должен ли он быть принят во внимание при оценке риска.
После полного анализа обширной литературы и целого массива доказательств, мы утверждаем, что междонорская вариабельность адаптивного ответа происходит, главным образом, из-за различных генетических статусов доноров, так как индивидуумы с серьезными дефектами в способности к репарации не проявляют радиоадаптации.
Незначительная краткосрочная междонорская вариабельность может быть следствием некоторых изменений в физиологических состояниях донора или, возможно, объясняется вариациями прогрессии клеток на стадии G2. Межэкспериментальная изменчивость — результат различных физических параметров лучевого воздействия. Наиболее важные параметры — доза и уровень (мощность) дозы адаптирующего и повреждающего воздействий, качественный вид излучения и временной параметр (промежуток) между воздействиями. Таким образом, мы можем объяснить противоречивые результаты по радиоадаптации с помощью тщательного учета физиологических, генетических и физических источников вариабельности; причем последние могут быть доступны даже для математического моделирования.
1. ВВЕДЕНИЕ
Адаптивный ответ в лимфоцитах человека впервые описан Olivieri et al. (Oli84)102 [в 1984 г.] для радиационно-индуцированных аберраций хромосом. Начиная с того времени феномен продемонстрирован для широкого разнообразия выбранных конечных показателей радиопоражаемости (endpoints) (UNS94). Однако, поскольку этот ответ устраняется нетоксическими концентрациями:
- Циклогексимида (ингибитора синтеза белка) (You89);
- 3-аминобензамида (ингибитора поли(АDP-рибозо) полимеразы103 (Wie86);
- Камптотецина (camptothecin) — ингибитора топоизомеразы I (Sko94),
то указанный эффект может быть обусловлен индукцией нового, эффективного механизма репарации хромосомных повреждений ДНК через белковый синтез de novo путем активации специфических генов.
2. ВНУТРИ И МЕЖДОНОРСКАЯ ВАРИАБЕЛЬНОСТЬ
Внутридонорская вариабельность является частично следствием преходящих физиологических состояний донора или, возможно, вариаций клеточной прогрессии в фазе G2 (Bos89). Однако отсутствие адаптивного ответа у некоторых доноров более вероятно объясняется некоторыми стабильными чертами конституции (Bos89). Важность генетического статуса ясна, поскольку пациенты с синдромом Дауна не дают адаптивного ответа (Kal94, Kha91). Более того, вариабельность в проявлении радиоадаптивного ответа в случае монозиготных близнецов много ниже, чем в случае дизиготных близнецов или неродственных доноров (Kal97). Наконец, возможность экспрессии адаптивного ответа также значительно снижается с возрастом, что видно из рис. 1 (Bos89, Gad98, Zha95).
Мы пришли к выводу, что, без учета статистической вариабельности, имеются две статистические группы (позитивные / негативные по адаптивному ответу). Данные, подтверждающие это предположение, представлены на рис. 2.
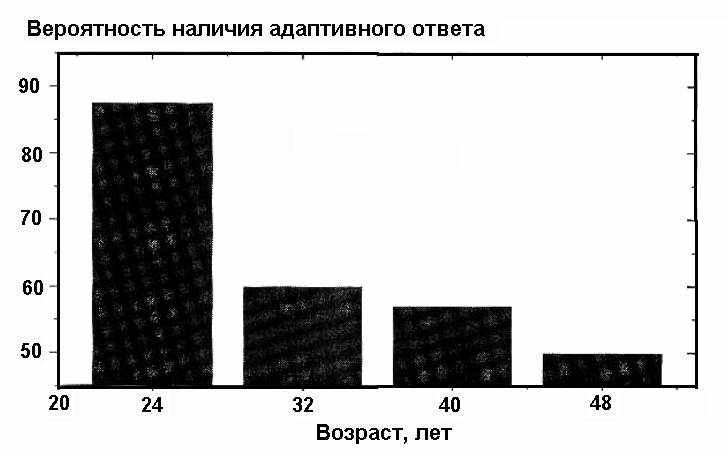
Рис. 1. Вероятность развития радиоадаптивного ответа в лимфоцитах людей в зависимости от возраста.
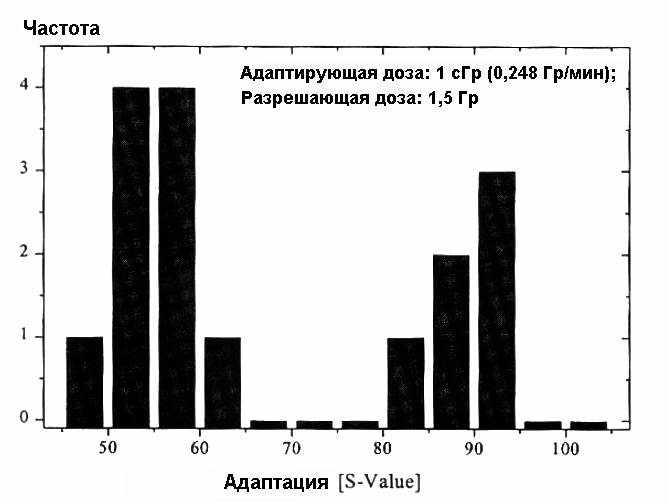
Рис. 2. Экспрессия радиоадаптивного ответа в лимфоцитах человека. Представлены две статистические группы (позитивные / негативные по радиоадаптации)104.
Чтобы гарантировать полную сопоставимость индивидуальных данных, каждый физический и химический параметр, влияющий на способность к экспрессии адаптивного ответа, должен быть идентичен [в разных работах]. К сожалению, это происходит только в очень редких случаях.
3. ЗАВИСИМОСТЬ ОТ ПРОМЕЖУТКА ВРЕМЕНИ
Полная экспрессия адаптивного ответа происходит через 4–6 ч после адаптирующего воздействия и адаптация наблюдается в течение 2–3-х клеточных циклов (Sha87, Cai90). Однако если воздействие малой дозы повторяется по крайней мере на 3-й клеточный цикл, то адаптивный ответ реиндуцируется (Cai90). Некоторые опыты in vivo показывают, что адаптация может сохраняться несколько недель (Woj90, Yon96) или, возможно, даже несколько лет (Sou97).
