Биологические и эпидемиологические эффекты облучения в малых дозах
| Вид материала | Документы |
- Эффекты облучения в твердых телах, 247.82kb.
- Алкоголь… Практически все мы употребляем алкоголь, кто-то очень редко, исключительно, 78.97kb.
- Статья Общие положения > Настоящие Требования к выдаче Свидетельства о допуске к работам, 138.38kb.
- Трии, служит тезис о принципиальной допустимости, приемлемости, а порой даже благотворности,, 411.15kb.
- Курсовая работа тема: «Алкалоиды и история их открытия», 101.03kb.
- Некоторые нерешенные вопросы в исследовании сенсорной системы у человека и ее обусловленности, 144.69kb.
- Тверской Государственный Университет Химико-Биолого-Географический факультет Кафедра, 103.37kb.
- Травы Гекаты в роли целителей, 2705.54kb.
- Дозы излучения и единицы измерения, 180.6kb.
- Болезнь, характеризующаяся непреодолимым влечением к наркотикам (напр., морфину), вызывающим, 19.62kb.
1. ВВЕДЕНИЕ
Эпидемиологические доказательства риска рака легких после воздействия радона основаны на многих исследованиях шахтеров, получивших относительно высокие по сравнению с бытовыми (в домах) дозы. Первое такое исследование проведено в 1971 г. [1]. За последующие 20 лет теми же авторами были опубликованы результаты, основанные на продолжительном изучении исходной когорты и двух других когорт, облученных в низких дозах. Серия соответствующих статей вышла в 1991 г. [2]. В 1990 г. начато большое изучение обитателей домов.
Цель представленной работы — анализ риска возникновения рака легких, связанного с воздействием малых доз радиации и облучением при малых уровнях (мощностях) доз у чешских шахтеров урановых рудников начиная с 1952 г. Анализ ограничивался шахтерами, не облучавшимися в ранние годы.
<…>
2. РЕЗУЛЬТАТЫ
<...>
Рисунок. Относительный риск развития рака легких у шахтеров урановых рудников в зависимости от накопленной кумулятивной дозы радона. Пятилетнее воздействие в шахтах (ladder exposure).
Оцененный относительный риск составляет 0,025 (95%-й доверительный интервал: 0,015–0,034).
<...>
3. ОБСУЖДЕНИЕ
Для оценки радиационного риска важны реальные данные по облучению. Исключительностью чешских исследований шахтеров урановых рудников является относительно высокая точность оценки воздействия, которая обусловлена большим числом определений концентрации радона (более 200 в год на шахту), производившихся уже начиная с 1949 г. Регистрация воздействий при обследовании когорты N имела то же самое или лучшее качество. Только данные по облучению в когорте L перед 1978 г. менее точны, что отразилось на специфической оценке риска для этой когорты.
Не получено доказательств нелинейности или зависимости от уровня воздействия, исходя из представленных данных [см. рисунок], а для уровня воздействия ERR/WLM [ERR — оцененный относительный риск] не продемонстрировано каких-либо специфических тенденций.
Так называемый «обратный» эффект мощности дозы, обнаруженный во многих исследованиях шахтеров [5] и при изучении суммарной когорты S [3], не выявлен в условиях низкого уровня воздействия (ниже 90 WLM в год). Поэтому, заключения представленной работы могут относиться ко всем диапазонам низкоуровневого облучения.
По сравнению с нашими предыдущими исследованиями [3], результаты, основанные на длительном наблюдении, показывают, что факторы, которые могут модифицировать основную линейную модель, стали более заметными.
Представленный анализ поддерживает факт сильного снижения эффекта от времени воздействия (2 = 95,08), обычно отмечаемого для шахтеров [5]. Вдобавок, одновременно наблюдалась значительная зависимость от возраста при облучении, которая анализировалась, в основном, исходя из достигнутого возраста [5]. Тем не менее, фактор достигнутого возраста включает фактор времени воздействия, который сам по себе является сильным модификатором. Если в представленной когорте достигнутый возраст включить в модель вместо возраста на момент воздействия, то влияние длительности облучения несколько снижается (2 = 45,74). <…>.
Чтобы получить отчетливый эффект каждого фактора, мы предлагаем модели «возраст на момент воздействия» и «времени, начиная с момента воздействия».
Далее сравнивали число случаев рака с национальными статистическими данными по следующим категориям: воздействие, возраст, период и т.д. Это позволило вычленить базовую линию спонтанного рака легких для когорт и для основной популяции. <…>
Проблема курения при оценке риска рака легких весьма существенна. Когда когорта была идентифицирована в 1970 г., шахты уже закрылись, и прямое исследование для когорты S было невозможно. Шахтеров обычно курят больше, чем обычное население.
Например, в объединенной когорте N и при исследовании когорты L доля курильщиков была 77% [4]. Обзор же для всего мужского населения, проводимый в начале 1970-х гг., оценил пропорцию курильщиков подобного возраста в 66% [6].
Фактор курения не исследовался в нашей работе, поскольку данные были недоступны, а число случаев с зарегистрированными привычками к курению в когортах пока слишком низко для детальных исследований.
4. ЗАКЛЮЧЕНИЕ
Эпидемиологические доказательства риска рака легких от радона основаны, главным образом, на изучении работников шахт. Результаты недавних исследований чешских шахтеров, посвященные низким уровням воздействия, не показали никакого отклонения от линейности или каких-либо иных существенных различий для специфического коэффициента риска при уровне экспозиции ниже 90 WLM в год.
Были проанализированы два главных фактора, которые влияют на риск радиогенного рака, а именно: время с начала экспозиции и возраст при воздействии. Новые исследования формы модели относительного риска подтвердили сильное снижение эффекта от времени воздействия (with time since exposure), которое наблюдалось и ранее. Кроме того, отмечена зависимость и от возраста при воздействии.
Таким образом, относительный риск уменьшается с повышением возраста при облучении. Это совместимо с результатами для оставшихся в живых после атомных бомбардировок или для облученных пациентов.
ЛИТЕРАТУРА
1. Ševc J, Plaček V, and Jeřábek J. Lung cancer risk in relation to long-term radiation exposure in uranium mines. Proc. 4th Conf. on Radiation Hygiene, Jasna pod Chopkom, Part II, pp. 315-326 (1971).
2. Ševc J, Tomášek L, and Plaček V. Risk of malignant lung tumours as a result of inhalation of radon daughter products. Cs. Hyg. 36, 3-13 (1991) [in Czech].
3. Tomášek L, Darby SC, Feam T, Swerdlow AJ, Plaček V, and Kunz E. Pattern of lung cancer mortality among uranium miners in West Bohemia with varying rates of exposure to radon and its progeny. Radiat. Res. 137,251-261 (1994).
4. Plaček V, Tomášek L, Heribanova A, Kunz E. Lung cancer and exposure to radon under present mining conditions. Pracov. Lek. 49, 14-20 (1997) [in Czech].
5. Lubin JH, Boice JD, Edhng C, Homung RW, Howe G, Kunz E, Kusiak RA, Morrison HI, Radford EP, Samet JM, Tirmarche M, Woodward A, Yao SX, Pierce DA. Lung cancer and radon: A joint analysis of 11 underground miners studies. Publ. No. 94-3644,US National Institutes of Health, Bethesda, MD, 1994.
6. Kubik A. Studies on smoking, chronic non-specific respiratory diseases, and lung cancer in selected territories of Czechoslovakia. Z. Erkrank. Atm.Org.152, 180-185 (1979).
Неоплазия щитовидной железы в уезде Муреш (Румыния) через 10 лет после аварии на ЧАЭС {76}
Stefania Salagean, Rita Burkhardt, Ildiko Mocsy
Институт народного здравоохранения, Румыния
Stefania Salagean, Rita Burkhardt, Ildiko Mocsy. Thyroid neoplasia in Mures county after Chernobyl accident: 10 years follow-up. In: “The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health”, ed. by WONUC. 2000. Elsevier Science B.V. P. 389–392.
Stefania Salagean, Rita Burkhardt, Ildiko Mocsy
Institute of Public Health, Cluj-Napoca, ROMANIA
РЕЗЮМЕ
Представлены результаты эпидемиологического обследования на предмет заболеваемости раком щитовидной железы в уезде Муреш Румынии в течение длительного периода времени до и после аварии на ЧАЭС. Цель работы — определение вероятности наличия зависимости (a casual relation) между дополнительным радиационным воздействием и риском для здоровья в популяции. В течении первых лет после аварии 1986 г. в уезде Муреш средняя величина эффективной дозы (E.D.) для популяции составила 35 мкЗв/год.
Подвергавшаяся изучению популяция уезда Муреш была представлена 10,4 миллионами человеко-лет, причем около 615.000 человек обследовано на протяжении 17-летнего периода — с 1980 по 1996 гг. Рассчитана частота встречаемости рака щитовидной железы на 100.000 жителей и распределение данного показателя в зависимости от пола, возраста (грудные, дети, подростки, взрослые) и образа жизни (горожане — сельчане). Вычислена динамика индексов (в %), которые могут отражать динамику этого злокачественного заболевания в течение исследованного периода, а также доля (в %) раков щитовидной железы от всех других видов рака.
Раки щитовидной железы составляют очень малую пропорцию — менее 1%, — от общего числа случаев раковых новообразований, регистрируемых ежегодно в уезде Муреш, с частотой встречаемости между 0,16 и 1,81 на 100.000 человек. Максимальное значение отмечено в 1995 г. Обнаружены различия в распределении заболеваемости в зависимости от пола: частота встречаемости в течение всего периода времени была вдвое выше у женщин, чем у мужчин. Данный показатель оказался выше у городских жителей по сравнению с сельскими, в особенности перед 1986 г. Мониторинг неоплазий щитовидной железы в зависимости от возраста продемонстрировал только один случай в молодом возрасте (в 1995 г.), а все остальные раки относились к взрослому возрасту. Даже при том, что в течение всего исследованного периода частота рака щитовидной железы характеризовалась постоянной тенденцией к увеличению (наиболее отчетливой начиная с 1993 г.), избыточный относительный риск (отношение величины наблюдаемых случаев к величине ожидаемых) только в незначительной степени коррелировал с дополнительной средней дозой радиации, накопленной населением после аварии.
ЛИТЕРАТУРА
1. ANSPAUGH, L.R. (1988) -"The Global Impact of Chernobyl Accident." Science 4: 1513-1519.
2. BRODWAY, J.A. (1988) - "Estimates of Radiation Dose and Health Risks to the U.S. Population Following the Chernobyl Nuclear Plant Accident." Health Phys. 55: 533-535.
3. GALERIU, D., and ONCESCU, M. (1989) - "Environmental Radioactivity of 1987 in Romania." (in Romanian) Radioactivitatea mediului in Romania, ICEFIZ. R8-27, 1-12.
4. PARETZKE, H.G. (1988) - "The Impact of Chernobyl Accident on Radiation Protection." Health Phys. 55: 139-143.
5. PARKIN, D.M., and CLAYTON, D. (1996) - "Childhood Leukaemia in Europe after Chernobyl." British J. Cancer, 73: 1006-1012.
6. RICHARDSON, R.B. (1990) - "Past and Revised Risk Estimates for Cancer Induced by Irradiation and Their Influence on Dose Limits." The British J. Radiol. 63: 235-245.
7. RON, E., and MODAN, B. (1989). "Thyroid Neoplasia Following Low-dose Radiation in Childhood." Rad. Res. 120: 516-531.
8. SALAGEAN, S., BURKHARDT, R., MOCSY, I., and MUNTEAN, N. - "Health Impact of the Chernobyl Accident on Children in Two Romanian Areas." 3rd Simp. of Croat. Rad. Prot. Association, Zagreb, Croatia, Nov. 20-22, 1996. V. l. P. 143-146.
9. SALAGEAN, S., BURKHARDT, R., MOCSY, I., and MUNTEAN, N. (1998) - "Epidemiological Study of Thyroid Cancer in Cluj County after Chernobyl: 10 Years Follow-up"- Central Eur. J. of Occup. & Environm. Med. 4 (2): 155-160.
10. UNSCEAR (1993) - Annex D. Report 1993. P. 676-678.
Биомониторинг радиационных СПЕЦИАЛИСТОВ в Бельгии: результаты широкомасштабного цитогенетического исследования с использованием центромерного микроядерного анализа {77}
H. Thierens, A. Vral, B. Aousalah et al.
Отдел анатомии, эмбриологии и гистологии Гентского университета, Бельгия
Thierens H., Vral A., Aousalah D. et al. Biomonitoring of radiation workers in Belgium: results of large scale cytogenetic studies using the micronucleus-centromere assay. In: “The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health”, ed. by WONUC. 2000. Elsevier Science B.V. P. 517–526.
H. Thierens*, A. Vral*, B. Aousalah*, M. Barbe***, R. Morthier**** and L. De Ridder**
* Department of Biomedical Physics and Radiation Protection, University of Ghent, Proeftumstraat 86, B-9000 Ghent, Belgium
** Department of Anatomy, Embryology and Histology, University of Ghent, L. Pasteurlaan 2, B-9000 Ghent, Belgium
*** Occupational Medicine Service CBMT, Kemcentrale Doel, Haven 1800, B-92130 Doel, Belgium
**** Occupational Medicine Service IDEWE, University Hospital Ghent, De Pintelaan 185, B-9000 Ghent, Belgium
РЕЗЮМЕ
Проведено широкомасштабное цитогенетическое исследование с использованием центромерного анализа микроядер у работников АЭС и медицинских специалистов больницы, повергавшихся профессиональному воздействию Х- и -излучения. Помимо влияния радиации изучены эффекты возраста, пола и курения на число микроядер с центромерами (центромерно-положительных), без центромер (центромерно-отрицательных) и на общее число микроядер на 1000 бинуклеарных (двуядерных) клеток.
Все исследования демонстрируют систематическое увеличение частоты микроядер с возрастом (индекс 0,24–0,4 микроядра в год), которое наблюдается в группе некурящих, что, в основном, обусловлено повышением хромосомных потерь, выражающихся в показателе центромерно-позитивных микроядер. Изучение работников больницы, состоящих на две трети из женщин, показало, что частота микроядер у женщин на 30% выше, чем у мужчин. Это увеличение микроядер снова было обусловлено хромосомными потерями, причем, весьма вероятно, в Х-хромосомах.
Для ограниченного числа индивидуумов — 4-х работников больницы и одного с АЭС, частота микроядер оказалась очень высокой (более 50-ти). FISH-анализ продемонстрировал, что в этих случаях столь большое число связано с центромерно-позитивными микроядрами. Анализ данных по влиянию курения на частоту микроядер был отрицательным: не обнаружено корреляции между курением и повышением числа как центромерно-позитивных, так и центромерно-негативных микроядер.
Не было статистически значимых отличий на уровне 95% достоверности между облученной и контрольной группами для обеих исследованных популяций, даже без классификации работников в соответствии с их радиационным стажем, соответствующим приблизительно 10-ти годам, перед взятием образцов крови на анализ. С другой стороны, линейная регрессия данных по работникам АЭС показала слабое повышение общего числа микроядер и числа центромерно-негативных микроядер в зависимости от дозы (0,025 микроядра на один мЗв). Основываясь на этих результатах, статистически значимое повышение частоты микроядер не может ожидаться при дозе ниже 20 мЗв в год, то есть, при нормах МКРЗ 60. Банк данных, полученный в результате представленных опытов и включающий 350 работников, будет иметь значительную ценность при обследованиях работников с высокими уровнями облучения, например, после аварий.
1. ВВЕДЕНИЕ
Эпидемиологические исследования показывают, что ионизирующая радиация индуцирует опухолевые образования у облученных индивидуумов. Переоценка (reevaluation) случаев рака и лейкозов в облученных популяциях привела к выработке международных рекомендаций (МКРЗ 60 1991 г.) [1] по снижению пределов дозы для профессионально облученных работников и для населения. Следовательно, систематическое исследование вреда, индуцированного радиацией, имеет большую важность для оценки риска в популяциях работников ядерной отрасли и радиационного медицинского сектора. Лучевые несчастные случаи указали на потребность в надежной методологии, позволяющей быстро и точно определить полученные дозы, причем не только для ограниченного числа индивидуумов, но и для значительной массы населения.
Генетические повреждения играют критическую роль в радиационном канцерогенезе. Поэтому цитогенетическая техника предпочтительна для оценки индивидуального риска, связанного с профессией или с аварийными воздействиями ионизирующей радиации. Возникновение аберраций хромосом и микроядер в периферических лимфоцитах человека является известным биоиндикатором радиационных повреждений. Применение этой цитогенетической техники для биомониторинга радиационных работников снимает некоторые специфические недостатки, присущие физической дозиметрии, например, ее невыполнимость в случае частичного облучения тела. Более того, биоиндикаторы радиационных повреждений учитывают и индивидуальную радиочувствительность. Систематический биомониторинг путем цитогенетической биологической дозиметрии является важным дополнительным инструментом при исследовании работников ядерной отрасли с высокой радиационной экспозицией (вдобавок к физической дозиметрии).
Хотя цитогенетический анализ дицентриков и транслокаций является видом техники биодозиметрии, применение этой методики для биомониторинга или скрининга относительно больших групп работников ядерной отрасли затруднено, поскольку хромосомный анализ отнимает много времени и требует квалифицированного персонала. Анализ микроядер после цитокинетического блока для периферических лимфоцитов человека [2] является ценной и менее трудоемкой альтернативой для широкомасштабных обследований [3]. В недавней работе [4] обнаружена значительная корреляция между радиационным воздействием и частотой микроядер у работников АЭС. Флуоресцентная гибридизация in situ с панцентромерными зондами (FISH-метод) на препаратах микроядер позволяет отличить кластогенное и анеуплоидогенное действие радиации [5]. Использование одновременного подсчета микроядер с учетом и без учета центромер ощутимо повышает чувствительность метода [5]. Согласно [6], применение центромерного анализа микроядер дает возможность детектировать эффект хронического облучения у шахтеров урановых рудников через значительный период времени после окончания воздействия.
Применив центромерный анализ микроядер, мы за последние два года провели широкомасштабное обследование работников АЭС и работников больниц, подвергавшихся воздействию Х- и -излучения. Помимо лучевых эффектов, изучено влияние возраста, пола и курения на число центромерно-позитивных, центромерно-негативных и на общее число микроядер на 1000 бинуклеарных клеток. Исследование проведено в рамках программы Научной поддержки защиты здравоохранения работников при правительстве Бельгии (Programme of Scientific Support to the Protection of Workers in the Area of Health of the Services of the Prime Minister Science Policy Office of the Belgian Government).
2. МАТЕРИАЛЫ И МЕТОДЫ
Исследуемые субъекты и скрининг. Скрининг проведен для популяции медиков, имеющих дело с радиационным фактором, университетской больницы в Генте и для работников АЭС в Doel131.
Первое обследование охватывало 120 человек, работающих в 14-ти различных отделах больницы. Другая группа состояла из 71-го радиационного работника (там же) и включала 36 мужчин и 35 женщин со значительной радиационной экспозицией. Контрольная популяция состояла из 49-ти человек (12 мужчин и 37 женщин, не подвергавшихся облучению). Половина обследуемых не курили.
Работники должны были заполнить информационную форму обследования (пол, возраст, курение, отдел, медицинские воздействия). Образцы крови отбирали при медосмотрах.
Информация о накопленной дозе за последние 10 лет была обеспечена исходя из записей о персональной дозиметрии.
При изучении 215-ти работников АЭС все процедуры были сходными. После письменного информационного согласия, эти люди заполняли форму запроса, аналогичную форме для медицинских работников; образцы крови был взяты при медосмотрах. Все участники были мужчинами.
Статистический анализ по сравнению показателей для различных групп доноров осуществляли путем теста Вилкоксона теста.
Центромерный анализ микроядер (micronucleus-centromere assay). <…>. Лимфоциты инкубировали с ФГА. Для блока деления клеток через 42 ч после начальной инициации добавляли цитохалазин. Инкубировали 70 ч <…>. Гибридизация in situ с центромерными ДНК-зондами (centromeric DNA probe). ДНК зонды «p82H» (предоставленными A.R. Mitchell) были специфичны к центромерным участкам хромосом человека. Биотинилированные зонды. <…>.
FISH-анализ132. <...>.
Микроядра и центромеры детектировали под флуоресцентным микроскопом. <...> Результаты выражали:
а) в общем количестве микроядер (MN) на 1000 бинуклеарных клеток;
б) в количестве микроядер, содержащих центромеры (MNCM+) на 1000 бинуклеарных клеток;
в) в количестве микроядер, не содержащих центромеры (MNCM–) на 1000 бинуклеарных клеток.
4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
4.1. Зависимость показателей от возраста
Для популяции медицинских работников индивидуальные данные (число MN, MNCM+ и MNCM– на 1000 бинуклеарных клеток), в зависимости от возраста донора, представлены на рис. 1.
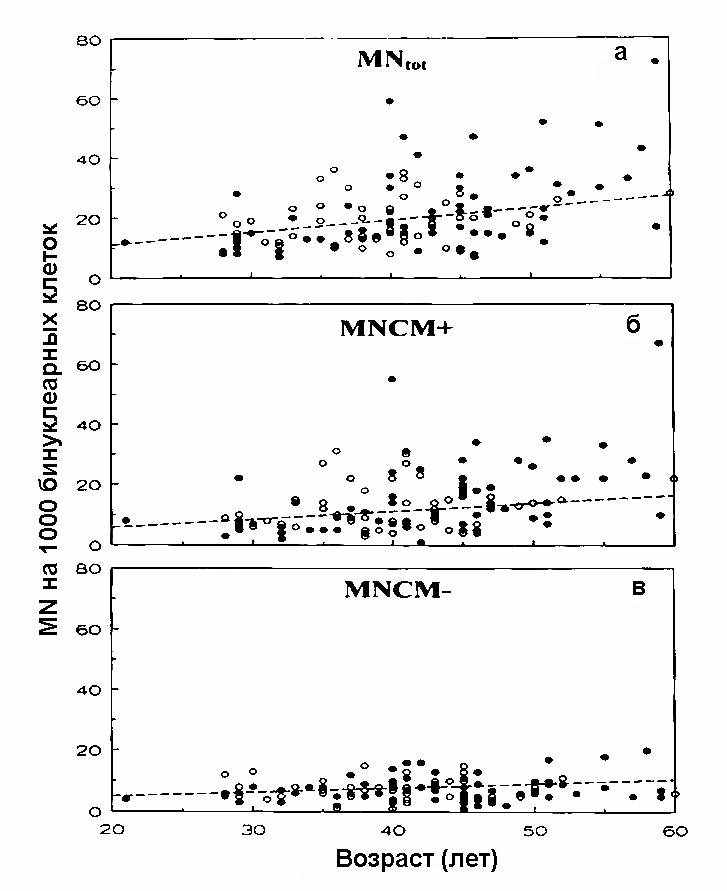
Рис. 1. Число MN, MNCM+ и MNCM– на 1000 бинукдеарных клеток в зависимости от возраста донора для группы медицинских работников. Данные для людей с облучением представлены черными кружками, а для контрольной популяции — светлыми. Пунктирные линии — результат анализа путем линейной регрессии данных для контрольной популяции, включающей некурящих.
При изучении зависимости от возраста на основе базовой частоты микроядер данные для некурящих людей контрольной популяции показаны светлыми кружками. Наклон прямых линейной регрессии зависимости от возраста для контрольной некурящей популяции из 29-ти людей составил для MN, MNCM+ и MNCM– следующие величины: 0,4; 0,27 и 0,13 микроядра в год соответственно. Две трети увеличения в зависимости от возраста общего числа микроядер относились к MNCM+, в то время как MNCM– составляли только одну треть такого увеличения. По сравнению с результатами в контроле (обозначенными пунктирными линиями на рис. 1), у 3-х женщин и у одного мужчины, являющихся работниками, имеющими дело с радиационным фактором, показано исключительно высокое число микроядер (более 50-ти), которые на 80% были представлены MNCM+.
Анализ зависимости от возраста выхода микроядер для некурящей контрольной популяции (n = 91) работников АЭС продемонстрировал повышение общего числа микроядер с возрастом (индекс 0,24 микроядра в год). Это повышение почти полностью было обусловлено MNCM+ (0,23 микроядра в год). Малое значение для зависимости от возраста у этой популяции, весьма вероятно, обусловлено полом. Только мужчины являлись работниками АЭС, в то время как медицинские работники, в основном, были женщинами.
При широкомасштабном обследовании (более 1000 нормальных людей) [9] представленные значения для наклонов линии регрессии кривых зависимости от возраста составили 0,314 микроядра в год для мужчин и 0,517 микроядер в год для женщин.
Детекция центромер в микроядрах с панцентромерными зондами при гибридизации in situ позволяет отличить кластогенный и анеуплоидогенный эффекты радиации [5]. Результаты нашего исследования продемонстрировали, что систематическое повышение частоты микроядер у доноров с возрастом, в основном, обусловлено ростом MNCM+, отражающим зависимое от возраста увеличение хромосомных потерь.
