Биологические и эпидемиологические эффекты облучения в малых дозах
| Вид материала | Документы |
- Эффекты облучения в твердых телах, 247.82kb.
- Алкоголь… Практически все мы употребляем алкоголь, кто-то очень редко, исключительно, 78.97kb.
- Статья Общие положения > Настоящие Требования к выдаче Свидетельства о допуске к работам, 138.38kb.
- Трии, служит тезис о принципиальной допустимости, приемлемости, а порой даже благотворности,, 411.15kb.
- Курсовая работа тема: «Алкалоиды и история их открытия», 101.03kb.
- Некоторые нерешенные вопросы в исследовании сенсорной системы у человека и ее обусловленности, 144.69kb.
- Тверской Государственный Университет Химико-Биолого-Географический факультет Кафедра, 103.37kb.
- Травы Гекаты в роли целителей, 2705.54kb.
- Дозы излучения и единицы измерения, 180.6kb.
- Болезнь, характеризующаяся непреодолимым влечением к наркотикам (напр., морфину), вызывающим, 19.62kb.
4.2. Эффект пола
Сортировка данных по медицинским работникам в зависимости от пола показала, что частота суммарных MN и MNCM+ была значимо выше (p < 0,01) для женщин, чем для мужчин. При этом между количество MNCM– микроядер различия не значимы. Выход MN, MNCM+ и MNCM– у женщин был в 1,4; 1,57 и в 1,15 раз больше, чем у мужчин. После корректировки данных на зависимость от возраста и на средний возраст суммарной популяции (40,9 лет), соответствующие соотношения для женщины /мужчины составили значения: 1,33 (0,12); 1,49 (0,17) и 1,1 (0,1) соответственно.
Данные по микроядрам, подразделенные по полу и скорректированные по возрасту, представлены на рис. 2.
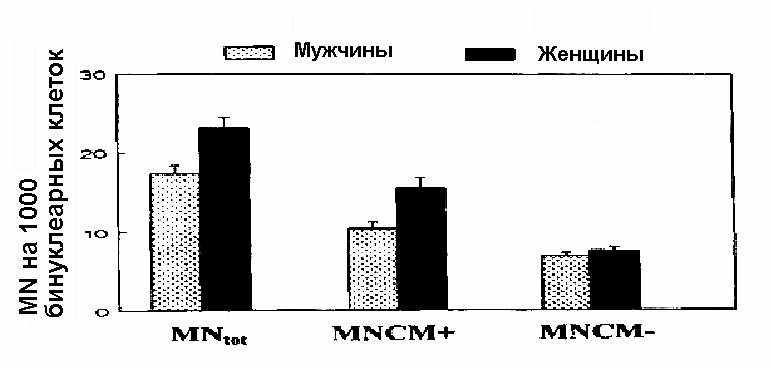
Рис. 2. Сравнение средних значений количества MN, MNCM+ и MNCM– для мужчин и женщин в группе медицинских работников после корректировки на эффект возраста. Представлены M SD (среднее стандартное отклонение).
Зависимость от пола, выявленная в нашем исследовании, находится в соответствии с данными [6]: частота микроядер систематически выше у женщин с фактором увеличения от 1,2 до 1,6 (в зависимости от возраста). Центромерный анализ в нашей работе показал, что эти эффекты пола могут почти полностью быть связаны с хромосомными потерями у женщин, поскольку число MNCM+ на 50% выше у женщин, чем у мужчин. Вероятно, обнаруженные эффекты возраста и пола объясняются, по большей части, потерями в Х-хромосоме при старении, как показано в предыдущих исследованиях [10, 11].
4.3. Эффект курения
Что касается эффекта курения на выход MN, MNCM+ и MNCM–, то заключения для обеих популяций одинаковы: не было отличий между курящими и некурящими, как в контрольной необлученной группе, так и в суммарной популяции. В качестве примера на рис. 3 представлено сравнение между курящими и некурящими в суммарной популяции работников АЭС.
4.4. Эффект аккумулированной дозы
Применительно к эффекту облучения на частоту микроядер, при исследовании популяции с АЭС могут быть важны два аспекта. Первый: доза, накопленная за последние 10 лет в соответствии с официальной персональной дозиметрией для радиационных работников была много выше в ядерной отрасли, чем для больницы. Второй: для работников больницы доза, определенная персональной дозиметрией, является недооцененной и ненадежной. Обычно кусок пленки помещается ниже передника (фартука),что не позволяет принять во внимание дозу для частей тела, не закрытого им (Usually the film-badge is worn underneath the lead apron and takes not into account the dose of the part of the body not covered) {78}.
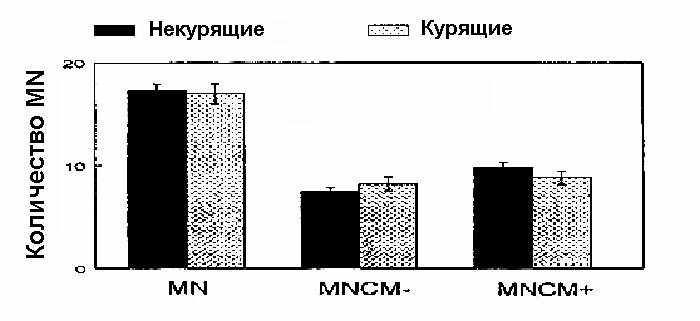
Рис. 3. Сравнение средних значений количеств MN, MNCM+ и MNCM– для курящих и некурящих лиц среди обследуемой группы работников АЭС. Представлены M SD (среднее стандартное отклонение).
Другие цитогенетические исследования для работников больниц [12, 13, 14] показали значительное повышение аберраций хромосом структурного типа и многочисленные нарушения в облученной популяции по сравнению с контролем. Однако не было корреляции между частотой аберраций хромосом и зарегистрированной полученной дозой [14]. Следовательно, для работников больниц сравнение данных по микроядрам для облученной и контрольной группы было выполнено без коррекции на эффект пола и возраста.
Максимальная частота микроядер, отмеченная для облученной популяции работников больницы, в основном была cвязана с повышением MNCM+. Однако различия не были значимы на уровне 95%-й достоверности в соответствии с тестом Вилкоксона. Скорректированные по возрасту (приведение обеих групп к среднему возрасту 40,9 лет) и полу (согласованные по мужчинам и женщинам) данные для контрольной и облученной популяции, суммированы в табл. 1.
Из табл. 1 видно, что после корректировки различия между контрольной и облученной группами становится почти достоверными (p < 0,1) для общего числа микроядер и для частоты MNCM+. Это сравнение представлено на рис. 4. Из анализа исключены 4 человека с чрезвычайно высоким уровнем микроядер. Результаты демонстрируют, что различия между суммарным числом микроядер и MNCM+ для облученной и контрольной группами по большей части объяснялись исключенными индивидуумами.
Таблица 1. Выход различных показателей микроядер в лимфоцитах облученных и необлученных работников больницы в зависимости от возраста, пола, курения и накопленной дозы.
| | MN | MNCM+ | MNCM– | Возраст, лет | Число сигарет в год133 | мЗв за последние 10 лет | Мужчины | Женщины |
| Облученные | 21,88 (13,5) р=0,21 | 14,74 (11,71) р=0,1 | 7,15 (4,01) р=0,47 | 41,6 (8,3) | 102 (256) | 11,25 (18,0) | 35 | 36 |
| Без облучеия | 19,48 (7,24) | 11,84 (7,34) | 7,64 (3,26) | 39,9 (6,4) | 79 (145) | 0,96 (0,86) | 12 | 37 |
Примечание.
В скобках — стандартное отклонение. Значения р для анализа по Вилкоксону показывает вероятность равенства между двумя популяциями.
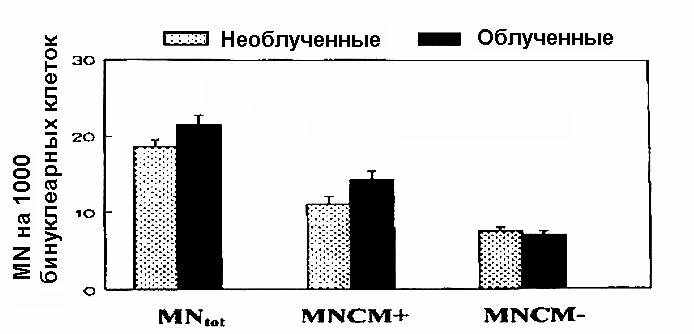
Рис. 4. Сравнение между средними значениями для количеств MN, MNCM+ и MNCM– у работников больницы, подвергавшихся и не подвергавшихся воздействию Х- и -излучения. Данные скорректированы по возрасту и полу. Представлены M SD (среднее стандартное отклонение).
Для статистического анализа популяции с АЭС работники были разделены на 4 группы в соответствии с эквивалентной поглощенной дозой за последние 10 лет. Группа с минимальной экспозицией — I, то есть, контрольная популяция, имела накопленную дозу менее 10 мЗв. Группы II и III: 10–20 мЗв и 20–50 мЗв соответственно. Воздействие для группы IV было максимальным — более 50 мЗв.
В табл. 2 представлены уровни MN, MNCM+ и MNCM– на 1000 бинуклеарных клеток, накопленная за 10 лет доза и возраст доноров; средние значения по группам приведены вместе с числом людей. Приведены также данные для облученных групп, разделенных на подгруппы курящих и некурящих. В скобках — значения SD (стандартные отклонения). Показаны также величины р по тесту Вилкоксона для всех групп.
Таблица 2. Уровни для различных показателей микроядер в лимфоцитах работников АЭС в зависимости от возраста и накопленной дозы.
| Группа I (менее 10 мЗв) | Группа II (10–20 мЗв) |
| MN 16,68 (8,16) | MN 17,62 (8,12) р < 0,52 |
| MNCM– 6,99 (4,00) | MNCM– 8,21 (5,25) р < 0,16 |
| MNCM+ 9,69 (6,64) | MNCM+ 9,41 (5,98) р < 0,79 |
| Средняя доза 3,08 (3,52) мЗв | Средняя доза 14,08 (2,59) мЗв |
| n = 104 | n = 47 |
| Средний возраст 45,6 лет | Средний возраст 42,8 лет |
| Группа III (20–50 мЗв) | Группа IV (более 50 мЗв) |
| MN 17,77 (9,75) р < 0,52 | MN 17,22 (8,17) р < 0,79 |
| MNCM– 7,86 (6,04) р < 0,38 | MNCM– 8,95 (6,44) р < 0,20 |
| MNCM+ 9,91 (5,97) р < 0,85 | MNCM+ 8,27 (4,11) р < 0,20 |
| Средняя доза 29,42 (6,61) мЗв | Средняя доза 70,51 (14,65) мЗв |
| n = 44 | n = 20 |
| Средний возраст 42,9 лет | Средний возраст 42,5 лет |
Как видно из табл. 2, не было значимых отличий в числе MN, MNCM+ и MNCM– между контролем и другими группами при 95%-м уровне достоверности.
Коррекция количества микроядер на возраст (как для работников больницы) не проводилась, поскольку ясно, что группы с различными дозами не могут быть зависимы от возраста.
На рис. 5 представлен график линейной регрессии зависимости индивидуальных значений выхода MN, MNCM+ и MNCM– от накопленной дозы в течение 10 лет перед обследованием. Линейная регрессия показывает увеличение выхода микроядер на 0,025 микроядра на один мЗв, причем это повышение практически нацело связано с MNCM–, указывая на кластогенный эффект радиации.
В соответствии с [6] для шахтеров урановых рудников с высокой экспозицией после ингаляции радона продемонстрировано только слабое повышение выхода суммарных микроядер по сравнению со здоровыми субъектами, но обнаружено значительное отличие в выходе MNCM– микроядер. Наклон кривой «Доза — эффект» для суммарного числа микроядер, полученный в нашей работе, составил 0,025 микроядра на один мЗв, и это значение находится в соответствии со значением 0,03 микроядра на один мЗв, приведенное в [4], где были исследованы 142 работника АЭС с накопленными дозами до 700 мЗв.
5. ЗАКЛЮЧЕНИЕ
Представленное исследование демонстрирует применимость биомониторинга ядерных работников с помощью центромерного анализа микроядер. Систематическое повышение частоты микроядер с возрастом доноров и повышенный выход их у женщин объясняются, в основном, хромосомными потерями. Курение не изменяет выход микроядер. Для исследованных популяций радиационных работников не было статистически значимого эффекта накопленной дозы на выход MN, MNCM+ и MNCM–.
На основе дозовой зависимости выведен индекс 0,025 микроядра на один мЗв. Это указывает, что изменений нельзя ожидать при дозах ниже 20 мЗв в год (что является лимитом МКРЗ 60).
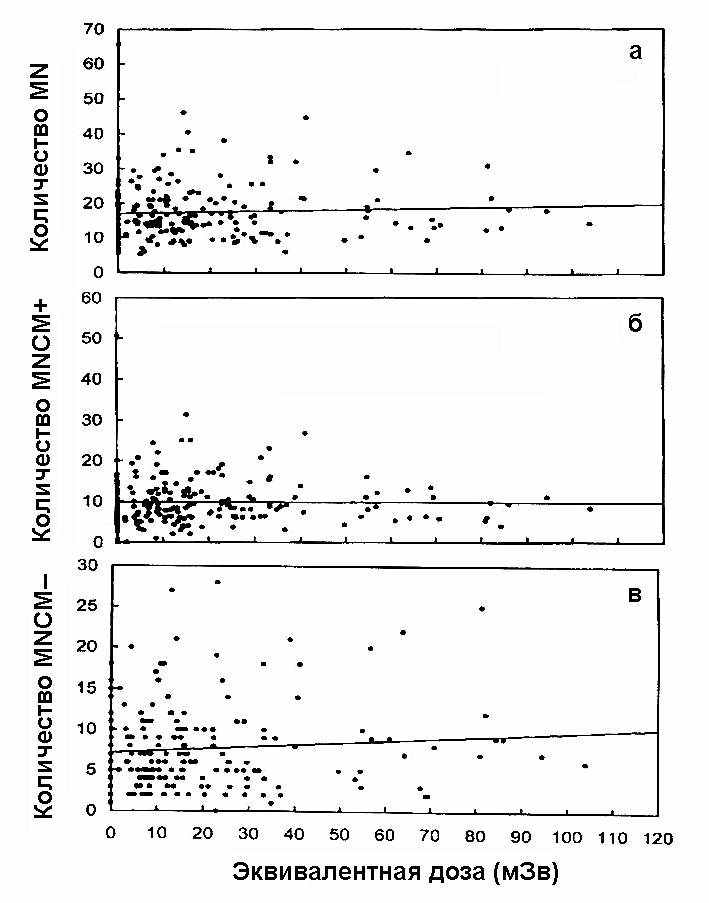
Рис. 5. График линейной регрессии зависимости индивидуальных значений выхода MN, MNCM+ и MNCM– от накопленной дозы в течение 10-ти лет перед обследованием. Сплошные линии — линейная регрессия данных.
ЛИТЕРАТУРА
1. ICRP Publication 60 (1991). 1990 Recommendations of the International Commission on Radiological Protection. Annals of the ICRP, Vol. 21, No. 1-3, Pergamon Press, Oxford.
2. M. Fenech and A.A. Morley. Measurement of micronuclei in human lymphocytes. Mutat. Res. 147 (1985) 29-36.
3. H. Thierens, A. Vral, L. De Ridder, N. Touil, M. Kirsch-Volders, V. Lambert and C. Laurent. Interlaboratory comparison of cytogenetic endpoints for the biomonitoring of radiological workers. Int. J. Radiat. Biol. 75 (1999) 23-34
4. A.K. Vaglenov, V.V. Bliznakov and A.G. Karadjov. Cytogenetic monitoring of workers from a nuclear power plant. Centr. Eur. J. Occup. Environ. Med. 3 (1997) 40-47.
5. A. Vral, H. Thierens and L. De Ridder. In vitro micronucleus-centromere assay to detect radiation-damage induced by low doses in human lymphocytes. Int. J. Radiat. Biol. 71 (1997) 61-68.
6. C. Streffer, W.U. Muller, A. Kryscio and W. Bokker. Micronuclei-biological indicator for retrospective dosimetry after exposure to ionizing radiation. Mutat. Res. 404 (1998) 101-105.
7. A. Vral, F. Verhaegen, H. Thierens and L. De Ridder. The in vitro micronucleus assay: a detailed description of an improved slide preparation technique for the automated detection of micronuclei in human lymphocytes. Mutagenesis 9 (1994) 439-443.
8. M. Fenech. The cytokinesis-block micronucleus technique: A detailed description of the method and its application to genotoxicity studies in human populations. Mutat. Res. 285 (1993) 35-44.
9. M.Fenech. Important variables that influence base-line micronucleus frequency in cytokinesis-blocked lymphocytes – a biomarker for DNA damage in human populations. Mutat. Res. 404 (1998) 155-165.
10. J.C. Hando, J. Nath and J.D. Tucker. Sex chromosomes, micronuclei and aging in women. Chromosoma, 103 (1994) 186-192.
11. F. Richard, M. Muleris and B. Dutrillaux. The frequency of micronuclei with X-chromosome increases with age in human females. Mutat. Res. 316 (1994) 1-7.
12. P. Bigatti, L. Lamberti, G. Ardito and F. Armellino. Cytogenetic monitoring of hospital workers exposed to low-level ionizing radiation. Mutat. Res. 204 (1988) 343-347.
13. A.N. Jha and T. Sharma. Enhanced frequency of chromosome aberrations in workers occupationally exposed to diagnostic X-rays. Mutat. Res. 260 (1991) 343-348.
14. J.F. Barquinero, L. Barrios, M.R. Caballin, R. Miro, M. Ribas, A. Subias and J. Egozcue. Cytogenetic analysis of lymphocytes from hospital workers occupationally exposed to low levels of ionizing radiation. Mutat. Res. 286 (1993) 275-279.
Развитие рака легких у крыс после воздействия продуктов распада радона: комплексная связь между кумулятивной дозой и мощностью дозы
Georges Monchaux, Jean-Paul Morlier
Отдел радиобиологии и радиопатологии, лаборатория экспериментального канцерогенеза, Франция
Monchaux G., Morlier J.-P. Lung cancer induction in rats after exposure to radon progeny: The complex interplay between cumulative exposure and exposure rate. In: “The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health”, ed. by WONUC. 2000. Elsevier Science B.V. P. 183–189.
Georges Monchaux, Jean-Paul Morlier
CEA — Departement de Radiobiologie et Radiopathologie, Laboratoire de Cancerologie Experimentale, BP 6, F - 92265 Fontenay aux Roses Cedex, France
РЕЗЮМЕ
Эксперименты на животных являются дополнительными к эпидемиологическим исследованиям эффектов воздействий, их уровней, а также других факторов. Подобные эксперименты проводятся с целью предсказания рисков в случае воздействий на людей. Преимущество данных, полученных на животных, обусловлено возможностью соблюдения хорошо контролируемых условий и тем, что доза и ее уровень (мощность) могут быть определены достаточно точно.
Тенденция к увеличению риска опухолеобразования при снижении уровня облучения была обнаружена на крысах, подвергавшихся экспозиции в аккумулированной дозе от 0,72 Дж/ч м–3 (200 WLM {79}) до 10,8 Дж/ч м–3 (3000 WLM) и при высоком уровне экспозиции от 0,09 Дж/ч м–3 (25 WLM в неделю) до 1,8 Дж/ч м–3 (500 WLM в неделю).
Напротив, результаты, полученные при низкой кумулятивной экспозиции, сравнимой с уровнем в домах, показали отсутствие «обратного эффекта мощности дозы». Хроническое воздействие радона при 0,09 Дж/ч м–3 (25 WLM) в течение 18 месяцев при потенциальной концентрации энергии (PAEC) частиц, равной 0,042 мДж м–3 (2 WL), привело к меньшему числу карцином легких у крыс, чем в случае кумулятивного воздействия в течение 4–6 месяцев при PAEC, равной 2,1 мДж м–3 (100 WL).
Более того, частота случаев рака легких у крыс после воздействия с низким уровнем (0,6%) была даже немного ниже, чем в контроле (0,63%).
Предварительные результаты новой серии экспериментов по исследованию влияния уровня экспозиции на индукцию рака легких у крыс при относительно низких кумулятивных дозах, соответствующих 0,36 Дж/ч м–3 (100 WLM), и PAEC, изменяющейся от 0,22 мДж м–3 (10–12 WL) до 3,15 мДж м–3 (150 WL), указывают, что при относительно низких кумулятивных экспозициях, сопоставимых с полученными в течение жизни в зданиях с высоким уровнем радона или же в шахтах, риск рака легких у крыс снижается с уменьшением PAEC, то есть, с уровнем (мощностью) дозы.
Эти данные указывают, что для риска индукции рака легких имеется сложное взаимодействие между кумулятивной экспозицией и ее уровнем (мощностью), заканчивающееся оптимальной величиной уровня для данной величины дозы. Предложенное Brenner значение для уровня экспозиции при оценке опасности радона в домах было основано на биофизических предпосылках. Brenner заключил, что в случае, когда кумулятивная доза достаточно низка, то многократные пролеты клеток-мишеней частицами также достаточно редки (это имеет место для типичного воздействия радона в помещениях). В результате все эффекты, обусловленные повышением уровня экспозиции, исчезают. Наши данные, полученные для крыс, видимо, характеризуются той же самой тенденцией.
1. ВВЕДЕНИЕ
Эпидемиологические обследования шахтеров урановых и др. рудников продемонстрировали связь между риском появления избыточных случаев рака легких и воздействием радона и его производных [1, 2]. Для различных стран измерения в жилых помещениях показали, что во многих домах концентрация радона только на один или два порядка величины ниже, чем в типичных подземных шахтах [3, 4]. Несмотря на то, что некоторые недавние исследования с учетом случайных отклонений (case-control) демонстрируют малый, но статистически значимый риск появления избыточных случаев рака легких от воздействия радона в жилых помещениях [5, 6, 7], доказательства риска избыточного рака легких от радона в домах менее ясны. Риск, связанный с воздействием в домах, оценивался исходя из данных для шахтеров в приложении к ситуации в жилых помещениях. Однако и дозы, и их уровни в шахтах были выше по сравнению с показателями в домах.
Анализ объединенных данных для 11-ти когорт шахтеров показал, что избыточный относительный риск рака легких повышается со снижением уровня экспозиции. Этот феномен был назван эффектом «замедления увеличения» (protraction enhancement), или «обратным эффектом от мощности дозы». Указанное явление обнаружено для высоких кумулятивных экспозиций [8], однако ослабление данного эффекта наблюдалось при кумулятивной экспозиции ниже 0,18 Дж/ч м–3 (50 WLM).
Исследования на животных используются в дополнение к эпидемиологическим с целью изучения эффектов доз, их уровня, а также других факторов, для предсказания рисков применительно к воздействиям на человека в домашних условиях и на рабочем месте. Преимущество данных, полученных для животных, заключается в том, что подобные опыты проводятся при хорошо контролируемых условиях, причем и доза, и ее мощность могут быть оценены достаточно точно. Данные по влиянию радона на животных, прежде всего на взрослых крыс, были получены, главным образом, в Тихоокеанской Северо-западной лаборатории (Pacific Northwest Laboratory — PNL) в США и усилиями нашей группы во Франции [2].
Несмотря на тот факт, что значительные кумулятивные экспозиции при типичном для жилых помещений уровне в 1,8 10–5 Дж/ч м–3 в неделю (или около 0,005 WLM в неделю) не могут быть тестированы из-за короткого времени жизни крыс, крысиная модель способна устранить неясности, существующие для данных на людях, в частности, в отношении эффекта уровня экспозиции.
В опытах в лаборатории PNL, проведенных в течение всей жизни животных, тенденция к повышению риска опухолеобразования в зависимости от снижения уровня экспозиции для крыс была показана для мощности дозы, равной 2,1 Дж/ч м–3 (100 WL) и 21 Дж/ч м–3 (1000 WL), и для кумулятивной экспозиции от 2,3 Дж/ч м–3 (640 WLM) до 18,4 Дж/ч м–3 (5120 WLM) [10].
Сходная тенденция обнаружена для крыс с кумулятивной экспозицией от 3,6 Дж/ч м–3 (1000 WLM) до 21,6 Дж/ч м–3 (6000 WLM) и высоким уровнем экспозиции — от 0,25 мДж/ч м–3 (70 WL в неделю) до 0,9 мДж/ч м–3 (250 WL в неделю) [11].
Напротив, результаты воздействия при низком уровне экспозиции, сравнимой с показателем жилых помещений, показали отсутствие эффекта «обратной зависимости от мощности дозы». Действительно, хроническое облучение радоном при дозе 0,09 Дж/ч м–3 (25 WLM) в течение 18 месяцев при потенциальной энергии -частиц в 0,042 мДж/ч м–3 (2 WL) привели к меньшему количеству карцином легких у крыс, чем при той же кумулятивной экспозиции, но в течение 4–6 месяцев при потенциальной энергии -частиц в 2,1 м Дж/ч м–3 (100 WL) [12]. Более того, частота случаев рака у крыс при низкой экспозиции, составившая 0,6%, была немного ниже, чем в контроле (0,63%).
<...>
2. ОБСУЖДЕНИЕ
Наши исследования все еще не закончены, в частности, проводятся гистопатологические анализы. Перед окончательным выводом необходима полная статистическая сводка данных для всех животных. Однако на основе аутопсии и дальнейшего микроскопического исследования, а также предварительных гистопатологических данных, можно сказать, что результаты нашей работы сравнимы с результатами изучения исторической контрольной группы (historical control group) из 785 крыс, а также с результатами предыдущих опытов на крысах, подвергавшихся кумулятивным экспозициям с различными уровнями экспозиций.
Наши предварительные данные показывают, что при относительно низкой кумулятивной экспозиции в 0,36 Дж/ч м–3 (100 WLM), сравнимой с экспозицией в течение жизни в домах с высоким уровнем радона, или же с экспозициями для подземных шахтеров, риск возникновения рака легких у крыс снижается вкупе с потенциальной концентрацией энергии -частиц (PAEC), то есть, со снижением уровня (мощности) экспозиции.
Это коррелирует с данными, полученными для низких кумулятивных экспозиций [12], которые показывают, что для одного и того же значения кумулятивной экспозиции в 0,09 Дж/ч м–3 (25 WLM) относительный риск снижается с 4,45 у крыс с уровнем воздействия в 3,15 мДж/ч м–3 (150 WL) до 3,48 при 2,1 мДж/ч м–3 (100 WL) и до 0,94 при 0,042 мДж/ч м–3 (2 WL).
Наши предварительный результаты демонстрируют также, что риск индукции опухолей легких у крыс максимален для кумулятивной экспозиции в диапазоне от 0,09 Дж/ч м–3 (25 WLM) до 720 мДж/ч м–3 (200 WLM), и в диапазоне PAEC от 1,05 м Дж/ч м–3 (50 WL) до 3,15 м Дж/ч м–3 (150 WL), то есть, для уровня экспозиции от 18 м Дж/ч м–3 в неделю (5 WLM в неделю) до 90 мДж/ч м–3 в неделю (25 WLM в неделю).
Эти данные показывают, что индукция рака легких является результатом комплексного взаимодействия между кумулятивной экспозицией («дозой») и уровнем экспозиции («мощностью дозы»). Причем имеется оптимальная комбинация обоих параметров для проявления наибольшего эффекта.
Значение уровня экспозиции при оценке опасности радона во внутренних помещениях было основано на биофизических предпосылках. Так, Brenner [14] заключил, что, когда кумулятивные воздействия (дозы) достаточно низки, многократные пролеты клеток-мишеней -частицами наблюдаются редко. Такая картина имеет место для типичных воздействий радона внутри жилых помещений. И, в результате, все эффекты повышения, зависимые от уровня экспозиции (мощности дозы) исчезают.
Недавние эксперименты той же самой группы [15] продемонстрировали, что пролет ядер клетки единственной -частицей134 индуцирует значительно меньшее количество онкогенных трансформаций в системе C3H10T1/2 фибробластов мышей, чем можно ожидать из простого среднего Пуассоновского распределения, когда результатом является одна -частица на клетку в среднем135.
Это указывает, что клетки, многократно пораженные -частицами, обеспечивают бóльшую часть риска трансформации136. С подобных позиций, если основываться на эффектах уровня дозы, то экстраполяция данных по низкоуровневым воздействиям с ситуации с шахтерами на воздействия в жилым помещениях (где никакая клетка-мишень не поражена более чем одной -частицей) может приводить к слишком высоким оценкам риска при типичных для жилых помещений дозах и уровнях экспозиции.
Наши данные на крысах, по-видимому, характеризуются той же самой тенденцией и поддерживают гипотезу, согласно которой при низких дозах риск рака легких связан в том числе и с уровнем дозы (экспозиции), а не только с одной кумулятивной дозой. Аналогичные результаты получены в Chalk River Laboratories [16] после хронических воздействий природной пыли урановой руды (natural uranium ore) в высоких концентрациях, которые (данные) также указывают, что риски злокачественных опухолей легких не прямо пропорциональны дозе, но прямо пропорциональны уровню дозы.
Эти эксперименты демонстрируют, что при кумулятивных экспозициях, сопоставимых с теми, которые могут быть в подземных шахтах и в домах, при PAEC на один порядок величины больший, чем зарегистрированный в настоящее время для шахт и приблизительно на два порядка величины больший, чем в жилых помещениях, существование практического порога для индукции рака легких не может быть исключено, хотя статистическое и теоретическое моделирование данных для риска может подвергаться различным интерпретациям.
Очевидные пороги для индукции рака легких также отмечали после низких доз -излучения и на экспериментальных животных — на крысах, подвергавшихся ингаляции PuO2 [17], на собаках-биглах, которым инъецировали 226Ra [18], и на людях («радиевые живописцы» [19] и пациенты с введением торотраста [20]).
Кроме того, существование порога для уровня (мощности) дозы не ограничивается воздействием -излучения, так как подобный порог отмечен после внешнего облучения мышей -лучами [21, 22], после орального введения мышам тритиевой воды [23], скармливании собаках-биглам 90Sr [24] и после тотального внешнего воздействия -излучения на мышей [25].
