Биологические и эпидемиологические эффекты облучения в малых дозах
| Вид материала | Документы |
- Эффекты облучения в твердых телах, 247.82kb.
- Алкоголь… Практически все мы употребляем алкоголь, кто-то очень редко, исключительно, 78.97kb.
- Статья Общие положения > Настоящие Требования к выдаче Свидетельства о допуске к работам, 138.38kb.
- Трии, служит тезис о принципиальной допустимости, приемлемости, а порой даже благотворности,, 411.15kb.
- Курсовая работа тема: «Алкалоиды и история их открытия», 101.03kb.
- Некоторые нерешенные вопросы в исследовании сенсорной системы у человека и ее обусловленности, 144.69kb.
- Тверской Государственный Университет Химико-Биолого-Географический факультет Кафедра, 103.37kb.
- Травы Гекаты в роли целителей, 2705.54kb.
- Дозы излучения и единицы измерения, 180.6kb.
- Болезнь, характеризующаяся непреодолимым влечением к наркотикам (напр., морфину), вызывающим, 19.62kb.
Влияние ионизирующей радиации в очень низких дозах на продолжительность жизни и иммунную систему У мышей {62}
M. Courtade*, A. Caratero*, H. Planel*, L. Bonnet**, B. Pipy***, C. Caratero*
* Лаборатория гистологии и эмбриологии медицинского факультета, Тулуза
** Отдел количественной биологии Тулузского университета
*** Лаборатория UPS, Тулуза
Courtade M., Caratero A., Planel H. et al. Influence of very low doses of ionizing radiation on life span and immune system in mice. In: “The Effects of Low and Very Low Doses of Ionizing Radiation on Human Health”, ed. by WONUC. 2000. Elsevier Science B.V. P. 85–95.
M. Courtade*, A. Caratero*, H. Planel*, L. Bonnet**, B. Pipy***, C. Caratero*
* Laboratoire d'Histologie-Embryologie. Faculte de Medecine Toulouse-Rangueil. 133, route de Narbonne. 31062 Toulouse Cedex - Tel (33) 05 62 17 20 08 - Fax (33) 05 62 17 20 10 -E-mail caratero@cict.fr
** Groupe de Biologie Quantitative U.M.R. 5552 Universite Paul Sabatier. 118, route de Narbonne. 31062 Toulouse Cedex
*** Laboratoire UPS EA 2405 - INSERM IFR 31. CHU Rangueil; 7, av. J. Poulhes - 31403 Toulouse Cedex 4.
РЕЗЮМЕ
Эпидемиологические исследования продемонстрировали благоприятный эффект ионизирующей радиации в малых дозах (гормезис). В некоторых работах эффект отмечался при дозах около 1 сГр в день, однако данные по очень низким уровням доз отсутствуют.
Для определения влияния хронического облучения при очень низких уровнях доз на продолжительность жизни, 600 мышей-самок C57BL6 возрастом 1 месяц облучали в дозах 7 и 14 сГр в год. Это в 25 и 50 раз выше, чем ЕРФ, но ниже, чем дозы в проведенных ранее опытах. 300 контрольных мышей находились в той же комнате. Средняя продолжительность жизни, определенная по времени жизни 50% каждой популяции, у облученных мышей была увеличена (549 дней в контроле и 673 дня у обеих облученных групп). Отличия между контрольной и опытными группами оказались статистически значимыми, в то время как достоверных различий для показателей мышей, облученными при уровнях 7 и 14 сГр в год, обнаружено не было. Не было отличий в динамике прироста массы тела для всех групп.
Эффект излучения на продолжительность жизни может быть объяснен стимуляцией иммунной системы или модуляцией окислительного статуса. Для проверки данных гипотез проведены соответствующие опыты. Мышей облучали в дозе 10 сГр в год и на 2, 4, 6, 8 и 12-й мес определяли состояние иммунной системы и окислительного статуса.
На 4 и 12 месяц отмечено увеличение количества спленоцитов109 у облученных животных, но не было отличий в ответе спленоцитов на митогены. Снижение числа Т-супрессорных лимфоцитов в селезенке обнаружено в срок 4 мес после воздействия; различия в уровне различных подклассов IgG по сравнению с контролем отмечены на 2, 4 и 12 мес. Выявлено снижение продукции свободных радикалов перитонеальными макрофагами на 3 и 12 мес после облучения. На 12 мес значительно повышался уровень глутатиона в печени.
В заключение отметим, что до сих пор мы не зарегистрировали никаких повреждающих эффектов для хронического облучения в указанных низких дозах. Напротив, результаты свидетельствуют о временной стимуляции иммунной системы, ассоциированной со сниженной продукцией свободных радикалов, что находится в соответствии с увеличением продолжительности жизни.
1. ВВЕДЕНИЕ
Природа эффектов ионизирующей радиации низкого уровня является предметом противоречивых мнений. Нежеланные побочные эффекты, вызванные относительно высокими дозами радиации, привели вначале к мнению, что радиация вредна при всех дозах. Позже была представлена концепция пороговой дозы для объяснения того факта, что отрицательные эффекты наблюдались только выше некоторых уровней доз. Кроме того, было обнаружено, что низкие дозы радиации могут приводить и к благоприятным эффектам для организма (гормезис) [36].
Для прояснения факта существования пороговой дозы были выполнены эпидемиологические обследования. Оказалось, что высокий ЕРФ сопровождается сниженной частотой раков [22, 25]. Тот же самый эффект был описан для поселений работников ядерной индустрии [1] или жителей домов в США с высокими концентрациями радона [6]. Однако данные относительно случаев рака у оставшихся в живых после атомных бомбардировок показали более высокие уровни раков у людей, получивших дозы свыше 200 мЗв [27].
С начала 1940-х гг. E. Lorenz и его сотрудники начали расширенное изучение хронических эффектов ионизирующей радиации низкого уровня для выявления диапазона толерантности у человека. При использованном уровне облучения — 0,1 рад в день (вплоть до момента естественной смерти) экспериментальные мыши и морские свинки имели слегка увеличенную продолжительность жизни по сравнению с контролем [7, 21]. Согласно [28], воздействие 0,4 или 5 сГр в день 60Со привело к приблизительно 10%-му увеличению продолжительности жизни. Подобные результаты были получены и на мышах [29], подвергавшихся облучению в дозе 1 сГр в день в течение многих поколений, или после воздействия в дозе 0,8 сГр в день в течение года [4]. Увеличенная продолжительность жизни была отмечена также у 2-х месячных мышей, облучаемых непрерывно при 0,7 или 6 сГр в день [31]. Все это указывает, что повышение продолжительности жизни произошло в большинстве экспериментов, где хроническое облучение составляло по уровню (мощности) дозы приблизительно 1 или несколько сГр в день.
Другие авторы описали сокращение жизни и увеличение частоты опухолеобразования у мышей, подвергавшихся низким дозам [8, 24, 32], но всегда — при уровнях (мощностях) доз порядка, по крайней мере, 1 или 2 Гр110. Однако в [23] отмечалось увеличение продолжительности жизни у мышей, облученных в раннем возрасте единственной фракцией в 0,5 Гр (Х-излучение). Феномен объяснялся, вероятно, сокращением [частоты] нераковых заболеваний печени и легких.
Все эти эксперименты находятся в соответствии с гормезисным эффектом, который был описан при уровнях доз между 1 и 50 сГр [36].
Что касается механизмов, которые могли бы обусловливать указанное явление, то следует сказать, что репарация ДНК [9, 33], инактивация свободных радикалов [11, 12] и иммунная система [16, 17, 18, 19, 20] стимулируются при низких дозах.
С другой стороны, пищевое ограничение (caloric restriction) обеспечивает единственное вмешательство, проверенное до настоящего времени для млекопитающих, которое неоднократно демонстрировало значительное увеличение продолжительности жизни и, в то же время, сокращение уровней связанных с возрастом патологий и биологических изменений [35]. Главный механизм действия пищевого ограничения — снижение окислительного статуса [30], который играет роль в механизме, обусловливающем различия в продолжительности жизни между видами [26]. Иммунная система также участвует в старении, поскольку демонстрировалось, что иммунное старение влияет на различные аспекты роста и распространения опухолей [10], и некоторые параметры иммунной системы могли обеспечивать предсказание о выживании в старости111 (could predict survival in the elderly) [13].
Чтобы изучить эффект очень низких доз радиации на целостный организм, мы провели два эксперимента. Сначала была изучена продолжительность жизни мышей, облучаемых в течение их жизни соответственно в дозах 7 и 14 сГр в год [5]. Затем в течение более чем одного года был проведен другой эксперимент, целью которого являлось объяснение механизмов, обеспечивающих увеличение средней продолжительности жизни, наблюдаемой в первом опыте. Исследовались иммунная система и окислительный статус, участвующие в процессе старения.
2. МАТЕРИАЛЫ И МЕТОДЫ
Долгосрочный эксперимент
Использованы мыши-самки линии C57BL/6 возрастом от 3 до 4 недель {63}.
Животные содержались при комнатном освещении и температуре 20–22°C. <...>
Облучение проводили с помощью воздействия нитратом тория. Источники излучения были помещены в пластиковые контейнеры под клетками. <...>
Опытные и контрольная группы включали по 300 мышей. Мышей взвешивали и регистрировали смертность каждый день за исключением воскресений.
Иммунная система
При исследовании иммунного и окислительного статуса облучение проведено также, но в дозе 10 сГр в год. <...>
Подклассы IgG определяли с помощью иммуноферментного анализа (ELISA) с использованием моноклональных антител к иммуноглобулинам мышей. <...>
Окислительный статус
Изучен выход свободных радикалов, продуцируемых перитонеальными макрофагами. Метод основан на хемилюминесценции макрофагов в присутствии люминола и форболового эфира <...>
Активность супероксиддисмутазы
Определяли в гомогенате печени калориметрически с помощью коммерческого набора реактивов (SOD-525 kit from Oxis International — Portland OR, USA).
<...>
Уровень глутатиона
Регистрировали в гомогенате печени также калориметрически (GSH-400 kit from Oxis International — Portland OR, USA). Результаты выражали в мкмолях глутатиона на 1мл гомогената. <...>
3. РЕЗУЛЬТАТЫ
Долгосрочный эксперимент
Скорость роста [прирост массы тела] у облученных мышей по сравнению c с контролем не изменялась.
На рис. 1 представлены кривые выживаемости для контрольной и опытной групп мышей.
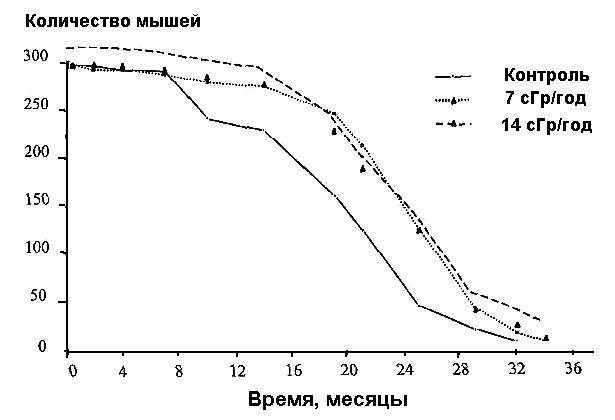
Рис. 1. Кривые выживаемости для трех групп мышей.
Из рис. 1 видно, что выживаемость выше в обеих облученных группах по сравнению с контролем. <...>. Различия были статистически достоверны по критерию 2. <...>
В табл. 2 представлены данные об увеличении продолжительности жизни облученных животных (по показателю времени жизни 50% популяции — ST50). Величина ST50 аналогична таким параметрам, как взвешенный пробит (weighted probit) или взвешенный логит (weighted logit).
Таблица 2. Время жизни (в днях) 50% популяции (ST50).
| Группа | ST50 | 95% доверительный интервал для ST 50 | |
| Взвешенные пробиты (weighted probits): Контроль 7 сГр/год 14 сГр/год | 549,6 673,1* 673,6* | 536,9 659,8 660,7 | 562,3 686,4 686,5 |
| Взвешенные логиты (weighted logits): Контроль 7 сГр/год 14 сГр/год | 553,8 684,6* 680,7* | 540,8 671,7 668,1 | 566,7 697,6 693,4 |
* Отличия достоверны (p < 0,01).
Исследование иммунной системы
На рис. 2 представлено количество спленоцитов у хронически облученных мышей.
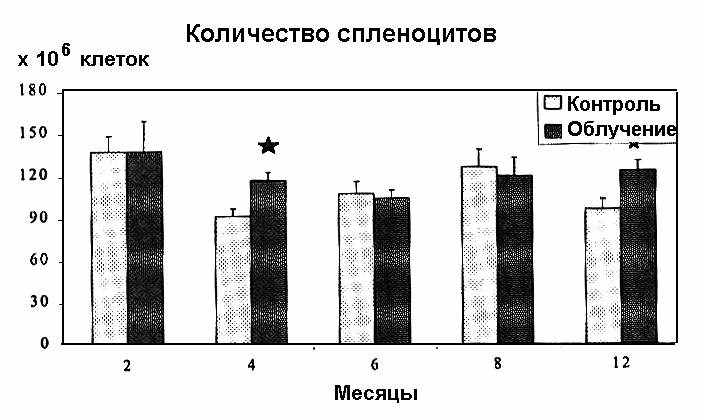
Рис. 2. Количество спленоцитов и тимоцитов при хроническом облучении мышей (10 сГр/год). Представлены M m для 10 опытов. [Звездочка — отличия достоверны по сравнению с контролем].
Обнаружено достоверное повышение числа спленоцитов на 4 и 12 мес. Однако количество тимоцитов112 оставалось неизменным (данные не представлены).
<…>
Исследование пролиферации клеток
Пролиферация спленоцитов (по параметру выживаемости после инкубации первичной культуры этих клеток в течение 48 ч) и их активация лектином (регистрируемая по уровню CD25 позитивных клеток) оставались неизменными.
Иммуноглобулины
На рис. 3 приведены результаты определения уровня различных подклассов IgG у облученных и контрольных мышей.
Выявлено некоторое снижение содержания IgG3 и IgG2b в срок 4 мес и IgG1 — 12 мес после начала воздействия. Отмечено, однако, увеличение уровня IgG2b через 2 мес после начала облучения.
Окислительный статус
На рис. 4 приведены данные по определению секреции [генерации] свободных радикалов перитонеальными макрофагами113.
Отмечено значительное снижение показателя в сроки 3 и 12 мес. Примеры кривых ответа на форболовый эфир и A23187 в срок 12 мес приведены на рис. 4.
На рис. 5 представлены результаты определения активности супероксиддисмутазы и уровня глутатиона в печени мышей в разные сроки после начала хронического облучения (10 сГр/год).
Как видно из рис. 5, уровень глутатиона был увеличен в срок 4 мес, а активность супероксиддисмутазы в условиях облучения оставалась неизменной.
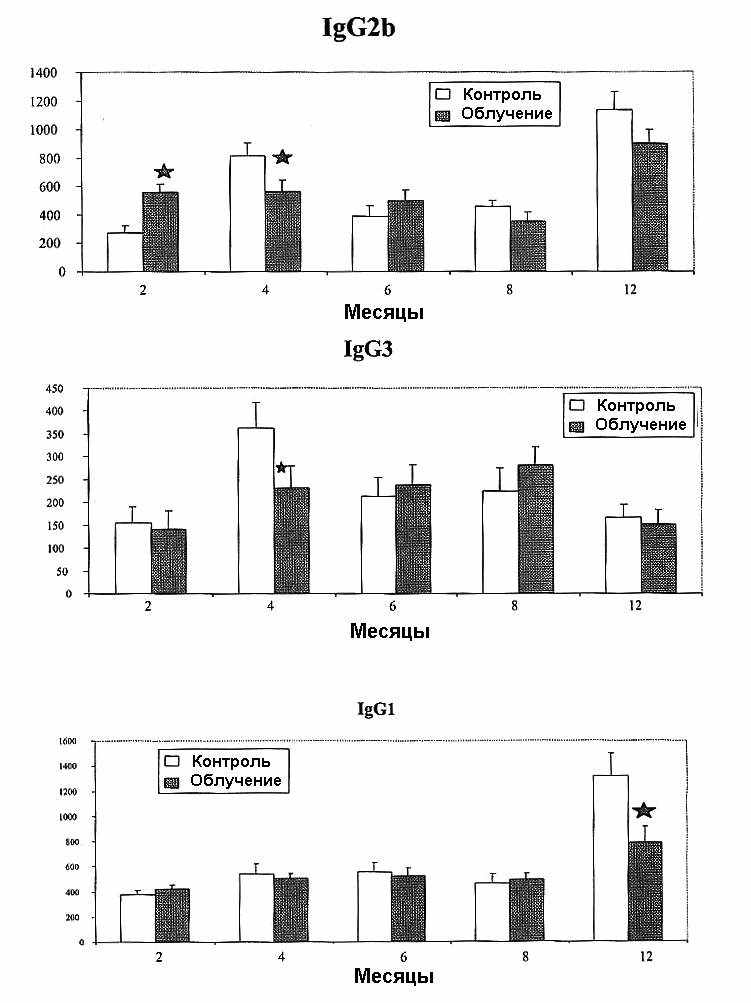
Рис. 3. Уровни различных подклассов IgG у мышей, подвергавшихся хроническому облучению (10 сГр/год). Представлены M m для 12 опытов. Звездочка — отличия достоверны по сравнению с контролем.
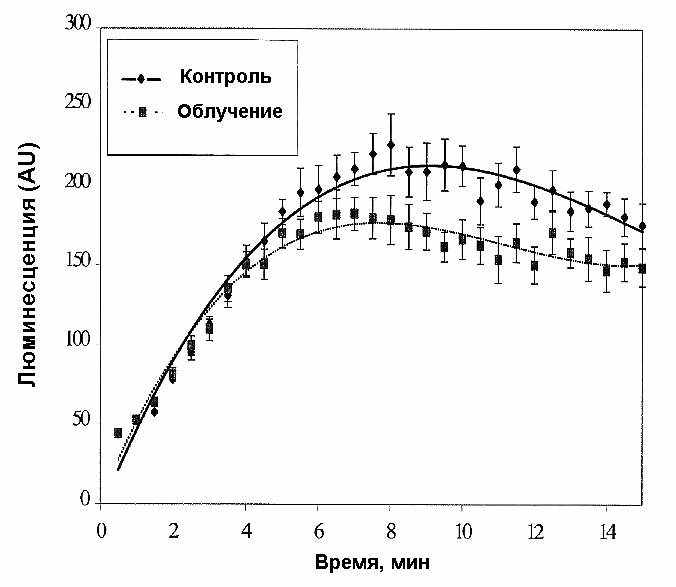
Рис. 4. Секреция свободных радикалов перитонеальными макрофагами [в срок 12 мес после начала хронического облучения (10 сГр/год)]. Представлены M m для 10 опытов.
4. ОБСУЖДЕНИЕ
Увеличение продолжительности жизни при низкоуровневом облучении уже было описано. Но в нашем исследовании использованная доза была очень мала, приближаясь к верхним границам доз, с которыми имеет дело радиационная защита.
Механизмы увеличения продолжительности жизни у мышей, облученных в очень низких дозам, неизвестны. Можно предполагать, что радиация защищает от развития неопластических или нераковых заболеваний. Это особенно отчетливо видно на линиях мышей, для которых смерть большинства животных происходит вследствие образования карцином или лейкозов114. В линии AKR, в которой приблизительно 80% самцов умирает от лимфом, удлинение продолжительности жизни наблюдалось у мышей, облученных в дозах 5 сГр или 15 сГр (соответственно три раза или два раза в неделю). Это, очевидно, связано с уменьшением частоты возникновения лимфом [15].
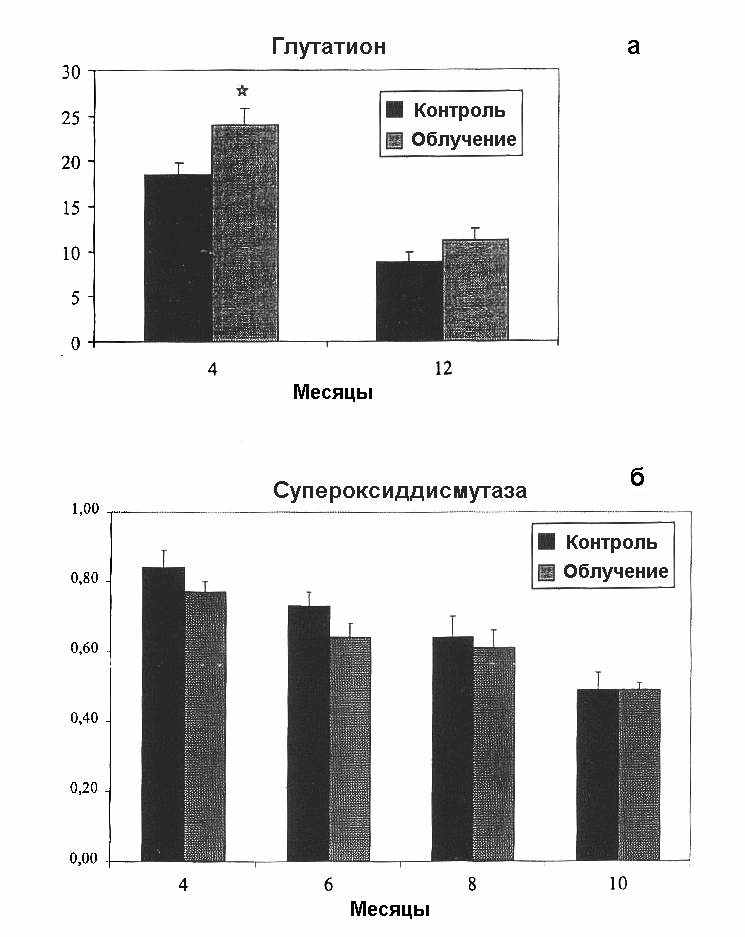
Рис. 5. Уровень глутатиона (а) и активности супероксиддисмутазы (б) в печени мышей в разные сроки после начала хронического облучения (10 сГр/год). Представлены M m для 12 опытов. Звездочка — отличия достоверны по сравнению с контролем.
У C57BL6 мышей частота опухолеобразования очень низка, и в наших экспериментах опухоли не были выявлены ни в контроле, ни после облучения.
Мы не обнаружили значимой стимуляции клеточного иммунитета. Однако снижение числа T-супресоров на 4 мес после начала радиационного воздействия может указывать на обратимую стимуляция иммунной системы. Повышенная реакция тимоцитов на конканавалин А была обнаружена с 1 по 7 день после однократного облучения в дозе 7 сГр [20] или после суммарной накопленной дозы 80 сГр [16]. Предложенное объяснение этих фактов заключается в том, что происходит предпочтительное повреждение или элиминация супрессорных Т-клеток [2]. Это предположение, однако, не получило экспериментального подтверждения при исследовании субклассов Т-лимфоцитов в тимусе и селезенке [20].
Обнаружено увеличение уровня IgG2b в срок 2 мес и уменьшение содержания подклассов IgG на 4 и 12 мес. Это наблюдение не находится в противоречии с предположением об иммуностимуляции. Полагают, что фракция иммуноглобулинов включает все антитела, индуцированные в ответ на различные антигены. Если распространенность инфекции более низка у облученных мышей, то уровни IgG у них могут уменьшаться. Мыши исследованной нами линии имеют тенденцию к облысению (alopecia), часто являющуюся следствием инфицированных повреждений, вызванных другими мышами в клетке. В наших опытах мыши, имеющие такие повреждения, систематически изолировались. Мы обнаружили, что облученные мыши выздоравливали (recovered) более быстро, чем контрольные115.
Последнее наблюдение находится в хорошем соответствии со стимуляцией иммунной системы облучением, но [в гормезисном эффекте] могут участвовать и другие клетки типа фибробластов. Повышенные уровни IgA и IgM были описаны у оставшихся в живых после атомных бомбардировок [14], причем показатели увеличивались с повышением дозы. Это объяснялось хроническими воспалениями после воздействия радиации в результате бомбардировки. Однако полученная доза была намного выше, чем уровень дозы, используемый в наших экспериментах. В настоящее время [нами] проводится исследование содержания IgA и IgM у контрольных и облученных мышей.
Перитонеальные макрофаги подвергавшихся радиационному воздействию мышей продуцировали сниженный уровень свободных радикалов. Увеличение содержания глутатиона отмечено в срок 4 мес после начала облучения. Все это может быть обусловлено радиоадаптивным ответом, заключающимся в повышении уровней антиоксидантов и в снижении свободных радикалов. Наше исследование должно быть завершено измерением уровня и других антиоксидантов, типа каталазы.
Известно, что радиация проявляет свои повреждающие эффекты через продукцию свободных радикалов [3]. Облучение в низких дозах, как известно, стимулирует адаптивный ответ и систему детоксикации свободных радикалов [11]. Действительно, после воздействия излучения в низких дозах обнаружено увеличение уровня супероксиддисмутазы116 в коре головного мозга крыс [34]. Продолжаются опыты по исследованию окислительного статуса после облучения в низких дозах.
Наши результаты, свидетельствующие о преходящей стимуляции иммунной системы и уменьшении продукции свободных радикалов перитонеальными макрофагами, находятся в хорошем соответствии с увеличением продолжительности жизни облученных мышей, которая описана нами ранее. Таким образом, хроническое облучение в столь низких дозах, как 10 сГр в год, может обусловливать благоприятные эффекты.
ЛИТЕРАТУРА
1. Abbat JD, Hamilton TR, Weeks JL. Epidemiological studies in three corporations covering the Canadian nuclear fuel cycle. Biological effects of low level radiation IAEA: Vienna, 351, 1983.
2. Anderson RE, Lefkowits I. In vitro evaluation of radiation-induced augmentation of the immune response. Am. J. Pathol. 1979; 97: 456-472.
3. Breen AP, Murphy JA. Reactions of oxyl radicals with DNA. Free Rad Biol Med 1995; 18:1033-1077.
4. Bustad L, Gates N, Ross A, Carlson L: Effects of prolonged low-level irradiation of mice. Rad. Res. 1965; 25: 318-328.
5. Caratero A, Courtade M, Bonnet L, Planel H, Caratero C. Effect of a continious gamma irradiation at a very low dose on the life span in mice. Gerontology 1998; 44: 272-276.
6. Cohen BL, Colditz GA. Tests of the linear-threshold theory for lung cancer induced by exposure to radon. Environ. Res. 1994; 64: 65-89.
7. Congdom CC. A review of certain low-level ionizing radiation studies in mice and guinea pigs. Health Physics 1987; 52: 593-597.
8. Covelli V, Coppola M, Di Majo V, Rebessi S, Bassani B. Tumor induction and life shortening in BC3F1 female mice at low doses of fast neutrons and X-rays. Radiat. Res. 1988; 113: 362-374.
9. Crompton NEA. Programmed cellular response to ionizing radiation damage. Acta Oncol 1998; 37: 129-142.
10. Ershler WB. The influence of an aging immune system on cancer incidence and progression. J. Gerontol. 1993;48: B3-B7.
11. Feinendegen LE, Bond VP, Sondhaus CA, Altman KI. Cellular signal adaptation with damage control at low doses versus the predominance of DNA damage at high doses. C.R.Acad. Sci. Paris 1999; 322: 245-251.
12. Feinendegen LE, Muehlensiepen H, Bond VP, Sondhaus CA. Intracellular stimulation of biomedical control mechanisms by low-dose low LET irradiation. Health Phys.1987; 52:663-669.
13. Ferguson FG, Wikby A, Maxson P, Olsson J, Johansson B. Immune parameters in a longitudinal study of a very old population of Swedish people: a comparison between survivors and nonsurvivors. J. Gerontol. 1995;6: B378-B382.
14. Fujiwara S, Carter RL, Akiyama M, Akahoshi M, Kodama K, Shimaoka K, Yamakido M. Autoantibodies and immunoglobulins among atomic bomb survivors. Radiat. Res. 1994; 137: 89-95.
15. Ishii K, Hosoi Y, Yamada S, Ono T, Sakamoto K: Decreased incidence of thymic lymphoma in AKR mice as a result of chronic, fractionated low-dose total body X irradiation. Rad. Res. 1996; 146: 582-585.
16. James SJ, Makinodan T. T cell potentiation in normal and autoimmune-prone mice after extended exposure to low doses of ionizing radiation and/or caloric restriction. Int. J. Rad. Biol. 1988; 53: 137-152.
17. James SJ, Enger SM, Peterson WJ, Makinodan T. Immune potentiation after fractionated exposure to very low doses of ionizing radiation and/or caloric restriction in autoimmune-prone and normal C57B1/6 mice. Clin. Immunol. Immunopathol. 1990; 55: 427-437.
18. Liu S, Liu W, Sun J: Radiation hormesis: its expression in the immune system. Health Physics 1987; 52: 579-584.
19. Liu S, Xia F, Yu H, Qi J, Wang F, Wang S: A restudy of immune functions of the inhabitants in high background radiation area in Guangdong. Chin. J. Radiol. Med. Protect. 1985; 5: 124-130.
20. Liu SZ, Han ZB, Liu WH. Changes in lymphocyte reactivity to modulatory factors following low dose ionizing radiation. Biomed. Environ. Sci. 1994; 7: 130-135.
21. Lorenz E, Gorgdon C, Deringer M, Hollcraft J: Long-term effects of acute and chronic irradiation in mice; survival and tumor incidence following chronic irradiation of 0.11 r per day. J. Nat. Canc. Inst. 1955; 15: 1049-1058.
22. Luxin W et al. Epidemiological investigation of radiological effects in high background radiation areas of Yangjiang, China. J. Radiat. Res., 1990; 31: 119-136.
23. Maisin J, Gerber G, Vankerkom J, Wambersie A: Survival and diseases in C57BL mice exposed to X rays or 3.1 MeV neutrons at an age of 7 or 21 days. Rad. Res. 1996; 146: 453-460.
24. Maisin JR, Wambersie A, Gerber GB, Mattelin G, Lambiet-Collier M, De Coster B, Gueulette J. Life-shortening and disease incidence in C57B1 mice after single and fractionated gamma and high-energy neutron exposure. Radial. Res. 1988; 113: 300-317.
25. Nambi KSV, Soman SD. Environmental radiation and cancer in India. Health Phys. 1987; 52: 653-657.
26. Park JW, Choi CH, Kirn MS, Chung MH. Oxidative status in senescence accelerated mice. J Gerontol 1996; 5: B337-B345.
27. Pierce DA, Shimizu Y, Preston DL, Vaeth M, Mabuchi K. Studies of the mortality of atomic bomb survivors. Report 12, Part I. Cancer: 1950-1990. Radiat. Res. 1996; 146: 1-27.
28. Sacher G, Grahn D: Survival of mice under duration of life exposure to gamma rays. I. The dosage survival relation and the lethality function. J. Nat. Canc. Inst. 1964; 32: 277-321.
29. Searle A: Effects of low-level irradiation on fitness and skeletal variation in an inbred mouse strain. Genetics: 1964; 50 (suppl): 1159-1168.
30. Sohal RS, Weindruch R. Oxidative stress, caloric restriction and aging. Science 1996; 273: 59-63.
31. Spalding J, Thomas R, Tietjen G: Life-span of C57 mice as influenced by radiation dose, dose rate at exposure. Rep. No. Vc. 48-LA 9528 Los Alamos Nat. Lab. 1982.
32. Thomson JF, Grahn D. Life shortening in mice exposed to fission neutrons and gamma rays. VII. Effects of once-weekly exposures. Radiat. Res. 1988; 115: 347-360.
33. Wallace SA. Enzymatic processing of radiation-induced free radical damage in DNA. Radiat Res 1998; 150: S60-S79.
34. Yamaoka K, Edamatsu R, Itoh T, Mori A. Effect of low dose X-ray irradiation on biomembrane in brain cortex of aged rats. Free Rad. Biol. Med. 1994; 16: 529-534.
35. Weindruch R. Retardation of aging by caloric restriction: studies in rodent and primates. Toxicol Pathol 1996; 24: 742-745.
36. Wyngaarden KE, Pauwels EKJ. Hormesis: are low doses of ionizing radiation harmful or beneficial? Eur. J. Nucl. Med. 1995; 22: 481-486.
