О. А. Громова Допустить к защите
| Вид материала | Диплом |
- Юрия Иосифовича Громова. Фестиваль-конкурс, 83.33kb.
- Г. Г. Исаев (гл редактор), Е. Е. Завьялова, Т. Ю. Громова, 4887.01kb.
- Тематическое и поурочное планирование по физике к учебнику С. В. Громова, Н. А. Родиной, 1532.4kb.
- Архангельский Государственный Технический Университет Институт экономики, финансов, 947.48kb.
- Я. И. Кузьминову Код абитуриента : заявление прошу допустить меня к участию в конкурс, 31.08kb.
- Кафедра Информационных Систем и Технологий. Сдана на проверку Допустить к защите 2007, 625.08kb.
- И. И. Ползунова Факультет руководящих работников и специалистов «Допустить к защите», 782.6kb.
- И. И. Ползунова Факультет руководящих работников и специалистов «Допустить к защите», 785.97kb.
- Г. Р. Латфуллин, О. Н. Громова Организационное поведение Авторский коллектив:, 4898.59kb.
- А. М. Горького Институт управления и предпринимательства Кафедра управления Формирование, 530.85kb.
Министерство образования и науки Российской Федерации
Ивановский государственный университет
Кафедра физиологии человека и животных
ДИПЛОМНАЯ РАБОТА
Тема:
Исследования микроэлементного состава в структурах головного мозга крыс, получавших пищевую добавку MgB6
Дипломник Аникина Анастасия Висльевна
Руководитель к.м.н., Л.Н. Катаева,
д.б.н., профессор каф. фармакологии ИГМА
О.А. Громова
Допустить к защите:
Зав. кафедрой к.б.н., доцент В.Н. Зарипов
«___»_____________ 2005 г.
Иваново
2005
ОГЛАВЛЕНИЕ
Аббревиатура
ВВЕДЕНИЕ………………………………………………………………………5
ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ ………………………………………………7
1.1. Современные представления минерального обмена………………7 1.2. Распределение микроэлементов в центральной нервной системе в
норме ………………………………………………………………….8
- Микроэлементный и макроэлементный состав головного мозга
и его влияние на физиологические функции нейронов …………9
- Изменение микроэлементного и макроэлементного состава
головного мозга при различных заболеваниях……………………12
- Витамины их действие на организм. Витамины группы B (Витамин B6)……………………………………………………….14
- Пищевая добавка Magne-B6 ……………………………………...16
ГЛАВА II. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ……………….17
- Цели и задачи исследования …………………………………….17
- Методика проведения эксперимента …………………………...18
- Характеристика исследуемых микроэлементов………………..20
- Магний……………………………………………………..21
- Фосфор……………………………………………………..25
- Цинк ……………………………………………………….26
- Кобальт ……………………………………………………28
- Магний……………………………………………………..21
- Методика исследования микроэлементного состава головного мозга белых крыс………………………………………………..29
- Методика статистической обработки результатов …………...31
ГЛАВА III. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ……………………………..33
- Распределение макро-микроэлементов в различных отделах головного мозга контрольных крыс……………………………..34
- Распределение макро- микроэлементов в различных отделах головного мозга крыс при внутрижелудочном 10-ти дневном введении MgB6…………………………………………………….40
- Сравнение содержания макро-микроэлементов в головном мозге контрольной и экспериментальной группы животных………...44
ГЛАВА IV. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ…………………………………47
ВЫВОДЫ ………………………………………………………………………51
ЛИТЕРАТУРА…………………………………………………………………...52
Аббревиатура
АТР – аденозинтрифосфат
БА – болезнь Альцгеймера
БП – болезнь Паркинсона
ГТ – гипоталамус
ДЦП – детский церебральный паралич
Мае – макроэлементы
МТОЗ – микроэлементозы
МЭ – микроэлементы
ОЛ – обонятельные луковицы
РР – раствор
ЦИЛДК – центральная извилина лобной доли коры
ЦНС – центральная нервная система
Со – кобальт
Mg – магний
Zn – цинк
Р – фосфор
MgB6 – пищевая добавка MAGNE – B6
СОД – супероксиддисмутора
ВВЕДЕНИЕ
Учение о минеральном обмене и микроэлементозах, заложенное в 20-е годы ХХ столетия русским ученым-биохимиком, философом, общественным деятелем В.И. Вернадским, а затем углублено и разработано А.Л. Виноградовым и Ковалевским, переживало неоднородные периоды своего развития. С начала 80-х интерес к проблеме М/Э в России стал ослабевать, в то время как за рубежом в это время начинается новый расцвет микроэлементологии.
Микроэлементы – уникальная группа химических элементов, существующих в диапазоне ионных концентраций 10-8 10-10 mol L-11 и входящих в состав подавляющего большинства кофакторов ферментов факторов транскрипции и ДНК обслуживающего аппарата. Ряд М/Э играет существенную роль в росте клетки, в обмене веществ. Их транспорт и накопление в различных клетках определены или в соответствии с функциональными требованиями компонентов клетки с синтетическим стимулом или патологически развивающимися механизмами проходимости. Поэтому даже умеренный дефицит или избыток М/Э в различных токсикологических моделях могут иметь длительные эффекты на жизненные процессы регуляции клеток. Микроэлементный состав может изменяться при различных патологических процессах в организме (инфаркт Миокарда, ишемическая болезнь сердца, при язвенной болезни, острой почечной недостаточности, циррозе печени (Печенникова Е.В., Вашкова В.В., Можаев Е.А.;1997)
Микроэлементный состав нейронов зависит от питания, от количества поступающих в организм витаминов, углеводов, минеральных солей (Райцес В.С., 1981). В наше время для нормализации макро- и микроэлементов, входящих в состав нейронов, широко используют различные пищевые добавки, содержащие витамины иМ/Э, например, такие как ревит, черника +С, кальцид, MgB6. Однако в доступной литературе отсутствуют сведения о влиянии этих пищевых добавок на микроэлементный состав нейронов головного мозга (Ноздрюхина Л.Р.,1997; Москалёв Ю.И.,1985)
Актуальность работы заключается в изучении влияния пищевой добавки MgB6 на микро- и макроэлементный состав тканей головного мозга крыс, выявление влияния высоких доз пищевой добавки на содержание ионов в нейронах головного мозга крыс. Согласно исследованиям Ю.Ф. Крылова (2001) и Э. Минделла (2000), присутствие Mg в пищевой добавке активирует ферменты, содержащие витамины гр. В. В связи с механизмом действия MgB6 широко используется при заболеваниях нервной системы. Литературные данные по этому вопросу отсутствуют.
Изучение влияния пищевой добавки MgB6 на содержание МаЭ и МЭ в нейронах головного мозга позволит оценить участие ее в функциональном состоянии нейронов.
В настоящее время в целях улучшения функционального состояния организма ученые рекомендуют использование различных пищевых добавок, среди которых особое значение придается MgB6, в которой сочетание витамина В6 и Mg при длительном применении улучшает работу различных систем организма. Однако окончательно не изучен механизм действия этой пищевой добавки, ее влияние на состояние ЦНС. Поэтому мы поставили перед собой цель исследовать изменение содержания микро- макроэлементов в нейронах различных отделов головного мозга.
ГЛАВА I. МАКРО- И МИКРОЭЛЕМЕНТЫ В ОРГАНИЗМЕ
1.1. Современные представления минерального обмена
Минеральный обмен – это совокупность процессов всасывания, усвоения, распределения, превращения и выделения из организма веществ, которые находятся в нем преимущественно в виде неорганических соединений (Громова О.А., Авдеенко Т.В., Андреев А. Г., 1997). Контроль за всей совокупностью обменных процессов, их направлением и скоростью проникания осуществляется тремя системами. Прежде всего, это нервная система, которая занимается обработкой информации, поступающей как от внутренних органов, так и от внешней среды. В соответствии с характером информации нервная система принимает решение и задает программу действий организму, целью которой является сохранение гомеостаза (Антонов А.Р., Ефремов А.В.1975).
Изучая потребность в одном М/Э следует учитывать наличие коррелятивных взаимоотношений как с М/Этк и др. пищевыми веществами (Скальный А.В. 2000).
Концентрирование элементов в живой природе видоспицифично и наследственно. Так пасленовые, лютиковые накапливают Li, плауны Al, морские водоросли J. Из макроэлементов Ca и Р у высших животных образуют фосфорнокислый кальций – основу костной ткани (Скальный А.В. 2000). Для Mg, К и Na характерна ионная форма существования, уравновешенная в основном анионами хлора, фосфата и карбоната. Mg и Fe широко представлены в составе хлорофилла и гемоглобина. Обмен ряда М/Э протекает энергично. Так у млекопитающих большие количества Са и Р выводятся из организма в процессе лактации (Кудрин А.В., Скальный А.В. 2001).
Но и в составе клеток отдельные элементы обмениваются достаточно интенсивно, что выражается в изменении их концентрации в субклеточных структурах клетки, а также активном переносе через мембраны. Характерной особенностью обмена минеральных элементов является, с одной стороны, взаимозаменяемость ряда из них, и с другой – антагонизм действия. Так, в ферментативных процессах, там где К+, NH4+, или Rb+ выступают как активаторы (например, при действии альдегиддегидрогеназы из дрожжей), Na+,Li+ или С3+ являются ингибиторами. В таких же отношениях находятся Mg2+ и Со2+, Mr2+ и Zn2+ и т.п. (Штульман Д.Р. Левин О.С.,2002).
1.2. Распределение микроэлементов в центральной нервной системе в норме
Реальная информация о влиянии МЭ на формирование патологии нервной системы и содержание МЭ в различных отделах ЦНС является необходимым условием профилактики дефициторных расстройств нервной системы и разработки новых подходов к фармакотерапии неврологической патологии, ассоциированной с МТОЗами (Кукес В.Г.1999; Centero F, Mora A 1998).
Распределение МЭ в разных структурах ЦНС неодинаково (Райцес, 1981). Кора больших полушарий лидирует в организме человека по содержанию большинства элементов (Авцын с соавт., 1990). Раздельное изучение серого и белого вещества головного мозга позволило установить, что в коре и подкорковых ядрах в связанном с лигандами состоянии избирательно накапливается Mg, Cu, Co, Ti, Cr, Mn, Mo, V, Zn. Сравнительно мало в коре головного мозга Si и Al (Goyer, 1995). Ножки мозга содержат меньше, чем другие образования ствола мозга Mn, Ti, Ag. Вместе с тем, в них обнаружено большое количество Cu. В белом веществе мозжечка отмечена высокая концентрация Cu, Mn, Ti и Ag. Оболочки головного мозга и его сосудистые сплетения характеризуются исключительно высоким содержанием Si и Al (Райцес, 1981). Содержание металлов в отдельных структурах мозга ассиметрично. Так левое полушарие головного мозга содержит больше Fe, Cu, Mn чем правое (Goyer et al., 1995).
Биохимическая асимметрия мозга, в том числе ассиметричное расположение МЭ, предположительно связаны с асимметрией функционального назначения больших полушарий. Пока неустановленны межполушарные различия в содержании Co, Rb, Zn, Cu, Ag и Cs.
Laffer (1995) при изучении срезов мозга больных, умерших от нейродистротивных заболеваний, показал, что при болезни Альцгеймера нейротоксичные МЭ Al, Fe, Sn накапливаются в коре, а при болезни Паркинсона – в подкорковых ядрах и мозжечке (Райцес, 1981).
Гипоталамус содержит меньше МЭ, чем подкорковые и стволовые структуры. Количество МЭ в передних отделах гипоталамуса выше, чем в задних (М. Anthony, 1995).
Большой интерес представляет изучение вопроса о форме пребывания МЭ в нервной ткани. Как показали исследования Войнар А.О.,1955; Белоусов Ю.Б.,2002 и др. большинство МЭ содержатся в мозговой ткани, в связанном состоянии с белками, биополимерами, которые не проникают через полупроницаемую мембрану.
Таким образом, МЭ в ЦНС находятся в связанном состоянии с белками и биополимерами. Их распределение не равномерно, в левом полушарии содержание МЭ больше, чем в правом.
1.3. Микроэлементный и макроэлементный состав головного мозга
и его влияние на физиологические функции нейронов
Нервная ткань с физиологической точки зрения обладает уникальными свойствами, которые определяют специфику функций МЭ в ЦНС:
- нервы содержат очень небольшой компонент стволовых клеток, вследствие чего регенераторные и восстановительные способности нейронов низки (В.В. Малайцев, И.М. Богданова, Р.Т. Сухих, 2002);
- жизненный цикл нейронов стабилен и иногда равен продолжительности жизни индивидуума, в силу чего уровень аноптотической активности нервной ткани мал и требует значительных антиоксидантных ресурсов (Морозов С.Г.,2001);
- энергетические пластические процессы в нервной ткани протекают очень интенсивно, что требует развитой системы васкуляризации, эссенциальных микронутриентов, МЭ и кислорода (В.Г. Ребров, О.А. Громова, 2003);
- высокая чувствительность мозга к различным токсическим продуктам экзогенного и эндогенного происхождения в процессе эволюции потребовала формирование высокоорганизованных структур РЭБ, ограничивающего ЦНС от прямого поступления большинства гидрофильных токсических продуктов и лекарственных препаратов ;
- нервная ткань на 96 – 98% состоит из воды, свойства которой определяют процессы поддерживания объема нейронов, осмолярных сдвигов и транспорта, различных биологически активных веществ (Одинак М.М.,2002; Оленев С.Н.,1995).
В связи с вышеуказанными свойствами, можно выделить следующие функции МЭ в ЦНС (по О.А. Громовой и А.В. Кудрину, 2001):
1) МЭ участвуют в формировании каталитических центров и в стабилизации регуляторных сайтов в составе более чем 1000 различных ферментов нервной и глиольной ткани, что обеспечивает поддержание разнообразных энергетических (медь, железо в составе цитохромоксидазы, цитохромов и др., марганец в составе пируваткиназы и т.д.), пластических процессов (марганец и магний в рибосомальном синтезе нейроспецифических белков и миелиновых липопротеидных комплексов).
2) Ряд эссенциальных МЭ – цинк, железо, марганец и медь – участвуют в процессах синтеза нейромедиаторов: котехоламинов и их дегродации, нейропептидов (цинк в синтезе и внутримолекулярной стабилизации эндорфинов, непотоламических факторов, вещества Р).
3) МЭ вовлечены в различные антиоксидантные функции нейронов и глиальных элементов: селеноцистин участвует в формировании активных центров глутангион-пероксидазы и миоредоксин – редуктазы (до 50 – 70% активностей в глии), медь, цинк и марганец формируют металл – содержание кластеры в каталитическом центре СОД, железо в составе каталазы и пероксидазы.
4) МЭ с антиоксидантными свойствами участвуют в процессе стбилизации и защиты аспартотных и глициновых рецепторов от повреждения свободными радикалами, токсическими веществами и лекарствами.
5) МЭ стабилизируют аппарат нейрофиламентов и цитоскелета нейронов, что способствует поддержанию пластического обмена в нервной ткани, онто- и ретроградному перемещению веществ и органелл по оси аксонов (цинк, медь, селен).
6) Металлы участвуют в регуляции синтеза мозго-специфического металлотсонина З, который выполняет функцию депонирования внутриклеточного цинка, детоксикации и секвестрации тяжелых металлов.
7) Внутриклеточная и межклеточная коммуникативная и сигнальная функции МЭ и МаЭ определяются ролью некоторых ионов (Zn2+, Mn2+, Mg2+, Co2+) в модуляции активности тирозинкиназ (внутриклеточное проведение сигналов в процессах жизнедеятельности и апоптоза нейронов), а также высвобождением металлов в синаптическую цепь определенным эффектом на транссинаптическое проведение нервных потенциалов.
8) МЭ участвуют в организации и преобразовании водно-кристаллической решетки и оптимизации осмолярных процессов в нервной ткани (Орджонакидзе З.Г., Громова О.А.,2001).
1.4. Изменение микроэлементного и макроэлементного состава головного мозга при различных заболеваниях
МЭ и МаЭ представляют собой взаимосвязанную систему, возникающую в результате конвергенции нейроэндокринных и иммунологических механизмов. МЭ и МаЭ связаны друг с другом синергичными или антагонистическими взаимоотношениями: одностронними, двусторонними, трехсторонними. Поэтому дисбаланс одного МЭ может привести к дисбалансу нескольких МЭ (Ноздрюхина Л.Р.,1985).
При различных нейрофизиологических заболеваниях происходит изменение МЭ состава головного мозга. Следует выделить следующие основные заболевания, при которых происходит сдвиг концентрации МЭ и МаЭ от нормы:
1) Болезнь Альцгеймера – была описана впервые в 1907 году немецким врачом А. Alzheimerom – это первичное нейродигенеративное заболевание мозга не уточненной этиологии, протекающее по типу простой апатичной формы старческого слабоумия. При этом характерна диффузная атрофия мозга, более выраженная в теменно-височной области (Ершов Ю.А.,Воротова Е.М.,1981).
При БА существенно увеличивается содержание алюминия, марганца, скандия, кремния в корковых и подкорковых областях и уменьшается содержание селена, цинка в мозговой ткани этих областей. Увеличивается вероятность развития БА, если происходит неполное насыщение трансферина железом или его сниженный аффинитет к железу, что приводит к связыванию 20 трансферрина с другими металлами (алюминием) и их транспорту через ГЭБ (Пальчик А.Б.,2002).
2) Болезнь Паркинсона – это заболевание описал у себя в 1817 году английский врач J. Parcinson. БП сочетает в себе акинезию или гипокинезию, мышечную ригидность и старческий тремор. В основе заболевания лежит мидиаторный дисбаланс, недостаток дофамина и относительный избыток ацетилхолина (Гусев Е.И., Скворцова В.И., 1999).При БП происходит увеличение ионов марганца (Frederickson C.J.,1983) и уменьшение ионов селена, цинка, меди, кобальта, а также увеличение ионов алюминия, железа, олова (Одинак М.М.,2002; Артемьв Д.В.,2000).
3) ДЦП – описал впервые это заболевание в 1853 году английский врач W. Little. ДЦП – это не прогрессирующие последствия повреждения структур мозга, проявляющиеся главным образом нарушением двигательных функций и интеллектуального развития.
По А.Б. Пальчику (2000) ДЦП – это нарушение двигательной функции и позы, обусловленное спастическим дефектом или нарушением незрелого мозга. При ДЦП происходит увеличение содержания ионов кобальта, меди, никеля в мозге (особенно в затылочной доле, мозжечке, зрительном бугре) и уменьшение их концентрации во внутренних органах, при повышении содержания ионов кальция и натрия (Селоври,1991). Кроме этого, у детей, страдающих ДЦП, выявлен дефицит ионов цинка и селена в крови, который сопровождается патологически высоким уровнем ионов меди и марганца (Подколозин А.А., Донцов В.И.,1994).
4) Минимальная мозговая дисфункция – состояние, проявляющееся расстройством поведения и обучения в отсутствии выраженных интеллектуальных нарушений и возникающее вследствие нарушения созревания основных регулирующих систем мозга (Д.Р. Штульман, О.С. Левин, 2002).
5) При шизофрении происходит повышение содержания Al, Mg, скандия, кремния в корковых и подкорковых областях и уменьшение содержания селена, цинка в мозговой ткани этих областей, также увеличено содержание меди (Sandstead H.H. 2000).
6) При ишемии увеличена концентрация кальция, в связи с этим происходит вазоконстрикция и инициация апоптоза и снижена концентрация магния, селена, цинка. При диффузной хронической церебральной ишемии кобальт совместно с АТФ оказывает антигипоксическое и нейропроникторное действие (В.Р. Ребров, О.А. Громова, 2003).
7) При олигофрении некоторыми исследователями было отмечено повышенное содержание меди (Протасова Н.А.,1998).
Таким образом, можно сказать, что практически при всех выше описанных заболеваниях наблюдается дефицит цинка или железа, но иногда может наблюдаться избыток железа, что может быть связано с избыточным содержанием антагонистов Fe.
1.5. Витамины, их действие на организм.
Витамины группы В (витамин В6)
Витамины являются незаменимыми компонентами жизни. Большая их часть не производится самим организмом человека. Витамины представляют собой сложные органические соединения, многие из которых входят составной частью в молекулы ридиоферментов – катализаторов биохимических реакций. Они используются для регуляции метаболических процессов и необходимы организму в определенных количествах. При недостатке в рационе витаминов происходят сбои в работе различных систем, а постоянная и временная их нехватка (гиповитаминоз) ведет к развитию серьезных заболеваний. Общим характерным свойством водорастворимых витаминов является то, что они поступают организм в виде водных растворов, включаются в процессы обмена и, как правило, не накапливаются в организме; излишки их легко выводятся с мочой и потом. И можно использовать достаточно долго, без перерывов (Машковский М.Д.,2005).
Витамины гр. В. Тиамин (В1), рибофлавин (В2), пантотеновая кислота (В3), пиридоксин (В6), фолиевая кислота (Вс), цианкобаламин (В12), пангамовая кислота (В15) – входят в состав активной части ферментов, участвующих в образовании энергии, улучшают обеспечение тканей кислородом, участвуют в окислительных реакциях, в белковом и минеральном обменах, в синтезе стероидных гормонов, улучшают работу сердечно-сосудистой и эндокринной систем; необходимы для нормальной работы нервной системы; улучшают зрение; повышают работоспособность и физическую выносливость (Машковский, 2005).
Витамин В6 (пиридоксин) был открыт Г. Дьерди в 1934 г. и через четыре года выделен в кристаллическом состоянии.
Витамин В6 синтезируется растительными и микробными клетками. Наибольшее количество его в печени, яйцах, дрожжах.
Суточная потребность в витамине 3 – 4 мг. Витамин В6 играет большую роль в обмене веществ.
1) Белковый обмен. Пиридоксин соединяется с фосфорной кислотой и входит в состав ферментов.
2) Явления со стороны ЦНС при состояниях В6 витаминной недостаточности (затруднения при ходьбе, судороги) по-видимому связаны с участием этого витамина в глюталиновом обмене.
3) Жировой обмен: окисление жиров, их синтезе и др. процессах. Длительный недостаток витамина В6 в пище способствует развитию жировой инфильтрации печени.
Применение витамина В6 способствует сохранению гликогена, меньшему накоплению жира и холестерина. Признаками авитаминоза В6 являются кожные заболевания (эритеми), нарушения ЦНС и кроветворения. Пиридоксин применяют при токсикозах у беременных, атеросклерозе, нервных и кожных заболеваниях (Кудрин А.В., Громова О.А.,2000).
В6-авитаминоз имеет клиническую картину. Больные либо раздражительны, либо заторможены и сонливы. Аппетит понижается, а потом совсем исчезает, повышается тошнота. Профилактика В6-авитаминозов состоит в назначении пиридоксина (Подколозин А.А. Гуревич К.Г.,2002).Возможны симптомы избыточного приема витамина В6 – беспокойство во сне и слишком яркие образы сновидений (Подколозин А.А. Гуревич К.Г.,2002).
1.6. Пищевая добавка Magne – B6
среди пищевых добавок широко используют препарат MgB6. В состав этого препарата входит витамин В6 и Mg в оптимальном сочетании: ампула с 10 мл раствора содержит 250 мг магния лактата и 62,5 мг пиридоксина гидрохлорида (или витамина В6). Согласно исследованиям Ю.Ф. Крылова (2001) и Эрл Миндела (2000), присутствие Mg в пищевой добавке активизирует ферменты, содержание витамины группы В. В связи с механизмом действия MgB6 широко используется при заболеваниях нервной системы.
MgB6 уменьшает возбудимость нейронов и замедляет нейромышечную передачу (ионы Mg), нормализует многие ферментативные реакции (Ю.Ф. Крылов, 2001). Mg уменьшает возбудимость нейронов, снижает нервномышечную проводимость (Нери Д.,2000). Витамин В6 участвует в обмене веществ в тканях нервной системы. Недостаток его сопровождается повышением возбудимости коры больших полушарий головного мозга. В лечебных целях витамин В6 применяется при функциональных нарушениях ЦНС, при различных токсикозах, кишечных инфекциях, кожных заболеваниях (Громова О.А., Андреев А.В.,2000).
ГЛАВА II. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Цели и задачи исследования
Минеральные вещества, наряду с витаминами и другими биологически активными веществами, являются обязательными элементами, обеспечивающими нормальное течение процессов жизнедеятельности человека и животных (Ю.Ф. Крылов, 2001). Экспериментальные исследования В.С. Райцеса (1981), Подымов В.К.(1982) клинические работы M. Anthoni (1995) и R.A. Goyer (1995), показали, что без гарантированной нормализации баланса МЭ и МаЭ другие действия недостаточны или безуспешны, т.к. деформированный минеральный обмен не только вносит свой вклад в патогенез нервных заболеваний, но и изменяет фармакокинетическое действие вазоактивных препаратов, неоотонов, нейропротекторов и других лекарств.
Как показали исследования (Селоври А.1991) на функциональное состояние нейронов оказывает влияние принимаемая пища, поэтому скудный пищевой рацион изменяет состав нейронов, их функции. Однако в литературе этот вопрос изучен недостаточно. В связи с этим целью нашей работы является изучение влияния пищевой добавки MgB6 на микроэлементный состав головного мозга крыс.
В соответствии с этим были сформулированы следующие задачи:
1) Определить содержание МЭ в структурах головного мозга (ГТ; ОЛ; ЦИЛДК контрольных групп животных).
2) Исследовать микроэлементный состав головного мозга крыс, получивших пищевую добавку MgB6.
3) Выявить действие пищевой добавки MgB6 на ионный состав различных отделов головного мозга.
2.2 Методика проведения эксперимента
Эксперименты проведены на 18 беспородных крысах средней массой 180 2,6 г, которые содержались в клетках по 6 особей в каждой на стандартном рационе при свободном доступе к воде. Схема эксперимента представлена на рисунке 1.
Все животные были разделены на 3 группы:
1 гр. – интактные животные.
2 гр. – животные, которым внутрижелудочно вводили воду дистиллированную в течении 10 дней из расчета 5 мл/кг массы ежедневно.
3 гр. – экспериментальные животные, которые в течение 10 дней получали внутрижелудочно MgB6 из расчета 5 мл/кг массы ежедневно.
Через 12 часов после последнего введения MgB6 соответственно животные получали нембуталовый наркоз и подвергались декапитации. Извлекали головной мозг белых крыс. Его помещали в чашечки Петри, после чего брали срезы кусочков ткани мозга толщиной 1 – 1,5 мм из трех отделов головного мозга: центральной извилины лобной доли коры, гипоталамуса, обонятельных луковиц. Эти образцы сохраняли в промаркированных пакетах и замораживали при температуре -18 -20 С до проведения масс-спектрометрического исследования.
Белые крысы n = 18


1 гр. – n = 6
Интактные животные
2 гр. – n = 6
Контрольные животные
введение дистиллированной воды в дозе 5 мл/кг массы тела
3 гр. – n = 6
Экспериментальные животные
введение MgB6 в дозе 5 мл/кг массы тела


Введение нембутала (0,003 мг на 1 гр массы тела крысы)
с последующей декапитацией
Выделение структур головного мозга

ЦИЛДК
ГТ
ОЛ
Исследование микроэлементов
Mg
Р
Со
Zn
Условные обозначения:
ЦИЛДК – центральная извилина лобной доли коры
ГТ – гипоталамус
ОБ – обонятельные луковицы
Рис 1. Схема эксперимента.
Влияние пищевой добавки MgB6 на микроэлементный состав
головного мозга крыс
С помощью этого метода определяли содержание фосфора, магния, цинка, кобальта в тканях головного мозга.
Полученные результаты подвергались статистической обработке с целью установления достоверности наблюдаемых различий.
2.3. Характеристика исследуемых макро-и микроэлементов
Среди природных соединений важное место в нормальном жизнеобеспечении организма занимают минеральные компоненты пищи, которые играют существенную роль в правильном функционировании всех систем и органов. Эти компоненты способствуют усвоению аминокислот и витаминов, активизируют полезные свойства, входят в состав жидкостей тела, крови, необходимы для нормальной работы нервов. Подобно витаминам, минеральные соединения выступают в роли коферментов. В организме человека должен поддерживаться соответствующий химический баланс минеральных веществ магния, кальция и фосфора. При дефиците хотя бы одного элемента система может выйти из равновесия, что негативно скажется на состоянии организма. По уровню содержания в организме человека необходимые минеральные вещества подразделяются на две большие группы макроэлементы и микроэлементы.
Макроэлементы содержатся в организме в достаточном количестве. Они являются строительным материалом, используются в основных биологохимических процессах. Их уровень должен поддерживаться постоянным поступлением их с питанием (Челышев Ю.А.,2001). К макроэлементам относятся: магний (Mg), фосфор (Р).
2.2.1. Магний
Содержание Mg в теле животного составляет 0,05% живой массы. Из этого количества 50% приходится на скелет, 40% - на клетки мясных тканей и лишь 1% - на внеклеточные жидкости (Антонов А.Р., Ефремов А.В.,1975).
Таблица
Содержание Mg в клетках некоторых животных и человека (в расчете на обезжиренное вещество, мг %)
| Вид | После рождения | Взрослые |
| Человек | 26,0 | 45,5 |
| Свинья | 38,0 | 45,0 |
| Мышь | 33,6 | - |
| Кошка | 26,1 | 45,0 |
| Крыса | 25,1 | 40,0 |
| Кролик | 23,4 | 50,0 |
В плазме крови концентрация Mg составляет от 0,7 до 1 ммоль/л, из них до 65% приходится на ионы и 35% на комплексы с АТФ. Среднесуточное поступление Mg с пищей должно быть 300 – 400 мг. Mg2+, поступающий с пищей, всасывается в тонкой кишке. Процессы его всасывания зависят от количества поступающего Mg, одновременности поступления жира, тормозятся Са и фосфатом (Скальный А.В.,1998). Mg чрезвычайно важен для нормального функционирования нервной системы. Одним из важнейших эффекторов Mg является торможение процессов возбуждения в коре головного мозга и связанная с этим реализация наркотического, снотворного, седативного, анальгетического и противососудистого эффектов. Большинство эффектов характеризует влияние фармакологических средств на состав, распределение Mg, активность Mg2+, Са2+ АТФ в различных структурах спинного и головного мозга. Была доказана роль Mg в качестве модулятора эффектов, возбуждающих аминокислот в ЦНС.
Mg своего рода природный изоляционный материал на пути проведения нервного импульса. Исследования De Block (1999) показало, что синтез ацетилхолина в головном мозге возможен только при присутствии ионов Mg. Кора голоного мозга обладает выраженной реактивностью, поэтому расстройства ВНД сопровождаются не только нарушениями энергетического обмена, но и нарушениями трансмембранного транспорта ионов в первую очередь Mg (Чекман, 1992; De Block, 1999; Goyew R.A. 1997) на большом экспериментальном материале показал зависимость выраженности элементарной готовности в коре головного мозга от уровня ионов Mg.
Регуляция гомеостаза Mg в организме. Дефицит или избыток его в организме чаще всего проявляется нарушением нервно-мышечной возбудимостью. Экспериментально показано, что уменьшение содержания в клетках Mg2+ ведет к истощению внутриклеточных запасов К и поступлению в клетку Na и Са2+, что сопровождается нарушением функции клеток.
Гипомагниплазмия, регистрируемая при уменьшении уровня Mg2+ в плазме крови ниже 0,5 ммоль/л может не отражать общего содержания Mg2+ в организме. В исследованиях (Ancsin R.,1998) показано, что дефицит цитозального Mg в нейронах является наиболее ранним и точным маркером апоптоза нервных тканей. Дефицит Mg повышает чувствительность организма к нейроинфекции (Demmel V., 1980).При дефиците Mg в организме бактериальный, токсический шок происходит более выражено и микроорганизмы более активно продуцируют B-лактозу, определяющую устойчивость к воздействию антибиотиков пенициллинового ряда. Введение препаратов Mg постоянно понижает риск нейротоксичности. Дефицит Mg в организме обычно является для людей подвергающихся хроническим стрессам, страдающих депрессией.
Препараты Mg и повышение дозы витамина В6 уже более 20 лет составляют основу фармакологического протокола лечения детского аутизма (Frey W.N.,1997). Исследования (Sensi S.L.,2000) показали, что длительно существующий дефицит Mg особенно на фоне эссенциальной гипертонии, является достоверным фактором риска возникновения острых нарушений мозгового кровотока. Кровеносные сосуды, снабжающие ткани мозга чрезвычайно чувствительны к Mg балансу. При понижении уровня Mg повышается тонус мозговых сосудов, что ведет к ишемическому повреждению. Если в организм мало поступает Mg с кормом, то недостающее количество его восполняется за счет костей скелета. При резком понижении Mg у животных тяжелое заболевание – тетония (замедляется рост, повышается возбудимость). Длительный недостаток Mg может привести к возникновению сильных судорог. Клинически больного при дефиците Mg можно выявить специфичные нервно-мышечные знаки, связанные с повышенной возбудимостью нервных и мышечных клеток:
- покалывание в области стоп,
- гиперактивность: человек не может долго находиться на одном месте,
- мышечные судороги,
- сердечно-сосудистые нарушения,
- пищеварительные нарушения (поносы, запоры).
- дыхательные расстройства (учащение дыхательного ритма),
- расстройства мочеиспускания (боли в области мочевого пузыря),
- сексуальные расстройства.
Гипермагниплазмия. Избыток Mg2+ в организме может наблюдаться прежде всего при уменьшении выделения его почками (острая и хроническая недостаточность почек).
Гипермагниплазмия регулируется при повышении концентрации Mg2+ в плазме крови более 0,78 – 1 ммоль/л. При концентрации Mg2+ в плазме крови от 1,8 до 2,5 ммоль/л и более наблюдаются тошнота, рвота, возникает брадикардия, появляется чувство жажды и жара. При повышенной концентрации его до 2,5 – 3,5 ммоль/л – большая сонливость, сухожильные рефлексы снижены, возникают нарушения формирования импульса возбуждения и его проведения по миокарду. При концентрации Mg2+ в плазме крови до 6 ммоль/л наступает остановка дыхания, кома. При концентрации Mg2+ в плазме крови 7,5 – 10 ммоль/л может наблюдаться остановка сердца (Chond J.Y., 1999).
Острый инфаркт миокарда – заболевание, имеющее тенденцию к постоянному прогрессированию, в связи с чем любые вопросы патогенеза при данной патологии являются актуальными. Конечно, ни в коем случае нельзя все свести только к нарушениям обмена катионов, не учитывая таких важных факторов, как ишемия миокарда, изменения активности различных отделов вегетативной нервной системы.
У больных с острым инфарктом миокарда большинство исследователей отмечается гиперкалиемия с последующей нормализацией к концу первой недели заболевания (ЕлиновН.П.,2003).Одновременно наблюдается усиление экскреции К с мочой в первые дни заболевания .
Анализируя имеющиеся данные об обмене двухвалентного катиона Mg при остром инфаркте миокарда, как менее изученного по сравнению с Са, все исследователи единодушны в своем мнении, что в первые 2 – 3 суток после развития острого инфаркта миокарда у больных отмечается понижение концентрации Mg в плазме крови (Frey W.N., Lui Y.,1997).
Исследователи считают, что гипомагниемия при инфаркте миокарда может служить причиной мгновенной смерти, т.к. продуктирует резко выраженный спазм коронарных артерий . Английские ученые сделали вывод, что относительный дефицит Mg в питьевой воде во много раз повышает опасность смерти больных после инфаркта миокарда (Скальный А.В.,1989).
По данным национального исследовательского совета США взрослым нужно 250 – 350 мг Mg ежедневно, а беременным и кормящим женщинам от 300 до 355 мг(Гусев Е.И.,Скворцова В.И.,1999).
Mg помогает в борьбе с депрессией, укрепляет сердечно-сосудистую систему, предупреждает сердечный приступ, поддерживает зубы здоровыми, помогает предупредить отложение Са, камни в почках и желчном пузыре; в сочетании с Са действует как естественный транквилизатор.
Источниками Mg являются:
- необработанные зерновые,
- миндаль,
- орехи,
- семена,
- темно-зеленые овощи,
- бананы.
2.2.2. Фосфор
У животных и человека в костях находится до 90% Р, в мышцах до 10%, а в нервной ткани около 1%. В организме он встречается в виде неорганических и органических соединений.
В мышцах, печени, мозге и других органах фосфор содержится в виде фосфатидов, фосфорных эфиров. Фосфор принимает участие в мышечных сокращениях, построении нервной и костной ткани.
Фосфорные соли калия и натрия участвуют создании буферности крови. Нормальное усвоение фосфора может осуществляться лишь при наличии витамина Д.
При уменьшении Р у животных понижается аппетит, замедляется рост, появляется хромота, телята рождаются ослабленными или мертвыми.
Часть фосфора, необходимого организму, может быть пополнена за счет овощей и фруктов, содержащих его в значительном количестве (щавель, фасоль, морковь) (Книжников В.Н., 1993).
Рахит и остеомаллуия представляют собой истинные расстройства фосфорного обмена в том случае, когда концентрация фосфатов кальция в жидкости, омывающей костную ткань, падает ниже критической величины. Понижение концентрации сывороточного Р и соответственно уменьшение содержания соединений, в образовании которых принимает участие Са и Р, связанное с возрастанием уровня сывороточного Са, препятствует нормальному образованию центров костеобразования костной ткани.
Избыток Р в кормах нежелателен. У крыс при добавлении к рациону с нормальным содержанием Р еще 1% Р отмечаются тяжелые физические повреждения (например, конечных канальцев) Шейбок М.П.,2000.
Концентрация в организме микроэлементов определяется тысячными и миллионными долями грамма, но без их участия не могут происходить важные биологические процессы. С их помощью поддерживается работа ферментативных систем, регулируется температура тела, усиливается мышечный тонус, регулируется передача нервного импульса, снимаются депрессии, реализуется работа эндокринной системы, укрепляется структура клеток и тканей.
К микроэлементам относятся: цинк (Zn), кобальт (Со).
2.2.3. Цинк
Цинк – эссенциальный микроэлемент, который требуется для функционирования более 500 различных белков. Электронная конфигурация цинка позволяет ему участвовать в самых разнообразных биохимических процессах. Цинк является важным ингибитором апоптоза в различных клеточных системах (эпитемиальная, эндотемиольная) (Тутельян В.Я.,2001).Цинк обладает способностью защищать эндотелий сосудов в процессах атеросклероза и сосудистой ишемии. Вместе с ним, в некоторых других типах клеток Zn является стимулятором апоптоза (Лаврова А.Е.,2000). Zn играет роль в многочисленных аспектах жизни клеток и существует много различных мнений на котором действует Zn.
Содержание Zn в ткани серого вещества мозга от 150 – 200 мк моль (Зильберштейн Х.И.,1971) в то время как в терминальных отростках нейронов концентрация Zn в 2,5 – 3 раза выше в присутствии его вертикальной фракции (Frederickson, 1983) концентрация Zn в веществе мозга превысилась. Концентрацию других двухвалентных металлов составляет 10 мкг на 1 г сырой ткани мозга. Среди мозговых структур max концентрациями Zn характеризуются гиппокомп, миндалевидное тело и передняя доля гипофиза (Demmel, 1980; Tokeda, 2000). Известно, что круговые волокна гиппокампа способны высвобождать Zn в повышенных количествах и активизировать GABA рецепторы, что может играть роль в формировании очагов в височной доле. Недостаточность Zn в периоде развития мозга приводит к уменьшению объема мозга от общего числа нервных клеток, в которых изменяется ядерно-цитоплазматическое соотношение Zn, что указывает на изменение клеточного деления в период формирования крупных нейронов (Anthony, 1995). Возможная роль Zn в развитии апоптоза в мозге остается слабоисследованной (Линьков В.В.,2000) показал, что ингибитор плазмогена подавляет Zn зависимый аноитоз нейронов. Интересно, что Ме способствует стабилизации гематоэнцефалического барьера, при интоксикации тяжелых Ме: Pb, Cd, Hg тем самым препятствуя их апоптоническому эффекту, т.е. Zn может быть антагонистом тяжелых металлов в развитии смерти и может быть использован, как профилактическое средство в группах риска. В неврологической практике дефицит Zn встречается значительно чаще чем его избыток. Мобилизация Zn происходит за счет перераспределения его из других органов, особенно печени, которая является депо микроэлементов. Zn в больших кол-ох усиливает обмен веществ, понижает энергетические и окислительно-восстановительные процессы (Яхно Н.Н., Штульман Д.В.,2001).
Некоторые элементы могут усиливать действие Zn или снижать. В крови беременных количество Zn и Cu возрастает, что свидетельствует об их низкой функциональной связи (Романаускайте М.Б., 1994). Zn совместно с Cu и Mn оказывает положительное влияние на рост, развитие и размножение, поэтому недостаток его в кормах вызывает замедление роста и истощение животных, выпадение волос. Все эти признаки исчезают при подкормке животных оптимальными дозами солей Zn. В крови содержание Zn в среднем 700 млг %. Биологическая роль Zn определяется активным действием на процессы кроветворения, обмен углеводов, белков, жиров. Zn способен в 6 раз продлевать действие инсулина, снижать уровень сахара в крови больного диабетом (Войнар, 1953). Во время различных заболеваний (инфекционных) в кровь поступает Zn больше, чем обычно. Показано, что введение сульфата Zn способствовало более быстрому заживлению ран.
2.2.4. Кобальт
Со важный микроэлемент. Является кофактором витамина В12 (витамин В12 входит в состав S оденозинмеелионин В12 меенилтрансферазы), которая участвует в процессе метилирования ДНК и липидов, входящих в состав миелинового вещества. Потребность человека в Со составляет 3 мг/м в день, регулярное употребление Со в дозах превышающих 20 мг/кг, вызывает риск развития кардиомиопатии. Со участвует в процессах кроветворения регенерации продукции тироидных гормонов и биосинтеза миелине (Авцын с соавт., 1991). Со стимулирует лейкопоэз и продукцию ФИО- (Standstead H.H, 2000). Нейтрализует in vivo оксид азота гиперпродукция, которого при сепсисе вызывает шок. С одной стороны Со может стабилизировать разнообразные рецепторы, в частности Со нейтрализует адрено-, норадрено-литические эффекты (Auntony, 1995) в организме больных Na, K, Fe, Cu (Ершов Ю.А., 1981).
Со повышает защитные силы организма при инфекционных заболеваниях, а у людей страдающих спазмами желудочно-кишечного тракта, улучшает моторную деятельность, способствует лучшему кровоснабжению сердечной мышцы. Со способствует росту организма (детского), поэтому в материнском молоке его находится от 14 до 132 мкг %. В отличии от Cu Со не может накапливаться в больших количествах в организме животного и поэтому требуется его регулярное поступление с кормом. Выделяется Со в основном с фекалиями 30 – 60% и незначительно с мочой (Л.Р. Ноздрюхин, 1977).
Комплекс Со с АТФ оказывает нейропротекснорное действие при диффузной хронической церебральной анемии в экспериментальной модели на кроликах (Соловьёв М.М.,1997). С другой стороны, Со при поступлении в цитоплазму нейронов активизирует фактор, индуцирующий гипоксию 1 (HDF-1). Данный транскрипционный фактор играет значительную роль в процессе антистрессорной защите мозга, предупреждение анонтора и в механизмах клеточного цикла и роста нейронов (Завошили И.А.,1996). В эксперименте на мышах отмечено, что при избыточном введении витамина В12, содержащего 4% Со по весу, происходит не только накопление Со, но и перераспределение других металлов в мозговой ткани, что подтверждает принцип взаимодействия макро и микроэлементов . Наряду с дефицитом Со у больных имеется дефицит Са, Mg, Se и избыток содержания.
2.4. Методика исследования микроэлементного состава
головного мозга белых крыс
Для исследовании микроэлементного состава головного мозга был использован аппарат для хроматомасс спектрометрической диагностики, который состоит из хромато масс спектрометра НКВ – 20 Si (Швеция), системы обработки данных LKD 2130 (Швеция), содержащий компьютер PDP, дисплей (Tekformix) и графикостроитель (Verstaben), а также обработки биопроб, устройства для термообработки и ввода проб собственного изготовления. Мон-спектральный анализ с предварительным хромаграфическим разделением соединений и обработкой результатов на ЭВМ обеспечивает достоверную идентификацию индивидуальных компонентов, которые достигаются как четким разделением анализируемых веществ, так и получением однозначной характеристики каждого из них. Преимущества этого метода характеризуются повышенной чувствительностью и одновременного получения необходимой информации о структуре компонентов и позволяет усиленно проводить количественное определение несмотря на то, что делектирующее устройство обладает повышенной пороговой чувствительностью 0,05 – 5 кг, надежно зафиксировать необходимые соединения с высокой точностью путем ввода в прибор малых биопроб затруднено. Прямой ввод биопроб в хромато-масс спектрометр не всегда целесообразен из-за низкой концентрации определенных компонентов, присутствия легко разлагающихся веществ загрязнение газопромагтофической колонки летучим остатком, следовательно необходимо отделять определенные летучие соединения от биосубстратов. Извлечение анализируемых проб из концентратора с сорбентом проводят термической десорбцией концентрированных органических веществ при 250 – 300 С охлажденным жидким азотом в оптимальном капилляре. При последующем нагревании с помощью источника тока. Б 5-21 проба с током носителя поступала в хроматографическую колонку для разделения веществ. Разделение проводили на стеклянной капиллярной колонке с подвижной жирной фазой SЕ – 30 размером 0,3 мм х 50 м в изотермическом режиме в течении 5 мин. и последующим программированием нагрева со скоростью 5 с (мин до 150).
Пройдя газохроматографическую колонку, разделенные индивидуальные компоненты поступают в масс спектрометр, в нем для каждого из веществ образуется комплекс ионов с различными массами. При сопоставлении с размерами физико-химическими параметрами веществ можно сделать вывод, что масс-спектрометр является строго специфической характеристикой соединений. Такой метод позволяет за короткое время получить значительный объем данных, характеризующий исследуемую биопробу и предоставлять их в виде графиков и таблиц.
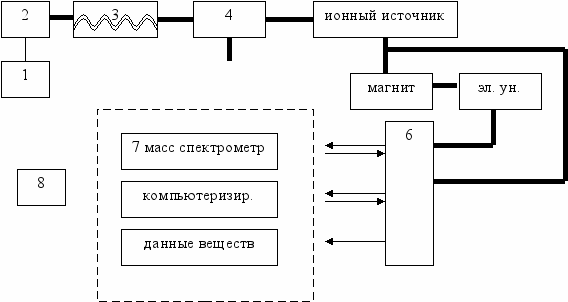
Схема строения хроматомасс-спектрометра
Условные обозначения:
1 – блок ввода и обработки биопроб
2 – устройство для термодесорбции
3 – газовый хроматограф
4 – молекулярный сепаратор
5 – масс-спектрометр
6 – ЭВМ
7 – дисплей
8 – графопостроитель
2.5. Методика статистической обработки результатов
Статистическую обработку результатов исследования проводили с помощью Т-критерия Стьюдента. Закон Т-распределения служит основой так называемой малой выборки, которая характеризует распределение выборочных средних в нормально распределяющейся совокупности в зависимости от объема выборки. Т-распределение зависит только от числа степеней свободы. К = n – 1, при чем с увеличением объема выборки, Т-распределение быстро приближается к нормальному с параметрами = 1 и = 1 и уже при n 30 не отличается от него.
Т-распределение симметрично и отражает специфику распределения средней арифметической (
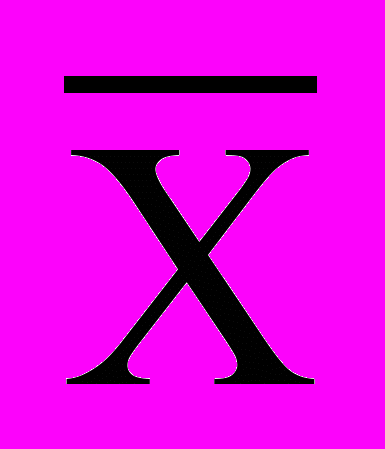 ) в случае малой выборки в зависимости от ее объема (n). Для выборок, объем которых превышает 30 единиц, величина Т распределения зависит от числа наблюдений. Если же n 30, характер Т распределения составлена специальная таблица (см. табл. 5 приложений Т.Ф. Лакин, 1990), в которой содержатся критические точки (tst) для разных уровней значимости L и числа степеней свободы К.
) в случае малой выборки в зависимости от ее объема (n). Для выборок, объем которых превышает 30 единиц, величина Т распределения зависит от числа наблюдений. Если же n 30, характер Т распределения составлена специальная таблица (см. табл. 5 приложений Т.Ф. Лакин, 1990), в которой содержатся критические точки (tst) для разных уровней значимости L и числа степеней свободы К.Для определения достоверности различий между показателями микроэлементов опытной и контрольной групп вычисляли следующие величины:
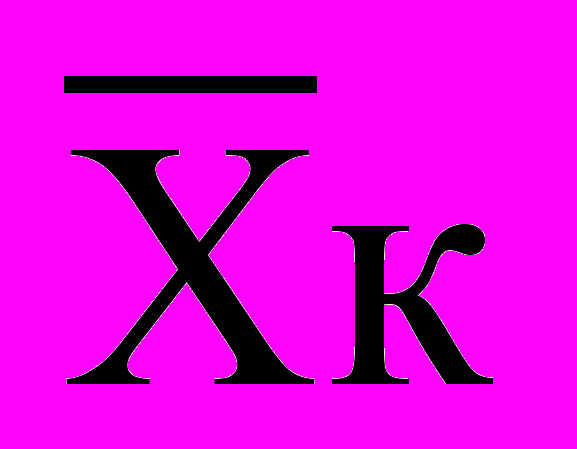 - средняя арифметическая контрольной группы;
- средняя арифметическая контрольной группы; - средняя арифметическая опытной группы;
- средняя арифметическая опытной группы;S
 , S
, S - ошибки средних арифметических.
- ошибки средних арифметических.Физическое значение Т критерия Стьюдента вычисляли по формуле:
tф = d / Sd , где
d – разность средних арифметических
Sd – ошибка разности средних арифметических
tst находят по таблице «критические точки Т-критерия Стьюдента» при различных уровнях значимости L для К = n – 1, где К – число степеней свободы, а n – объем выборки.
Если tф > tst, то Но принимается и различия между выборочными средними являются не достоверными, P > 0,05 (0,001 или 0,01). tф < tst , то Но – отвергается, различия считаются достоверными, P < 0,05 (0,001 или 0,01).
ГЛАВА III. Результаты исследования
Под нашим наблюдением находилось 18 крыс, которые были разделены на 3 группы. Первая группа - интактные животные, т.е. находившееся в условиях вивария; вторая группа - контольные животные, которым внутрижелудочно вводили дистиллированную воду в течение 10 дней из расчета 5мл/кг массы ежедневно; третья группа - экспериментальные животные, которые в течение 10 дней получали внутрижелудочно MgB6 из расчёта 5мл/кг массы ежедневно.
У всех животных определялось содержание магния, фосфора, кобальта, цинка в следующих отделах головного мозга: в центральной извилине лобной доли коры (ЦИЛДК), гипоталамусе (ГТ), обонятельных луковицах (ОБ).
Полученные результаты обрабатывались с помощью Т-критерия Стьюдента.
3.1. Распределение макро-микроэлементов в различных отделах головного мозга контрольных крыс.
12 животных контрольной группы были разделены на 2 подгруппы: интактные животные (6 особей ) и животные, получившие внутрижелудочно дистиллированную воду. Интактная группа животных необходима для исключения влияния на состав микроэлементов в головном мозге белых крыс условий жизни и питания в виварии. Сравнение содержания ионов в 1и 2 группах животных не выявило достоверных отличий, поэтому в дальнейшем мы исследовали данные, полученные у 2 группы животных.
Полученные результаты представлены в таблицах 1,2.
Обработка полученных результатов показала что среднее содержание фосфора в различных структурах головного мозга распределилось следующим образом:
ЦИЛДК- 279450мкг/кг; ГТ- 421910мкг/кг; ОЛ-411390мкг/кг.
Содержание магния составило:
ЦИЛДК-39458мкг/кг; ГТ-27430мкг/кг; ОЛ-20402мкг/кг (таблица 1).
Как видно на таблице 2 представлены данные по содержанию кобальта и цинка в отделах головного мозга контрольной группы животных. В ЦИЛДК содержится 1629мкг/кг кобальта и 2881,4мкг/кг цинка. В ГТ содержание кобальта составило 1,19мкг/кг, а цинка 4191мкг/кг. В ОЛ (табл.2)содержание кобальта-4,44мкг/кг, а цинка-3145,3мкг/кг.
Т.о. метод статистической обработки этого материала показал, что отличия в распределении МЭ в различных отделах головного мозга присутствуют (табл.1,2). Следовательно, дальнейшие экспериментальные данные о составе МЭ в ЦИЛДК, ГТ, опытных групп будем связывать с контролем.
Таблица 1
