Учебное пособие Рекомендовано научно-методическим советом
| Вид материала | Учебное пособие |
- Бизнес-планирование предприятия учебное пособие Рекомендовано учебно-методическим советом, 1729.98kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2005 удк 330., 1365.17kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2006, 1339.31kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2009, 2459.47kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2008, 3188.71kb.
- Учебное пособие Часть 1 Рекомендовано учебно-методическим советом угаэс уфа 2006, 1359.55kb.
- Учебное пособие Изд. 2-е, перераб и доп. Петрозаводск Издательство Петргу 2006, 1457.49kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.22kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.72kb.
- Учебно-методическое пособие, 281.65kb.
Защитные свойства металлических покрытий
В одну пробирку с раствором соляной кислоты с добавкой красной кровяной соли помещается пластинка луженого (покрытого оловом), а в другую – оцинкованного железа. На каждой пластинке предварительно делаются глубокие царапины, которые повреждают покрытия и делают доступным для коррозионной среды защищаемый металл ─ железо (рис. 5.13). Через некоторое время на лужёном образце появляется синее окрашивание (признак коррозии железа).

Рис. 5.13. Схема поведения металлических защитных покрытий
при нарушении их целостности
Составьте электронные уравнения процессов, происходящих при нарушении целостности металлических защитных покрытий.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
В каком случае корродирует защищаемый металл, а в каком − защитное покрытие?
________________________________________________________________________________________________________________________________________________________________
Цинк в контакте со сталью выполняет функцию анода и разрушается, это покрытие анодное. Олово ─ менее активный металл, чем железо, поэтому корродировать будет железо, как более активный металл. Функцию катода выполняет олово, это будет катодное покрытие. В качестве анодных покрытий по стали выполняют цинковые, хромовые и кадмиевые (в морской воде). Материалом для катодных покрытий стали служат никель, олово, медь, серебро, золото.
Упражнение 5.7. Для защиты стального изделия в качестве катодного покрытия может быть использован металл
1) Никель 2) Цинк 3) Хром 4) Марганец
Для ответа пользуйтесь табл. 5.1.
________________________________________________________________________________________________________________________________________________________________
Упражнение 5.8. При нарушении свинцового покрытия на железном изделии в кислоте на катоде будет протекать реакция…
1) Pb0 – 2 ē → Pb2+ 2) Pb2+ + 2 ē → Pb0 3) H+ + 2 ē → H2 4) O2 + 2H2O + 4 ē → 4OH ˉ
Укажите правильный ответ в соответствии с табл. 5.5.
Упражнение 5.9. Уравнение процесса, протекающего на катоде при электрохимической коррозии железных изделий в нейтральной среде, имеет вид …
1)O2 + 4H+ + 4 ē → 2H2O 2) 2H+ + 2 ē → H2
3)Fe2+ + 2 ē → Fe0 4)O2 + 2H2O + 4 ē → 4OH-
Укажите правильный ответ в соответствии с табл. 5.5.
Упражнение 5.10. Уравнение процесса, протекающего на аноде при электрохимической коррозии кадмия в нейтральной среде, …
1)2H2O – 4 ē → O2 + 4H+ 2) Cd0 – 2 ē → Cd2+
3) 2H2O + 2 ē → H2 + 2OH ˉ 4) Cd2+ + 2 ē → Cd0
Для заметок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 6. АНАЛИТИЧЕСКАЯ ХИМИЯ
6.1. КАЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
лекцию «Качественный химический анализ» [Часть 2 УМК, раздел 6.1]
Цель выполнения задания
∙ Усвоить суть и задачи идентификации состава строительных материалов.
∙ Ознакомиться с качественными реакциями обнаружения катионов и анионов.
Теоретическое введение
Под идентификацией понимают установление тождества неизвестного соединения с другим известным, т.е. определение качественного (что) и количественного (сколько) состава исследуемого объекта.
Основанием для проведения исследования является наличие аналитического сигнала, т.е. свойства, функционально зависящего от качественного и количественного состава анализируемого объекта. В качественном анализе фиксируется наличие аналитического сигнала, а в количественном ─ измеряется его интенсивность.
Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора (рис. 6.1).
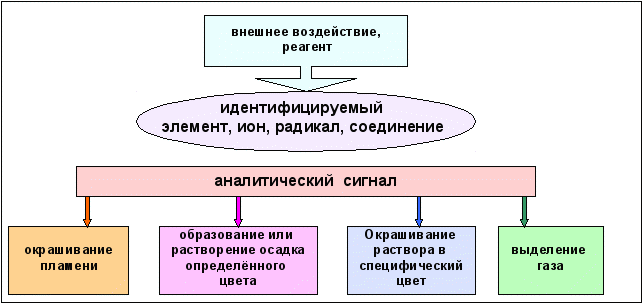
Рис. 6.1. Виды аналитических сигналов в качественном химическом анализе
Если присутствуют несколько катионов, то любой катион можно идентифицировать с помощью определенной (специфической) реакции, если удалить другие катионы, мешающие этой идентификации. Некоторые качественные реакции приведены в табл. 6.1.
Таблица 6.1
Качественные химические реакции обнаружения некоторых катионов и анионов
| Ион, вещество | Реактив | Реакция | Наблюдаемое явление |
| Fe2+ | K3[Fe(CN) 6] красная кровяная соль | 3Fe2+ + 2K3[Fe(CN) 6] → Fe3[Fe(CN) 6]2 + 6K+ | Синее окрашивание |
| Fe3+ | K4[Fe(CN) 6] жёлтая кровяная соль | 2Fe2+ + 3K2[Fe(CN) 6] → Fe2[Fe(CN) 6]3 + 6K+ | Синее окрашивание |
| Fe3+ | NH4CNS роданид аммония | Fe3+ + 3 NH4CNS → Fe(CNS)3 + 3NH4+ | Красное окрашивание |
| Са2+ | (NH4)2С2О4 оксалат аммония | Са2+ + (NH4)2С2О4 → CaC2O4↓ + 2NH4+ | Белый осадок |
| Bа2+ | Н2SO4 | Bа2+ + Na2SO4 → BaSO4↓ + 2Н+ | Белый осадок |
| Cu2+ | NH4OH | Cu2+ + 4NH4OH → [Cu(NH3)4]2+ + 4H2O | Ярко-синее окрашивание |
| Pb2+ | KJ | Pb2+ + 2KJ → PbJ2↓ + 2K+ | Жёлтый осадок |
| Ca2+, Sr2+,Ba2+ | H2S | Ca2+(Sr2+, Ba2+) + H2S → Ca(Sr,Ba)S↓ + 2H+ | Осадок |
| NH4+ | NaOH | t NH4+ + NaOH → NH3↑ + H2O + Na+ | Выделение аммиака |
| Cr3+→Cr6+ | Щелочная среда | Cr3+→ CrO42ˉ | От зелёной к жёлтой окраске |
| СО32ˉ | HCl | СО32ˉ + 2H+ → H2O + CO2↑ | Выделение газа |
| SO42ˉ | BaCl2 | SO42ˉ + BaCl2→ BaSO4↓ + 2Clˉ | Белый осадок |
| NO3ˉ | Дифениламин | [O] (С6Н5)2−NH —→ (C6H4)2−NH + H2O | Синее окрашивание |
| РО43ˉ | Магнезиальная смесь | РО43ˉ + Mg2+ + NH4+ → Mg NH4РО4↓ | Белый осадок |
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Рисунок 6.2 даёт наглядное представление о некоторых качественных реакциях.
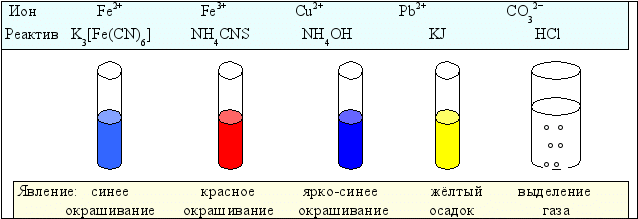
Рис. 6.2. Вид качественных реакций на некоторые ионы
Изучите примеры, а в упражнениях, на основании табл. 6.1, укажите правильные ответы или напишите соответствующие реакции.
Пример 6.1. Для обнаружения в растворе катионов кальция используют …
1) нитрат аммония 2) сульфид аммония 3) оксалат аммония 4) хлорид аммония
Решение. Для обнаружения в растворе катионов кальция используют оксалат аммония
CaCl2 + (NH4)2C2O4 → СаС2O4↓ + 2NH4C1,
Ca2+ + С2O42‾ → СаС2O4↓
Упражнение 6.1. Наиболее селективным реагентом для обнаружения катионов аммония является …
1) раствор щелочи 2) раствор кислоты 3) раствор CuSO4 4) раствор KMnO4
Упражнение 6.2. Присутствие нитрат-ионов в растворе можно доказать, используя в качестве реактива …
1) магнезиальную смесь 2) дифениламин 3) раствор щелочи 4) раствор иода
Упражнение 6.3. Доказать присутствие карбонат-иона можно с помощью раствора …
1) сильной кислоты 2) перманганата калия 3) сероводорода 4) щелочи
_______________________________________________________________________________
Пример 6.2. Определить степень окисления ионов железа (+2 или +3) в растворе можно с помощью реагентов …
1) NH4CNS и (NH4)2С2О4 2) K3[Fe(CN) 6] и KJ 3) NH4OH и HCl 4) NH4CNS и K3[Fe(CN) 6]
Решение. Специфической реакцией на ион Fe2+ является взаимодействие с красной кровяной солью, сопровождающееся синим окрашиванием раствора
3Fe2+ + 2K3[Fe(CN) 6] → Fe3[Fe(CN) 6]2 + 6K+.
Ион Fe3+ обнаруживается специфической реакцией с роданидом аммония (красное окрашивание)
Fe3+ + 3 NH4CNS → Fe(CNS)3 + 3NH4+.
Правильный ответ 4.
Упражнение 6.4. Качественным реагентом на фосфат-ионы является …
1) красная кровяная соль 2) реактив Несслера 3) дифениламин 4) магнезиальная смесь
Пример 6.3. Признаком протекания качественной реакции между йодом и крахмалом является ...
1) выпадение бурого осадка 2) образование синей окраски
3) выделение бурого газа 4) образование бурой окраски
Решение. Взаимодействие йода и крахмала сопорвождается образованием окрашенного в синий цвет соединения
(С6Н10О5)n + nJ2 → n(С6Н10О5)∙J2.
Правильный ответ 2.
Упражнение 6.5. Качественная реакция на ион аммония описывается уравнением …
1) 2NH4C1 + Na2S04→(NH4)2S04 +2NaCl 2) NH4Cl + AgN03→AgCl + NH4NO3
t
3) 2NH4C1 + Cu(OH)2→2NH4OH + CuCl2 4) NH4C1 + NaOH → NaCl + NH3↑+H20
6.2. КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
лекцию «Количественный химический анализ» [Часть 2 УМК, раздел 6.2]
Цель выполнения задания
∙ Ознакомиться с основными методами количественного химического анализа.
∙ Научиться вести расчёты результатов химического анализа.
Теоретические сведения
В зависимости от вида аналитического сигнала количественный химический анализ выполняется в двух формах: гравиметрический и титриметрический.
Гравиметрический метод основан на точном измерении массы определяемого вещества или его составных частей, выделяемых в виде соединений постоянного состава, т.о. аналитическим сигналом в гравиметрии является масса.
Основной операцией в титриметрическом анализе является титрование, которое заключается в прибавлении из бюретки по каплям одного раствора к предварительно точно отмеренному объёму второго раствора. Концентрация одного раствора точно (до 0, 0001 моль/л) известна, он называется рабочим, стандартным или титрованным. Второй раствор − исследуемый, его концентрация определяется в ходе анализа (рис. 6.3).
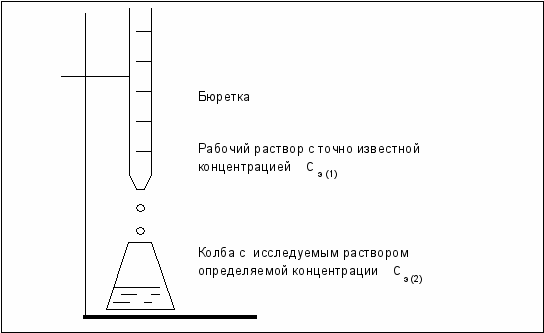
Рис. 6.3. Схема установки для проведения титриметрического анализа
Титриметрический метод исследования состоит в точном измерении объемов растворов двух веществ, вступающих между собой в реакцию.
Титрование ведется до точки эквивалентности, когда количества реагирующих веществ станут эквивалентны
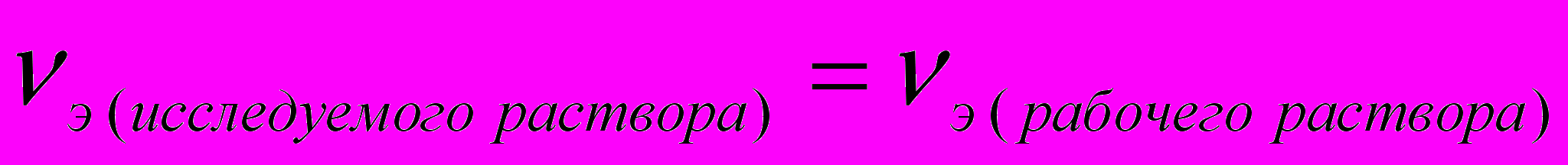 .
.Для расчёта результата анализа в титриметрии используется основная формула
 (6.1)
(6.1)где сЭ (1) и V1 − молярная концентрация эквивалента (моль/л) и объём рабочего раствора
(мл), пошедшего на титрование;
сЭ (2) и V2 − молярная концентрация эквивалента (моль/л) и объём исследуемого
раствора (мл), взятого для титрования.
Молярная концентрация эквивалента
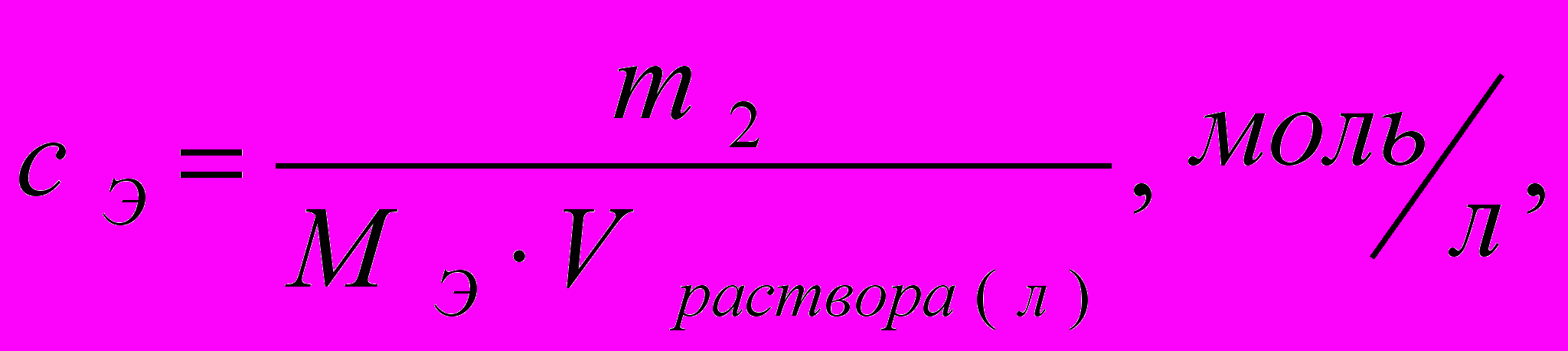 (6.2)
(6.2)где m 2 − масса растворённого вещества;
V − объём раствора, л;
MЭ (2) − молярная масса эквивалента растворённого вещества вычисляется по
формуле МЭ = f · М.
Коэффициент f равен числу эквивалентов, содержащихся в 1 моль вещества, или, что то же самое, обратной величине числа химических связей МЭ = (М) : (n).
Например: M (HCl) = MЭ (HCl); MЭ (H2SO4) = ½ M (H2SO4); MЭ(K2SO4) = ½ M (K2SO4);
МЭ (Ва(ОН)2 = ½ М(Ва(ОН)2; МЭ (Al2(SO4)3 = 1/6 М (Al2(SO4)3.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Пример 6.4. Молярная концентрация эквивалента раствора NaOH, на титрование 10 мл которого до точки эквивалентности потребовалось 7,8 мл раствора HCl, с молярной концентрацией эквивалента 0,1 моль/л равна ________ моль/л
1) 0,78 2) 0,078 3) 7,8 4) 0,1
Решение. В соответствии с формулой 6.1:
с э (НСl) · V (HCl) = c э (NaOH) · V (NaOH),
0,1 моль/л · 7,8 мл = c э (NaOH) · 10 мл, ==>
c э (NaOH) = (0,1 моль/л · 7,8 мл) : 10 мл = 0,078 моль/л.
Правильный ответ 2.
Упражнение 6.5. Для нейтрализации 40мл раствора уксусной кислоты с молярной концентрацией 0,5 моль/л требуется раствор, содержащий ____ моль гидроксида натрия.
1) 0,01 2) 0,02 3) 0,04 4) О 0,05
Пример 6. 5. В растворе серной кислоты объемом 200 мл и концентрацией 0,01 моль/л содержится ___ г растворенного вещества.
1) 196 2) 19,6 3) 0,196 4) 0,098
Решение. В соответствии с определением «молярная концентрация раствора»
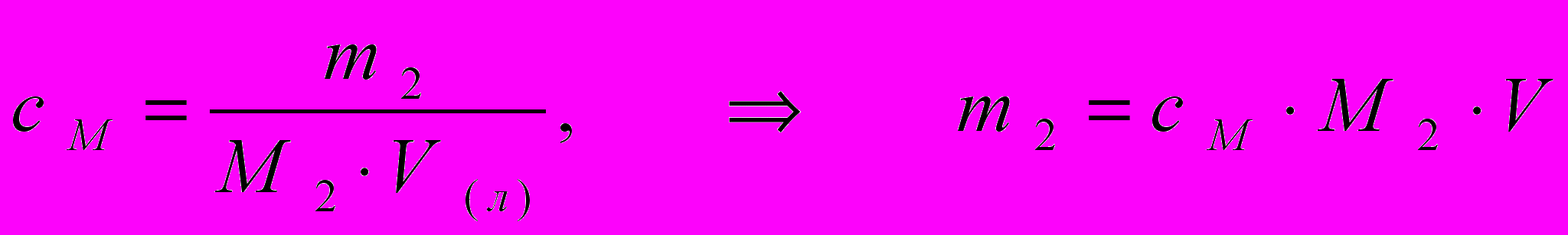
М H2SO4 = 98 г/моль, Vраствора = 0,2 л; масса растворённого вещества
m2 = 0,01 моль/л · 98 г/моль· 0,2 л = 0,196 г
6.3. ФИЗИКО-ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить лекцию «Физико-химические и физические методы анализа» [Часть 2 УМК, раздел 6.3].
Цель выполнения задания
Ознакомиться с инструментальными методами исследования состава, структуры и свойств строительных материалов.
Теоретические сведения
Любое (физическое, химическое, физико-химическое) явление, в результате которого изменяются свойства системы, может служить основанием для проведения анализа, если есть возможность зафиксировать эти изменения качественно или количественно. Можно считать, что основанием для появления аналитического сигнала в химических методах служит химическая реакция, в физико-химических методах аналитическим сигналом является физическое явление, возникшее в результате химической реакции, а в физических методах фиксируется определённое физическое свойство аналита. Как правило, в инструментальных методах анализа применяются сенсоры (датчики), которые дают информацию о составе и свойствах среды, в которой они находятся.
Наиболее часто для исследования состава, структуры и свойств строительных материалов применяют следующие группы методов анализа:
· оптические;
· электрохимические;
· термоаналитические;
· хроматографические.
Оптические спектроскопические методы исследования основаны на взаимодействии электромагнитного излучения с веществом и изучают спектры испускания (эмиссия), поглощения или рассеяния.
Возникающие аналитические сигналы несут качественную и количественную информацию в виде спектра. Спектр − совокупность спектральных линий, принадлежащих данной частице. Качественную информацию несёт частота сигнала ν (длина волны λ), связанная с природой вещества, количественную − интенсивность сигнала, зависящая от его количества (концентрации).
Методы, основанные на изучении спектров излучения, получили название эмиссионно-спектральных методов. Атомный эмиссионный спектральный анализ основан на изучении спектра паров исследуемого вещества. Прибор для эмиссионного анализа содержит следующие основные узлы:
· атомизатор, в котором идентифицируемое вещество переводится в атомарное состояние, например в пламени;
· диспергирующее устройство (призмы, дифракционные решётки, светофильтры) для выделения монохроматических составляющих излучения;
· приёмник излучения (детектор) для преобразования электромагнитной энергии в другие виды энергии, более удобные для измерения;
· устройство, регистрирующее спектр (рис. 6.4).
Эмиссионная пламенная фотометрия используется для идентификации щелочных и щелочноземельных металлов, которые окрашивают пламя в характеристические цвета:
Li, Sr, Ra ─ карминово-красный;· Na ─ ярко-жёлтый;· K ─ фиолетовый;· Rb ─ синевато-красный;· Cs ─ синий;· Ca ─ оранжево-красный.
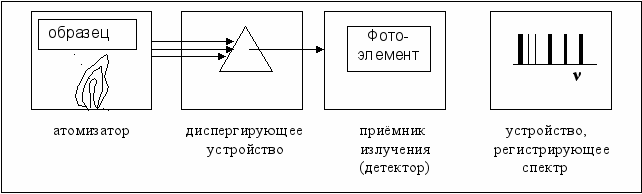
Рис. 6.4. Схема основных узлов прибора для эмиссионного спектрального анализа
Методы, основанные на изучении спектров поглощения, называются абсорбционно-спектральными методами. На поглощении света в видимой части спектра истинными растворами основаны фотоколориметрия и спектрофотометрия; взвесями − турбидиметрия, на рассеянии света взвесями − нефелометрия.
Спектрофотометр или фотоколориметр содержат по пять основных узлов:
1) источник излучения; 2) монохроматор, где выделяется длина волны, при которой происходит наиболее интенсивное поглощение; 3) исследуемый образец; 4) приёмник излучения; 5) устройство, регистрирующее спектр.
В фотоколориметрии проводится сравнение интенсивности окраски растворов: стандартного (с точно известной концентрацией) и исследуемого (с определяемой концентрацией). Основные узлы фотоэлектроколориметра представлены на рис. 6.5.
.

Рис.6.5. Схема основных узлов фотоэлектроколориметра
При прохождении через раствор аналита интенсивность падающего на раствор светового потока уменьшается вследствие перехода световой энергии во внутреннюю энергию вещества. Падающий световой поток интенсивностью ─ J0 отражается, поглощается и рассеивается до величины J ─ интенсивности прошедшего через раствор светового потока. Десятичный логарифм отношения lg [(J0) : (J)] = D называется оптической плотностью.
Согласно закону Бугера ─ Ламберта ─ Бера оптическая плотность D пропорциональна концентрации раствора ─ c и толщине слоя светопоглощающего раствора ─ l:
D = ε · c · l,
где ε ─ молярный коэффициент погашения раствора с концентрацией 1 моль/л, зави-
сящий от длины волны падающего света, природы аналита, температуры.
График в координатах: концентрация - оптическая плотность должен быть линеен и прямая должна проходить через начало координат. По калибровочному графику, который строят по нескольким растворам с точно известной концентрацией, определяют концентрацию анализируемого вещества.
Электрохимические методы идентификации основаны на окислительно-восстановительных свойствах веществ и таких химических процессах, протекание которых сопровождается возникновением электрического тока, или, наоборот, происходит при воздействии тока.
Аналитическим сигналом служит любой электрический параметр:
· в потенциометрии − электродный потенциал, ЭДС
· в кондуктометрии − электропроводимость
· в кулонометрии − количество электричества,
величина которого зависит от состава исследуемой системы (концентрации аналита).
В потенциометрическом методе исследования измеряют электродвижущую силу (ЭДС) обратимых электрохимических систем, для чего необходимо наличие двух электродов: индикаторного и электрода сравнения.
Индикаторный электрод обнаруживает и фиксирует аналитический сигнал, а электрод сравнения помогает измерить этот сигнал (рис. 6.6).
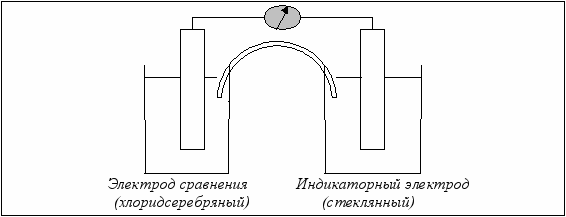
Рис. 6.6. Схема измерения ЭДС в потенциометрии
Потенциал индикаторного электрода зависит от концентрации анализируемого вещества, потенциал электрода сравнения не меняется при проведении исследований. В качестве последнего часто используют хлоридсеребряный электрод, потенциал которого при постоянной концентрации Сl ˉ остаётся неизменным.
Особую группу индикаторных электродов составляют ионоселективные (мембранные) электроды, потенциал которых в зависимости от типа мембраны и может определяться активностью различных ионов. В частности, потенциал стеклянного электрода зависит от активности ионов водорода ан+. Поскольку рН = − lg ан+, то с помощью индикаторного стеклянного электрода можно измерять рН растворов и суспензий. Примером является измерение рН водных вытяжек цементного камня, которые получают путём отделения жидкой фазы суспензии измельчённого цементного камня и воды.
Кондуктометрические методы основаны на измерении электропроводимости. В области сравнительно невысоких концентраций эквивалентная электрическая проводимость электролитов λ, [ Cм · м2 · моль-1] обычно растет с уменьшением концентрации раствора. На существовании линейной зависимости между электропроводимостью и концентрацией основана прямая кондуктометрия.
Электрическая проводимость разбавленных растворов обратно пропорциональна концентрации электролитов, что даёт возможность определять содержание аналита в растворе по методу калибровочного графика, который строится по значениям электрической проводимости того же раствора с известными концентрациями (рис. 6.7 − а).
В методе кондуктометрического титрования могут быть использованы химические реакции, в ходе которых достаточно заметно изменяется электрическая проводимость и в точке эквивалентности изменение происходит скачкообразно (рис. 6.7 − б).
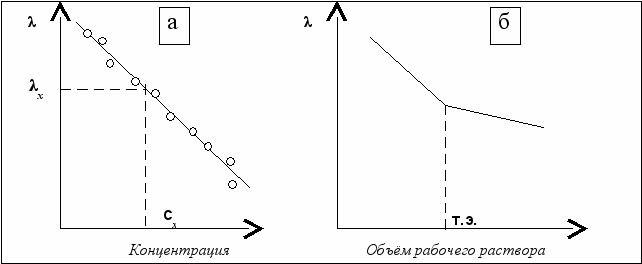
Рис. 6.7. Калибровочный график (а) и кривая кондуктометрического титрования (б)
Кулонометрический метод идентификации основан на законе М. Фарадея (закон электролиза), согласно которому масса, образующегося на электродах вещества (испытавшего электрохимическое превращение) прямо пропорциональна количеству прошедшего электричества:
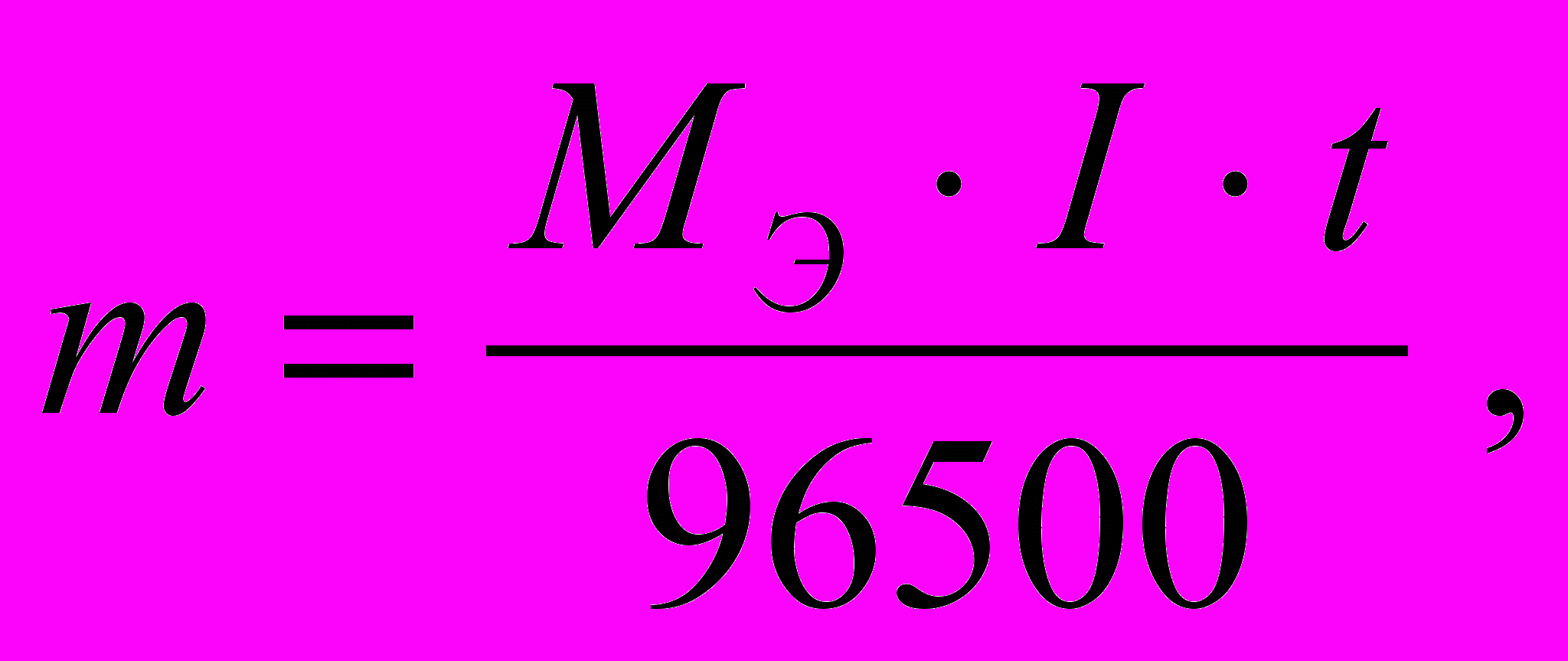
где m ─ масса вещества, окисленного или восстановленного на электроде, г;
М э ─ молярная масса эквивалента вещества, г/моль; I ─ сила тока, А;
t ─ время электролиза, с; 96500 ─ число Фарадея, Кл/моль (А · с/моль).
Установка для проведения анализа должна содержать источник постоянного тока, по которому фиксируется сила тока I, а также ячейку, в которой происходит электрохимическое превращение аналита. По окончании электролиза, проведённого в течение определённого времени t, определяется количество преобразованного вещества: взвешиванием катода, измерением объёма выделившегося газа или титрованием − изменение концентрации раствора (рис. 6.8).
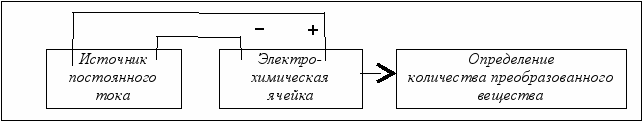
Рис. 6.8. Схема установки для кулонометрического анализа
