Учебное пособие Рекомендовано научно-методическим советом
| Вид материала | Учебное пособие |
СодержаниеРеакция среды характеризуется через водородный показатель pH = ─ lg [Н]. (4.8) Выполнение задания Гидролиз солей Кислота, образовавшая соль |
- Бизнес-планирование предприятия учебное пособие Рекомендовано учебно-методическим советом, 1729.98kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2005 удк 330., 1365.17kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2006, 1339.31kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2009, 2459.47kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2008, 3188.71kb.
- Учебное пособие Часть 1 Рекомендовано учебно-методическим советом угаэс уфа 2006, 1359.55kb.
- Учебное пособие Изд. 2-е, перераб и доп. Петрозаводск Издательство Петргу 2006, 1457.49kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.22kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.72kb.
- Учебно-методическое пособие, 281.65kb.
Реакция среды характеризуется через водородный показатель pH = ─ lg [Н+]. (4.8)
При решении задач будем пользоваться формулой pН = – lg сH+ . В более точных расчётах следует пользоваться активностью ─ pН = – lg аH+ , где аH+ − активность ионов водорода.
Если подставить значения концентраций ионов водорода сH+, полученные в вышеприведённом примере, в формулу для вычисления рН, то получим:
в нейтральной среде: рН = ─ lg 10–7 = 7;
в кислой среде: рН = ─ lg 10–6 = 6, (рН < 7);
в щелочной среде: рН = ─ lg 10–8 = 8, (рН > 7).
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Колориметрический метод определения рН
В пробирки с водой (нейтральная среда) добавляются растворы индикаторов и наблюдается соответствующая окраска растворов. Затем содержимое пробирок делится на две части и в одних пробирках среду делают кислой, добавляя кислоту, а в других − щелочной. Наблюдаемое изменение цвета (лат. color цвет) растворов показано на рис. 4.4.
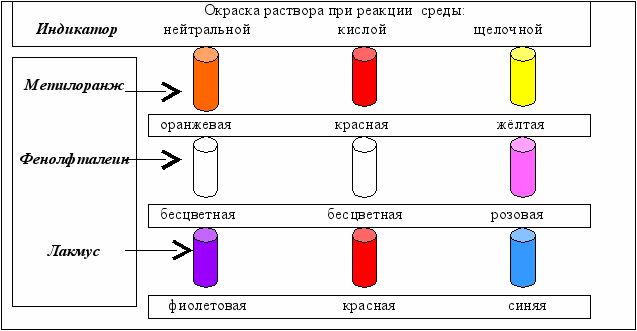
Рис. 4.4. Окраска некоторых индикаторов в нейтральной, кислой и щелочной среде
Более точные результаты определения рН среды даёт универсальная индикаторная бумага, где точность определения составляет ± единица рН. Современные приборы: иономеры и рН-метры имеют погрешность измерения ± 0,05 рН и меньше.
Пример 4.11. При разбавлении 0,5 М раствора соляной кислоты в пять раз, рН будет иметь значение, равное ... 1) 1 2) 10 3) 12 4) 5
Решение. После разбавления раствора соляной кислоты, имеющей концентрацию 0,5 моль/л в пять раз, концентрация раствора будет 0,1 моль/л. Соляная кислота является кислотой сильной, для неё степень диссоциации α = 1, поэтому концентрация ионов водорода сH+ = 0,1 моль/л = 10 ‾1 моль/л. Тогда в соответствии с формулой 4.8:
pН = – lg сH+ = – lg 10 ‾1 = 1.
Упражнение 4.8. При разбавлении 0,2 М раствора соляной кислоты в два раза, рН будет иметь значение, равное ... 1) 1 2) 13 3) 14 4) 4
________________________________________________________________________________________________________________________________________________________________
Пример 4.12. В 0,1 М растворе гидроксида калия рН будет иметь значение, равное ...
1) 1 2) 14 3) 13 4) 0,1
Решение. В соответствии со схемой диссоциации сильного основания
КОН → К+ + ОН‾
с ОН‾ = 0,1 моль/л. По формуле 4.7 находим концентрацию ионов водорода:
сH+ = (10 ‾14) : с ОН‾ = (10 ‾14) : 10 ‾1 = 10 ‾13.
Значение рН вычисляем по формуле 4.8: pН = – lg сH+ = – lg 10 ‾13 = 13.
Упражнение 4.9. При разбавлении 0,03 М раствора гидроксида натрия в три раза, рН будет иметь значение, равное ... 1) 3 2) 12 3) 13 4) 14
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ГИДРОЛИЗ СОЛЕЙ
Теоретические сведения
При растворении соли в воде происходит её электролитическая диссоциация на анионы и катионы, которые могут взаимодействовать с водой. Если катион соли является остатком слабого основания, то образуется это слабое основание; если анион соли – остаток слабой кислоты, то в результате гидролиза образуется слабая кислота.
Хлорид аммония NH4Cl, образованный слабым основанием NH4OH и сильной кислотой HCl, при растворении в воде вступает в обменное взаимодействие:
N

 H4Cl + HOH NH4OH + HCl
H4Cl + HOH NH4OH + HClN

 H4+ + Cl¯ + HOH NH4OH + H+ + Cl¯
H4+ + Cl¯ + HOH NH4OH + H+ + Cl¯N

 H4+ + HOH NH4OH + H+
H4+ + HOH NH4OH + H+В данном случае устанавливается ионно-молекулярное равновесие, так как слабый электролит (Н2О) является одним из исходных веществ и слабое основание NH4OH – один из продуктов реакции.
Таким образом, гидролиз солей относится к обратимым реакциям и протекает тем полнее, чем более слабым электролитом будет кислота или основание, образовавшие соль. Причиной гидролиза, то есть веществом, смещающим равновесие гидролиза в сторону образования продуктов реакции, являются слабые кислоты и основания. Чем слабее электролит (чем меньше величина его константы диссоциации), тем полнее протекает гидролиз.
В результате взаимодействия с водой хлорида аммония в растворе накапливаются свободные ионы Н+ и реакция среды становится кислой, т.к. СН+ > СОН ˉ . NH4Cl гидролизуется по катиону ─ остатку слабого основания.
Нитрит натрия NaNO2 образован слабой кислотой HNO2 и сильным основанием NaOH.

 NaNO2 + HOH NaOH + HNO2
NaNO2 + HOH NaOH + HNO2N

 a+ + NO2‾ + HOH Na+ + OH‾ + HNO2
a+ + NO2‾ + HOH Na+ + OH‾ + HNO2N

 O2‾ + HOH OH‾ + HNO2
O2‾ + HOH OH‾ + HNO2Реакция среды в растворе нитрита натрия щелочная вследствие накопления свободных ионов ОН ˉ, так как СН+ < СОНˉ. Причиной гидролиза является образование слабой кислоты – HNO2 , т.о. NaNO2 гидролизуется по аниону.
Нитрит аммония образован слабым основанием NH4OH и слабой кислотой HNO2. При взаимодействии с водой образуются данные слабые электролиты:

 NH4 NO2 + НОН NH4OH + HNO2;
NH4 NO2 + НОН NH4OH + HNO2;
 NH4+ + NO2‾ + НОН NH4OH + HNO2.
NH4+ + NO2‾ + НОН NH4OH + HNO2.В данном случае рН среды меняется незначительно, т.к. СН+ ≈ СОН–.
NH4 NO2 гидролизуется как по катиону, так и по аниону.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, и pH среды не меняется, например:

 KNO3 + HOH KOH + HNO3;
KNO3 + HOH KOH + HNO3; 
 K+ + NO3‾ + HOH K+ + OH‾ + H+ + NO3‾;
K+ + NO3‾ + HOH K+ + OH‾ + H+ + NO3‾; 
 HOH H+ + OH‾.
HOH H+ + OH‾.Соли, образованные многозарядными остатками слабых кислот и оснований, подвергаются ступенчатому гидролизу.
Таким образом, гидролизом называется обменное взаимодействие ионов соли с водой, которое сопровождается образованием слабого электролита и изменением рН среды.
Реакция среды раствора соли зависит от химической природы кислот и оснований, образовавших данную соль (табл. 4.4).
Таблица 4.4
Реакция среды в растворах гидролизующихся и негидролизующихся солей
-
Кислота, образовавшая соль
Основание, образовавшее соль
Гидролиз
по …
Реакция
среды
рН
сильная
слабое
катиону
кислая
< 7
слабая
сильное
аниону
щелочная
> 7
слабая
слабое
катиону и
аниону
близкая к
нейтральной
≈ 7
сильная
сильное
не гидролизуется
нейтральная
= 7
