Учебное пособие Рекомендовано научно-методическим советом
| Вид материала | Учебное пособие |
- Бизнес-планирование предприятия учебное пособие Рекомендовано учебно-методическим советом, 1729.98kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2005 удк 330., 1365.17kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2006, 1339.31kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2009, 2459.47kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2008, 3188.71kb.
- Учебное пособие Часть 1 Рекомендовано учебно-методическим советом угаэс уфа 2006, 1359.55kb.
- Учебное пособие Изд. 2-е, перераб и доп. Петрозаводск Издательство Петргу 2006, 1457.49kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.22kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.72kb.
- Учебно-методическое пособие, 281.65kb.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Отличие солей гидролизующихся и негидролизующихся
В три пробирки наливается по 4–5 мл воды и измеряется pH универсальной индикаторной бумагой. На кончике микрошпателя вносится в одну пробирку FeCl3, в другую – Na2CO3, в третью – NaCl. Пробирки встряхиваются для растворения солей, и вновь измеряется pH. Результаты опыта внесены в табл. 4.5.
Запишите в таблицу данные об изменении рН (увеличение или уменьшение). Напишите в тетради уравнения взаимодействия солей с водой. В тех случаях, когда идёт гидролиз, определите: по аниону, или по катиону гидролизуется соль. Докажите, написав ионно-молекулярные уравнения, что при растворении в воде хлорида натрия pH не должен меняться.
Таблица 4.5
Реакция среды растворителя и растворов солей
Среда | pH | Изменение pH (увеличение, уменьшение) при растворении соли | Гидролиз по аниону, по катиону, отсутствие гидролиза |
| H2O | 7 | — | — |
| Раствор FeCl3 | 2 | | |
| Раствор Na2CO3 | 10 | | |
| Раствор NaCl | 7 | | |
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние на процесс гидролиза нагревания и разбавления растворов
Реакция гидролиза является обратной реакции нейтрализации, а т.к. последняя идёт с выделением теплоты, то процесс гидролиза является эндотермическим, т.е. идёт с поглощением теплоты.
поглощение теплоты в ходе процесса

 Соль + Вода Кислота + Основание; ΔrH > 0
Соль + Вода Кислота + Основание; ΔrH > 0выделение теплоты в ходе процесса
В соответствии с правилами смещения химического равновесия нагревание раствора соли должно смещать равновесие в сторону процесса, идущего с поглощением тепла, т.е. усиливать гидролиз соли. Разбавление раствора водой также способствует протеканию гидролиза, т.к. увеличивается число ионов H+ и OH‾, взаимодействующих с ионами соли.
В 1 мл воды растворяется немного хлорида железа (III) и раствор подогревается. Наблюдается помутнение прозрачного раствора вследствие образования соли Fe(OH)2Cl. Содержимое пробирки разбавляется в 2 – 3 раза водой и некоторое время кипятится. Наблюдается образование красно-бурого осадка гидроксида железа (III). Схема опыта и наблюдаемые результаты представлены на рис.4.5.
Ионно-молекулярные уравнения ступенчатого гидролиза хлорида железа (III) имеют следующий вид:
1-я ступень: Fe 3+ + HOH ↔ FeOH 2+ + H+;
2-я ступень: FeOH 2+ + НОН ↔ Fe(OH)2 + + Н+;
3-я ступень: Fe(OH)2 + + НОН ↔ Fe(OH)3 ↓ + Н+.

Рис. 4.5. Схема ступенчатого гидролиза хлорида железа (III)
Усиливает или уменьшает гидролиз соли разбавление и нагревание раствора?
________________________________________________________________________________
Пример 4.13. При помощи фенолфталеина можно различить растворы солей
1) Ba(NO3)2 и NaCl 2) CuCl2 и K2SO3 3) FeCl2 и AlBr3 4) KNO3 и NaBr
Решение. Рассмотрим характер кислот и оснований, образовавших соли, реакцию среды (табл. 4.4) и окраску растворов фенолфталеином (рис. 4.4). Результаты анализа представлены в табл. 4.6.
Таблица 4.6
Характеристика растворов некоторых солей
| Номер ответа | Соль | Соль образована | рН | Окраска фенолфталеина | |
| кислотой | основанием | ||||
| 1 | Ba(NO3)2 | сильной | сильным | = 7 | бесцветная |
| NaCl | сильной | сильным | = 7 | бесцветная | |
| 2 | CuCl2 | сильная | слабое | < 7 | бесцветная |
| K2SO3 | слабая | сильное | > 7 | розовая | |
| 3 | FeCl2 | сильная | слабое | < 7 | бесцветная |
| AlBr3 | сильная | слабое | < 7 | бесцветная | |
| 4 | KNO3 | сильной | сильным | = 7 | бесцветная |
| NaBr | сильной | сильным | = 7 | бесцветная | |
Фенолфталеин в кислой и нейтральной среде бесцветен, а в щелочной имеет розовую окраску, поэтому раствор K2SO3 он окрашивает в розовый цвет, а раствор CuCl2 не окрашивает. По этому признаку можно различить растворы данных солей.
Правильный ответ 2.
Упражнение 4.10. При помощи лакмуса можно различить растворы солей
1) Na2SO4 и NaCl 2) FeCl2 и AlBr3 3) K2SO4 и CaBr2 4) NaCl и Na2SO3
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.14. Гидролизу по катиону подвергается соль, формула которой
1) FeSO4 2) NaCl 3) Na2SiO3 4) Na2CO3
Решение. В соответствии с табл. 4.4 гидролизу по катиону подвергается соль, образованная слабым основанием и сильной кислотой. В данном случае это соль FeSO4, образованная слабым основанием Fe(OH)2 и сильной кислотой H2SO4.
Упражнение 4.11. Формула соли, не подвергающейся гидролизу, имеет вид
1) FeCl3 2) K2CO3 3) K2SO4 4) As2S3
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.15. В наибольшей степени гидролиз протекает в 1 %-ном растворе соли
1) нитрат кальция 2) хлорид железа (III) 3) сульфат меди(II) 4) хлорид железа (II)
Решение. Степень гидролиза соли при равной концентрации раствора будет тем больше, чем слабее электролит, образовавший соль (у него меньше константа диссоциации).
В нашем случае следует сравнивать константы диссоциации оснований: Са(ОН)2 − основание средней силы, а из оставшихся трёх, самое слабое Fe(OH)3 (табл. 4.4).
Правильный ответ 2.
ТИПОВЫЕ КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Гидролизу по аниону подвергается соль, формула которой
1) AlBr3 2) Ba(NO3)2 3) NaBr 4) Na2SO3
2. Метилоранж окрашен в красный цвет, фенолфталеин бесцветен в растворе
1) KNO3 2) Na2СO3 3) CaBr2 4) Al(NO3)3
3. Для уменьшения степени гидролиза хлорида меди (II) необходимо
1) разбавить раствор 2) увеличить температуру
3) добавить кислоты 4) добавить щёлочи
Для заметок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
5.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель выполнения задания
· Усвоить суть процессов окисления и восстановления.
· Научиться рассчитывать коэффициенты в уравнениях окислительно-восстановительных реакций.
· Ознакомиться с влиянием среды на характер окислительно-восстановительных процессов.
Теоретические сведения
Окислительно-восстановительные реакции сопровождаются перемещением электронов от одних частиц (восстановителей) к другим частицам (окислителям), при этом изменяются степени окисления этих частиц. Под степенью окисления понимают воображаемый заряд атома, вычисленный из предположения, что соединение состоит из ионов. Степени окисления имеют знак «+» или «−» и целочисленное значение.
Степени окисления элемента в простом веществе равны нулю. В химических соединениях более электроотрицательный элемент имеет отрицательную степень окисления, а менее электроотрицательный − положительную. Алгебраическая сумма степеней окисления в нейтральной молекуле равна нулю, в сложном ионе − заряду иона.
У большинства элементов высшая степень окисления имеет положительный знак и равна номеру группы в периодической системе. Для неметаллов низшая степень окисления равна высшей минус восемь, а поэтому имеет отрицательный знак, Например, высшая степень окисления серы равна «+6», а низшая равна: 6 − 8 = −2.
Обычно в соединениях степень окисления фтора равна «─1», кислорода ─ «─2», водорода ─ «+1».
Пример 5.1. Вычислить степени окисления всех элементов в соединениях:
HNO2, H2SO4, Cr2O3, Fe2(SO4)3.
Одни элементы проявляют постоянную степень окисления, а другие − переменную. Постоянные степени окисления укажем как известные, а неизвестные обозначим через «х».
+1 х −2 +1 х −2 х −2
H N O2, H2 S O4, Cr2 O3,
Составим соответствующие алгебраические уравнения:
[+1 + х + (−2) 2] = 0 [+1 + х + (−2) 4] = 0 [2х + (−2) 3] = 0
Вычислим степени окисления:
«N» в HNO2: х = +3; «S» в H2SO4: х = +6; «C»r в Cr2O3: 2х = +6, х = +3.
В соединении Fe2(SO4)3 два элемента: железо и сера проявляют переменную степень окисления, поэтому вначале вычисляем степень окисления серы в сложном ионе SO42‾: [х + (−2)4] = −2, => х = +6.
Затем вычисляем степень окисления железа:
х +6 −2
Fe2 (S O4)3
[2х + (+6)3 + (−2) ·4 ·3] = 0, => х = +3.
Упражнение 5.1. Вычислить степени окисления всех элементов в соединениях:
H2O, HCl, K2CO3, KCl, KClO3, Gr2(SO4)3, H2S
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 5.2. Правила расчёта коэффициентов в уравнениях окислительно-восстановительных реакций рассмотрим на примере взаимодействия дихромата калия с йодидом калия в кислой среде. Запишем схему реакции, определим степени окисления всех элементов и подчеркнём те из них, которые изменили степени окисления:
+1 +6 −2 +1 −1 +1 +6 −2 +3 +6 −2 0 +1 +6 −2 +1−2
K2 Cr2 O7 + K J + H2 S O4→ Cr2 (S O4)3 + J2 + K2 S O4 + H2 O
Составим уравнения электронного баланса, в которых определим число электронов, принимаемых окислителем и отдаваемых восстановителем:
+6 +3
2 Cr + 6 ē → 2 Cr, процесс окисления;
−1 0
2 J + 2 ē → J2, процесс восстановления.
Кратное число отдаваемых и принимаемых электронов равно шести. Отсюда находим коэффициенты перед окислителем и восстановителем в уравнении реакции:
+6 +3
окислитель: 1 │ 2 Cr + 6 ē → 2 Cr, процесс окисления;
│ −1 0
восстановитель: 3 │ 2 J − 2 ē → J2, процесс восстановления
1 K2Cr2O7 + 6 KJ + H2SO4→ 1 Cr2(SO4)3 + 3J2 + K2 SO4 + H2O.
Уравниваем количества всех остальных атомов по закону сохранения массы веществ в следующем порядке:
а) количество атомов металла, не изменивших степень окисления (слева направо);
б) ионы кислотных остатков среды (справа налево);
в) количество ионов водорода.
K2Cr2O7 + 6 KJ + 7H2SO4→ Cr2(SO4)3 + 3J2 + 4K2 SO4 + 7H2O.
Проверку правильности определения коэффициентов осуществляют путём подсчёта атомов кислорода ─ их должно быть равно слева и справа: 35 = 35.
Упражнение 5.2. Рассчитать коэффициенты в реакции:
КСlO3 + FeSO4 + H2SO4 → KCl + Fe2(SO4)3 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Окислительно-восстановительные процессы с участием простых веществ
Схема проведения эксперимента и полученные результаты представлены на рис. 5.1.
В пробирку наливается раствор сульфата меди и в него помещается образец железа. Через некоторое время на железе появляется красно-коричневый налёт мелкодисперсной меди и уменьшается интенсивность окраски раствора, обусловленная гидратированными ионами меди. Схема происходящей окислительно-восстановительной реакции:
Fe + CuSO4 → Cu + FeSO4.
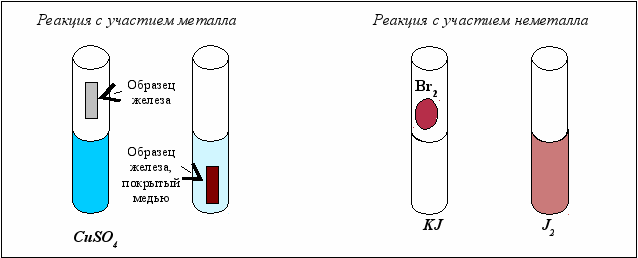
Рис. 5.1. Схема проведения окислительно-восстановительных реакций
с участием простых веществ
Во второй пробирке находится раствор йодида калия и в него вносится небольшое количество жидкого брома. Раствор окрашивается в красно-коричневый цвет раствора йода в KJ. Схема происходящей окислительно-восстановительной реакции:
KJ + Br2 → KBr + J2.
Рассчитайте коэффициенты в обеих реакциях, предварительно, определив степени окисления всех участников реакций и написав уравнения электронного баланса. Укажите, какую функцию (окислителя или восстановителя) выполняет металл, а какую − неметалл.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние реакции среды на окислительные свойства перманганата калия
Схема проведения эксперимента и полученные результаты представлены на рис. 5.2.
В три пробирки наливается фиолетово-розовый раствор перманганата калия. В первую пробирку наливается раствор серной кислоты (кислая среда), во вторую − раствор КОН (щелочная среда), в третьей пробирке среда остаётся нейтральной. Затем в каждую пробирку добавляется сульфит натрия.
В первой пробирке раствор обесцвечивается, во второй появляется зелёная окраска, а в третьей − бурый осадок. Схемы происходящих окислительно-восстановительных реакций написаны ниже.
Рассчитайте коэффициенты, укажите процесс (окисления или восстановления), окислитель и восстановитель.
KMnO4 + Na2SO3 + H2SO4 → K2SO4 + MnSO4 + Na2SO4 + H2O
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
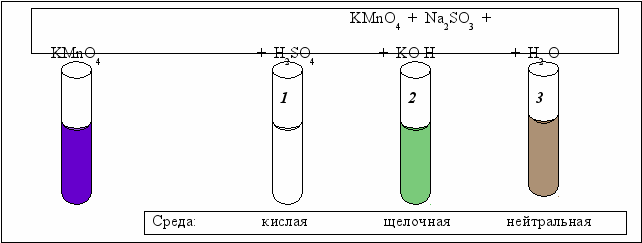
Рис. 5.2. Схема изучения окислительных свойств KMnO4 в различных средах
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O
_______________________________________________________________________________________________________________________________________________________________
KMnO4 + Na2SO3 + H2O → MnO2 + Na2S O4 + KOH
________________________________________________________________________________________________________________________________________________________________
В какой среде в наибольшей степени проявляются окислительные свойства KMnO4, т.е. где в бóльшей мере изменяется степень окисления марганца?
________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Коэффициент перед окислителем в уравнении реакции
K2S + NaClO + H2SO4 → S + NaCl + K2SO4 + H2O
равен… 1) 2 2) 1 3) 4 4) 3.
2. Общая сумма коэффициентов в уравнении реакции
KNO2 + KЈ + H2SO4 → Ј2 + NO + K2SO4 + H2O
равна … 1)12 2) 7 3) 10 4) 13.
3. В реакции
Cr2O3 + KNO3 + KOH → K2CrO4 + KNO2 + H2O
окислителем является …
1) Cr2O3 2) KOH 3) KNO2 4) KNO3
5.2. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Электродные потенциалы. Гальванический элемент» [Часть 2 УМК, раздел 5.2 ].
· видеофильм «Активность металлов в растворах электролитов» [Приложение к УМК]
· видеозапись лабораторной работы «Химическая активность металлов» [Приложение к УМК: диск 4].
Цель выполнения задания
· Рассмотреть механизм работы гальванического элемента.
· Научиться рассчитывать электродные потенциалы и ЭДС гальванического элемента.
Теоретические сведения
Все металлы являются восстановителями. Они сравнительно легко отдают валентные электроны, так как имеют низкое значение потенциала ионизации. Низшая степень окисления металлов равна нулю, они вступают в реакции с различными окислителями, при этом в полученных соединениях их ионы всегда имеют положительную степень окисления.
При контакте металла с раствором собственной соли протекают два противоположных процесса: 1) переход ионов из металла в раствор;
2) адсорбция катионов из раствора на поверхности металла.
Если в начальный момент времени скорость первого процесса больше скорости второго, поверхность металла приобретает избыточный отрицательный заряд, а прилегающий слой раствора – положительный; и наоборот, если скорость второго процесса больше скорости первого, поверхность металла заряжается положительно, а прилегающий слой раствора – отрицательно. И в том, и в другом случае между двумя заряженными слоями возникает разность потенциалов, называемая электродным потенциалом. Величина электродного потенциала зависит от природы металла, концентрации ионов в растворе, температуры и определяется уравнением Нернста:
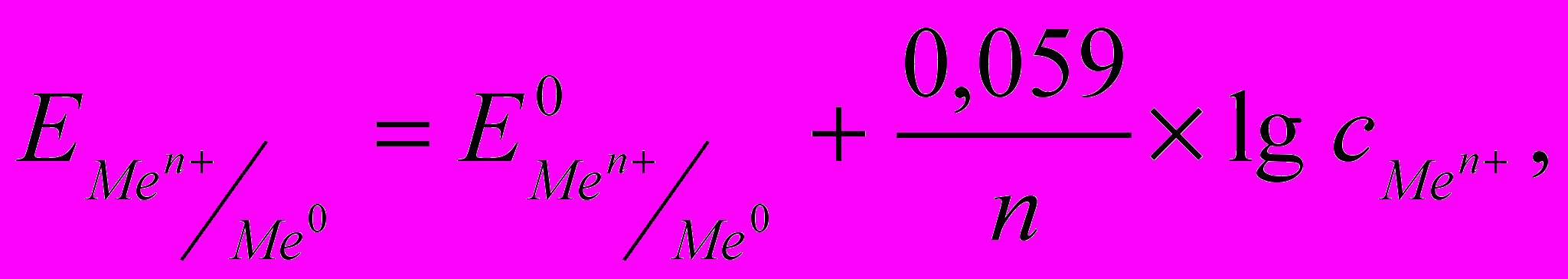 (5.1)
(5.1) где
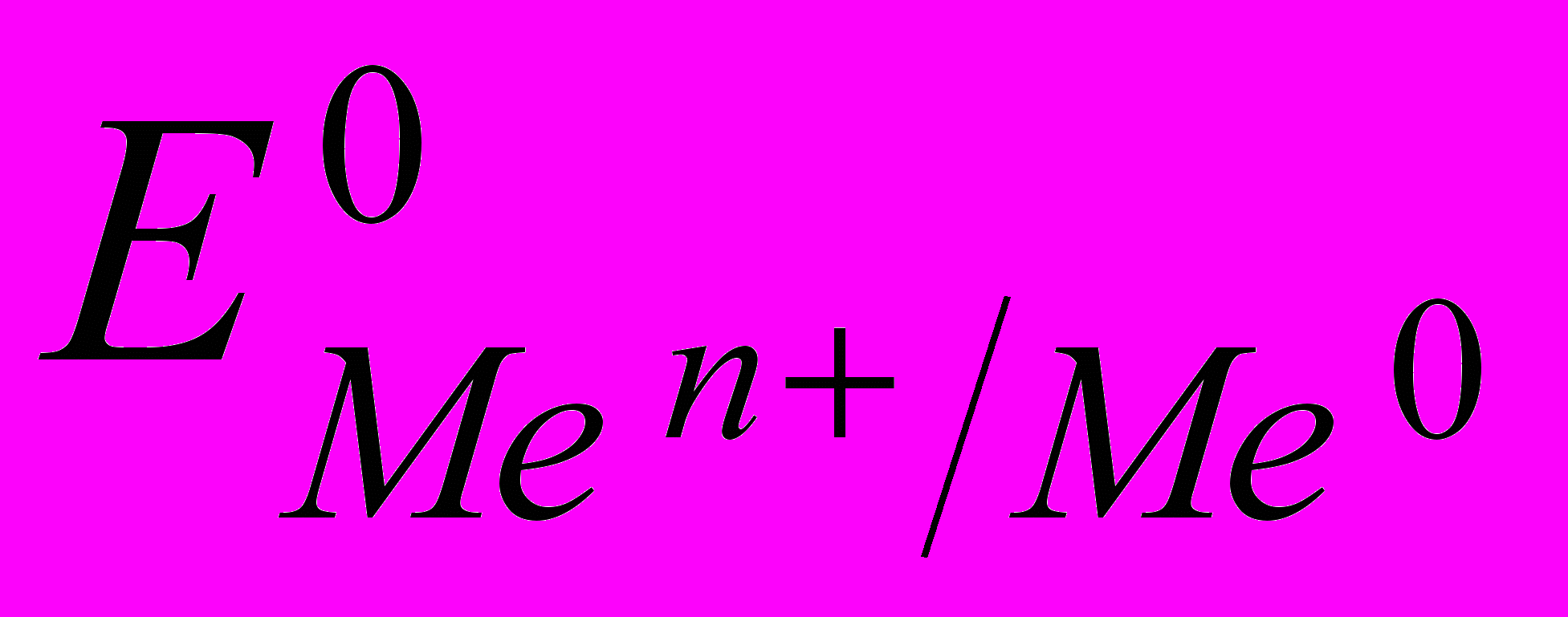 ― стандартный электродный потенциал, возникающий на границе раздела
― стандартный электродный потенциал, возникающий на границе раздела металл – раствор при концентрации ионов металла 1 моль/л, температуре
298 К и давлении 101 кПа;
n ― число электронов, принимающих участие в процессе на электроде;
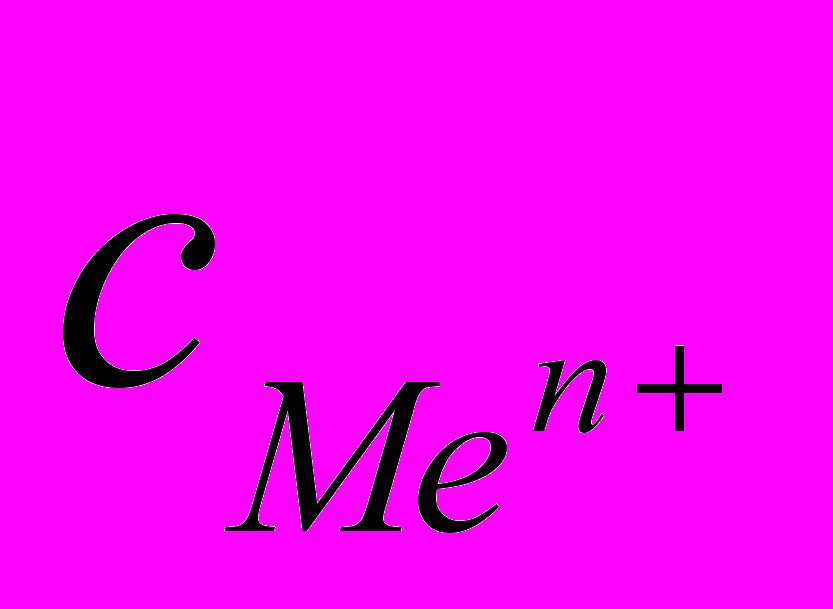 ― концентрация ионов металла в растворе.
― концентрация ионов металла в растворе.Значения стандартных электродных потенциалов содержатся в справочной литературе, некоторые из них представлены в табл. 5.1.
Металлы, расположенные в порядке возрастания алгебраической величины их электродных потенциалов, образует ряд электрохимической активности металлов, называемый «рядом активности» (рис. 5.3).

Рис. 5.3. Ряд активности металлов
Чем отрицательнее значение электродного потенциала, тем более активным восстановителем является металл. Ряд стандартных электродных потенциалов характеризует электрохимическую активность металлов в окислительно-восстановительных реакциях, протекающих в водной среде при стандартных условиях.
Таблица 5.1
Стандартные электродные потенциалы в водных растворах

Так как в любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю, можно создать такие условия, при которых окислительная и восстановительная реакции будут протекать на разных участках поверхности. При этом электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока, т.е. энергия химической реакции будет превращена в электрическую энергию.
Устройства, которые применяются для преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами (рис. 5.4). Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции.
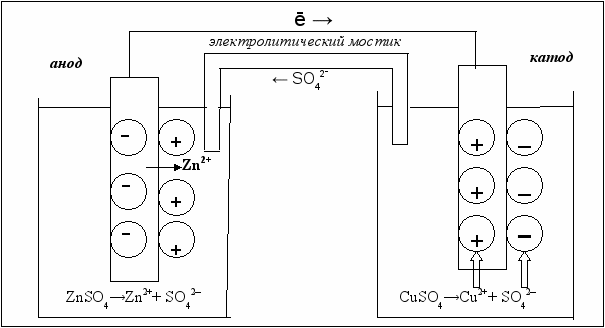
Рис. 5.4. Графическое изображение медно-цинкового гальванического элемента
В простейшем случае гальванический элемент состоит из двух металлических электродов, погруженных в раствор электролита. Процесс окисления протекает на более активном металле, его называют анодом; процесс восстановления – на менее активном, его называют катодом. Электроны при этом переходят от анода к катоду по внешней цепи, ионы движутся от катода к аноду в растворе и через электролитический мостик.
Электродвижущая сила гальванического элемента (ЭДС) равна разности электродных потенциалов катода и анода:
ЭДС = Е к − Е а, (5.2)
где Ек – потенциал катода;
Еа – потенциал анода.
Пример 5.3. Гальванический элемент состоит из железного электрода, помещённого в раствор нитрата железа (II) c молярной концентрацией 0,01 моль/л и серебряного электрода, помещённого в раствор нитрата серебра с молярной концентрацией 1 моль/л. Запишите схему гальванического элемента, процессы на электродах и вычислите ЭДС.
Решение. Для определения функции электрода (анод – катод) следует рассчитать величины их электродных потенциалов по уравнению Нернста (значения стандартных электродных потенциалов в табл. 5.1).
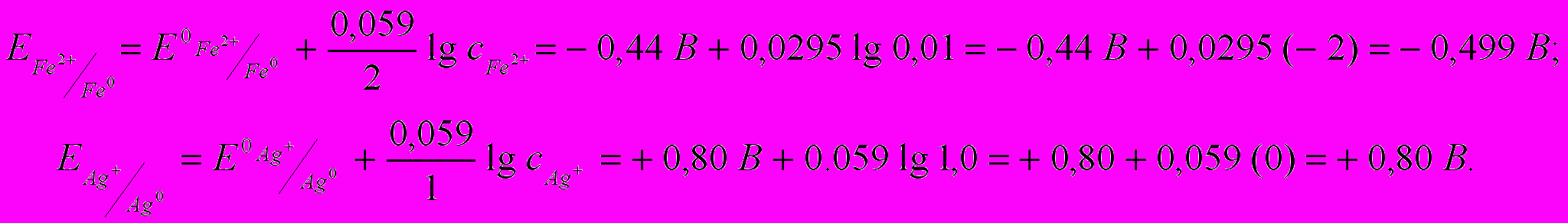 Железный электрод имеет отрицательное значение потенциала (является более активным металлом), поэтому будет выполнять функцию анода. Серебряный электрод менее активный, он будет катодом.
Железный электрод имеет отрицательное значение потенциала (является более активным металлом), поэтому будет выполнять функцию анода. Серебряный электрод менее активный, он будет катодом. Схема гальванического элемента записывается следующим образом:
(анод) Fe | Fe(NO3)2 || Ag(NO3) | Ag (катод). (5.3)
Процессы на электродах:
Анод: Fe0 – 2е → Fe2+; процесс окисления. (5.4)
Катод: 2Ag+ + 2е → 2Ag0; процесс восстановления. (5.5)
Реакция, в результате которой возникает электрический ток (токообразующая реакция):
Fe + 2Ag(NO3) → Fe(NO3)2 + 2Ag .
Электродвижущая сила гальванического элемента равна:
ЭДС = Екатода – Еанода = 0,80 В – (– 0,499 В) = 1,299 В.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Измерение ЭДС гальванического элемента
Медный и цинковый электроды помещаются в стаканы, наполненные соответственно растворами сульфата меди (0,1 М CuSO4) и сульфата цинка (0,1 М ZnSO4) (рис. 5.4).
Растворы соединяются электролитическим мостиком, а электроды подключаются к выводам измерительного прибора: (катод – к «+», анод – к «–»). Измеряется величина ЭДС и записывается в графу «величина ЭДС экспериментальная», табл. 5.2.
Таблица 5.2
ЭДС медно-цинкового гальванического элемента
| Электрод (полуэлемент) | Концентрация электролита, моль/л | Стандартный электродный потенциал, В | Величина электродного потенциала, В | Величина ЭДС | |
| теоретическая | экспериментальная | ||||
| Zn/ZnSO4 | 0,1 | | | | 1,07 |
| Cu/CuSO4 | 0,1 | | | ||
По уравнению Нернста (формула 5.1) вычислите значения электродных потенциалов медного и цинкового электродов, значения Е0 возьмите в табл. 5.1. Запишите схему гальванического элемента (подобно выражению 5.3), процессы на электродах (подобно выражениям 5.4, 5.5) и вычислите ЭДС (формула 5.2).
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Сравните теоретическое и экспериментальное значения ЭДС медно-цинкового гальванического элемента.
Пример 5.4. При работе гальванического элемента, состоящего из никелевого и кадмиевого электродов, погруженных в 0,01 М растворы их хлоридов, на катоде будет протекать реакция, уравнение которой имеет вид …
1) Ni2+ + 2 ē = Ni0 2) Cd0 – 2 ē = Cd2+ 3) Ni0 – 2 ē = Ni2+ 4) Cd2+ + 2 ē = Cd0
Решение. Вычислим значения электродных потенциалов по уравнению Нернста (формула 5.1):
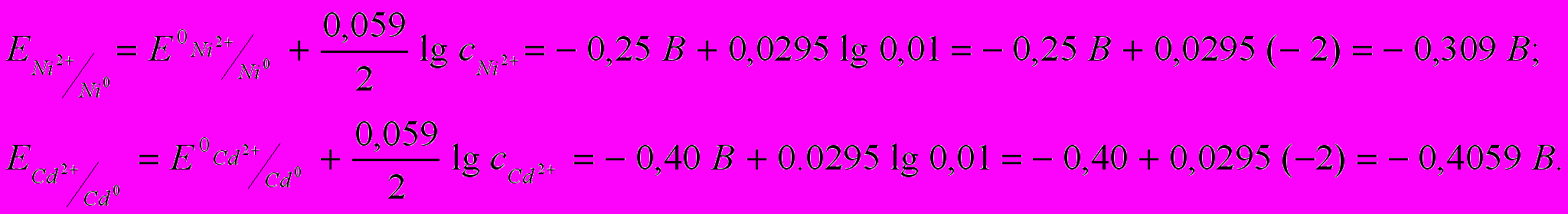
Кадмий имеет более отрицательное значение электродного потенциала, поэтому в гальваническом элементе он будет анодом, а никель − катодом.
На катоде протекает реакция восстановления катионов из раствора, в который погружен никелевый катод: NiCl2 → Ni2+ + SO42‾, т.е. ионов Ni2+. Правильный ответ 1.
Упражнение 5.3. При работе гальванического элемента, состоящего из серебряного и медного электродов, погруженных в 0,01 М растворы их нитратов (Е0(Ag+/Ag) = 0,80 В, Е0(Cu2+/Cu) = 0,34 В), на аноде протекает реакция, уравнение которой имеет вид…
1) Cu0 – 2 ē = Cu2+ 2) Ag+ + ē = Ag0 3) Ag0 - ē = Ag+ 4) Cu2+ + 2 ē = Cu0
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 5.5. Если гальванический элемент содержит стандартный свинцовый электрод (Е0 = −0,13 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из …
1) Co (Е0 = − 0,28 В) 2) Ag (Е0 = + 0,80 В) 3) Mn (Е0 = − 1,18 В) 4) Ni (Е0 = − 0,76 В)
Решение. ЭДС равна алгебраической разности электродных потенциалов катода и анода (формула 5.2), поэтому для достижения наибольшего значения ЭДС потенциал катода должен быть наименее отрицательным, а потенциал анода − наиболее отрицательным. В нашем случае этому условию отвечает гальванический элемент, составленный из свинца (катод) и марганца (анод):
ЭДС = (− 0,13) В − (− 1,18) В = 1,05 В.
Правильный ответ 3
Упражнение 5.4. Если гальванический элемент содержит стандартный никелевый электрод (Е0 = − 0,25 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из …
1) Cd (Е0 = − 0,40 В) 2) Ti (Е0 = − 1,63 В) 3) Ag (Е0 = + 0,80 В) 4) Zn (Е0 = − 0,76 В).
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. ЭДС гальванического элемента, состоящего из свинцового и цинкового электродов, погруженных в 0,001 М растворы их хлоридов
(Е0(Pb2+/Pb) = −0,13 В, Е0(Zn2+/Zn) = − 0,76 В), равна_________ В.
1) 0, 69 2) 0,63 3) 1,10 4) 0,28
2. При работе гальванического элемента, состоящего из марганцевого и цинкового электродов, погруженных в 0,01 М растворы их сульфатов, на аноде будет протекать реакция, уравнение которой имеет вид …
1) Mn2+ + 2e- = Mn0 2) Zn0 – 2e- = Zn2+ 3) Mn0 – 2e- = Mn2+ 4) Zn2+ + 2e- = Zn0
3. Если гальванический элемент содержит стандартный медный электрод (Е0 = +0,34 В), то для достижения наибольшего значения ЭДС второй электрод должен быть изготовлен из .. 1) Cd (Е0 = − 0,40 В) 2) Ag (Е0 = + 0,80 В) 3) Zn (Е0 = − 0,76 В) 4) Mg (Е0 = − 2,37 В)
5.3. ЭЛЕКТРОЛИЗ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Электролиз» [Часть 2 УМК, раздел 5.3].
Цель выполнения задания
· Усвоить основные закономерности процессов электролиза.
Теоретические сведения
Под электролизом понимается совокупность процессов, происходящих при пропускании постоянного тока через электрохимическую систему, состоящую из двух электродов и раствора или расплава электролита. Ограничимся рассмотрением электролиза растворов.
Электрод, подключённый к отрицательному полюсу источника тока, называется катодом, анод же подключается к положительному полюсу. Как во всех электрохимических системах на катоде идёт восстановление, а на аноде − окисление.
Выделение тех или иных продуктов на электродах происходит в результате окислительно-восстановительных процессов, которые в электрохимии называются процессами разряда или просто разрядом. Значение потенциала электрода, при котором происходит разряд называется потенциалом (напряжением) разложения. Из нескольких возможных процессов в первую очередь будет протекать тот, осуществление которого сопряжено с меньшей затратой энергии.
На катоде в первую очередь будут восстанавливаться те системы, потенциал разложения которых менее отрицателен (или более положителен), а на аноде в первую очередь будут окисляться системы с менее положительным напряжением разложения (рис. 5.5). Последовательность процессов идёт от начала стрелок.

Рис. 5.5. Направление последовательности процессов при электролизе
В случае водных растворов электролитов в электродных процессах принимает участие вода, причём, характер процесса зависит от реакции среды. В первом приближении, при электролизе воды, а также водных растворов щелочей и кислородсодержащих кислот на катоде выделяется водород, а на аноде ─ кислород.
На катоде при электролизе растворов солей наиболее активных металлов выделяется водород, эти металлы в свободном состоянии нельзя получить электролизом водных растворов их солей. Цинк и менее активные металлы можно получить при электролизе их водных растворов (табл. 5.3).
Таблица 5.3
Последовательность процессов на катоде
| Катионы раствора | Li+ K+ Ca2+ Mg2+ Al3+ Mn2+ Ti2+ | Zn2+ Cr3+ Fe2+ Cd2+ Ni2+ Sn2+ Cu2+ Ag+ |
| Процесс на катоде | 2Н2О + 2ē → Н2 + 2ОН¯ | Men+ + nē → Me0 |
Анодный процесс в первую очередь определяется материалом анода. Очень часто в качестве анода используют Zn, Cr, Fe, Cd, Ni, Cu, Ag, это растворимые аноды, т.е. идёт окисление анода по схеме: Ме 0 ─ n ē → Ме n+ .
Применяются также нерастворимые (инертные) аноды: угольные, графитовые, платиновые. На таких анодах могут разряжаться простые анионы в следующей последовательности: S2‾, J‾ Br‾, Cl‾. Кислородсодержащие ионы, например: NO3‾, SO4‾, а также F‾ в водных растворах не разряжаются, вместо них окисляется Н2О или ОН ¯ (табл. 5.4).
Таблица 5.4
Последовательность процессов на аноде
| Анод | Вид аниона | Процесс, продукты электролиза | |
| Растворимый (Fe, Ni, Cu, Ag …) | любой | Ме 0 − n ē → Ме n+ (Fe2+, Ni2+, Sn2+, Cu2+, Ag+, …) | |
| Нерастворимый (инертный) (C, Pt) | S 2¯, J¯, Br ¯, Cl ¯ | Эn− − nē → Э0 Последовательность разряда: S2‾→J‾→ Br‾→ Cl‾ S0, J2, Br2, Cl2 | |
| NO3¯, SO4¯, F ¯ | кислая среда | 2Н2О − 4ē → О2 + 4Н+ | |
| щелочная среда | 4ОН¯− 4ē → О2 + 2Н2О | ||
Простейшая установка для проведения электролиза в лабораторных условиях имеет вид, показанный на рис. 5.6.
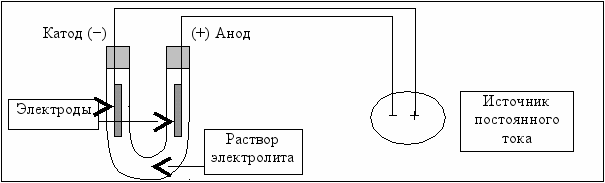
Рис. 5.6. Схема установки для проведения электролиза
Пример 5.6. Рассмотрим электролиз раствора хлорида железа (II) с угольными электродами (рис. 5.7). Это пример электролиза с инертным (нерастворимым) анодом.
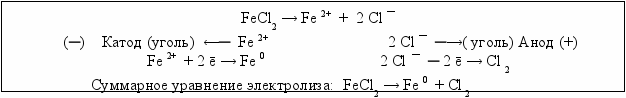
Рис.5.7. Схема электролиза раствора хлорида железа (II)
В растворе соль диссоциирует на ионы: FeCl2 → Fe 2+ + 2 Cl ¯.
На катоде происходит разряд ионов Fe 2+ и выделение металлического железа
Fe 2+ + 2 ē → Fe 0.
У анода разряжаются хлорид-ионы: 2 Cl ¯ ─ 2 ē → Cl 2.
В зависимости от условий электролиза в качестве побочного продукта на катоде может выделяться водород.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Электролиз раствора хлорида олова (II) с угольными электродами
В электролизёр (рис. 5.6) с раствором SnCl2 помещаются два угольных электрода, включается прибор и пропускается постоянный электрический ток, под действием которого происходят процессы восстановления на катоде, подключённому к отрицательному полюсу и окисления на аноде, подключённому к положительному полюсу. По окончании электролиза на катоде видны большие кристаллы выделившегося металлического олова.
В растворе дихлорид олова диссоциирует на ионы олова и хлорид-ионы. Положительно заряженные ионы олова перемещаются к отрицательно заряженному катоду и на нём разряжаются, т.е. восстанавливаются до металлического олова. Следовательно, на катоде выделяется металл. Олово относится к не очень активным металлам, а поэтому может быть получено в свободном состоянии при электролизе водного раствора своей соли. При определённом режиме электролиза одновременно с оловом может выделяться водород вследствие разряда молекул воды.
К положительно заряженному аноду перемещаются хлорид-ионы, происходит их окисление до молекулярного хлора. Угольный анод относится к инертным анодам и не окисляется (рис. 5.8).
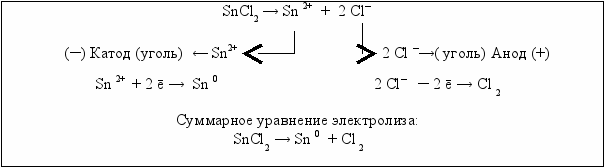
Рис. 5.8. Схема электролиза SnCl2 с инертным анодом
При электролизе водного раствора хлорида олова (II) с инертным анодом:
· на катоде выделяется металлическое олово,
· на аноде выделяется газообразный хлор
Электролиз раствора йодида калия с угольными электродами
В раствор йодида калия, налитый в электролизёр, добавляется по несколько капель фенолфталеина и крахмала. В электролит помещаются угольные электроды, которые подключаются к источнику постоянного тока и проводится электролиз.
На катоде наблюдается выделение газа и через некоторое время в прикатодном пространстве появляется розовое окрашивание фенолфталеина, что свидетельствует о щелочной реакции среды. В то же время синяя окраска крахмала в прианодном пространстве указывает на выделение свободного йода.
К катоду перемещаются катионы калия, имеющие потенциал разряда значительно более отрицательный, чем потенциал разряда воды, поэтому на катоде происходит разряд воды. Наряду с выделением водорода происходит накопление в прикатодном пространстве гидроксильных ионов, окрашивающих фенолфталеин в розовый цвет.
На инертном (угольном) аноде разряжаются йодид-анионы, выделяется свободный йод, которому соответствует качественная реакция с крахмалом, сопровождающаяся синим окрашиванием (рис. 5.9).
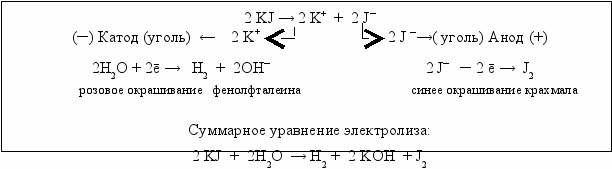
Рис. 5.9. Схема электролиза KJ с инертным анодом
Электролиз водного раствора йодида калия с инертным анодом сопровождается:
· на катоде выделением водорода и подщелачиванием раствора;
· на аноде выделением йода.
Электролиз раствора сульфата меди с медным анодом
В раствор сульфата меди помещаются медный анод, угольный катод и проводится электролиз. Через несколько минут ток отключается и при осмотре угольного катода отмечается выделение на нём меди.
Составьте схему процесса электролиза сульфата меди с медным анодом: покажите направление движения ионов к электродам, составьте уравнения катодного и анодного процесса.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Какие изменения будут происходить с электродами в результате электролиза?
________________________________________________________________________________________________________________________________________________________________
Во второй части опыта проводится переполюсовка электродов, т.е. угольный электрод с осаждённой на нём медью делается анодом и имеется, по-сути, медный анод. Катод будет также медным.
Составьте схему второй части процесса электролиза: покажите направление движения ионов к электродам, укажите , из какого материала состоят электроды, составьте уравнения катодного и анодного процесса.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Через несколько минут проведения электролиза медь на аноде растворяется и на угольном электроде (аноде) начинает выделяться газ (третья часть опыта).
Составьте схему третьей части процесса электролиза: покажите направление движения ионов к электродам, укажите, из какого материала состоят электроды, составьте уравнения катодного и анодного процесса.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оказывает ли материал катода на суть катодного процесса? ______________________
Какой процесс идёт на растворимом аноде? ___________________________________
Как влияет природа аниона на процесс на аноде? ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 5.7. При электролизе раствора, содержащего нитраты серебра, меди (II), свинца и натрия в стандартных условиях последовательность выделения веществ на катоде следующая:
1) Ag, Pb, Cu, Na 2) Ag, Pb, Cu, H2, Na 3) Ag, Pb, Cu, H2 4) Ag, Cu, Pb, H2
Решение. Относительное положение металлов в ряду активности следующее:
Na … Pb… Cu … Ag.
Последовательность их разряда обратная , причём щелочной металл натрий из водных растворов не восстанавливается и вместо него выделяется водород (табл. 5.3)..
Правильный ответ 4.
Упражнение 5.5. При электролизе раствора, содержащего нитраты меди (II), серебра, никеля и кальция в стандартных условиях, последовательность выделения веществ на катоде имеет вид …
1) Ag, Ni, Cu, Сa 2) Ag, Cu, Ni, H2, Сa 3) Ag, Cu, Ni, H2 4) Ag, Ni, Cu, H2
Упражнение 5.6. Продуктами, выделяющимися на инертных электродах при электролизе водного раствора серной кислоты, являются …
1) Н2 и SO2 2) O2 и SO2 3) H2 и S 4) H2 и O2
Для решения воспользуйтесь табл. 5.3 и табл. 5.4.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Продуктами, выделяющимися на инертных электродах при электролизе водного раствора хлорида калия, являются …
1) K и Cl2 2) H2 и Сl2 3) H2 и O2 4) K и O2
2. Продуктами, выделяющимися на инертных электродах при электролизе водного раствора сульфата натрия, являются …
1) Na и SO2 2) H2 и S 3) H2 и O2 4) Na и O2
3. Металлом, который нельзя получить электролизом раствора его соли, является …
1) Al 2) Cr 3) Pb 4) Ag
4. Уравнение процесса протекающего на инертном катоде при электролизе водного раствора гидроксида натрия, имеет вид …
1) 2H+ + 2e → H2 2) 2H2O – 4e → O2 + 4H+
2) 2H2O + 2e → H2 + 2OH ˉ 4) Na+ + e → Na
5. Уравнение процесса, протекающего на инертном аноде при электролизе водного раствора CaCl2, имеет вид.. 1) 2H2O – 4e → O2 + 4H+ 2) 4OH ˉ − 4e → O2 + 2H2O
3) Сa2+ + 2e → Сa0 4) 2Cl ˉ − 2e →Cl2
5.3. КОРРОЗИЯ МЕТАЛЛОВ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Коррозия металлов» [Часть 2 УМК, раздел 5.4].
· видеозапись лабораторной работы «Коррозия и защита металлов» [Приложение к УМК: диск 4].
Цель выполнения задания
· Усвоить суть химической и электрохимической коррозии металлов.
· Изучить факторы, влияющие на скорость коррозии.
·Ознакомиться с некоторыми методами защиты металлов от коррозии.
Теоретические сведения
Коррозией металлов называется процесс их самопроизвольного разрушения под воздействием окружающей среды. Коррозия представляет собой окислительно-восстановительный процесс, протекающий на границе раздела металл – среда. Металл всегда окисляется, а компоненты окружающей среды (О2, СО2, SO2, Cl2, H+, H2O и др.) восстанавливаются. В результате коррозии образуются продукты окисления металла – оксиды, гидроксиды, соли. Такое превращение металла сопровождается существенным изменением его механических свойств.
По механизму процесса различают химическую и электрохимическую коррозию.
Химическая коррозия происходит под воздействием агрессивных газообразных компонентов окружающей среды при высоких температурах (газовая коррозия) или под воздействием некоторых агрессивных жидкостей – неэлектролитов. Основным признаком химической коррозии является то, что она происходит без возникновения в системе электрического тока, когда реакции окисления и восстановления протекают в одной точке поверхности.
Электрохимическая коррозия протекает в электролитах и сопровождается возникновением коррозионного тока между анодными и катодными участками поверхности металла. Функцию анода выполняет более активный металл, на нём идёт окисление, в результате чего металл разрушается и его ионы «уходят» в коррозионную среду:
Ме 0 − n ē → Ме n+. (5.6)
Освободившиеся в результате окисления электроны переходят на катод и восстанавливают окислитель из среды (рис. 5.10). Вид процесса зависит от природы окислителя и состава среды.
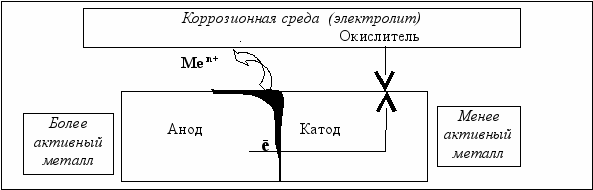
Рис. 5.10. Схема электрохимической коррозии
Уравнения наиболее часто встречающихся катодных процессов приведены в табл. 5.5
Таблица 5.5
Уравнения катодных коррозионных процессов в различных средах
| Реакция среды | Нейтральная | Кислая | Щелочная |
| Уравнения реакций | О2 + 2Н2О + 4ē → 4 ОН─ | 2Н+ + 2е → Н2 или О2 + 4Н+ + 4ē → 2 Н2О | 4ОН─+ 4ē → О2 + 2Н2О |
Отличием электрохимической коррозии от химической является то, что процессы окисления и восстановления протекают на разных участках поверхности корродирующих металлов.
Пример 5.8. Сталь (в первом приближении железо) плотно контактирует с никелем и оба металла находятся в воде, в которой растворён кислород, т.е. в нейтральной среде (табл. 5.5). Какой из металлов будет корродировать? Запишите электронные уравнения анодного и катодного процесса.
Решение. На менее активном металле − никеле (табл. 5.1) будет идти катодный процесс восстановления окислителя из среды:
О2 + 2Н2О + 4ē → 4 ОН‾ (табл. 5.5).
Железо более активный металл, чем никель, т.к. имеет более электроотрицательный стандартный потенциал поэтому на железе будет сосредоточен анодный процесс окисления:
2 │ Fe0 − 2 ē → Fе 2+.
В данном случае корродирует железо. Вторичный процесс коррозии состоит во взаимодействии ионов железа с гидроксильными ионами
2Fе 2+ + 4ОН‾ → 2 Fe(OH)2.
Суммарное уравнение коррозионного процесса имеет вид
2Fe + О2 + 2Н2О → 2 Fe(OH)2.
Основные направления защиты металлов от коррозии представлены на рис. 5.11.

НАПРАВЛЕНИЯ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ






Конструктивные
меры
Защитные
покрытия
Уменьшение
агрессивности среды
Электрохимические
методы
Рис. 5.11. Схема основных направлений защиты металлов от коррозии
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Электрохимическая коррозия при контакте двух металлов
Контакт двух металлов создаётся закреплением в стальной (Fe) скрепке цинковой и медной пластинок (рис. 5.12).
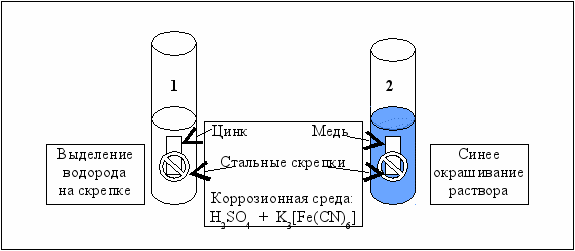
Рис. 5.12. Схема электрохимической коррозии при контакте двух металлов
Металлы помещаются в разбавленный раствор серной кислоты, куда добавляется несколько капель раствора красной кровяной соли, которая с ионами Fe2+ образует «турнбулеву синь» Fe3[Fe(CN)6]2 по уравнению
3 Fe2+ + 2 K3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 6 K+.
Запишите в табл. 5.6 стандартные электродные потенциалы Zn, Fe, Cu (табл. 5.1) и уравнения электрохимических процессов, протекающих при коррозии. Для составления катодного процесса воспользуйтесь данными табл. 5.5.
Укажите, какой из металлов корродирует (окисляется) в первом и во втором случаях, имея в виду, что только присутствие ионов железа Fe2+ окрашивает раствор в синий цвет.
Таблица 5.6
Процессы электрохимической коррозии при контакте двух металлов
 | |
| Контакт железа с цинком | Контакт железа с медью |
| Анодный процесс: (окисление) | Анодный процесс: (окисление) |
| Катодный процесс: (восстановление) | Катодный процесс: (восстановление) |
Составьте правило, по которому можно определить, какой металл будет корродировать при контакте с другим металлом.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
