Учебное пособие Рекомендовано научно-методическим советом
| Вид материала | Учебное пособие |
- Бизнес-планирование предприятия учебное пособие Рекомендовано учебно-методическим советом, 1729.98kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2005 удк 330., 1365.17kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2006, 1339.31kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2009, 2459.47kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2008, 3188.71kb.
- Учебное пособие Часть 1 Рекомендовано учебно-методическим советом угаэс уфа 2006, 1359.55kb.
- Учебное пособие Изд. 2-е, перераб и доп. Петрозаводск Издательство Петргу 2006, 1457.49kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.22kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.72kb.
- Учебно-методическое пособие, 281.65kb.
Характерные реакции оснóвных оксидов
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием щелочей (растворимых в воде оснований). Остальные оксиды металлов со степенью окисления «+2» и «+3» в воде не растворяются.
Оснóвные оксиды взаимодействуют с кислотами, с кислотными и амфотерными оксидами, а также с амфотерными гидроксидами. В результате таких реакций образуются соли.
Реакция среды может быть кислой, нейтральной и щелочной. Чистая вода имеет нейтральную реакцию среды. Окраска универсального индикатора в различных средах приводится в табл. 2.2.
Таблица 2. 2
Окраска универсального индикатора в различных средах
-
Реакция среды
Нейтральная
Кислая
Щелочная
Окраска универсального
индикатора
зелёная
красная,
жёлтая
синяя
Схемы опытов по изучению химических свойств оснóвных оксидов представлены на рис. 2.1
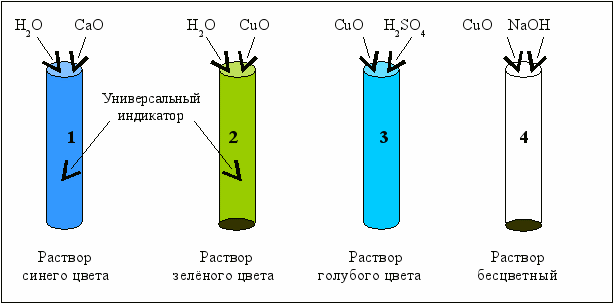
Рис. 2.1. Схемы взаимодействия оснóвных оксидов с водой и кислотой
Появление синей окраски универсального индикатора (пробирка 1) при взаимодействии оснóвного оксида с водой свидетельствует об образовании в растворе щёлочи. Напишите уравнение реакции взаимодействия оксида кальция с водой и назовите полученное соединение.
_____________________________________________________________________________
Оксид меди с водой не взаимодействует (окраска индикатора в пробирке 2 не меняется, осадок не растворяется). CuO растворяется в кислоте (в пробирке 3 образуется раствор соли меди голубого цвета) и не взаимодействует со щёлочью.
Напишите уравнение реакции взаимодействия оксида меди с серной кислотой, назовите полученную соль.
________________________________________________________________________________
Почему CuO не взаимодействует со щёлочью? _______________________________________
_______________________________________________________________________________
Объясните на основании рассмотренных опытов, почему оксиды CaO и CuO являются оснóвными.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 2.1. Основаниями являются гидроксиды
1) □ С (IV) 2) □ Mg 3) □ S (IV) 4) □ Fe (II)
Напишите формулы оснóвных гидроксидов и уравнения реакций, подтверждающих их химические свойства. Если перед номерами ответов стоят значки «□», то правильный ответ не один.
Решение.
Магний и железо являются металлами со степенью окисления «+2» и образуют оснóвные оксиды (табл. 2.1). В соответствии с принципом кислотно-оснóвного взаимодействия оксиды Mg и Fe (II) будут реагировать с соединениями кислотного характера, например, с кислотными оксидами и кислотами
Mg + SO2 → MgSO3; FeO + 2HCl → FeCl2 + H2O.
основный оксид кислотный оксид основный оксид кислота
Правильные ответы 2 и 4.
Упражнение 2.1. Основаниями являются гидроксиды
1) □ P (V) 2) □ Na 3) □ N (V) 4) □ Mn (II)
Напишите формулы оснóвных гидроксидов и уравнения реакций, подтверждающих их химические свойства.
______________________________________________________________________________
Характерные реакции кислотных оксидов
Газообразные кислотные оксиды взаимодействуют с водой с образованием кислот. Кислотные оксиды взаимодействуют со щелочами, с основными и амфотерными оксидами, а также с амфотерными гидроксидами. При этом образуются соли.
Схемы опытов по изучению химических свойств кислотных оксидов представлены на рис. 2.2.
В первой пробирке получен CO2 − оксид углерода (IV) (углекислый газ) путём взаимодействия карбоната кальция СаСО3 с соляной кислотой. Напишите данную реакцию
______________________________________________________________________________
Во второй пробирке находится вода, окрашенная в зелёный цвет универсальным индикатором. Пропускание углекислого газа приводит к изменению окраски на жёлтую, что свидетельствует о появлении в растворе кислоты.
Пропускание СО2 через раствор Са(ОН)2 приводит к выпадению белого осадка (пробирка 3), в то же время с раствором серной кислоты углекислый газ не взаимодействует (пробирка 4).
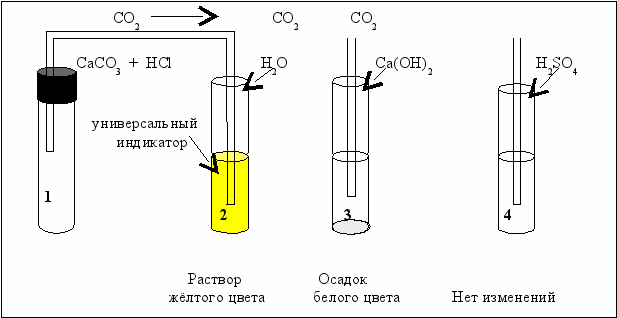
Рис. 2.2. Схемы взаимодействия кислотных оксидов с водой и основанием
Напишите уравнения реакций углекислого газа с водой и с гидроксидом кальция, назовите полученные соединения и определите, к каким классам они относятся. Почему оксид CO2 не реагирует с серной кислотой?
Объясните на основании рассмотренных опытов, почему СО2 является кислотным оксидом.
________________________________________________________________________________________________________________________________________________________________
Пример 2.2. Кислотами являются гидроксиды
□ 1) S (IV) □ 2) Na □ 3) S (VI) □ 4) Pb (II).
Напишите формулы соответствующих кислот и уравнения реакций, подтверждающих их кислотные свойства.
Решение. Оксиды натрия и Pb (II) проявляют оснóвные свойства, неметалл сера образует кислотные оксиды (см. табл. 3.1). При взаимодействии с водой образуются кислоты
SO2 + H2O = H2SO3 − сернистая кислота;
SO3 + H2O = H2SO4 − серная кислота.
В соответствии с принципом кислотно-оснóвного взаимодействия кислоты будут реагировать с соединениями оснóвного характера, например, с оснóвными оксидами и основаниями
H2SO3 + 2КОН → H2O + К2SO3 − соль, сульфит калия;
кислота основание
H2SO4 + MgO → H2O + MgSO4 − соль, сульфат магния.
кислота оснóвный оксид
Правильные ответы 1 и 3.
Упражнение 2.2. Кислотами являются гидроксиды
□ 1) N (V) □ 2) Li □ 3) Si □ 4) Ni (II).
Напишите формулы соответствующих кислот и уравнения реакций, подтверждающих их кислотные свойства.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Получение и свойства основных гидроксидов
Щёлочи (растворимые в воде основания) могут быть получены непосредственным растворением оксидов щелочных и щёлочноземельных металлов в воде. Нерастворимые в воде основания получают в результате взаимодействия растворимых солей соответствующих металлов со щелочами.
Основания взаимодействуют с кислотами, с кислотными и амфотерными оксидами, а также с амфотерными гидроксидами. В результате реакций образуются соль и вода.
Схемы опытов по получению и изучению химических свойств основных гидроксидов представлены на рис. 2.3.
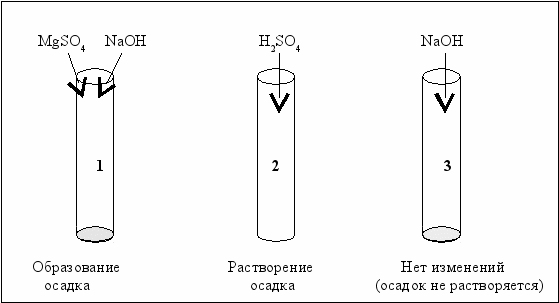
Рис. 2.3. Схемы получения и изучения свойств оснóвных гидроксидов
Нерастворимый в воде гидроксид магния получен взаимодействием растворимой соли магния и щёлочи (пробирка 1). Полученный гидроксид растворяется в кислоте (пробирка 2) и не растворяется в щёлочи (пробирка 3).
Напишите реакции получения гидроксида магния и его растворения в серной кислоте. Назовите полученные соединения. Объясните, почему Mg(OH)2 не реагирует с NaOH.
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Объясните, почему гидроксид магния обладает оснóвным характером.
________________________________________________________________________________________________________________________________________________________________
Получение и свойства амфотерных гидроксидов
Амфотерные гидроксиды взаимодействуют как с кислотами, проявляя при этом свойства оснований, так и с основаниями, проявляя свойства кислот.
Схемы опытов по получению и изучению химических свойств амфотерных гидроксидов представлены на рис. 2.4.
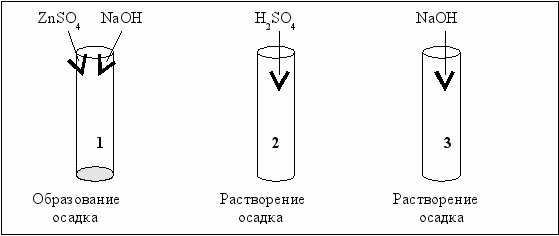
Рис. 2.4. Схемы получения и изучения свойств амфотерных гидроксидов
Нерастворимый в воде гидроксид цинка образуется при взаимодействии сульфата цинка со щёлочью (пробирка 1). Осадок растворяется как в кислоте, так и в щёлочи (пробирки 2 и 3).
Напишите реакции получения гидроксида цинка и его растворения в серной кислоте и NaOH. Назовите полученные соединения.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Объясните, почему гидроксид цинка обладает амфотерным характером.
______________________________________________________________________________
Пример 2.3. Амфотерным являются гидроксиды
□ 1)марганца (VII) □ 2) кальция, □ 3) бериллия, □ 4) алюминия
Напишите формулы гидроксидов в виде соответствующих кислот и в виде соответствующих оснований, а также уравнения реакций, подтверждающих их амфотерные свойства.
Решение.
Гидроксид марганца (VII) проявляет кислотные свойства, а гидроксид кальция − основные (см. табл. 3.1). Оксиды и гидроксиды металлов со степенью окисления «+3, +4», а также некоторые гидроксиды металлов со степенью окисления «+2», в том числе гидроксид бериллия являются амфотерными. Формулы амфотерных гидроксидов можно записать как в кислотной, так и в оснóвной форме:
Be(OH)2 <══> H2BeO2 ,
основание: гидроксид бериллия бериллиевая кислота
Al(OH)3 <══> H3AlO3 <══> HАlO2 + H2O.
основание: гидроксид алюминия ортоалюминиевая кислота метаалюминиевая кислота
Реакции амфотерных гидроксидов с кислотами, подтверждающие их оснóвные свойства: Be(OH)2 + 2HNO3 → 2H2O + Be(NO3)2 − соль, нитрат бериллия;
2Al(OH)3 + 3H2SO4 → 6H2O + Al2(SO4)3 − соль, сульфат алюминия.
Реакции амфотерных гидроксидов с основаниями, подтверждающие их кислотные свойства: H2BeO2 +2КОН → 2Н2О + К2ВеО2 − соль, бериллат калия;
HАlO2 + 2NaOH → H2O + NaAlO2 − соль, метаалюминат натрия.
Правильные ответы 3 и 4.
Упражнение 2.3.
Амфотерным является гидроксид 1) C (IV) 2) Ca 3) Мn (IV) 4) N (III)
Напишите формулы соответствующей кислоты и соответствующего основания, а также уравнения реакций, подтверждающих их кислотные и основные свойства.
________________________________________________________________________________________________________________________________________________________________
Составление уравнений реакций получения солей
Соли – сложные вещества, состоящие из кислотного и основного остатков. Соли бывают средние, кислые и основные. Примеры средних солей смотрите в табл. 2.3.
Общая формула средних солей: Меxy+Ayx, где x – число атомов металла, равное заряду кислотного остатка; y – число кислотных остатков, равное заряду атомов металла.
Формулы солей записываются в соответствии со степенью окисления атомов металлов и зарядом кислотных остатков. При этом необходимо помнить, что молекулы солей электронейтральны.
+2 1− +1 2−
Например: CaCl2 [+2 + (1−)·2 = 0], Na2SO4 [(+1)·2 + (2−) = 0].
Средние соли образуются при полном замещении атомов водорода в кислоте атомами металла или гидроксильных групп в основании кислотными остатками.
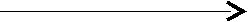 H2SO4 замещение атомов водорода – Н Na2SO4;
H2SO4 замещение атомов водорода – Н Na2SO4;кислота атомами металла – Na соль
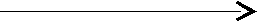 Mg(OH)2 замещение гидроксильных групп – ОН MgCl2.
Mg(OH)2 замещение гидроксильных групп – ОН MgCl2.основание кислотными остатками – Cl соль
Кислые соли образуются при неполном замещении водорода в молекулах многоосновных кислот атомами металла, т.е. в избытке кислоты. Например:
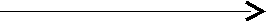 H2SO4 неполное замещение атомов водорода – Н NaНSO4.
H2SO4 неполное замещение атомов водорода – Н NaНSO4.двухосновная кислота атомами металла – Na кислая соль
Двухосновная кислота с любым металлом образует одну среднюю соль и одну кислую. Трехосновная кислота с любым металлом образует одну среднюю и две кислые соли. Одноосновные кислоты кислых солей не образуют.
Оснóвные соли образуются при неполном замещении гидроксильных групп в молекулах многокислотных оснований кислотными остатками, т.е. в избытке основания. Например:
M
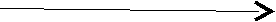 g(OH)2 неполное замещение гидроксильных групп – ОН MgОНCl.
g(OH)2 неполное замещение гидроксильных групп – ОН MgОНCl.двухкислотное основание кислотным остатком – Cl оснóвная соль
Двухкислотное основание может образовывать одну среднюю и одну оснóвную соль с данным кислотным остатком. Трехкислотное основание образует одну среднюю и две основные соли с данным кислотным остатком. Однокислотные основания оснóвных солей не образуют.
Таблица 2.3
Номенклатура некоторых кислот и солей
| Оксиды | Формулы кислот | Названия кислот | Соли средние | |
| формулы | названия | |||
| N2O3 | HNO2 | Азотистая | KNO2 | Нитрит натрия |
| N2O5 | HNO3 | Азотная | Cu(NO3)2 | Нитрат меди (II) |
| SO2 | H2SO3 | Сернистая | FeSO3 | Сульфит железа (II) |
| SO3 | H2SO4 | Серная | (NH4)2SO4 | Сульфат аммония |
| − | H2S | Сероводородная | PbS | Сульфид свинца (II) |
| − | HCl | Соляная | AlCl3 | Хлорид алюминия |
| CO2 | H2CO3 | Угольная | Na2CO3 | Карбонат натрия |
| SiO2 | H2SiO3 | Кремниевая | CaSiO3 | Силикат кальция |
| P2O5 | H3РO4 | Ортофосфорная | Mg3(РO4)2 | Ортофосфат магния |
| CrO3 | H2CrO4 | Хромовая | K2CrO4 | Хромат калия |
Порядок составления реакций получения солей рассмотрим на примере сульфата магния. Запишем формулу соли, а также формулы соответствующих оксидов и гидроксидов, из которых может быть получена данная соль:
соль: MgSO4;
кислота: H2SO4; оснóвный оксид: MgO;
кислотный оксид: SO3; оснóвный гидроксид: Mg(OH)2.
При составлении уравнений реакций получения соли следует иметь в виду принцип кислотно-оснóвного взаимодействия.
а) MgO + SO3 → MgSO4;
оснóвный оксид кислотный оксид соль
б) MgO + H2SO4 → MgSO4 + H2О;
оснóвный оксид кислота соль
в) Mg(OH)2 + SO3 → MgSO4 + H2O;
основание кислотный оксид соль
г) Mg(OH)2 + H2SO4 → MgSO4 + 2 H2O.
основание кислота соль
Выберите вариант в табл. 3.4. и напишите уравнения реакций получения средней соли, предложенной в вашем варианте.
Таблица 2.4
Варианты заданий
| Номер варианта | Название соли | Номер варианта | Название соли |
| I | Карбонат кальция | IV | Сульфит калия |
| II | Фосфат калия | V | Карбонат натрия |
| III | Силикат натрия | VI | Сульфат кальция |
Запишите формулы соответствующих соединений и уравнения реакций получения данной соли.
Соль _________,
кислота _______, кислотный оксид ________, основание _________, оснóвный оксид ______.
а) __________________________________________________________________________,
б) __________________________________________________________________________,
в) __________________________________________________________________________,
г) __________________________________________________________________________.
Пример 2.4.
Получению кислых солей соответствуют уравнения:
□ 1) KOH + H3PO4 → KH2PO4 − кислая соль, дигидрофосфат калия;
□ 2) 2 KOH + H3PO4 → K2HPO4 − кислая соль, гидрофосфат калия;
□ 3) 3 KOH + H3PO4 → K3PO4 − средняя соль, фосфат калия;
□ 4) 6 KOH + P2O5 → 2 K3PO4 − средняя соль, фосфат калия.
Закончите уравнения реакций, не меняя коэффициенты в левой части уравнения, и напишите названия полученных солей.
Правильные ответы 1 и 2.
Упражнение 2.4.
Основные соли образуются в реакциях, уравнения которых начинаются следующим образом: □ 1) NaOH + H2SO4 → □ 2) 2 KOH + N2O5 →
□ 3) Al(OH)3 + 2HNO3 → □ 4) Fe(OH)2 + HCl →
Закончите уравнения реакций, не меняя коэффициенты в левой части уравнения, и напишите названия полученных солей.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Принцип кислотно-основного взаимодействия
Все написанные ранее реакции соответствуют принципу кислотно-основного взаимодействия, согласно которому соединения, проявляющие кислотные свойства реагируют с соединениями, проявляющими оснóвные свойства.
Пример 2.5.
Какие из соединений:
□ 1) H2CO3 и P2O5 □ 2) H2S и Na2O □ 3) MgO и CrO3 □ 4) Fe(OH)2 и K2O
могут взаимодействовать между собой? Напишите уравнения реакций, названия всех веществ, указав к какому классу соединений они относятся и какими свойствами (оснόвными, кислотными, амфотерными) обладают. Объясните, почему не могут взаимодействовать другие из указанных соединений.
Решение.
1) H2CO3 − угольная кислота не будет взаимодействовать с кислотным оксидом P2O5.
2) H2S − сероводородная кислота будет взаимодействовать с оснóвным оксидом Na2O
H2S + Na2O → H2O + Na2S − соль, сульфид натрия.
3) MgO основный оксид при определённых условиях может вступить в реакцию с амфо-
терным (см. табл. 3.1) оксидом CrO3
MgO + CrO3 → MgCrO4 − соль, хромат магния.
4) Оснóвный гидроксид Fe(OH)2 не будет вступать в реакцию с оснóвным оксидом K2O.
Правильные ответы 2 и 3.
Упражнение 3.5.
Какие из соединений:
□ 1) SO2 и P2O5 □ 2) HNO3 и Na2O □ 3) NaOH и Al(OH)3 □ 4) NaOH и BaО
могут взаимодействовать между собой? Напишите уравнения реакций, названия всех веществ, указав к какому классу соединений они относятся и какими свойствами (оснόвными, кислотными, амфотерными) обладают. Объясните, почему не могут взаимодействовать другие из указанных соединений.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
Отметьте правильные ответы. Если перед номерами ответов стоят значки «□», то правильный ответ не один.
1. Оснóвный характер имеют оксиды, образованные металлами
1) со степенью окисления +1 и +2 2) со степенью окисления равной и выше +4
3) любой степени окисления 4) главных подгрупп
2. Основные свойства проявляют гидроксиды
□ 1) Sn (IV), □ 2) Na, □ 3) S (VI), □ 4) N (III).
3. Формула высшего оксида элемента, образующего летучее водородное соединение ЭН4, имеет вид 1) ЭО2 2) ЭО4 3) ЭО 4) ЭО3
4. Оксиды образуются
1) при растворении негашёной извести 2) при горении железа в хлоре
3) при растворении хлора в воде 4) при горении природного газа
5. Кислотами являются гидроксиды □ 1) Сr (VI) □ 2) Ca □3) Р (V) □ 4) Fe (II)
6. Какие из соединений:
□ 1) H2SiO3 и N2O5 □ 2) H2SO3 и Na2O □ 3) MgO и ZnO □ 4) Ni(OH)2 и FeO
могут взаимодействовать между собой?
7. При взаимодействии 1 моль гидроксида натрия и 1 моль оксида серы (IV) образуется _________ соль 1) основная 2) кислая 3) средняя 4) двойная
8. Фосфат калия образуется в реакциях
1) □ Р2О5 + 6КОН 2) □ Р2О5 + 2КОН
3) □ 3КОН + Н3РО4 4) □ КОН + Н3РО4
9. Получению основных солей соответствуют следующие уравнения
□ 1) Cu(OH)2 + 2 HCl → □ 2) Cu(OH)2 + HCl →
□ 3) Fe(OH)3 + HNO3 → □ 4) Fe(OH)3 + 3HNO3 →
Для заметок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 3. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
3.1. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Основы химической термодинамики» [Часть 2 УМК, раздел 3.1].
Цель выполнения задания
∙ Ознакомиться с основными термодинамическими параметрами химических процессов и научиться вести термохимические расчёты;
∙ Усвоить принцип решения вопроса о возможности и направлении самопроизвольного протекания химических процессов в стандартных условиях.
Теоретические сведения
Термодинамическая система ─ тело или группа тел, находящихся во взаимодействии и мысленно выделяемых из окружающего материального пространства. Между отдельными частями термодинамической системы, а также между системой и окружающей средой происходит обмен энергией.
Совокупность всех химических и физических свойств системы характеризует её состояние. Для характеристики состояния системы используются термодинамические параметры, в том числе:
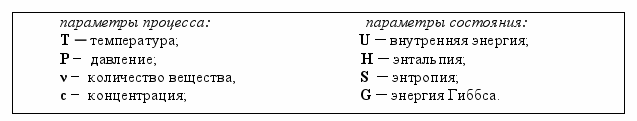
Функции состояния (U, H, S, G) обладают тем общим свойством, что их изменение (Δf) не зависит от пути процесса, а зависит от начального и конечного состояния системы.
Δ f сост. процесса = fсост. конечных веществ ─ fсост. начальных веществ.
(продуктов реакции) (исходных веществ)
Термодинамические функции в стандартных условиях (Р = 100 кПа, Т = 298 К (25 оС), ν = 1 моль) записываются так: Δ fН0298 (Δ fН0); S0298 (S0); Δ fG0 298 (Δ fG0).
Их значения приводятся в справочной литературе и используются в термодинамических расчётах.
Изменение энергии системы при протекании в ней необратимой химической реакции и условии, что совершается только работа расширения, называется тепловым эффектом химического процесса (ΔrН.).
Если запас энергии у конечных веществ выше чем у начальных, то система пополнила запас энергии за счёт окружающей среды. Такая реакция называется эндотермической и ΔrН > 0.
Когда запас энергии у продуктов реакции меньше, чем у начальных веществ, то система выделила в окружающую среду какое-то количество энергии. Такая реакция называется экзотермической и ΔrН < 0.
Закон Г.И.Гесса гласит: тепловой эффект химических реакций, протекающих при V,Т─const или Р,Т─const, не зависит от пути протекания процесса, а определяется лишь начальным и конечным состоянием системы.
Из закона Гесса следует, что тепловой эффект химического процесса равен разности между суммами энтальпий образования продуктов реакции и исходных веществ:
ΔrН = Σ ν ∙ΔfН (продуктов реакции) - Σ ν ∙Δ fН (исходных веществ), (3.1)
где ν ─ стехиометрические коэффициенты в уравнении реакции.
Раздел химии, изучающий тепловые эффекты, называется термохимией, а реакции, в которых указываются тепловые эффекты ─ термохимическими реакциями. В этих реакциях под формулами веществ понимают их количества, выраженные в моль, а поэтому в уравнениях реакций допустимы дробные коэффициенты.
Самопроизвольными называются процессы, которые идут без внешнего воздействия. Химическая термодинамика вводит функции, определяющие направление самопроизвольного протекания процесса.
Если система изолированная (не обменивается с окружающей средой ни веществом, ни энергией), то в ней самопроизвольно протекают процессы в сторону увеличения её неупорядоченности (уменьшения упорядоченности). Примером таких процессов может служить распределение воздуха по всему объёму помещения, растворённых частиц по всему объёму раствора, увеличением энтропии сопровождаются химические реакции, в ходе которых увеличивается число моль газообразных веществ.
В неизолированных системах критерием самопроизвольного протекания процесса служит изобарно-изотермический потенциал (энергия Гиббса) − ΔrG. Она учитывает совместное влияние на ход химического процесса энтальпийного и энтропийного факторов и рассчитывается по формуле:
ΔrG = ΔrН – Т ∙ ΔrS. (3.2)
где Т − температура, К;
ΔrS − изменение энтропии в химическом процессе:
Δ r S = Σ ν ∙ Sпродуктов реакции - Σ ν ∙ Sисходных веществ. (3.3)
В необратимых (односторонних) процессах энтальпия уменьшается ΔrН < 0, а энтропия растёт ΔrS > 0, тогда ΔrG < 0. Следовательно, в самопроизвольно протекающих процессах энергия Гиббса уменьшается Δ r G < 0.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Пример 3.1. При термическом разложении 1 моль карбоната кальция поглощается 178,5 кДж. Какое количество теплоты необходимо для разложения 10 кг СаСО3?
Решение.
Вычислим молярную массу СаСО3 и найдём массу одного моль:
Мr(СаСО3)=(40+12+16·3)=100; М (СаСО3)=100 г/моль; m(1 моль)СаСО3 = 100г.
10 кг СаСО3 составляет 10000 г, или (10000 г : 100 г/моль) = 100 моль.
При разложении 1 моль поглощается 178,5 кДж теплоты, а при разложении 100 моль ─ 17850 кДж.
Упражнение 3.1. При взаимодействии 4,6 г натрия с 6,4 г серы выделяется ______ кДж теплоты (стандартная теплота образования Na2S равна 372 кДж/моль).
1) 74,4 2) 37,2 3) 45,6 4) 55,8
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 3.2. При разложении 1 моль карбоната кальция поглощается 178,5 кДж теплоты. Объем выделившегося при этом газа равен ________ литра
1) 5,6 2) 44,8 3) 22,4 4) 11,2
Решение. В соответствии с уравнением реакции
СаСО3(твёрд.) → СаО (твёрд.) + СО2 (газ)
при разложении 1 моль карбоната кальция выделяется 1 моль углекислого газа, который при нормальных условиях занимает объём 22,4 л.
Упражнение 3.2. В соответствии с термохимическим уравнением
FeO (твёрд.) + H2 (газ) ↔ Fe (твёрд.) + H2O (газ), ΔrH0 = 23 кДж
для получения 560 г железа необходимо затратить ____ кДж тепла.
1) 23 2) 115 3) 560 4) 230
________________________________________________________________________________________________________________________________________________________________
В упражнениях, приведённых ниже, укажите правильные ответы.
Упражнение 3.3. Термодинамическая функция, характеризующая степень упорядоченности состояния системы, называется …
1) теплоемкостью 2) энтропией 3) внутренней энергией 4) энтальпией
Упражнение 3.4. При переходе от кристаллического состояния вещества к газообразному его энтропия … 1) изменяется хаотично 2)возрастает
3) остается неизменной 4) уменьшается
Упражнение 3.5. Уравнение реакции, для которой энтропия увеличивается, имеет вид
1) С2Н2(г) + 2Н2(г) → С2Н6(г) 2) 2Н2(г) + O2(г) → 2H2O(г)
3) 2СН4(г) → С2Н2(г) + 3Н2(г) 4) 2NО(г) + O2(г) → 2NO2(г)
Упражнение 3.6. В системе, находящейся при постоянном давлении и температуре, самопроизвольно могут протекать процессы, для которых …
1) ΔrS < 0 2) ΔrH > 0 3) ΔrG > 0 4)ΔrG < 0
Пример 3.3. Реакция СО2 (газ) + С (твёрд.) → 2СО (газ), для которой
Δr H0 = 173 кДж, ∆rS0 = 176 Дж/ K, при стандартных условиях …
1) протекает в обратном направлении 2) находится в равновесии
3) протекает в обоих направлениях 4) протекает в прямом направлении
Решение. В неизолированных системах критерием самопроизвольного протекания процесса служит изобарно-изотермический потенциал (энергия Гиббса) − ΔrG, значение которого в стандартных условиях рассчитывается по формуле 3.2:
ΔrG = ΔrН – Т ∙ ΔrS = 173 кДж − 298 К · 0,176 Дж/К = 173 кДж − 52,5 кДж = 120,5 кДж.
В данном случае ΔrG > 0, поэтому реакция самопроизвольно протекает в обратном направлении.
Упражнение 3.7. Реакция 2 NO (газ) + O2 (газ) ↔ 2 NO2 (газ), для которой:
Δr H0 = −120 кДж, ∆rS0 = −159 Дж/ K, при стандартных условиях …
1) протекает в обратном направлении 2) находится в равновесии
3) протекает в обоих направлениях 4) протекает в прямом направлении
____________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Формула для расчёта теплового эффекта химического процесса в условиях p,T − const имеет вид
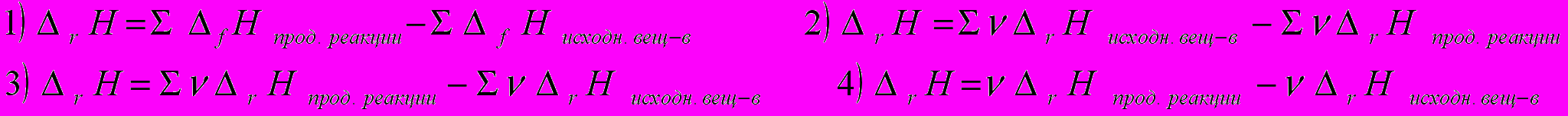
2. Для получения 22,4 л (н.у.) аммиака по реакции
N2 (газ) + 3H2 (газ) ↔2NH3 (газ), ΔrH = − 93,2 кДж
требуется затратить ________кДж теплоты
1) 46,6 2) 139,8 3) 69,9 4) 93,2
3. Реакция Fe2O3(твёрд.) + 3H2 (газ) → 2Fe(твёрд.) + 3H2O (газ), для которой ΔrH0 = 96,6 кДж, ∆rS0 = 138,7 Дж/K при стандартных условиях …
1) находится в колебательном режиме 2) протекает в обратном направлении
3) находится в равновесии 4) протекает в прямом направлении
3.2. ХИМИЧЕСКАЯ КИНЕТИКА
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить;
· лекцию «Химическая кинетика» [Часть 2 УМК, раздел 3.2];
· видеозапись лабораторной работы «Химическая кинетика. Скорость химических реакций» [Приложение к УМК: диск 1, работа 1].
Цель выполнения задания
· Усвоить основные положения химической кинетики.
· Изучить факторы, влияющие на скорость химических реакций.
Теоретические сведения
Химическая кинетика изучает механизмы химических реакций и факторы, влияющие на скорость химических процессов.
Под скоростью химической реакции понимают число элементарных взаимодействий в единицу времени. Химические реакции подразделяются на элементарные (одностадийные) и сложные. Уравнение химической реакции раскрывает механизм только одностадийной реакции. Большинство реакций являются сложными и представляют суммарный результат нескольких элементарных процессов, в этом случае уравнение реакции не отражает их реальный механизм. в формальной кинетике в целях упрощения принимается, что реакции являются элементарными и их уравнения отражают механизм реакции.
Скорость реакции определяется, прежде всего, природой реагирующих веществ и может быть изменена под влиянием следующих основных факторов:
∙ температуры;
∙ концентрации реагирующих веществ;
∙ давления (если в реакции участвуют газы);
∙ присутствия катализатора;
∙ для гетерогенных процессов ─ величиной поверхности раздела фаз.
Влияние концентрации реагирующих веществ на скорость химической кинетики выражается законом действующих масс:
При постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Кинетическое уравнение имеет вид:
υ = k ∙ (сА)а ∙ (сB)b , (3.4)
где k ─ константа скорости реакции;
с А, с B ─ концентрации реагирующих веществ А и В;
a, b ─ коэффициенты в уравнении реакции соответственно.
С повышением температуры скорость химических реакций увеличивается.
По правилу Вант-Гоффа, установленному экспериментально, при изменении температуры на каждые 10 градусов скорость химической реакции изменяется в (2-4) раза
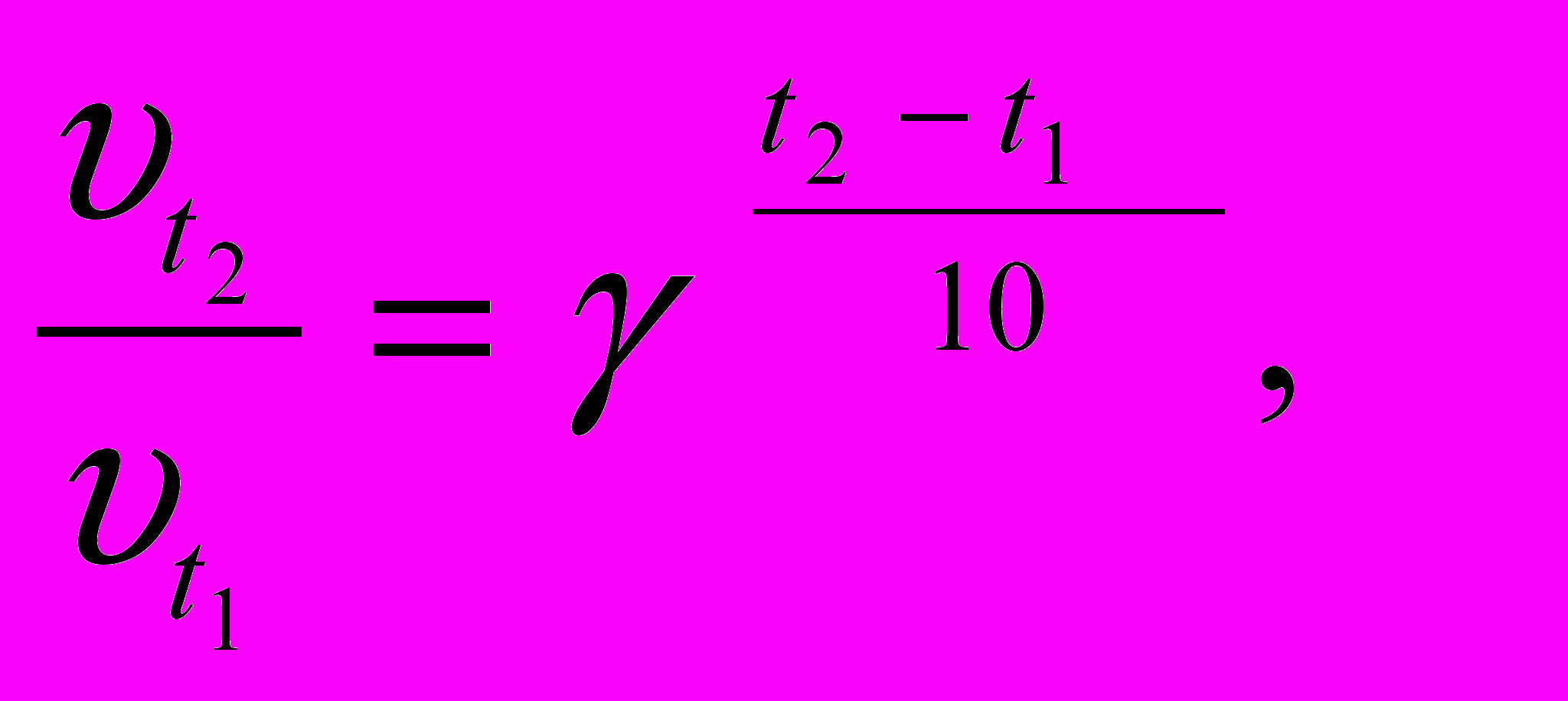 (3.5)
(3.5) где υ t1 и υ t2 – скорость реакции при температурах t1 и t2 ;
γ – температурный коэффициент скорости реакции, показывающий во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 0.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Влияние концентрации реагирующих веществ на скорость химической реакции
Схема проведения эксперимента и полученные результаты представлены на рис. 3.1.
Взаимодействие тиосульфата натрия (Na2S2O3) с серной кислотой
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S↓
сопровождается образованием осадка серы коллоидной степени дисперсности, что вызывает опалесценцию и дальнейшее помутнение раствора. По данному признаку можно судить о скорости химической реакции.
В три пробирки из бюретки наливается соответственно 1, 2, 3 мл раствора тиосульфата натрия, затем в первую пробирку добавляется 2 мл дистиллированной воды, во вторую – 1 мл, в третью ─ вода не добавляется. Таким образом, имеются три раствора с увеличивающейся концентрацией Na2S2O3.
Заметив время, в первую пробирку приливается 1 мл раствора серной кислоты, содержимое перемешивается и при наблюдении на темном фоне в проходящем свете отмечается время помутнения раствора. Число секунд, прошедшее от момента приливания кислоты (начало реакции) до помутнения указано на рис. 3.1. Аналогично выполняется опыт со второй и третьей пробирками.
Внесите в табл. 3.1 время помутнения раствора и рассчитаете относительную скорость реакции, разделив единицу на время помутнения.
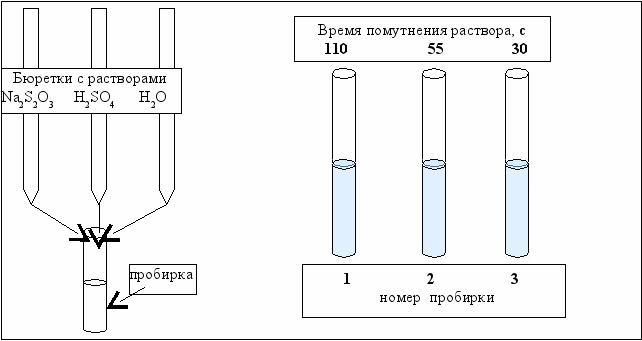
Рис. 3.1. Схема проведения эксперимента по изучению влияния концентрации веществ на скорость химической реакции
Таблица 3.1
Зависимость скорости реакции от концентрации тиосульфата натрия
| Номер пробирки | Объем раствора, мл | Время помутнения, τ, с | Относительная скорость реакции, υ = 1: τ, с-1 | ||
| Na2S2O3 | H2O | H2SO4 | |||
| 1 | 1 | 2 | 1 | | |
| 2 | 2 | 1 | 1 | | |
| 3 | 3 | − | 1 | | |
Представьте результаты эксперимента в виде графика (рис. 3.2), отложив по оси абсцисс объём раствора тиосульфата натрия (концентрация), а по оси ординат – относительную скорость реакции.
Рис. 3.2. Зависимость скорости реакции от концентрации тиосульфата натрия
Запишите кинетическое уравнение реакции взаимодействия тиосульфата натрия с серной кислотой.
______________________________________________________________________________
Сделайте вывод о влиянии концентрации Na2S2O3 на скорость химической реакции.
____________________________________________________________________________________________________________________________________________________________
Пример 3.4. Как изменится скорость реакции образования аммиака
N2 (газ) + 3 H2(газ) → 2 NH3 (газ),
если первоначальную концентрацию водорода увеличить в три раза?
Решение. Запишем кинетическое уравнение реакции
υ = k с (N2) · (с (Н2) )3.
При увеличении концентрации водорода в три раза кинетическое уравнение примет вид:
υ/ = k с (N2) · (3с (Н2) )3.
Отношение «υ/» к «υ» показывает во сколько раз увеличится скорость реакции:
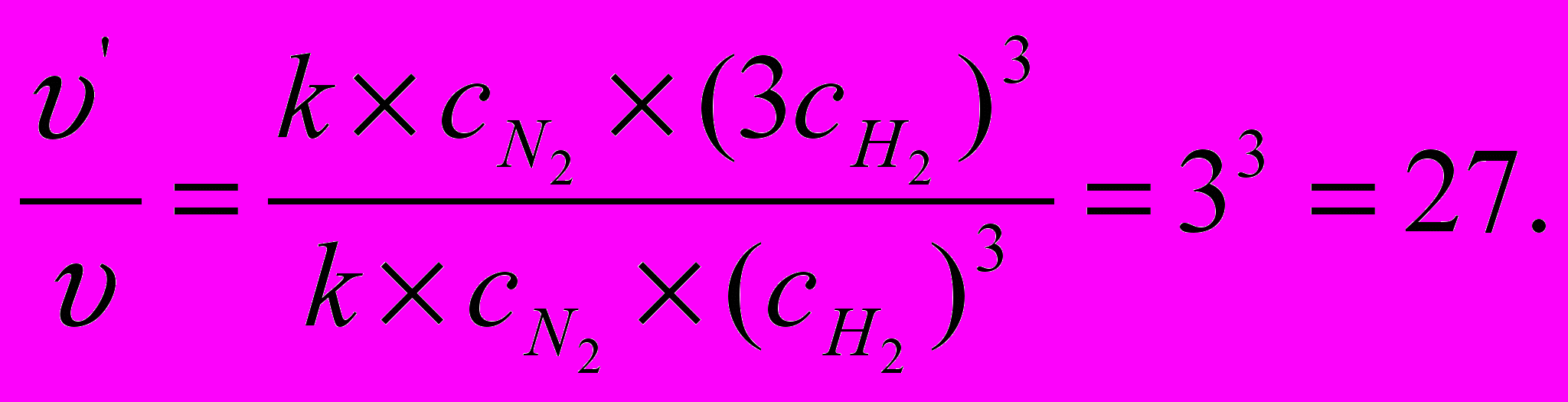
Упражнение 3.8. Как изменится скорость сгорания метана
СН4 (г) + 2 О2 (г) → СО2 (г) + 2 Н2О (г),
если парциальные давления исходных веществ увеличить в два раза?
Кинетическое уравнение реакций с участием газообразных веществ может быть выражено не через концентрации, а через парциальные давления (р):
υ = k ∙р (СН4)∙ р2 (O2) .
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 3.5. Для увеличения скорости обратной реакции
4 HCl (газ) + O2 (газ) <==> 2 H2O (пар) + 2 Cl2 (газ)
в 16 раз парциальные давления продуктов реакции следует увеличить в ____ раз
1)16 2) 8 3) 4 4) 2
Запишем кинетическое уравнение обратного процесса
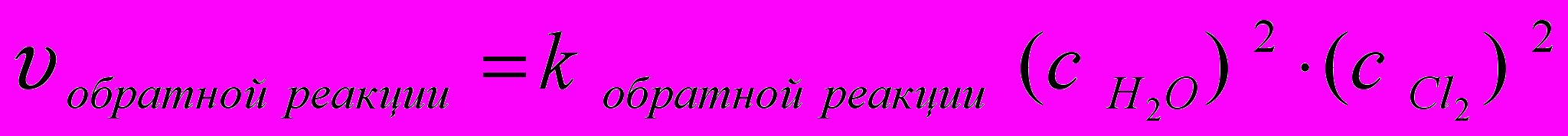 .
.Обозначим через «х» величину изменения парциального давления и запишем изменённое кинетическое уравнение
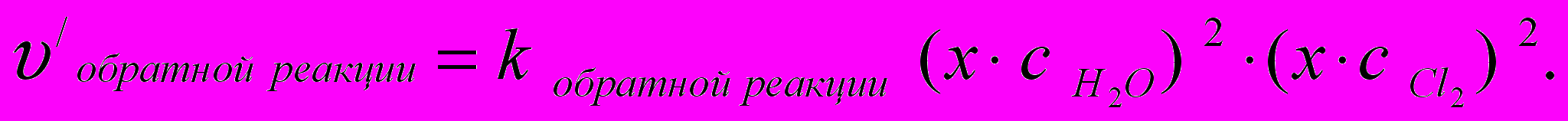
Отношение «υ/» к «υ» показывает во сколько раз увеличится скорость реакции:
υ/обратной реакции : υобратной реакции = х4.
По условию задачи эта величина равна 16-и, следовательно, х4 = 16 и х = 2.
Правильный ответ 4) 2.
Упражнение 3.9. Для увеличения скорости прямой реакции
2 NO (газ) + O2 (газ) ↔ 2 NO2 (газ) в 1000 раз необходимо увеличить давление в ____ раз.
1) 330 2) 200 3) 500 4) 10
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние температуры на скорость химической реакции
Зависимость скорости реакции от температуры изучается также на примере взаимодействия тиосульфата натрия с серной кислотой. Объёмы растворов берутся такими же, как в первой пробирке предыдущего опыта.
Вначале выполняется опыт при комнатной температуре (Т1), а затем при температуре на 20 0С выше (Т2), для чего пробирки с исходными растворами предварительно выдерживаются в водяной бане при температуре Т2 в течение 5–7 минут. Схема проведения эксперимента и полученные результаты представлены на рис. 3.3.
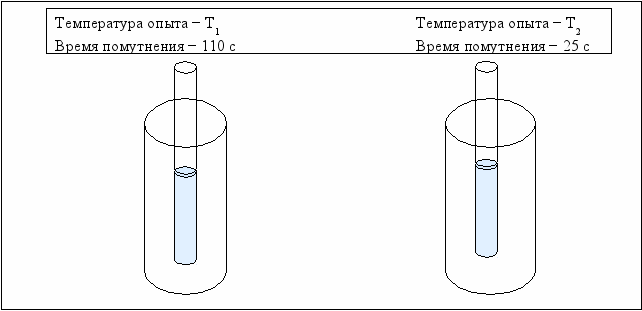
Рис. 3.3. Схема проведения эксперимента по изучению влияния температуры
на скорость химической реакции
Внесите в табл. 3.2 время помутнения раствора и рассчитаете относительную скорость реакции и температурный коэффициент «γ» (формула 3.5) и заполните таблицу 3.2.
Таблица 3.2
