Учебное пособие Рекомендовано научно-методическим советом
| Вид материала | Учебное пособие |
- Бизнес-планирование предприятия учебное пособие Рекомендовано учебно-методическим советом, 1729.98kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2005 удк 330., 1365.17kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2006, 1339.31kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2009, 2459.47kb.
- Учебное пособие Рекомендовано учебно-методическим советом угаэс уфа-2008, 3188.71kb.
- Учебное пособие Часть 1 Рекомендовано учебно-методическим советом угаэс уфа 2006, 1359.55kb.
- Учебное пособие Изд. 2-е, перераб и доп. Петрозаводск Издательство Петргу 2006, 1457.49kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.22kb.
- Учебное пособие для вузов Составитель Т. А. Тернова, 241.72kb.
- Учебно-методическое пособие, 281.65kb.
Зависимость скорости реакции от температуры
| Температура опыта, оС | Время помутнения, с | Относительная скорость реакции, υ=1:τ, с-1 | Температурный коэффициент скорости реакции, γ | |
| теоретический | экспериментальный | |||
| Т1 = | τ 1 = | υТ1 = | 1,8 | |
| Т2 = | τ 2 = | υТ2= | ||
Что характеризует «γ»? Сравнив экспериментальное значение температурного коэффициента с теоретическим значением, оцените точность эксперимента.
________________________________________________________________________________________________________________________________________________________________
Пример 3.6. Температурный коэффициент реакции равен 3. При охлаждении сис-
темы от 500 С до300 скорость химической реакции …
1) уменьшится в 9 раз 2) увеличится в 9 раз 3) уменьшится в 6 раз 4) не изменится
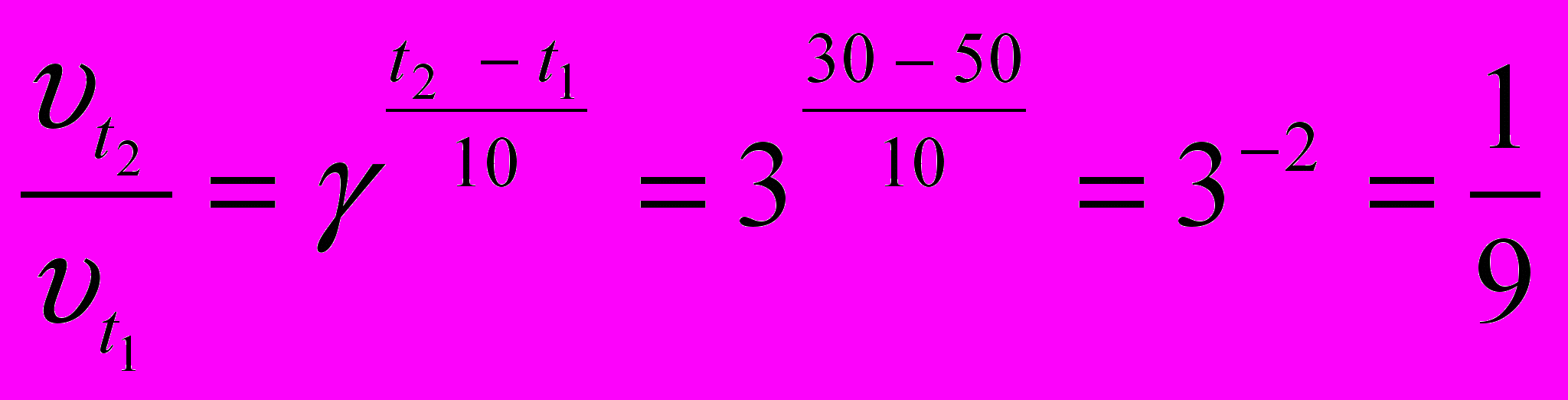 .
. Правильный ответ уменьшится в 9 раз.
Пример 3.7. Образец СаСО3 растворяется в соляной кислоте при 20 0С в течение 6 минут, при 40 0С – за 40 секунд. Температурный коэффициент реакции равен …
1) 2 2) 2,5 3) 3 4) 4
6 минут составляет 360 секунд. Температура увеличилась на 20 0С, скорость увеличилась в (360 : 40) = 9 раз. При изменении температуры на 10 0С скорость увеличится в три раза, т.е. температурный коэффициент равен трём.
Упражнение 3.10. Если температурный коэффициент реакции карбоната магния с кислотой равен 3 и при температуре 25 оС она заканчивается за 36 минут, то при температуре 45 оС время завершения будет равно _______ минут(ы).
1) 3 2) 4 3) 6 4) 8
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Основные факторы, от которых зависит скорость химических реакций:
1) природа реагирующих веществ и температура
2) в растворах: природа и концентрация реагирующих веществ, температура, присутствие катализатора
3) в газообразной системе: парциальные давления участников реакции, температура, присутствие катализатора 4) концентрация реагирующих веществ и температура
2. Если увеличить давление в 10 раз, то скорость прямой реакции
H2 (газ) + Br2 (газ)↔2 HBr (г),
при условии ее элементарности, увеличится в ____ раз.
1) 50 2) 100 3) 20 4) 5
3. Если скорость реакции увеличилась в 8 раз при повышении температуры на 30 0С, то температурный коэффициент скорости равен …..
1) 9 2) 3 3) 2 4) 8
3.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить;
· лекцию «Химическое равновесие» [Часть 2 УМК, раздел 3.1];
· видеозапись лабораторной работы «Химическое равновесие» [Приложение к УМК: диск 1, работа 2].
Цель выполнения задания
· Усвоить механизм установления химического равновесия и его отличительные признаки.
· Рассмотреть влияние внешних условий на смещение химического равновесия.
Теоретические сведения
Большинство химических процессов обратимы, т.е. наряду с прямой реакцией, по мере накопления продуктов реакции, начинает идти обратный процесс. Состояние равновесия наступает в тот момент, когда скорость прямой реакции станет равной скорости обратной реакции. Химический процесс при этом не прекращается, но концентрации всех веществ не меняются, называются равновесными и в кинетическом уравнении записываются в квадратных скобках.
Константа химического равновесия представляет собой отношение константы скорости прямой реакции к константе скорости обратной реакции, а также отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ. Константа химического равновесия зависит от температуры и природы реагирующих веществ, но не зависит от концентрации.
Если под воздействием внешних факторов (изменения концентрации реагирующих веществ, температуры, давления) скорость прямой и обратной реакции изменяется в разной степени, то химическое равновесие нарушается (смещается):
а) при увеличении концентрации исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов, химическое равновесие смещается к исходным веществам;
б) при увеличении внешней температуры химическое равновесие смещается в сторону эндотермической реакции (ΔrН > 0), а при уменьшении температуры − в сторону экзотермической реакции (ΔrН < 0);
в) при увеличении внешнего давления химическое равновесие смещается в сторону меньшего числа моль газов, т.е. в сторону понижения давления, при уменьшении внешнего давления − в сторону большего числа моль газов, т.е. в сторону повышения давления.
Общий принцип, определяющий влияние различных факторов на равновесие системы, называется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Влияние изменения концентрации реагирующих веществ
на смещение химического равновесия
Реакция между хлоридом железа (III) и роданидом калия идет с образованием окрашенного в интенсивно красный цвет роданида железа (III) и является обратимой:
 FeCl3 + 3 KCNS Fe(CNS)3 + 3 KCl.
FeCl3 + 3 KCNS Fe(CNS)3 + 3 KCl.При увеличении скорости прямой реакции увеличивается количество образовавшихся продуктов реакции (Fe(CNS)3 и KCl) и окраска раствора становится более интенсивной. Наоборот, при увеличении скорости обратной реакции окраска раствора становится менее интенсивной, т.к. увеличивается концентрация исходных веществ.
Схема проведения эксперимента и полученные результаты представлены на рис. 3.4.
В пробирку, на три четверти заполненную дистиллированной водой, вносится по 3–4 капли растворов хлорида железа и роданида калия. Содержимое перемешивается и делится на четыре пробирки. В первую пробирку добавляются 2–3 капли раствора FeCl3, во вторую столько же раствора KCNS, в третью – на кончике шпателя кристаллический KCl, четвертую пробирку оставляют для сравнения. Данные эксперимента внесите в таблицу 3.3.
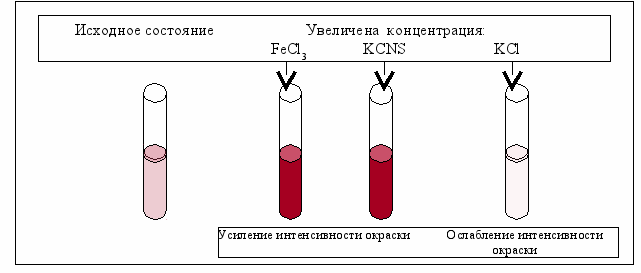
Рис. 3.4. Схема проведения эксперимента по изучению влияния изменения концентрации реагирующих веществ на смещение химического равновесия
Таблица3.3
Смещение химического равновесия
| Добавленное вещество | Изменение интенсивности окраски (усиление или ослабление) | Направление смещения равновесия |
| FeCl3 | | |
KCNS | | |
KCl | | |
В сторону какого процесса: прямого или обратного, смещается равновесие при увеличение концентрации: а) исходных веществ, б) продуктов реакции? Соответствует ли это принципу Ле Шателье? Является ли это противодействием на внешнее воздействие?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Влияние температуры на смещение химического равновесия
Все химические реакции сопровождаются образованием новых веществ, т.е. изменением природы участников реакции, а потому либо выделением теплоты (ΔrН < 0 – реакция экзотермическая), либо поглощением теплоты (ΔrН > 0 – реакция эндотермическая). Если прямая реакция идет с выделением теплоты, то обратная – с поглощением.
Реакция йода с крахмалом сопровождается образованием окрашенного в синий цвет соединения. Схема проведения эксперимента и полученные результаты представлены на рис. 3.5.
В пробирку наливается 2–3 мл раствора крахмала и добавляется несколько капель раствора йода. Наблюдается образование соединения синего цвета. При нагревании пробирки окраска раствора исчезает, а при охлаждении – появляется. Таким образом, наблюдается смещение равновесия
 охлаждение извне
охлаждение извне( С6Н10О5)x + x J2 ( С6Н10О5)x · x J2
 нагревание извне
нагревание извне 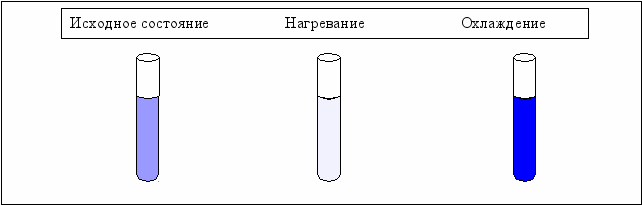
Рис. 3.5. Схема проведения эксперимента по изучению влияния изменения температуры на смещение химического равновесия
Используя принцип Ле Шателье, определите, с выделением или поглощением теплоты идет прямая реакция.
Укажите, в сторону какого процесса (экзотермического или эндотермического) смещается химическое равновесие: а) при повышении температуры, б) при понижении температуры.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 3.8. Каким изменением внешних условий можно повысить полноту сгорания угля
2С (кристалл.) + О2 (газ) <══> 2СО (газ) ; ∆rН<О ?
Решение. Для увеличения полноты сгорания угля необходимо, чтобы скорость прямой реакции стала больше, чем скорость обратной реакции.
Концентрация кислорода в ходе прямого процесса уменьшается, поэтому для увеличения скорости этого процесса концентрацию кислорода следует увеличивать.
В процессе сгорания угля теплота выделяется в окружающую среду
(∆rН <О), поэтому внешнее воздействие на систему должно состоять в понижении температуры окружающей среды.
Давление в системе в результате прямого процесса увеличивается (из одного моль газа О2 образуется два моль газообразного СО). Скорость прямого процесса будет больше, чем скорость обратного процесса при условии удаления из системы продукта реакции, что может произойти в том случае, если давление в окружающей среде станет меньше, чем в равновесной системе.
Таким образом, полноту сгорания угля можно повысить, если в среде, окружающей равновесную систему, понизить температуру и давление и ввести дополнительное количество кислорода.
Следовательно, для смещения равновесия в нужную сторону, внешний фактор (P, C, T) должен измениться противоположно тому, как это происходит в ходе данного процесса.
Пример 3.9. Уменьшение углекислого газа в системе
СаСО3 (твёрд.) ↔ СаО (твёрд.) + СО2 (газ)
приведет к…
1) увеличению содержания исходных веществ
2) уменьшению содержания продуктов и исходных веществ
3) увеличению содержания продуктов реакции
4) состояние равновесия не изменится
Удаление из системы продукта реакции (СО2) приведёт к уменьшению скорости обратной реакции и равновесная система ответит противодействием − образованием дополнительного количества СО2, т.к. скорость прямой реакции станет больше скорости обратной реакции. Правильный ответ 3.
Упражнение 3.11. Равновесие в системе
2NH3 (газ) + СO2 (газ) ↔ СO(NH2)2 (жидк.) + H2O (жидк.)
сместится в сторону продуктов реакции при…
□ 1) увеличении общего давления □ 2) уменьшении парциального давления СО2
□3) добавлении воды □ 4) уменьшении концентрации СO(NH2)2
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 3.10. Для увеличения выхода продуктов реакции
O2(г.) + 4HCl(г) ↔ 2Cl2(г.) +2H2O(г.), ∆rН < 0 необходимо…
1) повысить давление и повысить температуру
2) повысить давление и понизить температуру
3) понизить давление и понизить температуру
4) понизить давление и повысить температуру
В ходе прямого процесса в системе: Т−↑, р−↓. Температура увеличивается, т.к. прямой процесс идёт с выделением теплоты; давление уменьшается, поскольку из 5-и моль газообразных веществ образуется 4 моль газа.
В соответствии с принципом Ле Шателье, внешнее воздействие должно быть противоположно изменениям параметров в равновесной системе: Т−↓, р−↑.
Правильный ответ 2.
Упражнение 3.12. Равновесие в системе
O2 (газ) + 4HCl (газ) ↔ 2Cl2 (газ) +2H2O (газ), ∆rН < 0
сместится в сторону исходных веществ при…
□ 1) увеличении концентрации О2 □ 2) увеличении общего давления
□ 3) увеличении температуры □ 4) уменьшении общего давления
____________________________________________________________________________________________________________________________________________________________
Упражнение 3.13. Равновесие в системе
SO3 (газ) + C (кристалл.) ↔ SO2 (газ) + CO (газ), ∆rН > 0
сместится в сторону продуктов реакции …
□ 1) при увеличении температуры □ 2) при увеличении парциального давления СО
□ 3) при уменьшении общего давления □ 4) при уменьшении концентрации SО3
____________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
4. Равновесие в системе PCl3 (газ) + Cl2 (газ) <==> PCl5 (пар) ; Δ r H = 113 кДж
сместится в сторону исходных веществ …
□ 1) при увеличении концентрации Cl2 □ 2) при увеличении общего давления
□ 3) при уменьшении температуры □ 4) при уменьшении общего давления
5. Равновесие в системе ZnO (кристалл.) + CO (газ) <==> Zn (кристалл.) + CО2 (газ), ∆ r H > 0 сместится в сторону исходных веществ
□ 1) при увеличении общего давления □ 2) при уменьшении температуры □ 3) при увеличении парциального давления СО2 □ 4) при увеличении температуры
Для заметок
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Задание 4. СВОЙСТВА РАСТВОРОВ
4.1. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Общие свойства растворов» [Часть 2 УМК, раздел 4.1]
Цель выполнения задания
· Ознакомиться со способами выражения состава растворов.
· Научиться вести простейшие расчёты по приготовлению растворов.
· Рассмотреть причины, приводящие к изменению температур кипения и замерзания растворов, а также суть осмоса.
Теоретические сведения
Растворами называются гомогенные, самопроизвольно образовавшиеся системы переменного состава. Растворы состоят из растворителя и одного или нескольких растворённых веществ, особенно важное значение имеют водные растворы. Образование растворов ─ сложный физико-химический процесс, в котором наблюдаются как физические (непостоянство состава, диффузия), так и химические (образование неустойчивых соединений непостоянного состава) явления. Вся совокупность процессов, приводящих к появлению растворяемого вещества в растворе, называется сольватацией. Если растворителем является вода, то говорят о гидратации.
Состав раствора выражается через соотношение растворителя и растворённого вещества. Ниже приводятся наиболее часто используемые способы выражения состава раствора.
Молярная концентрация:
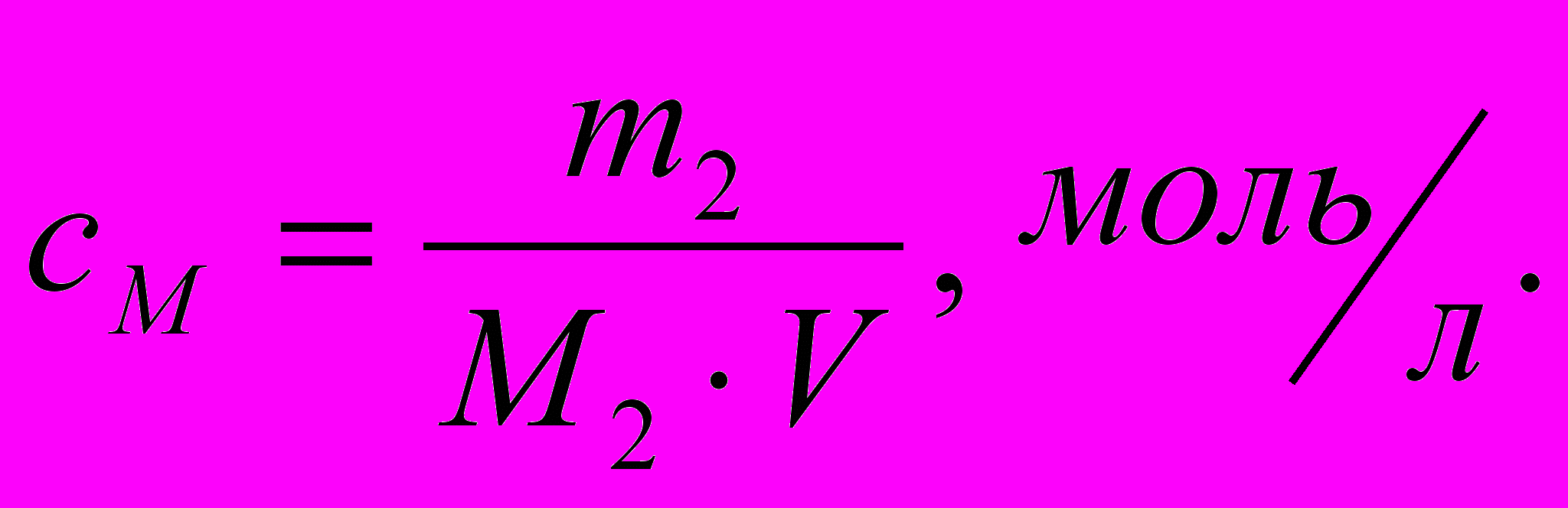 Например, 0,1 M HCl. (4.1)
Например, 0,1 M HCl. (4.1)Массовая доля:
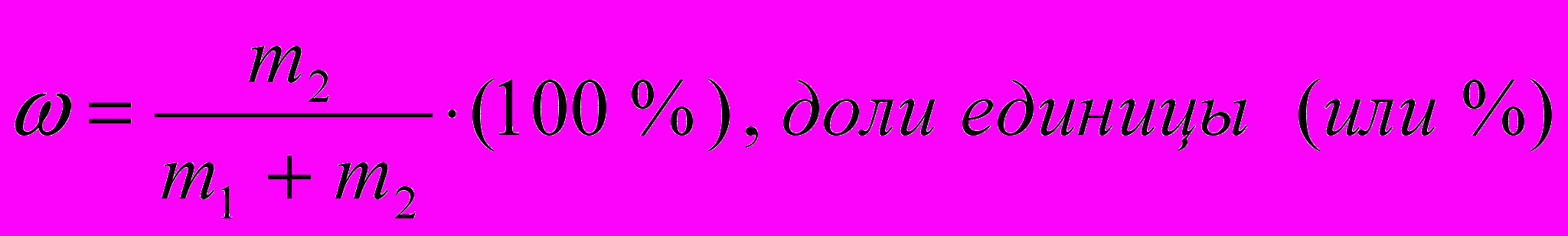 . (4.2)
. (4.2)Сумма: m1 + m2 = m раствора
Моляльность:
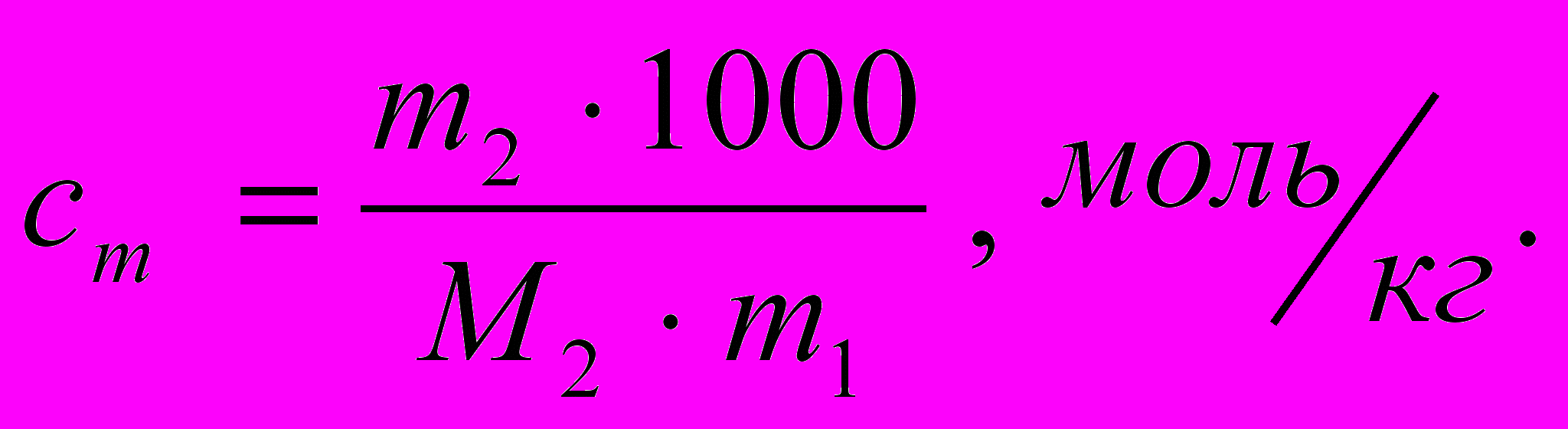 (4.3)
(4.3)Условные обозначения:
m1 − масса растворителя, г;
m2 − масса растворённого вещества, г;
М2 ─ молярная масса растворённого вещества, г/ моль;
V ─ объём раствора, л.
Общими называют свойства растворов, которые зависят от концентрации и практически не зависят от природы растворённых веществ. При рассмотрении общих свойств растворов условно принимается, что растворённое вещество является нелетучим неэлектролитом, т.е. не испаряется и не диссоциирует на ионы.
Давление насыщенного пара растворителя (воды) над чистым растворителем повышается с ростом температуры (рис. 4.1). Условием кипения жидкости является равенство давления её насыщенных паров атмосферному давлению, вода закипает при 100 0С.
Ф. Рауль установил, что давление насыщенного пара растворителя над раствором нелетучего вещества ниже, чем над чистым растворителем, что приводит к повышению температуры кипения таких растворов:
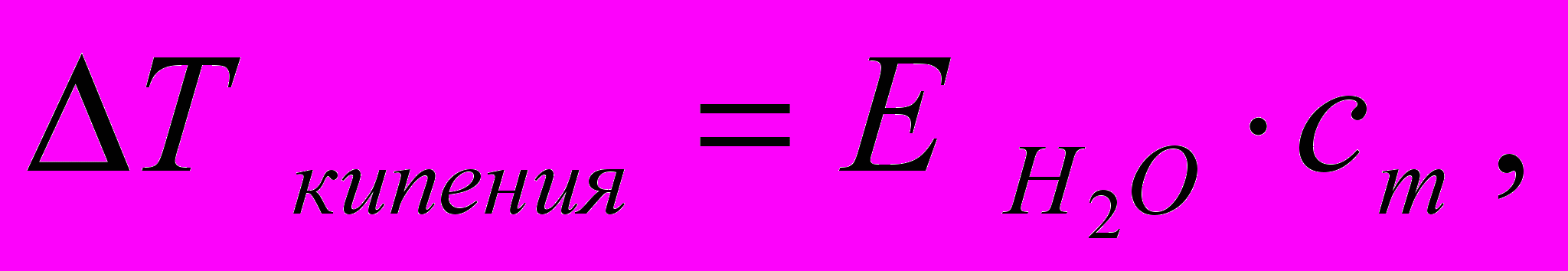 (4.4)
(4.4)где ΔТ кипения − повышение температуры кипения, градус;
Е (Н2О) − эбулиоскопическая постоянная воды, (градус · кг) / моль;
сm − моляльная концентрация раствора, моль/кг.
Условием кристаллизации является равенство давления насыщенного пара над твёрдой и жидкой фазой. Над растворами давление пара ниже, чем над чистым растворителем и поэтому растворы замерзают при более низкой температуре (рис. 4.1). Понижение температуры замерзания пропорционально моляльной концентрации растворённого вещества (с m ):
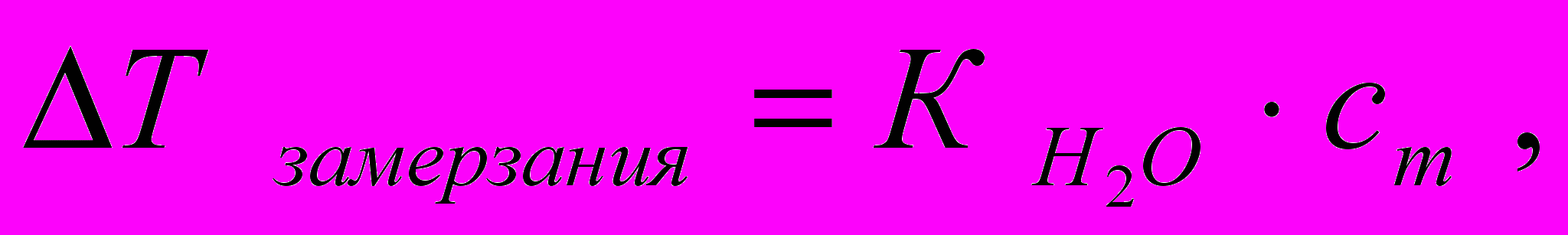 (4.5)
(4.5)где ΔТ замерзания − понижение температуры кипения, градус;
К (Н2О) − криоскопическая постоянная воды, (градус · кг) / моль;
сm − моляльная концентрация раствора, моль/кг.
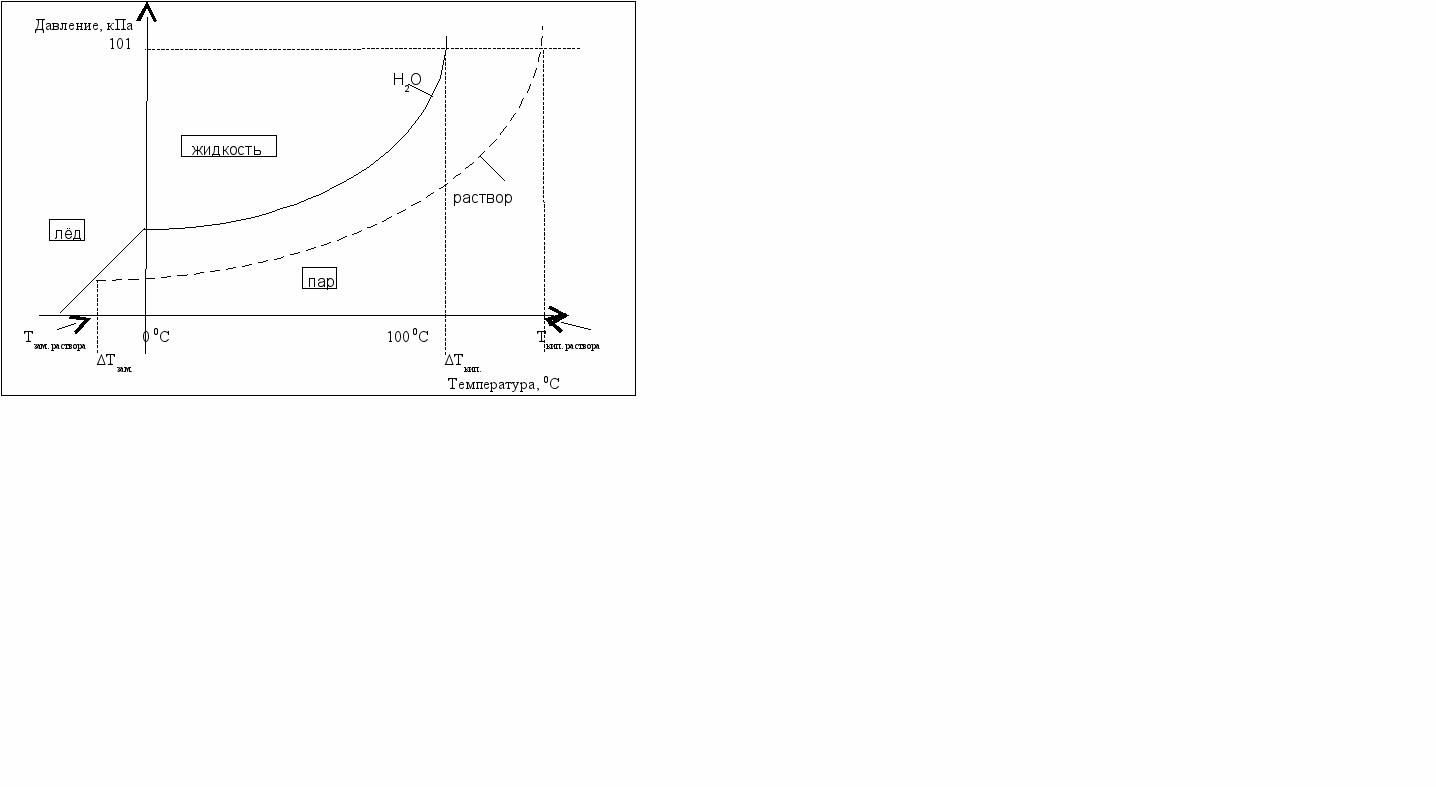
Рис. 4.1. Схема, поясняющая понижение температуры замерзания и
повышение температуры кипения раствора
Осмос ─ это диффузия вещества через полупроницаемую мембрану, через которую проходит растворитель, но не проходят растворённые вещества. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, который разбавляется и высота его столба (h) увеличивается (рис. 4.2).
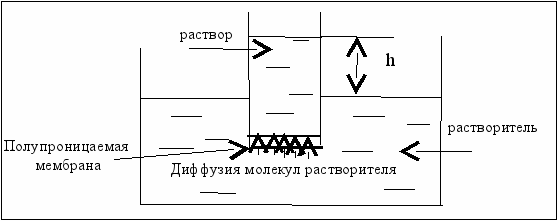
Рис. 4.2. Схема осмометра
Внешнее давление, которое нужно приложить, чтобы осмос прекратился, называется осмотическим и обозначается π (или росмот.). Экспериментально было найдено, что осмотическое давление пропорционально молярной концентрации раствора (см) и температуре (Т, К):
π = cм R T, (4.6)
где R ─ универсальная газовая постоянная, равная 8,31 Дж/(моль·К).
Это уравнение называют законом Вант-Гоффа. В таком виде оно применимо только к растворам неэлектролитов.
ВЫПОЛНЕНИЕ ЗАДАНИЯ
Пример 4.1. Для приготовления 700 г раствора с массовой долей иодида калия 5 % необходимо растворить ___ граммов соли 1) 84 2) 50 3) 35 4) 65
Решение. Из формулы 4.2 следует, что
m2 = (ω · m раствора ) : 100 % = (5 % · 700 г) : 100 % = 35 г.
Упражнение 4.1. Для приготовления 200 г раствора с массовой долей хлорида калия 8 % навеску соли необходимо растворить в ___ граммах воды
1) 84 2) 192 3) 184 4) 92
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.2. В растворе хлорида калия объёмом 1,0 л и концентрацией 0,01 моль/л содержится ___ граммов вещества
1) 0,75 2) 7,5 3) 0,075 4) 75
Решение. Молярная масса хлорида калия равна 75 г/моль. В соответствии с формулой 4.1:
m KCl = CM· V· M2 = 0.01 моль/л · 1,0 л · 75 г/моль = 0.75 г.
Упражнение 4.2. Молярная концентрация раствора сульфата натрия, в 50 мл раствора которого содержится 14,2 г данной соли, равна ________ моль/л
1) 0,02 2) 2 3) 0,2 4) 0,1
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.3. Рассчитать массу мочевины СО(NH2)2, необходимую для удаления с дорожного полотна льда массой, соответствующей 50 кг жидкой воды, если криоскопическая постоянная воды (КН2О) равна 1,86 (градус · кг) / моль. Температура окружающей среды минус 5 0С.
Решение. Понижение температуры Δ Т замерзания = 0 0С ─ (─ 5 0С) = 5 0С.
Для расчёта воспользуемся формулой 4.5:
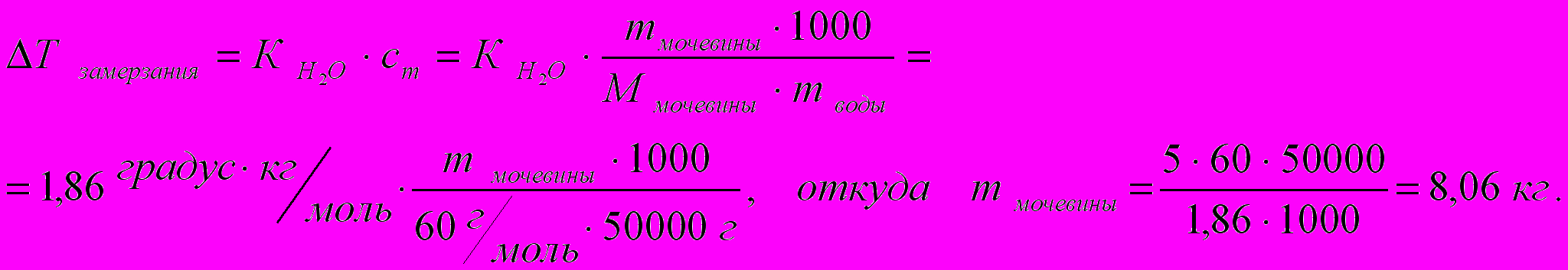
Упражнение 4.3. Для повышения температуры кипения раствора на 1,04 0С, необходимо, чтобы концентрация растворённого в нём неэлектролита составляла ___ моль/кг
(Е (Н2О)) = 0,52 (град · кг)/моль)
1) 0,2 2) 2 3) 1 4) 0,1
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.4. Для понижения температуры замерзания раствора на 3,72 0С, необходимо, чтобы концентрация растворённого в нём неэлектролита составляла ________ моль/кг (К (Н2О) = 1,86 (град · кг)/моль) 1) 1 2) 2 3) 0,2 4) 0,1
Решение. Понижение температуры замерзания неэлектролита вычисляется по формуле 4.5:
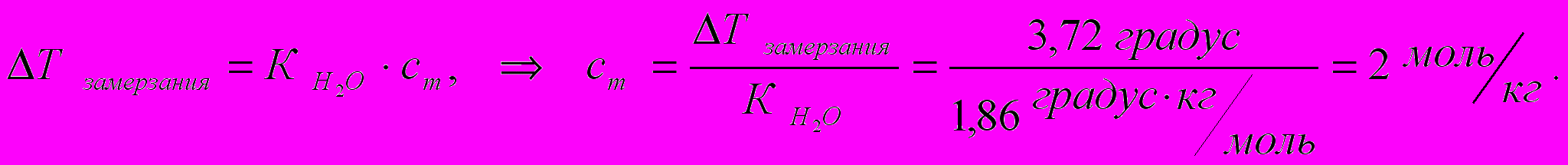
Упражнение 4.4. Раствор, содержащий 18 г глюкозы (Мr = 180) в 100 г воды замерзает при температуре _______ 0С (К (Н2О) = 1,86 (град · кг)/моль)
1) + 1,86 2) 0,93 3) − 1,86 4) − 0,93
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.5. Осмотическое давление раствора этанола с молярной концентрацией 1,0 моль/л при 25 0С равно __________ кПа
1) 207,8 2) 2476 3) 247,6 4) 2078
Решение. В соответствии с формулой 4.6:
π = cм R T = 1,0 моль/л · 8,31 Дж/(моль·К) · (273 + 25) К = 2476 Дж/л = 2476 кПа.
Упражнение 4.5. Осмотическое давление раствора неэлектролита с молярной концентрацией 0,2 моль/л при 20 0С равно __________ кПа
1) 487 2) 33.2 3) 332 4) 4870
________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ УПРАЖНЕНИЯ
1. Моляльная концентрация растворённого вещества может быть выражена в
1) моль/кг 2) моль/л 3) г/моль 4) процентах
2. В 50 мл 1 М ZnSO4 содержится ___ грамм(ов) вещества
1) 161 2) 8,05 3) 80,5 4) 16,1
3. Понижение температуры замерзания раствора неэлектролита может быть рассчитано по формуле:
1) ΔТ = i · К Н2О ·cm 2) p = с·R·Т 3) p = i ·с·R·Т 4) ΔТ = К Н2О ·cm
4. Уравнение р осмот. = с·R·Т (закон Вант-Гоффа), характеризующее зависимость осмотического давления от концентрации и температуры, применимо
1) только к растворам сильных электролитов 2) к любым растворам
3) к растворам слабых электролитов 4) только к растворам неэлектролитов
5. Температура кипения ацетона 56 0С. Если в 250 г ацетона растворить 6,4 г метанола (Мr = 32, Е ацетона = 1,5 (град · кг)/моль), то температура кипения раствора составит
1) 55,4 2) 57,2 3) 54,8 4) 56,6
6. Температура замерзания раствора, содержащего 46 г глицерина (Мr = 92) в 250 г воды (К Н2О = 1,86 (град · кг)/моль) равна _____ 0С
1) − 3,72 2) +3,72 3) − 0,186 4) − 0,93
4.2. РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
ПОДГОТОВКА К ВЫПОЛНЕНИЮ ЗАДАНИЯ
Изучить и усвоить:
· лекцию «Равновесия в растворах электролитов [Часть 2 УМК, раздел 4.2]
· видеозапись лабораторных работ «Ионно-молекулярные реакции», «Водородный показатель» [Приложение к УМК: диск 3, работы 1 и 2]
Цель выполнения задания
· Усвоить характерные свойства водных растворов электролитов.
· Изучить условия, при которых в растворах электролитов происходят химические реакции, и научиться составлять уравнения ионно-молекулярных реакций двойного обмена.
· Ознакомиться с методикой определения рН растворов.
· Усвоить суть гидролиза солей.
Теоретические ведения
Отличительным свойством электролитов является их способность под действием полярных молекул растворителя распадаться (диссоциировать) на ионы ─ заряженные частицы. К электролитам относятся кислоты, основания, соли.
Электролитическая диссоциация (разложение вещества на ионы) может записываться без участия молекул воды:
KCl → K+ + Cl¯.
Положительно заряженные ионы называются катионами, отрицательно заряженные ─ анионами.
Количественно электролитическая диссоциация характеризуется степенью и константой диссоциации. Степень электролитической диссоциации (α) равна отношению числа молекул, которые продиссоциировали на ионы, к общему числу молекул электролита.
Для сильных электролитов (табл. 4.1) степень диссоциации равна единице, для слабых – значительно меньше единицы. Отсюда следует, что в растворах сильных электролитов вещество находится в виде ионов, в растворах слабых – в виде молекул и небольшого числа ионов, в неэлектролитах – в виде молекул.
Таблица 4.1
Сильные и слабые электролиты
| Электролиты | Сильные | Слабые |
| Кислоты | HNO3, HCl, HBr, H2SO4 и другие | HNO2, H2S, H2SO3, H2CO3, H2SiO3, H3PO4, HF и другие |
| Основания | KOH, NaOH, Ba(OH)2 и другие | NH4OH, нерастворимые онования |
| Соли | Практически все соли | − |
Примечание: к слабым электролитам относится также вода.
Процесс диссоциации сильных электролитов происходит в одну ступень. Слабые электролиты диссоциируют обратимо, причём многоосновные кислоты и многокислотные основания диссоциируют по ступеням.
С точки зрения теории электролитической диссоциации молекулы кислот в воде диссоциируют на ионы водорода Н+, точнее гидроксония Н3О+ (Н+·Н2О), и на анион (отрицательно заряженную частицу). Серная кислота диссоциирует:
H2SO4 → 2H+ + SO42ˉ.
Основания — это электролиты, которые диссоциируют на ионы гидроксила OHˉ и катиона (положительно заряженную частицу). Гидроксид натрия диссоциирует:
NaOH → Na+ + OHˉ.
Соли при диссоциации разлагаются на катионы и анионы. Нитрат кальция диссоциирует: Са(NO3)2 → Са2+ + 2NO3ˉ.
Диссоциация слабых электролитов протекает в малой степени, поэтому в растворе присутствуют недиссоциированные молекулы и небольшое число ионов. Диссоциацию слабых электролитов записывают как обратимый процесс и характеризуют константой диссоциации (табл. 4.2).
Двухосновные слабые кислоты и двухкислотные слабые основания диссоциируют в две ступени и имеют две константы диссоциации. Ступеней и констант диссоциации столько, какова валентность кислотного или основного многовалентного остатка.
Таблица 4.2
Константы диссоциации некоторых слабых кислот и оснований в водных растворах
| Вещество | Константа диссоциации | ||
| КI | КII | КIII | |
| HF | 6,6 ∙ 10─4 | ─ | ─ |
| HNO2 | 4,0 ∙ 10─4 | ─ | ─ |
| H2S | 1,1 ∙ 10─7 | 1,0 ∙ 10─14 | ─ |
| H2SO3 | 1,6 ∙ 10─2 | 6,3 ∙ 10─8 | ─ |
| H2CO3 | 4,5 ∙ 10─7 | 4,8 ∙ 10─11 | ─ |
| H2SiO3 | 1,3 ∙ 10─10 | 2,0 ∙ 10─12 | ─ |
| H3PO4 | 7,5 ∙ 10─3 | 6,3 ∙ 10─8 | 1,3 ∙ 10─12 |
| NH4OH | 1,8 ∙ 10─5 | ─ | ─ |
| Cu(OH)2 | ─ | 3,4 ∙ 10─7 | ─ |
| Fe(OH)2 | ─ | 1,3 ∙ 10─4 | ─ |
| Fe(OH)3 | ─ | 1,8 ∙ 10─11 | 1,4 10─12 |
| Zn(OH)2 | 4,4 ∙ 10─5 | 1,5 ∙ 10─9 | ─ |
| Mg(OH)2 | ─ | 2,5 ∙ 10─3 | ─ |
| Pb(OH)2 | 9,6 ∙ 10─4 | 3,0 ∙ 10─8 | ─ |
Константа электролитической диссоциации характеризует равновесие диссоциации только слабых электролитов. Чем меньше величина константы диссоциации, тем более слабым является электролит.
Электролитическая диссоциация слабых электролитов, как процесс обратимый, подчиняясь принципу Ле Шателье, увеличивается с разбавлением раствора, т.к. при добавлении растворителя происходит уменьшение концентрации ионов в растворе. Кроме того, электролитическая диссоциация происходит с поглощением теплоты, а поэтому возрастает при нагревании.
Пример 4.6. Степень диссоциации гидроксида аммония увеличится
□1) при разбавлении □2) при добавлении соляной кислоты
□3) при охлаждении □4) при добавлении хлорида аммония
Решение. Запишем схему электролитической диссоциации гидроксида аммония
NH4OH ↔ NH4+ + OH‾; ΔrН > 0.
В соответствии с принципом Ле Шателье при разбавлении, т.е. добавлении в раствор воды, концентрация растворённых частиц в растворе уменьшается, поэтому увеличивается диссоциация молекул на ионы.
Введение в раствор соляной кислоты, диссоциирующей с образованием ионов Н+: HCl → Н+ + Cl‾ приводит к уменьшению концентрации ионов OH‾ вследствие образования слабого электролита: Н+ + OH‾ → Н2О. Равновесие смещается вправо и степень диссоциации увеличивается.
Добавление хлорида аммония, увеличивающего концентрацию иона NH4+ за счёт диссоциации соли NH4Cl → NH4+ + Cl‾ равновесие смещается влево, т.е. степень диссоциации уменьшается.
Процесс электролитической диссоциации эндотермический и при охлаждении степень диссоциации уменьшается.
Правильные ответы 1 и 2.
Упражнение 4.6. Степень диссоциации уксусной кислоты увеличится
□1) при добавлении гидроксида натрия □2) при добавлении ацетата натрия
□3) при нагревании □4) при разбавлении
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Химическое взаимодействие в растворе электролита возможно в том случае, если ионы одного электролита с ионами другого образуют малорастворимые или малодиссоциирующие вещества (осадки или слабые электролиты) и газы.
В осадок выпадают малорастворимые или практически нерастворимые вещества (табл. 4.3).
Таблица 4.3
Растворимость солей кислот и оснований в воде
| Катион | H+ | K+, Na+ | NH4+ | Mg2+ | Ca2+ | Cu2+ | Zn2+ | Mn2+ | Fe2+ | Fe3+ | AI3+ | Ва2+ |
| Анион | ||||||||||||
| OH- | | Р | Р | Н | М | Н | Н | Н | Н | Н | Н | Р |
| CI- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| S2- | Р | Р | Р | ─ | ─ | Н | Н | Н | Н | Н | ─ | ─ |
| SO32- | Р | Р | Р | М | М | ─ | М | Н | М | ─ | ─ | Н |
| SO42- | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Н |
| CO32- | Р | Р | Р | М | Н | Н | Н | ─ | Н | ─ | ─ | Н |
| HCO3– | Р | Р | Р | Р | Р | ─ | ─ | ─ | Р | Р | Р | Р |
| SiO32- | Н | Р | Р | Н | Н | Н | Н | ─ | Н | Н | Н | Н |
| РО43─ | Р | Р | ─ | Н | Н | Н | Н | Н | Н | Н | Н | Н |
Примечание. Р ─ растворимое вещество, М ─ малорастворимое,
Н ─ нерастворимое, «─» ─ разлагается водой
Пример 4.7. В каком случае произойдет химическое взаимодействие: если к раствору хлорида кальция добавить раствор нитрата натрия или сульфата натрия?
Решение. Запишем молекулярные уравнения предполагаемых реакций, указав растворимость всех участников реакции в соответствии с табл. 4.3. Все растворимые соли являются сильными электролитами.
CaCl2 + 2NaNO3 → Ca(NO3)2 + 2NaCl; CaCl2 + Na2SO4 → CaSO4↓ + 2NaCl.
Р Р Р Р Р Р Н Р
В соответствии с правилами написания ионно-молекулярных уравнений сильные, растворимые электролиты запишем в виде ионов, а слабые или нерастворимые – в виде молекул
Ca2+ + 2Cl‾ + 2Na+ + 2NO3‾ → Ca2+ + 2NO3‾ + 2Na+ + 2Cl‾;
Ca2+ + 2Cl‾ + 2Na+ + SO4 2‾ → CaSO4 ↓ + 2Na+ + 2Cl‾.
В первом случае все ионы сокращаются, а во втором – сокращенное ионно-молекулярное уравнение имеет вид:
Ca2+ + SO42‾ → CaSO4 ↓,
т.е. в данном случае имеет место химическое взаимодействие с образованием малорастворимого вещества.
Пример 4.8. Рассмотрим реакцию, приводящую к образованию слабого электролита.
NH4Cl + KOH → NH4OH + KCl,
NH4+ + Cl¯ + K+ + OH¯ → NH4OH + K+ + Cl¯,
NH4+ + OH¯ → NH4OH.
слабый электролит
ВЫПОЛНЕНИЕ ЗАДАНИЯ
ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции, протекающие с образованием
малорастворимых соединений, слабых электролитов и газов
Схема проведения эксперимента и полученные результаты представлены на рис. 4.3.
В 1-й пробирке при сливании растворов сульфата натрия и хлорида бария образуется белый осадок.
Образование слабой уксусной кислоты во 2-й пробирке обнаруживается по запаху.
Взаимодействие раствора карбоната натрия с соляной кислотой в 3-й пробирке сопровождается выделением углекислого газа.
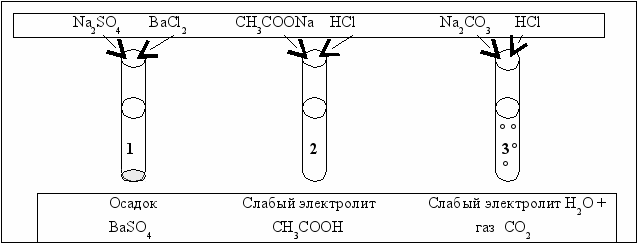
Рис. 4.3. Схема проведения эксперимента по осуществлению практически необратимых
реакций двойного обмена
Напишите молекулярные и ионно-молекулярные уравнения всех реакций.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
По каким наблюдаемым признакам можно установить наличие реакции двойного обмена между растворами электролитов?
________________________________________________________________________________
Сформулируйте условия протекания практически необратимых реакций двойного обмена.
________________________________________________________________________________________________________________________________________________________________
Пример 4.9. Химическое взаимодействие возможно между веществами
1) □ LiCl и KOH 2) □ NH4Cl и KOH 3) □ FeCl2 и KOH 4) □ NaCl и KOH
Составим уравнения предполагаемых реакций с указанием особенностей продуктов реакций
1) LiCl + KOH → LiOH + KCl
сильный, растворимый сильный растворимый
электролит электролит
2) NH4Cl + KOH → NH4ОН + KCl
слабый электролит сильный растворимый
электролит
3) FeCl2 + KOH → Fe(ОН)2 + 2 KCl
слабый нерастворимый сильный растворимый
электролит электролит
4) NaCl + KOH → NaОН + KCl
сильный растворимый сильный растворимый
электролит электролит
Правильные ответы: 2 (образуется слабый электролит) и 3 (образуется слабый нерастворимый электролит).
Упражнение 4.6. Химическое взаимодействие возможно между веществами
1) □ MgCl2 и NaNO3 2) □ K2CO3 и NaNO3
3) □ HCl и K2CO3 4) □ MgCl2 и K2CO3
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Пример 4.10. Левая часть сокращённого ионно-молекулярного уравнения
… → Mg2+ + H2O + CO2 имеет вид
1) MgCO3 + H2CO3 → 2) Mg2+ + HCO3ˉ + H+ →
3) MgCO3 + 2 H+ → 4) Mg2+ + CO32ˉ + 2 H+ →
Решение. Напишем сокращённые ионно-молекулярные уравнения полностью
1) MgCO3 + H2CO3 → MgCO3 + H2CO3, реакция не идёт;
2) Mg2+ + HCO3ˉ + H+ → Mg2+ + HCO3ˉ + H+, реакция не является практически необратимой;
3) MgCO3 + 2 H+ → Mg2+ + H2CO3 (H2O + CO2)
4) Mg2+ + CO32ˉ + 2 H+ → MgCO3 + 2 H+, правая часть уравнения имеет иной вид.
Правильный ответ 3.
Упражнение 4.7. Сокращённому ионно-молекулярному уравнению
Cu2+ + 2 OHˉ → Cu(OH)2
соответствует взаимодействие
1) между Cu и NaOH 2) между CuO и H2O
3) между CuCl2 и Fe(OH)3 4) между CuSO4 и NaOH
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ТИПОВЫЕ КОНТРОЛЬНЫЕ ЗАДАНИЯ
1. Степень электролитической диссоциации может принимать значения
1) α > 1 и α = 0 2) α > 1 и α < 1 3) α < 1 и α = 1 4) α ≤ 0 и α
2. Самому слабому из приведённых электролитов соответствует величина константы диссоциации
1) 10‾3 2) 10‾2 3) 10‾12 4) 10‾8
3. Константа электролитической диссоциации характеризует
1) сильные и слабые электролиты 2) только слабые электролиты
3) неэлектролиты 4) только сильные электролиты
4. Химическое взаимодействие возможно между веществами
1) □ Na2SO3 и KCl 2) □ Na2SO3 и HCl
4) □ ZnCl2 и KNO3→ 3) □ ZnCl2 и KOH
5. Сокращённому ионно-молекулярному уравнению Fe3+ + 3 OHˉ → Fe(OH)3
соответствует взаимодействие
1) между FePO4 и NH4OH 2) между FeCl3 и Mg(OH)2
3) между FeS и KOH 4) между Fe2(SO4)3 и KOH
МЕТОДЫ ОПРЕДЕЛЕНИЯ рН РАСТВОРОВ
Теоретические сведения
В любом водном растворе при 22 0С произведение концентраций ионов воды (ионное произведение воды – КW) является величиной постоянной:
КW = [Н+] ∙ [OH─] = 10–14, (4.7)
где [Н+] ─ равновесная концентрация ионов Н+;
[OH─] ─ равновесная концентрация ионов ОН─.
В нейтральной среде [Н+] = [OH─] = 10–7 моль/л;
в кислой среде [Н+] > [OH─] , т.е. [Н+] >10–7 моль/л, например [Н+] = 10–6 моль/л;
в щелочной среде [Н+] < [OH─], т.е. [Н+] < 10–7 моль/л, например [Н+] = 10–8 моль/л.
