Т. С. Рамазанов доктор физико-математических наук, профессор, Казну им. Аль-Фараби, г. Алматы; > С. К. Тлеукенов доктор физико-математических наук, профессор, пгу им. С. Торайгырова, г. Павлодар; > А. М. Мубараков
| Вид материала | Учебник |
- Титульный лист программы Форма обучения по дисциплине ф со пгу 18. 3/37 (Syllabus), 349.17kb.
- Б. А. – доктор юридических наук, профессор Казну им аль-Фараби, 209.21kb.
- Карпухин В. Б., доктор физико-математических наук, профессор кафедры «Высшая и прикладная, 263.95kb.
- А. М. Мубараков доктор пед наук, профессор. Н. Э. Пфейфер доктор пед наук, профессор, 1066.25kb.
- Веселаго Виктор Георгиевич, доктор физико-математических наук, профессор мфти, область, 30.58kb.
- Практических: 0 Лабораторных, 16.69kb.
- Практических: 34 Лабораторных, 24.5kb.
- Практических: 0 Лабораторных, 16.63kb.
- Практических: 34 Лабораторных, 20.05kb.
- Практических: 0 Лабораторных, 18.53kb.
2.3.2 Теплоемкость газа. Применение первого начала термодинамики к изопроцессам
Во многих процессах внешним результатом сообщения телу теплоты является нагревание и поэтому, не разделяя полученную теплоту на части соответственно изменению свойств тела, вводят общее понятие теплоемкости, которая представляет собой количество теплоты, необходимой для изменения температуры тела на один градус.
| C= ∆Q/∆Т | (2.40), |
где ∆Q — количество тепла, полученное в процессе повышения температуры тела от Т1 до Т2. В пределе, когда ∆T стремится к нулю, мы получаем истинную теплоемкость тела при данной температуре:
| С = lim ∆Q/∆Т = dQ/dТ | (2.41). |
Различают удельную теплоемкость, когда необходимая теплота отнесена к 1 кг массы
| с = C/m, | (2.42), |
и молярную теплоемкость, когда теплота отнесена к одному молю
| С = c М | (2.43). |
Наибольшее практическое значение имеют теплоемкости в изохорическом (CV) и изобарическом (Ср) процессах. В изохорическом процессе теплоемкость равна CV
| СV = dQV/dТ = (∂U/∂T)V , т. е. dUv = CvdT. | (2.44). |
В изобарическом процессе теплоемкость Ср может быть представлена выражением, если ввести энтальпию:
| Сp. = dQp/dТ = (∂H/∂T)p -) , т. е. dHp = CpdT | (2.45). |
В изотермическом процессе теплоемкость равна бесконечности: Сi = ∞, так как здесь при передаче системе теплоты ∆Q повышения температуры не происходит: ∆Т =0. В адиабатическом процессе теплоемкость равна 0, так как затраченная теплота dQ = 0 при наличии конечного изменения температуры.
Опыт показывает, что теплоемкость вообще зависит от температуры. Однако при обычных температурах эта зависимость выражена сравнительно слабо, благодаря чему иногда изменениями пренебрегают, рассматривая, например, небольшие интервалы температур, далеких от абсолютного нуля. При очень низких температурах теплоемкость сильно изменяется с температурой. Так, в области нескольких десятков градусов от абсолютного нуля она возрастает пропорционально кубу абсолютной температуры. Объяснение этой закономерности дает квантовая статистика. Молярная теплоемкость СV при обычных температурах для атомарных газов постоянна и. равна Сv = (3/2)R. Если молекула газа состоит из нескольких атомов, то расчет теплоемкости производиться с учетом степеней свободы по следующей формуле:
| Сv = dU/dT= i/2*RdT | (2.46). |
Если газ нагревается при постоянном давлении, то
| Cp = dU/dT + pdV/dT | (2.47). |
Учитывая, что dU/dT -— не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой T) и всегда равна CV; продифференцировав уравнение Клапейрона — Менделеева pVm = RT по T (p = const), получим
| Cp = Cv + R. | (2.48). |
Это выражение называется уравнением Майера. Оно показывает, что Ср всегда больше Cv .Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Для моля любого газа эта разность составляет одну и ту же величину R. = 8,31 Дж/мольК , которая одинакова для всех идеальных газов и называется универсальной газовой постоянной. Cp и Cv можно выразить через степень свободы:
| Cp = (i+2)/2*R | (2.49) |
и
| Cv = i/2*R | (2.50).. |
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Ср к Cv:
| γ = Cp/Cv = (i + 2)/i. | (2.51) |
Отсюда следует, что теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры.
По закону равномерного распределения энергии по степеням свободы, для комнатных температур Cv = = 7/2R. Из качественной экспериментальной зависимости молярной теплоемкости Cv водорода (рисунок - 2.21) следует, что СV зависит от температуры: при низкой температуре (≈50 К) Cy=3/2R, при комнатной CV = 5/2R (вместо расчетных значений - 7/2R) и очень высокой — CV =7/2R.
 |
| Рисунок - 2.21 |
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул. Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2R вместо 7/2R. Аналогично, можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
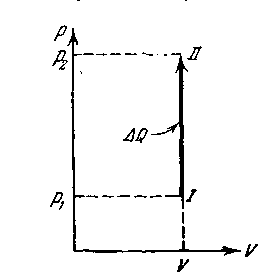
Применим первое начало термодинамики к ряду процессов в идеальном газе, при которых один из термодинамических параметров, характеризующих состояние газа, остается постоянной. Такие процессы носят название изопроцессов. Процесс, который происходит с сохранением объема (V=const), называется изохорическим. Газ не совершает никакой внешней работы. Вся полученная теплота идет на увеличение кинетической энергии молекул, соответственно чему возрастает внутренняя энергия газа. На диаграмме (р, V) изохорический процесс изображается изохорой, имеющей вид прямой, параллельной оси давлений (рисунок 44).
| dQ = dU | (2.52). |
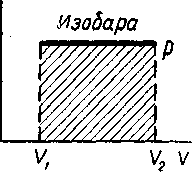
Процесс при котором остается неизменным давление называется изобарическим процессом (р = const). С молекулярно-кинетической точки зрения, при изобарическом расширении идеального газа, часть тепла идет на увеличение скорости движения молекул, а, следовательно, на изменение внутренней энергии идеального газа, и некоторая часть — на внешнюю работу молекул по преодолению внешнего давления. Следовательно, первое начало термодинамики для 1 моля идеального газа при изобарическом процессе выглядит следующим образом:
| dQ = dU+dA | (2.53). |
Изменение состояния изображается изобарой (рисунок - 2.23). Работа на этом графике равна площади прямоугольника высотой р и с основанием (V2—V1).
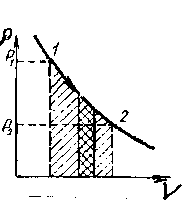
Процесс, протекающий при неизменной температуре (Т=const), называется изотермическом процессом. Из-за постоянства температуры внутренняя энергия газа в этом процессе также остается неизменной, a dU=0. В изотермическом процессе вся теплота, подведенная к системе, полностью идет на совершение работы. Следовательно, как первое начало термодинамики для изотермического процесса, имеем:
| dQ = dА = pdV | (2.54). |
Применяя уравнение Клапейрона, и интегрируем полученное выражение в пределах от V1 до V2. Тогда
| Q = A= RT lnV2/V1 | (2.55). |
Мы видим, что работа газа при изотермическом процессе пропорциональна абсолютной температуре и логарифму отношения V2/V1. На диаграмме (р, V) изотермический процесс изображается кривой, называемой изотермой, представляющей собой равностороннюю гиперболу (рисунок 6.4.), уравнение которой pV = const. Графически работа при изотермическом процессе определяется площадью заштрихованной на рисунке - 2.23 фигуры.
 |  |
| Рисунок - 2.22 | Рисунок - 2.23 |
Процесс, который совершается без теплообмена с окружающей средой, называется адиабатным процесс ((dQ=0).). Практически такие процессы осуществляются либо при наличии у системы теплоизолирующей оболочки, либо если они происходят столь быстро, что система не успевает обмениваться теплотой с окружающей средой. Первое начало термодинамики для адиабатного процесса дает:
| dU+dA=0, | (2.56) |
или
| —dU=dA, | (2.57), |
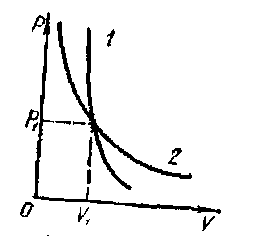
т. е. работа совершается за счет убыли внутренней энергии. При адиабатном процессе изменяются сразу все три параметра состояния. Связь между давлением и объемом установил Пуассон pVγ=const, где γ = Cp/Cv называется показателем адиабаты. Уравнение адиабаты графически изображено на рисунке - 2.24. Адиабата 1 проходит круче, чем пересекающаяся с ней изотерма 2, что вполне понятно: при адиабатном сжатии газ нагревается, в изотермическом процессе его температура не изменяется (рисунок - 2.25).
 |  |
| Рисунок - 2.24 | Рисунок - 2.25 |
Используя уравнение Пуассона для адиабатного процесса и уравнение состояния идеального газа можно определить выражение работы для адиабатного процесса:
| A = RT1/(γ-1)[1-(V1/V2)γ-1] | (2.58). |
Процессы, протекающие в системах с постоянной теплоемкостью, называют политропическим. Применяя первое начало термодинамики к политропным процессам, можно получить его уравнение. Действительно, для 1 моля идеального газа имеем: СdT=CvdT+pdV. Продифференцировав уравнение состояния, найдем: pdV+Vdp=RdT. Исключая из этих соотношений температуру, получим: pdV(Cp—C)= Vdp {С—Cv). Введя для краткости обозначение n = (C - Cp)/( С—Cv) последнее уравнение приведем к виду: dp/p + ndV/V = 0 После интегрирования получается уравнение политропы:
| pVn — const. | (2.59). |
Нетрудно убедиться в том, что любой изопроцесс является частным случаем политропного процесса. Например, п=1 соответствует изотермическому процессу, n=γ — адиабатическому и т. д.
2.4. Второе начало термодинамики
2.4.1. Работа тепловых машин. Цикл Карно
Процессы в системе бывают обратимые и необратимые. Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
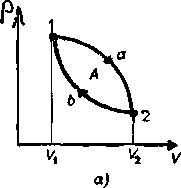
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (рис 84.) Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1—2) и сжатия (2—1) газа. Работа расширения (определяется площадью фигуры la2V2V1l) положительна (dV>0), работа сжатия (определяется площадью фигуры 2blV1V22) отрицательна (dV<0). Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если за цикл совершается положительная работа (цикл протекает по часовой стрелке), то он называется прямым (рисунок - 2.26,а), если за цикл совершается отрицательная работа (цикл протекает против часовой стрелки), то он называется обратным (рисунок - 2.26,6).
Прямой цикл используется в тепловых машинах, совершающих механическую работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах, где за счет работы внешних сил теплота переносится к телу с более высокой температурой. В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики для кругового процесса
| Q=∆U+A=A, | (2.60), |
т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса где Q1- количество теплоты, полученное системой, Q2 - количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса
| η = A/ Q1 = (Q1 - Q2)/ Q1 = 1- Q2/Q1 | (2.61). |
Тепловая машина, кроме тела с высокой температурой Ti (нагреватель), за счет внутренней энергии которого будет совершаться работа, и холодильника с температурой Т2, служащего для отвода части теплоты, должна иметь еще «рабочее тело». Действие тепловой машины происходит по следующей схеме. От теплового резервуара (нагревателя с температурой T1) теплота передается рабочему телу и частично преобразуется последним в работу; частично же теплота от рабочего тела передается холодильнику (с температурой Т2), а рабочее тело возвращается в исходное состояние. В соответствии с первым началом термодинамики необходимо, чтобы выполнялось равенство dQ1=dA+dQ2 . Работа за один цикл зависит от его формы и измеряется площадью, охваченной кривой, описывающей процесс.
Если ввести коэффициент полезного действия такой машины как отношение η = dA/dQ1 , то нетрудно получить следующее выражение для КПД идеальной машины:
| η = dA/dQ1 dA/dQ1 = 1- dQ2/dQ1; η = 1- dQ2/dQ1; | |
или
| η = 1- Т2/Т1 = (Т1- Т2)/Т1 | (2.62). |
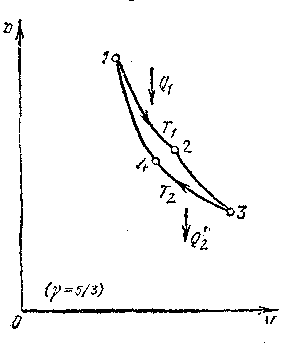
Итак, КПД идеальной машины определяется только температурами нагревателя и холодильника. Мощность тепловой машины определяется произведением работы, совершаемой за один цикл, на число циклов, происходящих за 1 с. Одной из возможных схем действия такой машины является работа по так называемому циклу Карно, впервые рассмотренному Сади Карно (1796—1832). На рисунке - 2.27 представлен цикл тепловой машины, работающей по циклу Карно. Он состоит из двух адиабат и двух изотерм. Работа, совершаемая рабочим телом за цикл, положительна. При переводе системы из состояния 1 в состояние 2 нагреватель отдает рабочему телу количество теплоты Q1 при температуре Т1, а при переводе системы из состояния 3 в состояние 4 рабочее тело передает холодильнику количество теплоты Q2 при температуре Т2.
Рассмотрим более подробно работу идеальной машины Карно, в которой рабочим телом служит идеальный газ, взятый в количестве 1 моль. На участке 1, 2 рабочее тело находится в контакте с
 | 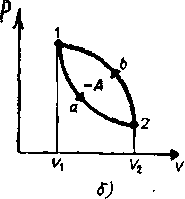 |  |
| Рисунок - 2.26 | Рисунок - 2.27 | |
нагревателем. Происходит изотермическое расширение газа от объема V1 до объема V2. Количество теплоты, переданное газу на этом участке, равно:
| Q1 =RT1* ln(V2/ V1) | (2.63). |
Эта теплота полностью переходит в работу расширения. На участке 3, 4 газ изотермически сжимают при температуре Т2. При этом сжатии холодильнику отдается количество теплоты, равное:
| Q2 =RT2* ln(V3/V4). | (2.64). |
Адиабатическим сжатием на участке 4, 1 рабочее тело приводят в исходное состояние. Так как внутренняя энергия рабочего тела за цикл не меняется, то алгебраическая сумма количеств теплоты, переданных газу, и работы, совершенной при его расширении и сжатии, должна быть равна нулю. На адиабатных участках работы расширения и сжатия газа взаимно компенсирую друг друга, так как процесс идет между двумя изотермами с температурами T1 и T2. Поэтому работа, совершаемая газом при изотермических процессах, является полезной работой; она равна:
| A = Q1- Q2 | (2.65) |
или с учетом выражений для Q1 и Q2:
| A= RT1* ln(V2/ V1)— RT2* ln(V3/V4) | (2.66). |
Зная выражение для полезной работы, нетрудно найти КПД машины, работающей по циклу Карно:
| η = A/ Q1 = [T1* ln(V2/ V1)— T2* ln(V3/V4)]/ T1* ln(V2/ V1) | (2.67). |
Из уравнений Пуассона, описывающих процессы 1, 4 и 2, 3, нетрудно найти связь между объемами:
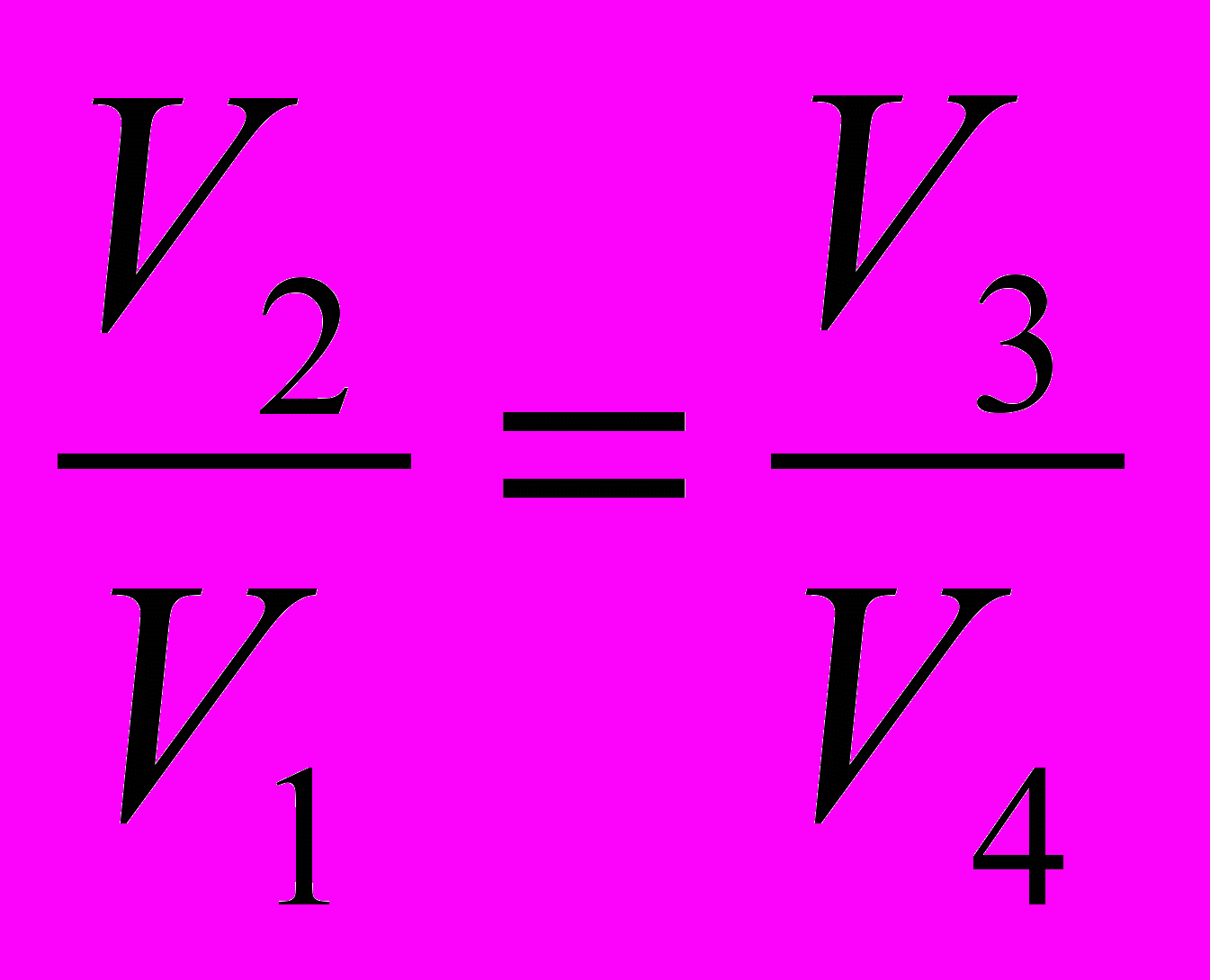 | (2.68). |
Поэтому для КПД машины получаем:
| η = (T1 - T2)/T1 | (2.69), |
т. е. КПД обратимого цикла Карно равен КПД идеальной тепловой машины и является наибольшим возможным в заданном интервале температур (Т1,Т2).
Кроме тепловых машин, в технике и быту широкое распространение получили холодильные, машины — устройства, в которых за счет внешней механической работы теплота передается от тела с меньшей температурой телу с более высокой температурой. Идеальной холодильной машиной может служить машина Карно, работающая по обращенному циклу. В обращенном цикле Карно рабочее тело проходит те же промежуточные состояния, что и в прямом цикле, только в обратном направлении. Результатом обращенного цикла Карно будет перенос теплоты от холодного тела к более нагретому за счет совершения работы внешними телами.
КПД идеального цикла Карно не зависит от рода рабочего тела (теорем Карно). Это можно доказать с помощью следующего мысленного эксперимента. Представим себе, что одна из машин Карно (с идеальным газом) работает по прямому циклу Карно и приводит в действие вторую машину, где рабочим телом служит какое-либо вещество, не являющееся идеальным газом. При этом обе машины работают с одними и теми же резервуарами теплоты (с температурами Т1 и Т2). Пусть КПД первой машины есть η1, а второй (при прямом цикле) — η2.
Совершая прямой цикл, первая машина получает из резервуара 1 количество теплоты Q1 и отдает резервуару 2 количество теплоты Q2. Работа машины A=Q1—Q2 затрачивается на приведение в действие второй машины. Вторая машина, совершая обратный цикл, отдаст резервуару 1 количество теплоты Q1, а у резервуара 2 отнимет количество теплоты Q2. Если КПД машин неодинаков (например, η1<η2), то Q11≠Q1. Сделав частоты циклов n1 и п1' различными {всегда между машинами можно поставить редуктор, меняющий число их оборотов в единицу времени), можно добиться, например, равенства: п1' Q11 = n1 Q1. При этом резервуар 1 не претерпит никаких изменений. Но в резервуаре 2 произойдут изменения: первая машина отдаст ему количество теплоты n1Q2,. а вторая заберет количество теплоты п1'Q21 которое отлично от n1Q2, так как не равны КПД машин. Следовательно, наша система, не получая теплоты извне, совершит работу за счет отнятия теплоты от резервуара 2, что противоречит законам термодинамики.
Предположив, что η1<η2. мы поменяем роли машин и придем к такому же невозможному результату. Следовательно, остается допустить, что оба КПД одинаковы и КПД идеального цикла Карно не зависит от рода рабочего тела.
