Т. С. Рамазанов доктор физико-математических наук, профессор, Казну им. Аль-Фараби, г. Алматы; > С. К. Тлеукенов доктор физико-математических наук, профессор, пгу им. С. Торайгырова, г. Павлодар; > А. М. Мубараков
| Вид материала | Учебник |
- Титульный лист программы Форма обучения по дисциплине ф со пгу 18. 3/37 (Syllabus), 349.17kb.
- Б. А. – доктор юридических наук, профессор Казну им аль-Фараби, 209.21kb.
- Карпухин В. Б., доктор физико-математических наук, профессор кафедры «Высшая и прикладная, 263.95kb.
- А. М. Мубараков доктор пед наук, профессор. Н. Э. Пфейфер доктор пед наук, профессор, 1066.25kb.
- Веселаго Виктор Георгиевич, доктор физико-математических наук, профессор мфти, область, 30.58kb.
- Практических: 0 Лабораторных, 16.69kb.
- Практических: 34 Лабораторных, 24.5kb.
- Практических: 0 Лабораторных, 16.63kb.
- Практических: 34 Лабораторных, 20.05kb.
- Практических: 0 Лабораторных, 18.53kb.
2.4.2 Второе начало термодинамики. Энтропия
Первое начало термодинамики позволяет определить, возможен, ли с энергетической точки зрения тот или иной процесс в замкнутой системе. Но оно ничего не говорит о возможных направлениях протекания процессов. Для этого в термодинамике вводится еще одна функция состояния — энтропия.
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты. Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно ∂Q/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю. Из того следует, что ∂Q/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит отпути, каким система пришла в это состояние. Функция состояния, дифференциалом которой является ∂Q/T и называется энтропией и обозначается S. Таким образом,
| ∂Q/T = dS | (2.70). |
Физический смысл энтропии связан с вероятностью. Каждое термодинамическое состояние газа не является безусловно обязательным, а существует с той или иной вероятностью. Т. е. состояние тем вероятнее, чем большим числом комбинаций в пространственном расположении молекул и в скоростях молекул оно осуществляется. Наименее всего вероятно состояние газа, когда скорости молекул совершенно одинаковы, так как такое состояние реализуется всего одной комбинацией (если говорить для простоты только о характеристике в отношении скорости). Условно можно определить вероятность такого состояния величиной Wi,. В статистической физике доказывается в самом общем случае (а не только для газа), что энтропия тем выше, чем большим числом комбинаций осуществляется данное состояние. Следовательно, существует соотношение между энтропией S и термодинамической вероятностью W состояния. Это соотношение было получено Больцманом, который на основании статистических соображений показал, что энтропия прямо пропорциональна логарифму вероятности, т. е. что
| Si=k ln Wi | (2.71), |
где k — постоянная Больцмана, a Wi — число микросостояний, соответствующих данному i-му состоянию макросистемы. Величину Wi называют термодинамической вероятностью состояния. Отношение Wi к полному числу возможных микросостояний макросистемы
| Wi /∑ Wi = Pi | (2.72) |
называют вероятностью (математической) i-гo состояния.
Так как наибольшей вероятностью обладает состояние максимального беспорядка, когда средние значения энергии всех молекул одинаковы и молекулы равномерно распределены по объему, то возрастание энтропии означает переход системы к более беспорядочному состоянию. Сама же энтропия может рассматриваться как мера беспорядка в макроскопической системе.
Важнейшими свойствами энтропии являются следующие свойства.
1) При самопроизвольных обратимых процессах энтропия замкнутой системы может возрастать (или оставаться постоянной):
| ∆S≥0. | (2.73). |
2) Во всех реальных (необратимых) процессах энтропия замкнутой системы обязательно возрастает:
| ∆SР>0 | |
3) Энтропия обладает свойством аддитивности, когда общее изменение энтропии системы равно алгебраической сумме изменений энтропии, которое произошло в каждом процессе, которое привело его в это состояние:
| ∆S = ∆S1 + ∆S2 +∆S3+ = ∑∆Si | (2.74). |
Практическое применение имеет не сама энтропия, а её изменение, которое происходит при переходе системы из одного состояния в другое:
| ∆S1-2=∫dQ/T. | (2.75). |
Найдем изменение энтропии в процессах идеального газа. При изотермическом процессе (Т1=Т2):
| ∆S= m/M ln(V2/V1 ). | (2.76). |
При изохорном процессе (V1=V2):
| ∆S = m/M CV ln(T2/T1). | (2.77). |
Так как для адиабатического процесса ∂Q=0, то ∆S=0 и, следовательно, S =const, то есть, адиабатический обратимый процесс протекает при постоянной энтропии. Поэтому его часто называют изоэнтропийным процессом по аналогии с другими изопроцессами.
Используя понятие энтропии и неравенство Клаузиуса второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Существует несколько других эквивалентных формулировок второго начала термодинамики. Например, можно дать более краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
Формула Больцмана позволяет объяснить постулируемое вторым началом термодинамики возрастание энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Таким образом, формула Больцмана позволяет дать статистическое толкование второго начала термодинамики. Оно, являясь статистическим законом, описывает закономерности хаотического движения большого числа частиц, составляющих замкнутую систему.
Укажем еще две формулировки второго начала термодинамики:
- по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
- по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
Формулировка Клаузиуса (1850): процесс, при котором в системе не происходит никаких изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым; иначе говоря, теплота не может самопроизвольно перейти от более холодного тела к более горячему без каких-либо других изменений в системе.
Формулировка Томсона (Кельвина) (1851): процесс, при котором теплота переходит в работу, является необратимым; иначе говоря, невозможно преобразовать в работу всю теплоту, взятую от тела с однородной температурой, не производя никаких других изменений в состоянии системы.
Принцип невозможности создания вечного двигателя второго рода: невозможно создать периодически работающую машину, которая производила бы работу за счет поглощения теплоты одного теплового резервуара, не вызывая при этом никаких других изменений состояния системы. Такую воображаемую машину принято называть вечным двигателем второго рода.
Второе начало термодинамики можно использовать для построения термодинамической шкалы температур. Так как КПД цикла Карно не зависит от рабочего тела, то можно вообразить такую процедуру. Некоторое стандартное тело в определенном состоянии (например, вода, кипящая при атмосферном давлении) выбирается в качестве нагревателя. Другое стандартное тело (например, лед, тающий при атмосферном давлении) выбирается в качестве холодильника. Разность температур Тн и Тх (сами температуры пока неизвестны) делится на произвольное число частей, чем устанавливается значение градуса (скажем, на сто частей). Осуществляется идеальный цикл Карно с каким-либо веществом. Измеряется количество теплоты Q1, заимствованной от нагревателя, и количество теплоты Q2, отданной холодильнику. Уже установлено, что Тх/ Тн = Q2/Q1
Имея, кроме того, условие: Тн—Тх=100 градусов, получаем два уравнения, определяющие Тн и Тх. Если теперь взять некое вещество при неизвестной температуре Т и использовать его в качестве нагревателя при прежнем холодильнике (температура Тх), то, проводя цикл Карно и измеряя Q'1 и Q'2, можно написать: Q'2/ Q'1 = Тх/Т. Отсюда находится искомая температура Т. Построенная таким образом шкала температур, как выяснилось, практически совпадает со шкалой, получаемой при измерениях с газовым термометром.
Так как энергия беспорядочного движения частиц газа пропорциональна температуре, то следует ожидать, что при абсолютном нуле беспорядочное движение должно прекратиться — частицы будут располагаться наиболее упорядоченным образом (но, конечно, будут иметь место внутримолекулярные или внутриатомные движения). Этой наибольшей упорядоченности расположения частиц должна отвечать наименьшая энтропия. В. Нернст (1864—1941), основываясь на научных наблюдениях, высказал положение, часто называемое третьим началом термодинамики: энтропия при абсолютном нуле равна нулю.
Первые два начала термодинамики дают недостаточно сведений о поведении термодинамических систем при нуле Кельвина. Поэтому их дополняет вышеназванное утверждение, называемое третьим началом термодинамики, или теоремой Нернста: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина: lim S = 0. Из теоремы Нернста—Планка следует, что теплоемкости Ср и Cv при О К равны нулю.
В середине XIX в. возникла проблема так называемой «тепловой смерти» Вселенной. Рассматривая Вселенную как замкнутую систему и применяя к ней второе начало термодинамики, Клаузиус свел его содержание к утверждению, что энтропия Вселенной должна достигнуть своего максимума. Это означает, что со временем все формы движения должны перейти в тепловую форму. Переход же теплоты от горячих тел к холодным приведет к тому, что температура всех тел во Вселенной сравняется и наступит полное тепловое равновесие, и все процессы во Вселенной прекратятся - наступит тепловая смерть Вселенной. Ошибочность вывода о тепловой смерти заключается в том, что бессмысленно применять второе начало термодинамики к незамкнутым системам, например к такой безграничной и бесконечно развивающейся системе, как Вселенная.
2.5 Реальные газы
2.5.1 Уравнение Ван-дер-Ваальса. Изотермы реального газа
При увеличении давления и понижении температуры средние расстояния между молекулами уменьшаются. Средняя кинетическая энергия молекул становится сравнимой с потенциальной энергией взаимодействия, и поведение газа все больше отличается от идеального. Отклонение от идеальности может быть установлено экспериментально, путем проверки справедливости уравнения Клапейрона — Менделеева для некоторого газа при различных давлениях. В таблице 2.1 приведены значения объема V, занимаемого одним молем азота N2 при различных давлениях р и температуре 273 К, а также значения произведения pV. Видно, что при уменьшении объема одного моля газа до размеров порядка 10-4м3 отступления от идеальности становятся значительными.
Объем одной молекулы азота по порядку величины равен: V0 = 4/3πr0 ≈ 4*10-28 м3. Так как в моле находится 6,02*1023 молекул, то их объем V≈10-4 м3. Как только молекулы газа попадут в условия, при которых среднее расстояние между ними становится, сравнимым с размерами самих молекул, свойства газа начинают отличаться от идеального.
Таблица 2.1 - Значения объема V, занимаемого одним молем азота при различных Р и Т
| Р*105, Па | V*10*, м8 | pV*109, м3Па | P*105, Па | V*104, м3 | pV*109, м3Па |
| 1 | 224 | 224 | 700 | 0,532 | 372 |
| 100 | 2,4 | 240 | 900 | 0,483 | 435 |
| 300 | 0,85 | 255 | - | - | - |
| 500 | 0,625 | 322 | 1000 | 0,460 | 460 |
Описание свойств реального газа можно осуществить различными способами. В частности, написав уравнение состояния, связывающее между собой макропараметры р, V и Т , можно ввести соответствующие изменения, с учетом реальных сил взаимодействия между молекулами. При этом следует, во-первых, принять во внимание существование сил отталкивания между молекулами, что приведет к уменьшению свободного объема, предоставленного молекулам, на некоторую величину b. Как показывает более детальное рассмотрение, эта величина равна приблизительно учетверенному объему молекул газа: b≈4V0. Поправка b для каждого газа имеет свое значение. Во-вторых, необходимо учесть силы притяжения между молекулами газа, которые вызывают уменьшение давления молекул газа на стенки сосуда на величину pi. Эта поправка определяется тем, что молекулы, находящиеся в поверхностном слое газа (их число п обратно пропорционально объему газа), притягиваются ближайшими молекулами внутри газа (их число также обратно пропорционально объему газа). Поэтому pi пропорционально п2 или обратно пропорционально квадрату объема: pi.= a/V2, где а — постоянная, зависящая от природы газа. С учетом обеих поправок, получаем уравнение состояния реального газа, носящее имя Ван-дер-Ваальса:
| p = RT/(V-b) - a/V2. | |
При достаточно малых Т и V это давление оказывается меньше давления идеального газа: Р<РиД = RT/V. Из этого уравнения следует, что давление реального газа может обратиться в нуль. Это значит, что при достаточном охлаждении и сжатии газ должен превратиться в жидкость, а затем и затвердеть, приобретая вполне определенный объем. Это важное следствие из уравнения Ван-дер-Ваальса полностью подтверждено опытом: все известные газообразные вещества могут быть переведены в жидкое, а затем, при их дальнейшем охлаждении, и в твердое состояние. Вид последнего уравнения ясно выявляет его физическую сущность. Для математического анализа это уравнение удобнее переписать в виде:
| (p+ a/V2)(V-b)=RT. | (2.78). |
Эти уравнения получены для 1 моль. Для произвольного числа молей υ уравнение Ван-дер-Ваальса имеет вид:
| p+ aν2/V2)(V-bν)=νRT | (2.79). |
Уравнение Ван-дер-Ваальса, несмотря на очевидную упрощенность рассуждений при его обосновании, в основном правильно описывает свойства реальных газов в.достаточно большом интервале температур и давлений, введенные поправки имеют ясный физический смысл и могут быть измерены экспериментально.
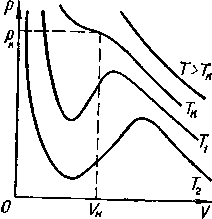
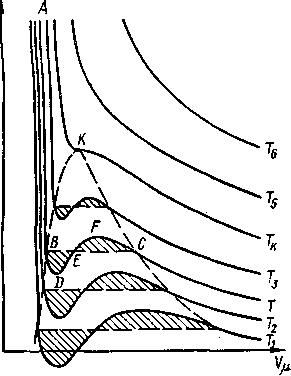
Уравнение Ван-дер-Ваальса позволяет построить теоретические изотермы реального газа и сравнить их с изотермами идеального газа и экспериментальными изотермами реального газа. Семейство теоретических изотерм для реального газа оксида углерода (IV) представлено на рисунке - 2.28. В отличие от монотонно изменяющихся изотерм идеального газа, изотермы реального газа, при низких температурах, изображаются сложными кривыми. Совпадение изотерм идеального и реального газа наблюдается при малых давлениях и больших объемах, что понятно, так как при этих условиях газ можно считать идеальным. Для семейства изотерм Ван-дер-Ваальса характерно наличие так называемой критической изотермы (при температуре ТК), имеющей точку перегиба при некотором давлении рк и объеме Vк; при Т>ТК все изотермы идут монотонно, при Т<.ТК все изотермы изгибаются и имеют минимум и максимум.
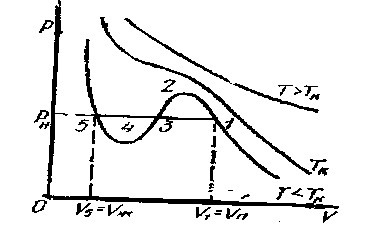
Для выяснения физического смысла состояний, описываемых изотермами Ван-дер-Ваальса, сравним их с экспериментальными изотермами реального газа. Для оксида углерода (IV) критическая температура равна 305 К. Изотермы, снятые экспериментально (рисунок - 2.29), при температурах выше критической, отражают монотонное увеличение давления газа при уменьшении его объема. При температурах, меньших критической, эксперимент показывает, что изотермы на участке 1,5 имеют «полочку», причем, начиная с объема V1, в цилиндре под поршнем находится и жидкость и газ (точнее, насыщенный пар). При объеме V5 пар полностью конденсируется, переходя в жидкость, заполняющую весь объем, и при дальнейшем уменьшении объема изотермы описывают уже свойства реальной жидкости.
 |  |
| Рисунок - 2.28 | Рисунок - 2.29 |
Состояния, соответствующие участку изотермы Ван-дер-Ваальса 2, 3, 4, не наблюдаются экспериментально, так как они неустойчивые; состояния 4,5 и 1,2 могут быть реализованы при особых условиях. Участок 4,5 соответствует так называемой растянутой жидкости. Это состояние можно получить, например, если осторожно вытягивать из сосуда со ртутью вертикальную трубку, заполненную ртутью и закрытую сверху. В этом случае удается получить столб, высота которого превосходит высоту, отвечающую атмосферному давлению, существующему в условиях опыта: жидкость в трубке занимает больший объем, чем ей положено. Но при малейшем сотрясении столб падает до нормальной высоты. Участок 1,2 можно реализовать, если достаточно медленно изотермически сжимать очень чистое вещество: конденсация может наступить при повышенном давлении. Такой пар называют пересыщенным. Состояния, соответствующие участкам /, 2 и 4, 5, называют метастабильными состояниями.
Таким образом, уравнение Ван-дер-Ваальса описывает не только свойства газов и паров, но и жидкостей. Анализ изотерм реального газа показывает, что превращение реального газа в жидкость возможно только при температурах, меньших критической, и при соответствующих давлениях.
Как видно из графиков реальных изотерм и изотерм Ван-дер-Ваальса, при критической температуре изотерма реального газа имеет точку перегиба. Обозначим критические значения соответствующих параметров Тк, рк и Vк. Для их нахождения проще всего воспользоваться известным свойством точки перегиба: в ней первая и вторая производные давления по объему обращаются в нуль:
| dp/dV = - RT/(V-b)2 + 2a/V3 = 0; d2p/dV2 = 2RT/ (V-b)3 -6a/V4 = 0 | |
Из этих соотношений сразу получается:
| Vк = 3b; Тк = 8а/27bR | (2.80). |
Подставив эти величины в уравнения Ван-дер-Ваальса, находим критическое давление:
| рк = а/27b2 | (2.81). |
Отношение (рк Vк)/RT = 3/8 ≠ 1. Оно не зависит от природы газа и резко отличается от единицы; следовательно, вблизи критической точки (и тем более при температурах ниже критической) нельзя пользоваться уравнением Клапейрона—Менделеева. При критической температуре и V>VK, вещество находится в парообразном состоянии. При V
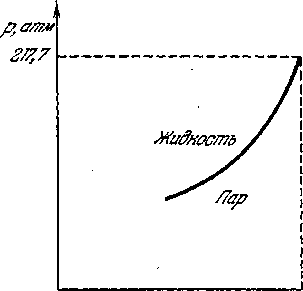
На рисунке 2.31 представлена зависимость упругости насыщенного пара от температуры для воды. Для всех других веществ эта зависимость имеет такой же характер. Любая точка слева от приведенной кривой соответствует жидкому состоянию, а точки, расположенные справа от нее, соответствуют газообразной фазе. Это значит, что пар, состояние которого характеризуется какой-либо точкой справа от кривой, сконденсируется, если, сохраняя неизменным давление, понизить его температуру. Точно так же жидкость, состояние которой задано координатами любой точки, расположенной слева от кривой, перейдет в пар, если повысить ее температуру. И только точки, лежащие на самой кривой, соответствуют фазовому равновесию, т. е. одновременному существованию жидкости и пара над ней.
Кривая рисунка - 2.30, точки которой соответствуют равновесию фаз, называется фазовой диаграммой, или кривой равновесия фаз (в данном случае жидкости и пара). Она разделяет области, точки которых соответствуют однофазным состояниям вещества, и является, одной из важных характеристик вещества. Такие диаграммы иногда называют также диаграммами состояния.
Характерной особенностью кривой рис. 82 является то, что она имеет конец, так как она не может быть продолжена выше критической температуры. Ведь выше этой температуры нет двух фаз, поэтому не может быть и их равновесия. Как мы увидим ниже, кривая равновесия «жидкость - пар» имеет и начало.
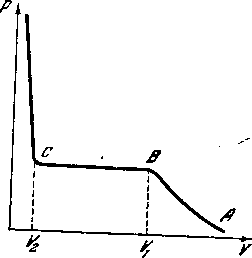
График рисунка - 2.31 иллюстрирует сказанное выше. При сравнительно больших удельных объемах (малой плотности) газа уменьшение объема сопровождается увеличением давления (участок АВ кривой). Так продолжается до тех пор, пока объем не уменьшится до значения V1. Дальнейшее уменьшение объема до значения V2 не вызывает изменения давления. Начиная с V2,уменьшение объема требует уже резкого повышения давления. В точке В, соответствующей объему V1, начинается процесс конденсации, и к тому моменту, когда объем достигнет значения V2, весь газ переходит в жидкое состояние.
 |  |
| Рисунок - 2.30 | Рисунок - 2.31 |
Наконец, резкое увеличение давления при уменьшении объема ниже V2 свидетельствует о том, что происходит уже сжатие самой жидкости. При давлениях и объемах, соответствующих участку ВС, часть объема сосуда занята жидкостью, другая часть — газом, который; в этом случае называется насыщенным паром (рисунок - 2.32). Ордината, cooтветствующая участку ВС, определяет давление насыщенного пара, и как обычно говорят, упругость насыщенного пара при данной температуре. При этой температуре, следовательно, стирается разница между жидкостью и ее насыщенным паром.
При температурах выше 647,3 К вода ведет себя как обычный газ, т. е. при повышении давления ее объем уменьшается. Вместо двух одновременно существующих состояний, жидкого и газообразного, теперь остается только одно состояние — газообразное, хотя при достаточно высоком давлении плотность такого газа может стать равной плотности жидкости и превзойти ее
Все это относится, разумеется, не только к воде, но и к любому другому веществу. Для каждого вещества существует своя некоторая температура, при которой исчезает различие между паром и жидкостью и выше которой вещество может быть только однородным при любом сжатии. Эта температура называется критической температурой. Разные вещества имеют различные значения критических температур. Самой низкой в природе критической температурой обладает редкий изотоп гелия Не3 —гелий с атомным весом 3. Она равна 3,35К, или - 269,80°С.
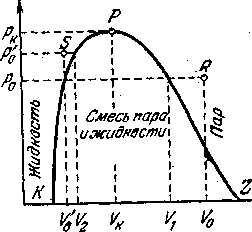
Если на изотермах, соответствующих фазовому переходу жидкость—пар, соединить точки перехода пара в жидкость и жидкости в пар, то получится плавная кривая с максимумом, изображенная пунктиром и воспроизведенная отдельно на рисунке - 2.33. Любая точка R с координатами р0 и V0, находящаяся справа ветви кривой PZ, соответствует, очевидно, газообразному состоянию, потому что удельный объем V0 больше того объема, при котором начинается переход в жидкое состояние при том же давлении. Точно так же точка S с координатами р'0 и V'0 как и любая друг точка, расположенная слева от ветви РК, соответствует жидкому состоянию — удельный объем V'a меньше удельного объема, при котором заканчивается процесс конденсации. Все же точки, лежащие внутри кривой KPZ, соответствуют двухфазным состояниям, таким состояниям, при которых одновременно существуют жидкость и насыщенный пар над ней. Точка же Р соответствует критическому состоянию. Ее координаты на кривой рисунке - 2.33 —рк и VK —-критические давление и объем.
 |  |
| Рисунок - 2.32 | Рисунок - 2.33 |
Как мы уже знаем, перевести вещество из газообразного в жидкое состояние можно, повышая его давление при данной температуре, если эта последняя ниже критической. Если температура выше Т', необходимо предварительное охлаждение. При таком превращении вещество должно пройти через промежуточную область двухфазного состояния, когда пар и жидкость сосуществуют и граничат друг с другом.
Можно, однако, осуществить этот переход и минуя эту область двухфазных состояний. Другими словами, можно превратить газ в жидкость (или наоборот) без того, чтобы в какой-то момент существовали обе фазы. Например, для того, чтобы газ, характеризуемый объемом Vo, давлением р0 и температурой Т0 превратить в жидкость при той же температуре и давлении, но, конечно, с другим объемом V'0, можно поступить следующим образом. Нужно нагреть газ до температуры выше критической, после чего сжать так, чтобы его объем стал равным V0. Наконец, сохраняя постоянным объем, нужно охладить газ до температуры Т0. Давление его при этом станет равным р0. Таким образом, мы можем превратить газ в жидкость «в обход» области двухфазных состояний, так что не будет такого промежуточного состояния, при котором появится граница между жидкостью и паром (мениск).
2.5.2 Внутренняя энергия реального газа. Эффект Джоуля—Томсона
Сжижение газов Внутренняя энергия Е реального газа определяется кинетической энергией его молекул и потенциальной энергией их взаимодействия:
| E=Ek+Ep. | (2.81). |
Как и для идеального газа, кинетическая энергия молекул реального газа пропорциональна его температуре, и для 1 моль - Eк=CvT.
Потенциальную энергию взаимодействия можно определить, если учесть, что элементарная работа сил взаимодействия при Т=const равна: dA = — ptdV= — а/V2dV. Эта работа связана с изменением потенциальной энергии взаимодействия молекул:
| dA =—dEp, т. е. dEp = а/V2dV. | |
Поэтому Ep.=- - а/V2+ E0 Приняв потенциальную энергию при V→.∞ равной нулю, получим для внутренней энергии газа:
| Е = СVТ— а/V | (2.82). |
В отличие от идеального газа температура реального газа может изменяться даже в том случае, если его внутренняя энергия остается постоянной. Так как внутренняя энергия реального газа зависит не только от температуры, но и от объема, то описание его поведения более сложно, чем идеального газа.
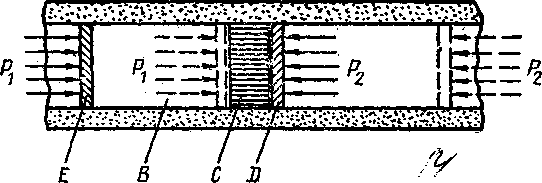
Особый интерес представляет процесс, предложенный Джоулем и осуществленный позднее Томсоном (Кельвином). В трубе с теплоизолированными стенками, разделенной на две части пористой перегородкой, могут перемещаться два поршня. В начале эксперимента 1 моль некоторого реального газа занимает объем Vt между левым поршнем и перегородкой при температуре Т1 и давлении p1. Правый поршень занимает положение вплотную к перегородке и находится под давлением р2 (рисунок - 2.34). В процессе эксперимента левый поршень под давлением p1 медленно продавливает газ через перегородку. При этом правый поршень перемещается под давлением р2. В результате весь газ оказывается справа от перегородки, занимая объем V2 при температуре Т2 и давлении р2. Определим соотношение между температурами Т1 и Т2. В соответствии с первым началом термодинамики при адиабатическом продавливания газа изменение внутренней энергии газа будет равно Δ(E2—E1)= Δ(p1V1—p2V2, ) или E2+ p2V2,= E1+ p1V1, т. е. процесс Джоуля — Томсона протекает при постоянной энтальпии.
 |
| Рисунок - 2.34 |
Для простоты рассуждения будем считать, что объем V2 так велик, что газ после дросселирования можно считать идеальным. При этом условии последнее соотношение можно записать в виде CVT2 + p2V2 = CVТ1— а/V1 + p1V1, откуда ΔT = T2 –T1 = Δ (p1V1—p2V2, )/CV. Процесс такого необратимого расширения называют адиабатическим дросселированием.
Явление изменения температуры при адиабатическом расширении газа без совершения им полезной работы экспериментально обнаружили в середине XIX в. английские физики Д. Джоуль и В. Томсон. Поэтому явление изменения температуры газа при таком процессе называют эффектом Джоуля—Томсона. Формула для расчета изменения температуры, наблюдаемый при конечном перепаде давления в дросселе при адиабатическом процессе, выражает интегральный эффект Джоуля — Томсона,
Опыты показали, что для каждого газа в зависимости от его состояния перед дросселем (р1,Т1) и перепада давления в дросселе (р1-р2) изменение температуры ΔT = T2 –T1 – может быть больше нуля (отрицательный (эффект Джоуля — Томсона), меньше нуля (положительный эффект Джоуля — Томсона), и равно нулю (нулевой эффект Джоуля — Томсона).
Этот эффект был положен в основу практического сжижения газов: если заранее достаточно охладить газ, а затем произвести процесс Джоуля — Томсона, то произойдет дальнейшее охлаждение. Если охлажденной порцией газа охлаждать следующие порции, поступающие в машину для сжижения газов, омывая холодным газом змеевик, несущий охлаждаемый газ, то можно добиться сжижения газа. С помощью этих сжиженных газов могут быть получены и любые промежуточные температуры, хотя это требует применения особых, иногда весьма сложных устройств.
Описанный принцип противотока применяется во всех холодильных машинах, хотя конструкции теплообменников подверглись значительным изменениям. В современных установках они обеспечивают лучший теплообмен и, кроме того, делают возможной очистку сжижаемого газа от примесей.
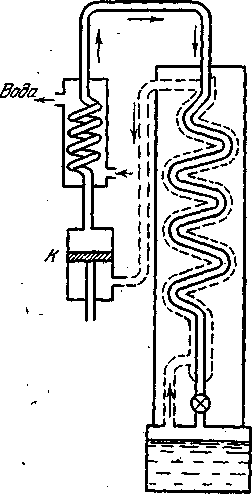
В качестве примера рассмотрим схему для сжижения водорода и гелия машины этого типа, действие которых основано на использовании эффекта Джоуля—Томсона. Так как температура инверсии эффекта Джоуля—Томсона Ti для гелия очень низкая (около 50 К), то он должен быть предварительно охлажден до температуры ниже Ti. В описываемой машине гелий охлаждается жидким водородом до температуры 14,5 К. Работу машины иллюстрирует схема, представленная на рисунке - 2.35.
 | 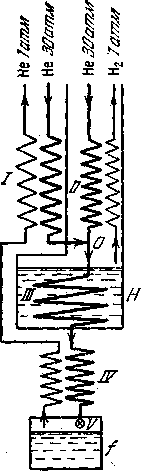 |
| Рисунок - 2.35 | |
Гелий, сжатый компрессором до давления 30 атм, поступает в машину двумя потоками по двум трубам, соединяющимся вместе в точке О. Обе эти трубы являются частями двух теплообменников — / и //. В теплообменнике / гелий охлаждается встречным потоком газообразного гелия, испаряющегося из приемника / и прошедшего уже через теплообменник IV. В теплообменнике // вторая часть сжатого газа охлаждается встречным потоком газообразного водорода, испаряющегося из ванны с жидким водородом Н.
Соединившись в точке О, оба потока вместе поступают в змеевик ///, проходящий через жидководородную ванну Я, и принимают ее температуру (14,5 К). Пройдя через эту ванну, гелий попадает в теплообменник IV, где он дополнительно охлаждается испаряющимся из приемника гелием до температуры 5,8 К. При такой температуре гелий подвергается дросселированию через вентиль и сжижается. Весь аппарат помещается в вакуумный чехол, обеспечивающий его тепловую изоляцию.
Приведенные выше цифры для температур в разных частях установки относятся, к установившемуся режиму работы. Во время разгона машины температура гелия перед дросселированием выше, чем 5,8 К, так как в это время в приемнике еще нет жидкого гелия. Машина обладает производительностью около 10 литров жидкого гелия в час, что является высоким показателем.
Применение детандеров, в которых газ охлаждается при адиабатном расширении с совершением внешней работы, повышает эффективность ожижительных машин. В машинах для сжижения гелия использование расширения в детандерах позволяет, кроме того, отказаться от предварительного охлаждения газа жидким водородом-— веществом, легко вменяющимся и взрывоопасным. Обе эти причины привели к широкому использованию детандерных машин. Впервые такая машина была построена Клодом для сжижения воздуха. Схема машины представлена на рисунке - 2.36.
Газ подвергается изотермическому сжатию в компрессоре К, откуда он поступает в теплообменник Е1. Здесь он разделяется на два потока (в точке О). Первый идет через теплообменник Е2 к дроссельному вентилю и подвергается дросселированию с охлаждением за счет эффекта Джоуля — Томсона; второй к (на его долю приходится 80% газа) поступает в детандер, расширяется в нем, совершая работу, и за этот счет охлаждается. Из детандера охлажденный газ возвращается в теплообменник Е1., охлаждая встречную очередную порцию сжатого газа. К нему в точке О' присоединяется и тот газ, который охладился в результате дросселирования. До этого он, проходя через теплообменник Е2, тоже охлаждал встречный газовый поток.
В первой машине Клода детандер представлял собой поршневую машину. Работу, которую в ней совершает сжатый газ, можно использовать для облегчения работы компрессора, для принудительной смазки машины и т. д. Условия, характерные для машины Клода (ожижающий воздух), примерно таковы: давление на выходе из компрессов 40 атм, температура на входе в детандер (т. е. после охлаждения обменнике E1) 200К; температура после расширения в детандере 110 К при давлении в 1 атм.
Существует много различных по конструкции машин типа Клода для сжижения воздуха. Одной из самых интересных машина П. Л. Капицы, в которой поршневой детандер заменен турбиной (турбодетандер). Другой особенностью этой машины является низкое давление, под которым газ поступает в детандер. Оно равно лишь 6,5 атм. Зато в этой машине почти весь газ (а не 80% в машине Клода) проходит через детандер. В результате расширения в турбодетандере газ охлаждается до 86 К и сжижает ту часть газа, которая миновала детандер. Получившаяся жидкость находится под повышенным давлением и дросселируется через соответствующий вентиль к более низкому давлению.
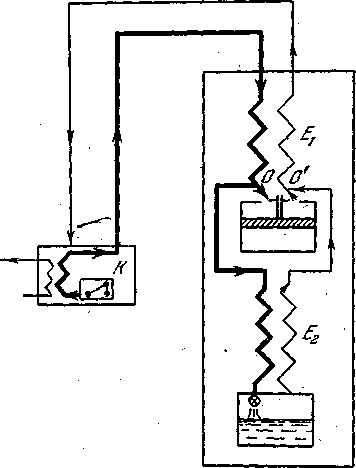 |
| Рисунок - 2.36 |
Расширение в детандерах (исключительно поршневых) используется также в машинах для сжижения водорода и гелия.
