Календарно-тематичний план практичних занять з біологічної хімії для студентів медичних факультетів на весняно-літній семестр 2007-2008 н р
| Вид материала | Документы |
- Календарно-тематичний план лекцій з біоорганічної та біологічної хімії для студентів, 40.6kb.
- Тематичний план практичних занять для студентів VI курсу медичних факультетів, 17.02kb.
- Львівський національний медичний університет імені данила галицького кафедра біологічної, 1655.89kb.
- Тематичний план практичних занять з медичної інформатики для студентів 2-го курсу медичного, 67.97kb.
- Календарно-тематичний план лекцій з загальної хірургії для студентів 3 курсу медичних, 44.9kb.
- Календарно-тематичний план лекцій з біоорганічної та біологічної хімії для студентів, 53.27kb.
- Львівський національний медичний університет імені Данила Галицького кафедра біологічної, 1954.66kb.
- Календарно тематичний план практичних занять із гігієни та екології для студентів IІІ, 296.49kb.
- Методичні рекомендації для підготовки до практичних занять студентів VI курсу медичних, 2563.92kb.
- Тематичний план лекцій з біологічної хімії для студентів 2 курсу медичного факультету, 611.76kb.
Теоретичні питання
1. Загальний азот плазми крові: білковий та небілковий (залишковий або резидуальний) азот. Види азотемії:
• абсолютна - регенційна, продукційна;
• відносна.
2. Сечовина — кінцевий продукт обміну білків та амінокислот:
• шляхи утворення аміаку в організмі людини, його токсичність, транспортні форми і механізми знешкодження; гіперамоніємія;
• ферментативні реакції біосинтезу сечовини;
• вміст сечовини в крові в нормі, коефіцієнт азоту сечовини, добове виведення сечовини з організму;
• генетичні дефекти ферментів синтезу сечовини.
3. Амінокислоти плазми крові.
4. Сечова кислота — кінцевий продукт катаболізму пуринових основ:
• схема катаболізму пуринових нуклеотидів;
• вміст сечової кислоти в крові в нормі та добове її виведення;
• порушення обміну сечової кислоти - гіперурикемії: первинні (спадкові) - подагра, хвороба Леша-Ніхана і вторинні (набуті) — захворювання крові, нирок, отруєння свинцем.
5. Креатин та кінцевий продукт його обміну — креатинін.
• біосинтез креатину та креатиніну;
• фізіологічне значення креатину в енергозабезпеченні функції м'язів;
• креатинін - форма виведення азоту амінокислот з організму;
• вміст в крові в нормі та добове виведення креатиніну.
6. Глутатіон — γ-глутамініл-цистеїніл-гліцин:
• біосинтез глутатіону;
• біологічні функції глутатіону.
7. Індикан — кінцевий продукт катаболізму триптофану.
8. Діагностичне значення визначення кінцевих продуктів обміну речовин.
9. Біохімічні показники небілкових азотовмісних компонентів цільної крові та плазми крові: сечовини, сечової кислоти, креатину, креатиніну, азоту амінокислот, індикану.
10. Безазотисті органічні компоненти крові: глюкоза, органічні кислоти, кетонові тіла, вітаміни їх біологічна роль.
- Неорганічні компоненти плазми крові.
Практичні роботи
Завдання 1. Визначення вмісту залишкового азоту крові методом Боданського.
Принцип методу. Вміст залишкового азоту крові визначають у безбілковому фільтраті після осадження білків крові — дією концентрованої сульфатної кислоти. При цьому азот усіх азотовмісних сполук у вигляді аміаку зв'язується із сульфатною кислотою, утворюючи сульфат амонію, який в свою чергу з реактивом Несслера утворює сполуку жовто-оранжевого кольору. Інтенсивність забарвлення прямо пропорційна концентрації азоту.
Хід роботи. У пробірку наливають 0,5 мл безбілкового фільтрату і 0,05 мл концентрованої сульфатної кислоти. Спалюють на піщаній бані до утворення бурого забарвлення. Пробірку охолоджують, додають 2 краплі пергідролю і знову спалюють до знебарвлення. Після охолодження в пробірку додають 10 мл свіжої кип'яченої води (дистильованої) і нейтралізують 12,5М розчином їдкого натру до слаболужної реакції. Реакцію визначають за зміною кольору лакмусового папірця (з червоного на синій). Потім додають 0,5 мл реактиву Несслера (калій-меркурію йодид). Вміст пробірки забарвлюється у жовтий колір різної інтенсивності залежно від вмісту азоту.
Паралельно з дослідною пробою обробляють стандартну: 0,2 мл стандартного розчину, 0,05 мл сульфатної кислоти, 0,3 мл 12,5М розчину їдкого натру, 0.5мл реактиву Несслера і 9,8 мл дистильованої води. Дослідну і стандартну проби вимірюють порівняно з контролем на реактиви за довжини хвилі 440-450 нм у кюветі завтовшки 5мм. У контролі замість сульфату амонію — вода і жовтуватий колір розчину .Розрахунки здійснюють за формулою:
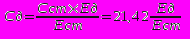 ,
,де Сд — концентрація залишкового азоту в досліді, ммоль/л; Ед — екстинкція дослідної проби; Ест — екстинкція стандартної проби; Cст — концентрація залишкового азоту в стандарті = 21,42 ммоль/л. Норма залишкового азоту в крові становить 14,3-25 ммоль/л (20-35 мг%).
Клініко-діагностичне значення.
1. Діагностика порушень видільної функції нирок і оцінки ступеня ниркової недостатності. Ретенційна ( ниркова) азотемія зустрічається при гломерулонефритах, пієлонефриті, туберкульозі нирок. Продукційну азотемію спостерігають при кахексії, лейкозі, новоутвореннях, кишковій непрохідності.
2.Оцінка сечовиноутворювальної функції печінки і виявлення печінкової недостатності.
Завдання 2. Мурексидна проба на сечову кислоту.
Принцип методу. Сечова кислота в присутності концентрованої нітратної кислоти утворює з аміаком пурпурно-червону речовину — мурексид, амонієву сіль пурпурової кислоти.
Хід роботи. До порошку сечової кислоти додають 1-2 краплі нітратної кислоти і обережно нагрівають (70оС). Після охолодження до коричнево-червоного залишку, який містить продукти окислення і гідратації сечової кислоти, додають краплю розчину аміаку — з'являється пурпурно-червоне забарвлення.
Клініко-діагностичне значення. Мурексидною пробою користуються для виявлення сечової кислоти у сечовому камені.
Завдання 3. Визначення аміаку в добовій сечі.
Принцип методу. При взаємодії формаліну з амонійними солями утворюється уротропін та соляна кислота, кількість якої еквівалентна вмісту амонійних солей у сечі.
Хід роботи. В колбу налити10 мл сечі, додати 1-2 краплі фенолфталеїну (нейтралізувати кислі продукти), додати 5 мл нейтрального розчину формаліну. Титрування проводять 0.1М розчином лугу до появи рожевого забарвлення. Розрахунок робимо за формулою:
X = а×0,0017×1300/В,
де X – вміст аміаку у г, а — кількість 0,1М (моль/л) лугу, що пішла на титрування, 1300 — добовий діурез у мл, В — кількість сечі у пробі — 10 мл.
Норма аміаку в сечі — 0,4-1,0 г/добу або 30-75 ммоль/добу.
Завдання 4. Якісна реакція на фенілпіровиноградну кислоту- проба Фелінга.
Принцип методу. Фенілпіровиноградна кислота утворює з іонами Fе (III) комплексну сполуку, забарвлену в синьо-зелений колір.
Хід роботи. До 2 мл свіжовідфільтрованої сечі наливають 8-10 крапель 10% розчину феруму хлориду. Через 30-60 с з'явиться синьо-зелене забарвлення, коли є ФПВК. Через 5-30 хв, залежно від концентрації ФПВК, колір вицвітає.
Клініко-діагностичне значення. Для діагностики фенілкетонурії.
Тема заняття № 18. Дослідження згортальної, антизгортальної і фібринолітичної систем крові. Патології гемостазу.
Цілі заняття:
Пояснювати сукупність механізмів збереження рідкого стану крові, функціональні та біохімічні властивості системи гемостазу.
Трактувати біохімічні принципи функціонування згортальної, антизгортальної та фібринолітичної систем крові.
Аналізувати основні фактори гемостазу, зовнішній і внутрішній шляхи згортання крові, антифібринолітичну систему.
Аналізувати стан здоров'я людини на підставі біохімічних параметрів змін (відсутності) факторів згортання крові.
Пояснювати причину порушень тромбоцитарного і коагуляційного гемостазу.
Аналізувати основні показники гемостазу та фібринолітичної системи крові.
Теоретичні питання
1. Функціонально-біохімічна характеристика системи гемостазу:
• судинно-тромбоцитарний гемостаз;
• коагуляцій ний гемостаз.
2. Згортальна система крові:
• фактори згортання крові;
• механізм активації системи згортання крові;
• функціонування каскадної системи згортання крові в згортальній системі, її особливості;
• внутрішній шлях коагуляції;
• зовнішній шлях коагуляції;
• роль вітаміну К у реакціях каскаду коагуляції.
3. Схема взаємовідносин між внутрішнім, зовнішнім та загальним кінцевим шляхами коагуляції.
4. Порушення тромбоцитарного гемостазу: тромбоцитопенії, тромбоцитопатії.
5. Порушення коагуляційного гемостазу: гемофілії (А, В, С), дефект Хагемана, хвороба Стюарта-Прауера.
6. Набуті порушення, зумовлені антитілами і факторами згортання, дефіцитом вітамін-К-залежних факторів згортання, лікарські коагулопатії; синдром десемінованого внутрішньосудинного згортання (тромбогеморагічні синдроми), мікротромбоваскуліти.
7. Антизгортальна система крові:
• антикоагулянти: антитромбіни, α1-інгібітор протеїназ, α2-макроглобулін, гепарин, кумарини;
• механізм дії антикоагулянтів.
8. Фібринолітична система крові. Етапи фібринолізу:
• І етап - перетворення плазміногену на плазмін;
• ІІ етап - розщеплення фібрину.
9. Фармакологічні препарати - компоненти фібринолітичної системи: плазмін, урокіназа, стрептокіназа, тканинний активатор плазміногену (ТАП), їх застосування в медичній практиці.
10. Нормальні показники основних фізіологічних антикоагулянтів: гепарину, антитромбіну, продуктів деградації тромбіну, ристоміцину.
11. Зміна показників крові при синдромі набутого імунодефіциту — СНІДі.
12. Нормальні показники фібринолітичної системи крові.
Практичні роботи
Завдання 1. Визначення протромбінового (тромбопластичного) часу згортання крові.
Принцип методу. Згортання плазми крові при рекальцифікації проходить в три етапи: активація тромбокінази, перетворення під дією тромбокінази протромбіну в тромбін, утворення фібрину під впливом тромбіну. Введення кальцію в плазму збагачує її на тромбокіназу і скорочує час згортання крові.
Хід роботи. Внести в пробірку Відаля, встановлену на водяну баню (37оС), 0,1 мл плазми, 0,1 мл тромбопластину і 0,7 мл 0,025М розчину хлориду кальцію. Одночасно з внесенням кальцію включити секундомір і виключити його при появі фібрину. Цей час і буде протромбіновим часом. При активності препарату промбопластину час становить 18с, норма без нього-45-60 сек. Зміна цього насу свідчить про порушення стану активації протромбіну.
Клініко-діагностичне значення. Подовження протромбінового часу згортання крові спостерігається при гіпофібриногенемії, надлишку антитромбінів, при накопиченні продуктів фібринолізу і деяких молекулярних аномаліях фібриногену. Повне незсідання крові — при гіпергепаринемії і при гострому ДВЗ-синдромі, при дефіциті деяких факторів протромбінового комплексу.
Завдання 2. Визначення вмісту вільного гепарину в крові за методом Сірмаї.
Принцип методу. Метод базується на здатності толуїдинового синього зв'язувати вільний гепарин крові, що призводить до скорочення тромбінового часу.
Хід роботи. В пробірку Відаля №1 (контроль), встановлену на водяну баню, відміряють 0,05 мл ізотонічного розчину натрію хлориду, в №2 (дослідну) — 0,05 мл толуїдинового синього і теж ставлять на водяну баню і в кожну додають по 0,1 мл досліджуваної плазми. Через 30 с додають тромбін по 0,1 мл в кожну і фіксують час згортання крові. Різниця в часі свідчить про кількість вільного гепарину. Норма 16-20 с.
Клініко-діагностичне значення. Найважливіша функція гепарину — антикоагулянтна, яка залежить від антитромбіну ІІІ (АТ-ІІІ) і його доступності для дії гепарину. Нагромадження в плазмі крові білків гострої фази, імунних комплексів та інших компонентів, що мають здатність зв'язувати та інактивувати гепарин, призводить до порушення комплексування АТ-ІІІ до гепарину. Зниження АТ-ІІІ спостерігається при гестозах, хворобах печінки, при інтенсивному лікуванні гепарином, вживанні гормональних контрацептивів. Зменшення гепарину — при інфаркті міокарда, порушенні функції печінки, псоріазі.
Тема заняття № 19. Дослідження біохімічних закономірностей реалізації імунних процесів. Імунодефіцитні стани.
Теоретичні питання
1. Загальна характеристика імунної систем: клітинні та біохімічні компоненти.
2. Природа антигенів та шляхи їх проникнення в організм.
3. Структура різних антигенів:
3.1. Структура високомолекулярних антигенів:
• Антигенна детермінанта (епітоп) полісахаридного антигену
• Епітопи білків-антигенів
3.2 Структура низькомолекулярних антигенів
4. Організація імунної системи:
4.1. Типи лімфоїдних клітин:
• В-лімфоцити
• Т-лімфоцити
4.2. Будова лімфоїдних клітин:
• Білки-рецептори В-лімфоцитів - мембранні форми імуноглобулінів
• Білки-рецептори Т-лімфоцитів
4.3. Функції лімфоїдних клітин:
• Регуляторна функція Т-хелперів, Т-супресорів
• Цитотоксична функція Т-ефекторів - клітинний імунітет.
• Секреторна функція плазматичних клітин.
5. Імуноглобуліни (антитіла):
5.1. Структура антитіл:
• Пептидні ланцюги
• Доменна структура
• Константна ділянка
• Варіабельна ділянка
• Активний центр молекули імуноглобулінів
5.2. Біологічні функції:
• Гуморальний імунітет
5.3. Механізми регуляції синтезу імуноглобулінів.
5.4 Біохімічні характеристики окремих класів імуноглобулінів людини (IgG,IgA,IgM,IgD,IgE).
6. Медіатори та гормони імунної системи:
6.1. Основні класи цитокінів:
• Інтерлейкіни (IL)
• Інтерферони: молекулярні механізми противірусної дії
• Білково-пептидні фактори регуляції росту та проліферації клітин (фактори некрозу пухлин (TNF), колонієстимулюючі фактори росту (КСФ), трансформуючі фактори росту (ТФР))
7. Біохімічні компоненти системи комплементу людини.
7.1 Шляхи активації системи комплементу:
• Класичний механізми активації;
• Альтернативний (пропердиновий) механізм активації
8. Біохімічні механізми імунодефіцитних станів:
• Первинні (спадкові)
• Вторинні імунодефіцити;
• Синдром набутого імунодефіциту людини.
Практичні роботи
Завдання 1. Визначення наявності гістаміну у розчині за специфічною кольоровою реакцією із солями кобальту.
Принцип методу. Гістамін реагує із солями кобальту з утворенням забарвлених комплексних солей.
Хід роботи. 0,01-0,02 г гістаміну розчиняють в 1 мл води, додають 2-3 краплі розчину кобальту нітрату Co(NO3)2, або кобальту хлориду СоСl2 й 1 краплю NaOH. Випадає осад червоно-фіолетового кольору.
Клініко-діагностичне значення. Гістамін є продуктом реакції декарбоксилювання L-гістидину, міститься в гранулах тканинних базофілів. Одним з фізіологічних ефектів гістаміну є участь його в імунологічних реакціях. Збільшення вмісту гістаміна в зоні запалення й ділянках взаємодії антигену з антитілом є одним з патогенетичних механізмів розвитку алергічних і анафілактичних реакцій.
Завдання 2. Визначення активності лізоциму у сироватці крові.
Принцип метода. Показником активності лізоциму служить величина, яка дорівнює різниці між процентом світлопропускання досліджуваної суміші після півторигодинної інкубації та процентом світлопропускання вихідної мікробної культури.
Хід роботи. В пробірку вносять по 0,03 мл досліджуваної сироватки, по і 1,47 мл мікробної культури мікрокока. Обережно струшують, а потім додають по 0,03 мл вітаміну В6 (вітаміну С) різної концентрації і витримують в термостаті при t=39°C 1,5 години. Після інкубації вимірюють оптичну густину на фотоколориметрі.
Приклад розрахунку: оптична густина культури 20; оптична густина дослідних проб після інкубації — 28; активність лізоциму в сироватці: 28 - 20 = 8 (%)
Клініко-діагностичне значення. Лізоцим (мурамідаза) слини — фермент, вміст якого складає 0,15-0,25 г/л, тобто біля 5% всіх білків слини. Основним джерелом є секрет піднижньощелепних залоз, в привушних залозах його вміст менший. Лізоцим має високі антибактеріальні властивості, оскільки руйнує клітиннустінку бактерій.
Клітини бактерій вкриті жорсткою пористою оболонкою пептидогліканової природи - муреїном. Муреїн побудований з довгих ланцюгів (ниток) полісахаридів, що складаються з N-ацетилглюкозаміну та N-ацетилмурамової кислоти. Полісахаридні ланцюги зшиті між собою білковими (пента- та тетра-пептидними) олігопептидами. Клітинна стінка (муреїн) - це гігантська мішковидна молекула пептидоглікану, що охоплює всю клітину. Лізоцим розщеплює глікозидні зв'язки між Н-ацетилглюкозаміном та N-ацетил-мурамовою кислотою в полісахаридах, і клітина гине.
Змістовий модуль 18. Функціональна та клінічна біохімія органів і тканин
Тема заняття №17 Дослідження процесів біотрансформації ксенобіотиків та ендогенних токсинів. Мікросомальне окислення, цитохром Р-450.
Цілі заняття:
- Трактувати біохімічні механізми функціонування детоксикаційної системи печінки: реакції мікросомального окислення та кон'югації в біотрансформації ксенобіотиків та ендогенних токсинів;
- Пояснювати молекулярні основи генетичного поліморфізму та індуцибельної природи цитохрому Р-450;
- Аналізувати причини розвитку толерантності до лікарських засобів при їх тривалому використанні;
- Пояснювати біохімічні основи розвитку недостатності функцій печінки за умов хімічного, біологічного та радіаційного ураження.
Теоретичні питання
1. Детоксикаційна функція печінки: біотрансформація ксенобіотиків та ендогенних токсинів.
2. Основні стадії біотрансформації чужорідних хімічних сполук в печінці:
• перша стадія - окислювально-відновлювальні та гідролітичні реакції;
• друга стадія - реакції синтезу, або кон'югації.
3. Реакції мікросомального окислення:
• мікросомальні оксигенази (монооксигенази);
• електронотранспортні ланцюги мембран ендоплазматичного ретикулуму;
• цитохром Р-450;
• каталітичний цикл функціонування цитохрому Р-450.
4. Генетичний поліморфізм та індуцибельність біосинтезу цитохрому Р-450.
5. Виникнення та природа розвитку толерантності до лікарських засобів.
6. Реакції кон'югації в гепатоцитах:
• реакції глюкуронування за участю УДФ-глюкуронової кислоти;
• реакції сульфатування за участю 3'-фосфоаденозин-5'-фосфосульфату;
• реакції метилування за участю S-аденозилметіоніну;
• реакції ацетилування за участю ацетил-S-KoA;
• реакції кон'югації з гліцином.
7. Приклади реакцій детоксикації ендогенних токсинів в печінці:
• знешкодження білірубіну - продукту розпаду гему;
• знешкодження скатолу та індолу — продуктів перетворення триптофану.
Практичні роботи
Завдання 1. Виявлення індикану в сечі (проба Обермейера).
Принцип методу. Індикан (тваринний індикан) — калієва сіль індоксилсульфату. Метод ґрунтується на перетворенні індикану в індоксил в процесі кислотного гідролізу ефірного зв'язку сильною мінеральною кислотою (хлористоводнева кислота). Утворений індоксил, в присутності тимолу, окислюється хлоридом заліза до індиголігнону — сполуки рожево-фіолетового кольору.
Хід роботи. До 4 мл сечі додають 2 мл 10% розчину ацетату свинцю [РЬ (СН3СООН)2] для осадження жовчних пігментів, солей та інших речовин, що заважають проведенню реакції. Утворений осад відфільтровують. До 2 мл фільтрату додають 1 мл 5% розчину тимолу в 96% етиловому спирті та 2 мл реактиву Обермейера (0,4 г хлориду заліза - FeCl3, розчиненого в 100 мл хлористоводневої кислоти). Через 10 хв додають 1 мл хлороформу, обережно перемішують і спостерігають за утворенням двох шарів: верхнього - водного та нижнього - хлороформового. Нижній, хлороформовий шар забарвлюється в рожево-фіолетове забарвлення. При вираженій індиканурії інтенсивність забарвлення посилюється до червоно-фіолетового кольору. Це дає змогу робити напівкількісну оцінку результатів.
З метою подальшого уточнення отриманого результату, нижній хлороформовий шар відбирають піпеткою, переносять в іншу пробірку і додають декілька крапель 20% розчину тіосульфату натрію. За відсутності індикану в сечі забарвлення зникає після додавання тіосульфату натрію. При позитивній реакції, за наявності індикану в сечі, забарвлення шару хлороформу не зникає після додавання тіосульфату натрію.
Клініко-діагностичне значення. Індикан - калієва або натрієва сіль індоксил-сульфату міститься в нормальній сечі в слідових кількостях і не виявляється звичайними лабораторними методами. Гіперіндиканемію та появу великої кількості індикану в сечі (гіперіндиканурію) спостерігають у разі посилення процесів мікробного гниття білків в кишечнику при закрепах, завороті кишки, інших видів кишкової непрохідності або зниженні травної функції шлунково-кишкового тракту.
Посилений розпад білків в тканинах організму при злоякісних новоутвореннях, абсцесах, формуванні гнійних ексудатів, гнійних процесах у легенях, туберкульозі також супроводжується значним утворенням індикану та зростанням його вмісту в сечі.
Завдання 2. Визначення анін-n-гідроксилазної активності мікросом печінки.
1 етап. Виділення мікросомальної фракції печінки (демонстрація).
2 етап. Визначення анілін-n-гідроксилазної активності мікросом печінки.
Принцип методу. Швидкість реакцій гідроксилювання в мембранах ендоплазматичного ретикулума печінки значно посилюється при інтоксикації ксенобіотиками, ендогенними токсинами, при вживанні лікарських засобів, під впливом фізіологічно активних сполук (гормонів, вітамінів, тощо).
Метод визначення активності ґрунтується на визначенні вмісту 4-амінофенолу, який утворюється при гідроксилюванні аніліну в монооксигеназному ланцюгу мікросом при участі цитохрому Р-450. При взаємодії 4-амінофенолу з фенолом в присутності карбонату натрію утворюється індофенольний комплекс синього кольору.
Хід роботи. У три пробірки (контрольну, дослідну №1 та дослідну №2) вносять по 0,4 мл трис-НСІ буферу (рН = 7,4), 0,4 мл 0,16 М розчину хлориду магнію, 0,1 мл суспензії мікросом (в контрольну та дослідну №1 вносять мікросоми нормального щура, в дослідну №2 - мікросоми щура, якому попередньо було введено індуктор мікросомального окислення - фенобарбітал), 0,2 мл 0,03 М розчину НАДФН і 0,11 мл свіжоперегнаного 0,03 М розчину аніліну. В контрольну пробу додають 0,5 мл 15% розчину трихлороцтової кислоти (ТХО). Пробірки поміщають на 20 хв в термостат при 37°C.
По закінченні інкубації до дослідної проби додають 0,5 мл 15% розчину ТХО для зупинки реакції. Пробірки центрифугують протягом 10 хв при 700g.
Відбирають з кожної пробірки по 1,0 мл надосадової рідини, додають по 0,5 мл 10% розчину карбонату натрію і по 1,5 мл 2% розчину фенолу, розчиненого в 0,2 М розчині гідроксиду натрію. Вміст пробірок перемішують. Для розвитку забарвлення пробірки поміщають на 30 хв в термостат при 37°С. Екстинкцію дослідних проб вимірюють проти контрольної на фотоелекгроколориметрі при 630 нм (червоний світлофільтр) в кюветі з товщиною шару 10 мм.
Розрахунок анілін-n-гідроксилазної активності. Для розрахунку активності будують калібрувальний графік. Для цього беруть декілька пробірок з різними стандартними розчинами 4-амінофенолу. У всі пробірки додають по 0,5 мл 10% розчину карбонату натрію та по 1,5 мл 2% розчину фенолу в 0,2 М розчині гідроксиду натрію. Вимірюють екстинкцію проб проти контролю і будують калібрувальний графік.
Розрахунок проводять за формулою:
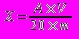 ,
,де X - гідроксилазна активність в нмоль на 1 мг білка за хвилину; А - вміст 4-амінофенолу в пробі, знайдений по калібрувальному графіку в нмоль; V - об'єм проби, рівний 1,71 мл; m - вміст білка в пробі, в мг.
За результатами проведеного експерименту зробити висновок щодо впливу фенобарбіталу на гідроксилазну активність мікросомальної фракції печінки.
Клініко-діагностичне значення. Порушення детоксикаційної функції печінки проявляється зниженням перетворення (гідроксилювання) та кон'югації ендогенних (білірубін, індол, скатол) та екзогенних (бензойна кислота, спирти, фармакологічні препарати) сполук.
Порушення метаболічних процесів достовірно відображають функціональні тести:
• за змінами активності ферменту - анілін-л-гідроксилази та за антипіриновим тестомоцінюють потужність монооксигеназних реакцій мікросомального окислення (перша стадія детоксикації);
• за тестом з бензойною кислотою оцінюють активність процесів кон'югації (друга стадія детоксикації).
Клінічно важливим прикладом оцінки інтенсивності реакції кон'югації з гліцином є утворення гіпурової кислоти при взаємодії ендогенного гліцину з введеною в оргашзм бензойною кислотою. Визначення кількості екскретованої з сечею гіпурової кислоти після введення per os стандартної дози бензоату натрію, лежить в основі дослідження антитоксичної функції печінки. Цей тест носить назву - проба Квіка.
