Календарно-тематичний план практичних занять з біологічної хімії для студентів медичних факультетів на весняно-літній семестр 2007-2008 н р
| Вид материала | Документы |
- Календарно-тематичний план лекцій з біоорганічної та біологічної хімії для студентів, 40.6kb.
- Тематичний план практичних занять для студентів VI курсу медичних факультетів, 17.02kb.
- Львівський національний медичний університет імені данила галицького кафедра біологічної, 1655.89kb.
- Тематичний план практичних занять з медичної інформатики для студентів 2-го курсу медичного, 67.97kb.
- Календарно-тематичний план лекцій з загальної хірургії для студентів 3 курсу медичних, 44.9kb.
- Календарно-тематичний план лекцій з біоорганічної та біологічної хімії для студентів, 53.27kb.
- Львівський національний медичний університет імені Данила Галицького кафедра біологічної, 1954.66kb.
- Календарно тематичний план практичних занять із гігієни та екології для студентів IІІ, 296.49kb.
- Методичні рекомендації для підготовки до практичних занять студентів VI курсу медичних, 2563.92kb.
- Тематичний план лекцій з біологічної хімії для студентів 2 курсу медичного факультету, 611.76kb.
Теоретичні питання
- Загальна характеристика вітамінів як компонентів харчування людини.
- Водорозчинні коферментні вітаміни (В1, В2, РР, B6, В12, Н, фолієва кислота, пантотенова кислота, вітаміни, С, Р);
• структура біологічно активних форм;
• біохімічні функції та роль в обміні речовин;
• прояви недостатності та гіпервітамінозу;
- Джерела та добова потреба. Жиророзчинні вітаміни(А, Е, К, F, D):
• біологічні властивості та роль в обміні речовин;
• прояви недостатності та гіпервітамінозу;
• джерела та добова потреба.
- Біоантиоксидантні властивості коферментних та жиророзчинних вітамінів.
- Хвороби вітамінної недостатності:
• екзогенні гіпо- та авітамінози;
• ендогенні гіпо-та авітамінози;
• клініко-біохімічні аспекти авітамінозів.
- Використання вітамінних препаратів у профілактиці та лікуванні захворювань.
- Вітамінні харчові добавки, профілактичні та лікувальні аспекти застосування.
Практичні роботи
Завдання 1. Виявлення та визначення вмісту водорозчинних вітамінів.
Робота 1. Визначення вітаміну С (аскорбінової кислоти) в сечі.
Для оцінки С-вітамінної забезпеченості організму найбільше поширення отримали прямі методи визначення аскорбінової кислоти в крові і сечі. Концентрація вітаміну в плазмі крові і виведення його з сечею знаходяться в тісному зв'язку і є показником забезпеченості харчового раціону вітаміном С.
Принцип методу. Аскорбінова кислота в кислому середовищі відновлює молекулярний йод. Поява синього забарвлення вказує на те, що вся аскорбінова кислота з відновленої форми перейшла в окислену, і перша надлишкова крапля розчину йоду в присутності крохмалю дає синє забарвлення.
Хід роботи. В колбу відміряють 5 мл сечі і додають 5 крапель розчину крохмалю. Титрують розчином йоду до появи синього забарвлення, що не зникає протягом 30 сек. Враховуючи, що 1 мл розчину йоду відповідає 1 мкмоль аскорбінової кислоти, обчислюють виділення аскорбінової кислоти за добу за формулою:
X = а ×1 × 1500 ÷ 5
де а - кількість мл розчину йоду, що пішла на титрування; 1500 - добовий діурез; 5 - об'єм сечі в пробі; X - вміст аскорбінової кислоти в добовій кількості сечі.
В нормі за добу з сечею виділяється 284-568 мкмоль аскорбінової кислоти.
Робота 2. Визначення вмісту аскорбінової кислоти в плазмі крові.
Принцип методу. Кількісне визначення вітаміну С грунтується на його здатності легко вступати у окисно-відновні реакції і відновлювати такі сполуки, як 2,6-дихлорфеноліндофенол (ДХФІФ). Розчин 2,6-ДХФІФ в нейтральному середовищі має синє забарвлення. Поки в розчині є аскорбінова кислота, 2,6-ДХФІФ відновлюється і при цьому знебарвлюється. Після окислення ним всієї аскорбінової кислоти надлишок реактиву забарвлює розчин в кислому середовищі в слабо рожевий колір.
Хід роботи. 1 мл робочого розчину (який містить одну частину плазми крові, одну частину бідистиляту та дві частини 5% розчину метафосфорної кислоти) титрують розчином 2,6-ДХФІФ з мікробюретки до появи рожевого забарвлення. Після чого титрування припиняють і відмічають кількість розчину 2,6-ДХФІФ, що пішла на титрування. Розрахунок проводять за формулою:
Х = а × 0,0045 ×1000 ÷ 1
де: а - кількість мл розчину 2,6-ДХФІФ, що пішла на титрування; 1000 - розрахунок на 1 л; 0,045 - кількість мкмоль аскорбінової кислоти, що відповідає титру розчину 2,6-ДХФІФ; X - вміст аскорбінової кислоти в плазмі крові; 1 - кількість мл плазми, взятої для аналізу.
В нормі в плазмі крові міститься 34,1-90,9 мкмоль/л аскорбінової кислоти.
Клініко-діагностичне і практичне значення. Вітамін С (аскорбінова кислота) є необхідним харчовим фактором в організмі людини. Аскорбінова кислота бере участь в окислювально-відновних реакціях, синтезі стероїдних гормонів у корі наднирників і катехоламінів у мозковому шарі наднирників, у процесах гідроксилювання й посттрансляційної модифікації колагену, в утворенні тетрагідрофолату з фолієвої кислоти; прискорює всмоктування заліза, активує пепсиноген. При нестачі вітаміну С організм втрачає здатність депонувати міжклітинні "цементуючі" речовини, що викликає ураження судинних стінок і опорних тканин.
Завдання 2. Виявлення жиророзчинних вітамінів.
Робота 1. Виявлення вітаміну А. Реакція Друммонда.
Принцип методу. Сірчана кислота (H2SO4), яка має водовіднімаючі (дегідратаційні) властивості, сприяє перетворенню вітаміну А - ретинолу в забарвлений комплекс фіолетово-червоного кольору.
Хід роботи. На сухе предметне скло наносять 2 краплі риб'ячого жиру в хлороформі і 1 краплю концентрованої сірчаної кислоти (H2SO4). Спостерігають за появою забарвлення.
Клініко-діагностичне й практичне значення. Вітамін А впливає на бар'єрну функцію шкіри, слизових оболонок, на проникність клітинних мембран і біосинтез їхніх компонентів, зокрема глікопротеїнів; бере участь в окислювально-відновних реакціях, оскільки здатний утворювати перекиси, які у свою чергу підвищують швидкість окислювання інших сполук.
При недостатності вітаміну А в людини з'являються симптоми гальмування росту, виснаження організму, специфічні ураження шкіри, слизових оболонок й очей. У першу чергу пошкоджується епітелій шкіри, що супроводжується його патологічним ороговінням. Наслідком цього порушення є, юява вторинних гнійних і гнилісних процесів слизових оболонок усього шлунково-кишкового тракту, сечостатевої й дихальної системи. Специфічним для А-авітамінозу є ксерофтальмія - ураження очного яблука внаслідок закупорки сльозного каналу, епітелій якого також піддається ороговінню.
Робота 2. Виявлення вітаміну D. Анілінова проба.
Принцип методу. Вітамін D при взаємодії з аніліновим реактивом при нагріванні забарвлюється в червоний колір.
Хід роботи. В суху пробірку вносять 3-5 крапель риб'ячого жиру і 5 крапель хлороформу, перемішують та додають 1 мл суміші аніліну та концентрованої соляної кислоти (НСl) (15:1). При нагріванні жовта емульсія набуває червоного забарвлення. Через 1-2 хв. емульсія розділяється на два шари, з яких нижній забарвлений в інтенсивний червоний колір.
Клініко-діагностичне й практичне значення. Активна форма вітаміну D - 1,25-дигідроксикальциферол підтримує постійний рівень кальцію й фосфору в крові. Вітамін D стимулює всмоктування кальцію й фосфору в кишечнику, сприяє посиленню тканинного дихання й окисного фосфорилювання, а також окисленню вуглеводів до лимонної кислоти; стимулює мобілізацію кальцію з кісткової тканини.
Нестача вітаміну D у раціоні дітей приводить до розвитку рахіту - захворювання, в основі якого лежать зміни обміну фосфору й кальцію, порушення відкладення їхніх солей на колагенову основу кісток, які ростуть. В результаті розвивається остеомаляція - розм'якшення кісток. Для D-авітамінозу
дорослих характерним є розвиток остеопорозу внаслідок вимивання солей кальцію й фосфору, кістки стають крихкими й це часто призводить до переломів.
Робота 3. Виявлення вітаміну Е. Реакція з азотною кислотою (HNO3).
Принцип методу. Оскільки продукт окислення токоферолу має хіноїдну структуру, то при взаємодії спиртового розчину токоферолу з концентрованою азотною кислотою (НЮз) реакційна суміш забарвлюється в червоний колір. Цю реакцію використовують для кількісного визначення вітаміну.
Хід роботи. В пробірку вносять 5 крапель 0,1% розчину α-токоферолу (вітаміну Е), додають декілька кришталиків сахарози і 10 крапель концентрованої азотної кислоти (HNO?). Перемішують скляною паличкою. Утворюється емульсія, яка поступово забарвлюється в червоний колір.
Клініко-діагностичне й практичне значення. Вітамін Е (токоферол) є потужним і основним антиоксидантом. Його дія спрямована на посилення тканинного дихання і підтримання на постійному рівні вільно-радикального пероксидного окислення. Опосередковано як кофактор вітамін Е бере участь у транспорті електронів і протонів у дихальному ланцюзі, стимулює синтез убіхінону.
Токоферол служить "пасткою" для вільних радикалів - утворює із ними неактивні форми, які обривають вільно-радикальний ланцюг. Цим вітамін Е захищає від пероксидного окислення поліненасичені жирні кислоти в складі клітинних мембран. Гіповітаміноз супроводжується патологією мембран у вигляді пероксидного гемолізу еритроцитів, розсмоктування плоду під час вагітності, м'язової дистрофії, некрозу печінки, розм'якшення мозку, атрофії сім'янників, що приводить до безплідності.
Робота 4. Виявлення вітаміну К. Реакція з лужним розчином цистеїну.
Принцип методу. При наявності цистеїну вікасол (вітамін К) в лужному середовищі забарвлюється в лимонно-жовтий колір.
Хід роботи. У пробірку вносять по 5 крапель розчинів вікасолу та цистеїну і 5 мл 10% розчину їдкого натру (NaOH). Спостерігають за появою лимонно-жовтого забарвлення.
Клініко-діагностичне й практичне значення. Цей вітамін є антигеморагічним фактором і має пряме відношення до згортання крові. Роль у вітаміну К у згортанні крові зумовлена його участю в утворенні протромбіну, який є неактивним попередником ферменту тромбіну, що перетворює білок плазми крові фібриноген у фібрин. Фібрин є нерозчинним волокнистим білком, що приймає участь в утворенні кров'яного згустка. Для того, щоб протромбін міг активуватися і перетворитися на тромбін, він спершу повинен зв'язати іони Са2+. Нормальна молекула протромбіну містить декілька залишків особливої амінокислоти - γ-карбоксиглутамінової кислоти, яка й зв'язує іони Са2+. При нестачі вітаміну К місце залишків γ-карбоксиглутамінової кислоти займають залишки звичайної глутамінової кислоти. Відтак, порушується каскад згортання крові і, як наслідок, підвищується кровотеча.
Тема заняття № 14. Дослідження фізіологічних та біохімічних функцій крові: буферні системи, кислотно-основний стан. Патологічні форми гемоглобінів.
Цілі заняття
- Пояснювати значення фізіологічних і біохімічних функцій крові.
- Пояснювати механізм участі гемоглобіну в транспорті кисню і діоксиду вуглецю в легеневих капілярах і капілярах периферичних тканин.
- Класифікувати молекулярні форми гемоглобінів в еритроцитах здорової людини і пояснювати виникнення патологічних форм гемоглобінів, їх оцінка в діагностиці патологічних станів.
- Використовувати результати біохімічного аналізу крові (норма і патологія) для оцінки стану здоров'я людини, механізму регуляції та підтримки кислотно-основного стану.
- Трактувати норму та молекулярно-біохімічні механізми виникнення патологічних форм гемоглобінів та зміну основних біохімічних показників біохімії крові для діагностики функціонального стану організму людини.
Теоретичні питання
- Кров - внутрішнє середовище організму. Роль крові в підтриманні гомеостазу.
- Склад крові, плазми, сироватки крові. Фізико-хімічні і біологічні властивості крові.
- Об'єм крові, рН крові. Форменні елементи крові: еритроцити, лейкоцити, тромбоцити. Норма і патологія.
- Гемоглобін, його структура, властивості, види.
- Патологічні стани гемоглобіну: гемоглобінопатії і таласемії.
- Дихальна функція еритроцитів в легеневих капілярах та тканинах.
- Ефект Бора.
- Залежність ступеня оксигенації від парціального тиску кисню. S-подібна кінетика дисоціації оксигемоглобіну.
- Кислотно-основний стан. Регуляція рН рідин в організмі:
- Порушення кислотно-основного стану: ацидоз метаболічний (кетоацидоз, лактат ацидоз, гломерулярний ацидоз) та респіраторний; алкалоз (метаболічний та респіраторний). Причини їх виникнення.
- Р оль нирок, органів дихання, тканин в регуляції кислотно-основного стану:
- Буферні системи крові, їх види:
- роль буферних систем крові в підтриманні постійності рН крові;
- функції гідрокарбонатної, фосфатної, гемоглобінової та білкової буферних систем в організмі людини.
- Основні типи гіпоксії, механізм їх виникнення, прийоми лабораторної діагностики:
- гіпоксія викликана зниженням рО2 в повітрі, що вдихається (екзогенна гіпоксія);
- гіпоксія викликана порушенням постачання тканин киснем внаслідок розвитку патологічного процесу ( легеневий тип, серцево-судинний, тканинний і немічний).
- Роль системи ренін-ангіотензин в регуляції осмотичного тиску.
- Гормони - регулятори осмотичного тиску крові.
- Залежність біохімічних показників крові від метаболічних процесів в організмі.
- "Загальний аналіз" крові і „біохімія" крові. Що входить в цей зміст?
Практичні роботи
Завдання 1. Визначення гемінової групи гемоглобіну бензидиновою пробою.
Принцип методу. Для визначення гемінової групи використовують бензидинову пробу, яка базується на каталітичних властивостях похідних гемоглобіну (оксигемоглобіну, карбоксигемоглобіну ).Продукт окислення бензидину має синій колір, який поступово може переходити в червоний. Проба дуже чутлива.
Хід роботи. В пробірку вносять 5 крапель розбавленої крові, додають 5 , крапель розчину бензидину і 2-3 краплі перекису водню. Спостерігають за зміною кольору.
Клініко -дігностичне значення. Концентрація гемоглобіну в крові у жінок становить 120-140 г/л, у чоловіків - 130-140г/л. Зменшення концентрації гемоглобіну є основним лабораторним симптомом анемії. 3ниження рівня гемоглобіну в крові залежить від форми анемії.
Завдання 2. Біуретовий метод на кількісне визначення білків у плазмі крові.
Принцип методу. Пептидні групи здатні утворювати з солями міді в лужному середовищі комплекс, який має фіолетовий колір. Біуретова реакція служить доказом наявності речовин, у яких існує не менше двох пептидних зв'язків.
Хід роботи. У першу пробірку вміщують 0,1 мл 0,9% розчину хлориду натрію (контроль), у другу — 0,1 мл стандартного розчину білка (50 г/д), у третю, четверту і п'яту - по 0,1 мл дослідного розчину білка (задачі). В усі пробірки вливають по 5 мл біуретового реактиву. Перемішують і через 30 хв визначають екстинкцію (оптичну густину) за допомогою ФЕК у кюветах на 10 мм при червоному світлофільтрі (750 нм) проти контрольного розчину. Розрахунок проводять за формулою:
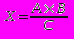 ,
,де X – концентрація речовин у дослідній пробі, г/л; А - концентрація речовин у стандартному розчині; В - екстинкція дослідного розчину; С - екстинкція стандартного розчину білка.
Клініко-діагностичне значення. У здорової людини вміст білків в крові становить від 60 до 80 г/л. Менше 60 г/л - гіпопротеїнемія: ентерит, хронічний панкреатит, опіки, хронічні захворювання нирок, масивні кровотечі, голодування, затримка солей і води. Більше 80 г/л - гіперпротеїнемія: ревматоїдний артрит, дифузні захворювання сполучної тканини (колагенози, бронхоектаз, цироз печінки), діарея, цукровий діабет.
У здорової людини практично не виділяється білок із сечею.
Завдання 3. Колоїдна проба Вельтмана на визначення стану білків крові.
Принцип методу. Білки — це колоїдні розчини, які зв'язують воду, не дозволяючи ій виходити із кров'яного русла. При взаємодії їх з осаджуючими речовинами відбувається зміна їх властивостей.
Хід роботи. До 0,1 мл плазми крові додають 4,9 мл дистильованої води, змішують і сюди ж добавляють 0,1 мл 0,5% розчину хлориду кальцію. Нагрівають. Охолоджують, спостерігаючи за появою осаду. Результати оцінюють за загальною кількістю кальцію в цій реакції. Норма — 0,4-0,5 мл.
Клініко-діагностичне значення. Проба Вельтмана використовується в діагностиці при захворюванні печінки, ревматизмі, туберкульозі легень.
Завдання 4. Якісне визначення кальцію, магнію, фосфору в плазмі крові.
Хід роботи. Іони кальцію визначають, додавши до 1 мл плазми крові 3-4 краплі насиченого розчину оксалату амонію — випадає осад. Іони магнію — до одержаного фільтрату від досліду першого додають 3-4 краплі концентрованого розчину аміаку — утворюється осад. Фосфорну кислоту визначають молібдатом амонію і аскорбіновою кислотою. Інтенсивність голубого кольору прямо пропорційна концентрації фосфору в плазмі крові.
Норма кальцію 2,1-2,55 ммоль/л, магнію — 0,82-0,94 ммоль/л, фосфору — 0,87-1,45 ммоль/л (в сироватці).
Тема заняття № 11. Дослідження білків плазми крові: білки гострої фази запалення, індикаторні ферменти, ліпопротеїни.
Цілі заняття:
- Пояснювати основні функції білків плазми крові на основі їх фізико-хімічних властивостей.
- Пояснювати діагностичне значення зростання вмісту білків гострої фази запальних процесів.
- Пояснювати молекулярно-біохімічні механізми змін вмісту в плазмі кров: секреторних і тканинних ферментів, атерогенних і антиатерогенних ліпопротеїнів.
- Пояснювати біохімічні основи функціонування систем регуляції тиску крові (калікреїн-кінінова та ренін-ангіотензивна системи) та науково обгрунтоване застосування гіпотензивних лікарських засобів — інгібіторів ангіотензин перетворюючого ферменту.
Теоретичні питання
- Основні групи білків плазми крові, їх склад та вміст в нормі і при патології.
- Фактори, що впливають на вміст білків у плазмі крові: гіпер- та гіпопротеїнемії.
- Білки гострої фази запалення: С-реактивний білок, церулоплазмін, гаптоглобін, кріоглобулін, α1-антитрипсин, α2-макроглобулін, інтерферон. Їх діагностичне значення.
- Ферменти плазми крові: власні (секреторні) та індикаторні( тканинні) ферменти.
- Діагностичне значення дослідженя активності ферментів та ізоферментів плазми крові: креатинфосфокінази, ЛДГ, АсТ, АлТ, амілази, ліпази
- Калікреїн-кінінова система, її біологічна роль.
- Ліпопротеїни плазми крові:
- класифікація: ХМ, ЛПДНЩ, ЛППЩ, ЛПНЦ, ЛПВЩ.
- схема будови ліпопротеїнів;
- метаболізм та функціональне значення окремих класів ліпопротеїнів плазми крові.
- гіпер- і гіпопротеїнемії, їх види, прояви. Гіперліпопротеїнемія та атеросклероз.
- молекулярно-біохімічні механізми атеросклерозу.
- Гіперліпопротеїнемія та гіперхолестеринемія - загроза розвитку атеросклерозу
- Роль глутатіону в захисті від пероксидного окисленні ліпідів, вітаміни-антиоксиданти.
- Залишковий азот плазми крові.
Практичні роботи
Завдання 1. Фракціонування білків плазми крові методом висолювання: визначення альбумінів і глобулінів плазми крові.
Принцип методу. Білки, в залежності від величини заряду і молекулярної ваги, з водного розчину осаджуються мінеральними, органічними кислотами та розчинами солей різної концентрації.
Хід роботи. В пробірку вносять 2 мл плазми крові, добавляють 2 мл 50% розчину сульфату амонію. Випадає осад — це глобуліни. У фільтраті залишились альбуміни, які осаджуються 100% насиченим розчином сульфату амонію.
Клініко-діагностичне значення. Осадження білків застосовують для виділення білків із тканин, виявлення їх у різних біологічних рідинах, розділення суміші білків.
Завдання 2. Визначенн типів ліпопротеїнів по вмісту в них холестерину.
Принцип методу. Співвідношення і вміст ліпопротеїнів може мінятися при патологічних станах, що дозволяє використовувати результати кількісного визначення ліпопротеїнів в діагностиці. При взаємодії з концентрованою сірчаною кислотою утворюється різної сили червоний колір (ліпопротеїни мають різний вміст холестерину, який і дає відтінки кольору).
Хід роботи. В пробірки №1 і №2 наливають по 5 крапель плазми крові потім добавляють 5 крапель концентрованої сірчаної кислоти і спостерігають за зміною кольору.
Клініко-діагностичне значення. Норма в крові 3-7 ммоль/г загального холестерину. Збільшення його пов'язане з віком, розвитком різних хвороб: ІХС, інфаркту міокарда, хвороб печінки, цукрового діабету.
Гіпохолестеринемія — зниження рівня холестерину, характерне при захворюваннях ЦНС, гіпотиреозі, гострому панкреатиті, гострих інфекційних хворобах, ревматизмі, гемолітичній жовтяниці.
Тема заняття № 13. Дослідження небілкових азотовмісних компонентів крові. Патобіохімія жовтяниць.
Цілі заняття:
Трактувати біохімічні закономірності функцій печінки: вуглеводної, ліпід-регулюючої, білок-синтезуючої, сечовиноутворювальної, пігментної, жовчоутворювальної, детоксикаційної;
Аналізувати стан здоров'я людини на підставі змін біохімічних параметрів проміжних та кінцевих продуктів обміну небілкових азотовмісних компонентів крові.
Аналізувати причини та молекулярно-біохімічні механізми виникнення жовтяниць.
Аналізувати диференційні зміни біохімічних показників крові та сечі (вільний та кон'югований білірубін) з метою оцінки патобіохімії жовтяниць;
Пояснювати причини виникнення основних патологічних станів і порушень функції печінки, роль індикаторних ферментів у виявленні цих порушень. Коефіцієнт де Рітіса.
Теоретичні питання
1. Біохімічні функції печінки в організмі:
• вуглеводна (глікогенна) функція печінки;
• функція регуляції ліпідного складу крові;
• білок синтезуюча функція печінки;
• сечовиноутворювальна функція печінки;
• жовчоутворювальна та пігментна функції печінки;
• детоксикаційна функція печінки.
2. Катаболізм гемоглобіну та його простетичної групи — гему:
• розрив тетрапірольного кільця з утворенням вердоглобіну;
• розпад вердоглобіну до білівердину;
• перетворення білівердину на білірубін;
• транспорт білірубіну з клітин ретикуло-ендотеліальної системи в печінку;
• утворення глюкуронід білірубіну;
• біотрансформація білірубін-глюкуронідів в кишечнику;
• рециркуляція продуктів біотрансформації.
3. Патобіохімія жовтяниць:
• передпечінкова (гемолітична) жовтяниця;
• печінкова (паренхіматозна) жовтяниця;
• післяпечінкова (обтураційна) жовтяниця;
• ферментативні (спадкові) жовтяниці.
4. Клініко-біохімічна характеристика жовтяниць за показниками: вільний (непрямий) білірубін, кон'югований (прямий) білірубін, білірубін сечі, уробіліноген сечі, стеркобілін калу.
5. Біохімічні лабораторні показники, що використовуються у діагностиці печінкових захворювань: активність АлТ, AсT та глутаматдегідрогенази, вміст загального, вільного та кон'югованого білірубіну, функціональні проби.
Практичні роботи
Завдання 1. Визначення білірубіну в плазмі крові за методом Бокальчука.
Принцип методу. Шляхом розведення сироватки знаходять найменшу кількість білірубіну, здатного давати забарвлення з діазореактивом (0,16 мг білірубіну). Враховуючи розведення сироватки, обчислюють вміст білірубіну.
Хід роботи. Беруть 8 пробірок. В одну наливають 1 мл сироватки, а в інші — по 0,5 мл фізіологічного розчину. З першої пробірки 0,5 мл сироватки переносять у другу і перемішують. З другої беруть 0,5 мл і переносять у третю і так далі. З останньої пробірки 0,5 мл виливають геть. До всіх додають по 0,5 мл діазореактиву та по 0,5 мл спирту і струшують. Відмічають останню пробірку, в якій є рожеве забарвлення — білірубіну в ній 0,16 мг. Це число помножують на номер останньої пробірки з рожевим забарвленням і одержують вміст білірубіну в мг/100 мл. Коефіцієнт перерахунку в одиницях СІ 17,104 мкмоль/л.
У нормі загальний білірубін 0,5-1,2 мг/дл, або 1,7-20,5 мкмоль/л.
Завдання 2. Визначення жовчних пігментів в сечі реакцією Гмеліна.
Принцип методу заснований на окисленні жовчних пігментів концентрованою азотною кислотою і появі різно забарвлених продуктів окислення (проби не струшувати).
Клініко-діагностичне значення. Жовчні пігменти — білірубін, білівердин, уробілін — з'являються лише при патології. Білірубінурію спостерігають при ураженнях печінки і жовчовивідних шляхів (хвороба Боткіна, механічна жовтяниця). Сеча за наявністю жовчних пігментів набуває темного жовто-зеленого кольору.
Завдання 3. Визначення уробіліну в сечі (за методом Флоранса і Богомолова).
Принцип методу. Уробілін здатний утворювати з сульфатом міді сполуку, яка має рожево-червоний або мідно-червоний колір і добре екстрагується хлороформом.
Хід роботи. В пробірки з 2-З мл сечі додають по 2-3 краплі насиченого розчину сульфату міді і по 0,5 мл хлороформу. Енергійно струшують. У присутності уробіліну хлороформ забарвлюється у рожевий колір (внизу пробірки).
Клініко-діагностичне значення. Уробілінурію спостерігають при паренхіматозних захворюваннях печінки (гепатити, цироз, отруєння), гемолітичних станах, кишкових захворюваннях (ентероколіт, закреп).
