Подписано в печать Усл печ л. 5,0
| Вид материала | Документы |
- Window xp home Edition, 380.83kb.
- Леонид Петрович Куклев удк 621. 396. 6 лабораторная работа, 470.81kb.
- Учебное пособие к курсовому и дипломному проектированию Дисц. "Технология электрических, 1642.35kb.
- Шдательстм, 4071.08kb.
- Издательство транзиткнига, 9214.92kb.
- Жан гранье, 1701.1kb.
- Учебное пособие для студентов вузов лр№0171045 от 09. 06. 99. Подписано в печать 23., 3343.3kb.
- Б. А. Хайбуллин Технический редактор, 3326.06kb.
- Амонашвили Ш. А. Здравствуйте, дети!: Пособие для учителя/ Предисл. А. В. Петровского, 2958.93kb.
- Гроф С. Г86 Революция сознания: Трансатлантический диалог/С. Гроф, Э. Ласло, П. Рассел;, 2194.54kb.
Подписано в печать . . . Усл. печ. л. 5,0.
Формат 6084 1/16. Печать офсетная. Тираж экз. Заказ №
197089, Санкт-Петербург, улица Льва Толстого, 6/8
Издательство СПбГМУ
Министерство здравоохранения Российской Федерации
Санкт-Петербургский государственный медицинский университет
имени академика И.П. Павлова
Кафедра патологической физиологии
Кафедра фармакологии с курсом клинической фармакологии
А.В. Амелин, Ю.Д. Игнатов, Н.Н. Петрищев,
М.В. Пчелинцев, М.Л. Степанян
Нарушения системы гемостаза
и их фармакологическая коррекция
Санкт-Петербург
2000 Издательство СПбГМУ, 2000
ВВЕДЕНИЕ
Настоящее издание представляет собой интегрированное учебное пособие по фармакологии, нормальной и патологической физиологии системы гемостаза. За последние годы получен ряд новых, важных для клиники, данных о механизмах взаимодействия тромбоцитов и сосудистой стенки, естественных антикоагулянтах, активаторах и ингибиторах фибринолиза и т.д. Изложение данного раздела в учебниках по этим дисциплинам весьма кратко и не отражает современный уровень знаний по этой проблеме, необходимый студентам. Данное пособие позволит уменьшить объем лекционного изложения соответствующих разделов и повысить эффективность их изучения на практических занятиях. Оно может быть рекомендовано для самостоятельной подготовки студентов на кафедрах нормальной физиологии, патологической физиологии и фармакологии.
Необходимость издания пособия возникла также потому, что знание современных данных о механизмах нарушения гемостаза и их фармакологической коррекции является основой для более эффективного изучения вопросов диагностики, лечения и профилактики тромбоэмболических и геморрагических осложнений. В связи с этим пособие может быть использовано для самостоятельной подготовки студентами старших курсов при изучении соответствующих разделов клинических дисциплин, а также может быть рекомендовано для клинических ординаторов и врачей-интернов.
^ СРЕДСТВА, РЕГУЛИРУЮЩИЕ ГЕМОСТАЗ И ФИБРИНОЛИЗ
Тромбозы, тромбоэмболии и геморрагический синдром наблюдаются при многих заболеваниях и нередко являются причиной летальных исходов, особенно при заболеваниях сердечно-сосудистой системы. Повышение свертываемости крови (гиперкоагуляция) и тромбоэмболия, т.е. предрасположенность к тромбозу, отмечаются при ишемической болезни сердца, сахарном диабете, в послеоперационном периоде и т.д. В механизме гиперкоагуляции большое значение имеют увеличение содержания прокоагулянтов в крови и уменьшение антикоагулянтной активности.
Понижение свертываемости крови (гипокоагуляция) и кровоточивость наблюдаются в основном при патологии печени, а также при гиповитаминозе К, лучевой болезни и т.д. Кроме того, гипокоагуляция возникает и при таких генетически обусловленных нарушениях свертывания крови, как гемофилия А, В и афибриногенемия. В большинстве случаев гипокоагуляция связана с дефицитом прокоагулянтов и, реже, с увеличением антикоагулянтной активности крови.
Изменение свертываемости крови нередко сочетается с изменением фибринолитической активности. Угнетение фибринолиза, особенно в сочетании с гиперкоагуляцией, создает благоприятные условия для тромбоза. Патологическое усиление фибринолиза может привести к разрушению прокоагулянтов и, следовательно, к гипокоагуляции и кровоточивости.
Особое место в патологии системы гемостаза занимает синдром диссеминированного внутрисосудистого свертывания крови (синдром ДВС). Синдром ДВС наблюдается при шоке, внутрисосудистом гемолизе, в послеродовом периоде, эмболии околоплодными водами, сепсисе, а также при первичном диффузном поражении сосудистой стенки (васкулиты, диффузные болезни соединительной ткани, инфекционные заболевания). Внутрисосудистое свертывание крови и активация фибринолиза приводят к геморрагическому синдрому.
Таким образом, фармакологическая регуляция свертываемости крови, агрегации тромбоцитов и фибринолиза является одной из актуальных задач современной медицины. Правильный выбор препаратов и схем их применения во многом зависит от понимания механизмов гемостаза, их нарушений и от знания фармакологических свойств лекарственных средств, воздействующих на эти механизмы.
Лекарственные средства могут быть систематизированы следующим образом:
^ Средства, регулирующие гемостаз и фибринолиз
| I. Средства, препятствующие тромбообразованию (антитромботические) | II. Средства, усиливающие гемостаз (гемостатические) |
| 1. Средства, понижающие свертываемость крови (антикоагулянты). | 1. Средства, повышающие свертываемость крови (коагулянты). |
| 2. Средства, уменьшающие агрегацию тромбоцитов (антиагреганты). | 2. Средства, увеличивающие агрегацию тромбоцитов (агреганты). |
| 3. Средства, усиливающие фибринолиз (фибринолитики, тромболитики). | 3. Средства, угнетающие фибринолиз (антифибринолитики, ингибиторы фибринолиза). |
^ МЕХАНИЗМЫ КОАГУЛЯЦИИ, ТРОМБОФИЛИИ. АНТИТРОМБОТИЧЕСКИЕ СРЕДСТВА
(Препараты, препятствующие гемокоагуляции
на разных стадиях процесса и лизирующие тромбы)
Остановка кровотечения, т.е. гемостаз, при повреждении кровеносных сосудов достигается, главным образом, благодаря образованию тромба в результате взаимодействия компонентов плазмы, тромбоцитов и сосудистой стенки. При повреждении сосудов микроциркуляторного русла образуются тромбоцитарные тромбы, содержащие сравнительно небольшое количество фибрина. При повреждении артерий и вен гемостаз осуществляется не только при участии тромбоцитов, но и благодаря свертыванию крови и образованию коагуляционного тромба. В сосудах с быстрым кровотоком (артерии) образуются преимущественно белые тромбы, а в сосудах с медленным кровотоком (вены) – красные тромбы, содержащие большое количество эритроцитов. Механизмы, обеспечивающие гемостаз, реализуются при любом повреждении сосудистой стенки, вызванном механическими (например, катетеризация), гемодинамическими, химическими факторами, воспалением, действием иммунных комплексов, нарушением метаболизма (атеросклероз, диффузные заболевания соединительной ткани и т.п.). При этом развивается пристеночный или интрамуральный тромбоз. Гиперкоагуляция, угнетение фибринолиза, повышение функциональной активности тромбоцитов, замедление кровотока, а также увеличение тромбогенного потенциала и снижение тромборезистентности сосудов способствуют тромбозу.
Механизмы тромбофилии
В механизме развития тромбофилии имеют значение:
повышение функциональной активности тромбоцитов и тромбоцитозы;
повреждения сосудистой стенки;
увеличения содержания прокоагулянтов в крови (гиперкоагуляция);
уменьшение антикоагулянтной активности крови;
угнетение фибринолиза.
Механизмы гиперкоагуляции
В некоторых случаях (например, при острой кровопотере) повышение свертываемости крови является компенсаторной реакцией и имеет положительное биологическое значение. Длительная и выраженная гиперкоагуляция создает условия для тромбообразования. Повышение свертываемости крови (гиперкоагуляция) и тромбофилия, т.е. предрасположенность к тромбозу, наблюдаются при многих заболеваниях и патологических процессах.
Увеличение содержания прокоагулянтов в крови
Повышение активности плазменных прокоагулянтов и коагуляционного потенциала само по себе не приводит к тромбообразованию, но при повреждении сосудистой стенки способствует ускорению и распространению тромбоза. В механизме гиперкоагуляции в условиях патологии, большое значение имеет поступление в кровь тканевого тромбопластина из сосудистой стенки. Это ведет к образованию протромбиназы и тромбина в количествах, превосходящих антитромбиновую активность крови, в результате повышается коагуляционный потенциал. В мобилизации активаторов свертывания крови из сосудистой стенки при стрессе большое значение имеет адреналин. Активация симпато-адреналовой системы стимулирует синтез фибриногена, а высвобождение глюкокортикоидов – промтромбина, фибриногена, проакцелерина.
Повышение активности прокоагулянтов может быть обусловлено непосредственным воздействием на них некоторых компонентов плазмы, так гиперлипидемия создает условия для спонтанной активации ф.XII (названия факторов см. табл. 1) и ускорения образования протромбиназы. Гиперлипидемия и тромбопластинемия отмечаются после интенсивной эмоциональной и физической нагрузкок, поэтому у спортсменов-профессионалов возможны острые тромбозы коронарных артерий при уменьшении тромборезистентных свойств сосудистой стенки. У больных с клиническими проявлениями атеросклероза (ИБС, облитерирующий атеросклероз артерий конечностей, церебральный атеросклероз), гипертонической болезнью гиперкоагуляция обусловлена значительным увеличением в крови фибриногена, протромбина, фф.VIII, XII и др. Массивное поступление в кровь тканевого тромбопластина в результате обширного повреждения тканей, гемолиза, внутрисосудистая активация ф.XII при септицемии могут привести к внутрисосудистому свертыванию крови и нарушению гемодинамики.
Таблица 1
^ Международная номенклатура факторов свертывания крови
| Факторы | Синонимы | Содержание | Период полурас- пада (ч) |
| I | Фибриноген | 2-4 г/л | 92-136 |
| II | Протромбин | около 0,1 г | 72-96 |
| III | Тромбопластин | | |
| IV | Кальций ионизированный | 0,9-1,2 м/моль | |
| V | Проакцелерин | около 0,01 | 12-36 |
| VII | Проконвертин | около 0,005 | 4-6 |
| VIII | Антигемофильный фактор А,VIII: С | 0,01-0,02 | 14-18 |
| IX | Антигемофильный фактор В | около 0,03 | 20 |
| XI | Плазменный предшественник тромбопластина | около 0,005 | 60 |
| XII | Фактор Хагемана | около 0,03 | 60 |
| XIII | Фибринстабилизирующий фактор | около 0,01-0,02 | 100 |
| Высокомолеку-лярный кинино- ген | Фактор Фитцжеральда | около 0,06 | |
| Прекалликреин | Фактор Флетчера | около 0,05 | |
Свертывание крови – сложный аутокаталитический процесс, при котором происходит последовательная активация неактивных факторов и образование сериновых протеаз. Выделяют три последовательные стадии коагуляционного гемостаза:
– образование протромбиназы;
– образование тромбина;
– образование фибрина.
Образование протромбиназы
Образование протромбиназы происходит по внутреннему и внешнему пути.
^ Внутренний путь образования протромбиназы начинается с контактной активации фактора XII при повреждении сосудистой стенки. Этому способствуют обнаженные нити коллагена и действие протеаз поврежденного эндотелия (рис.1).
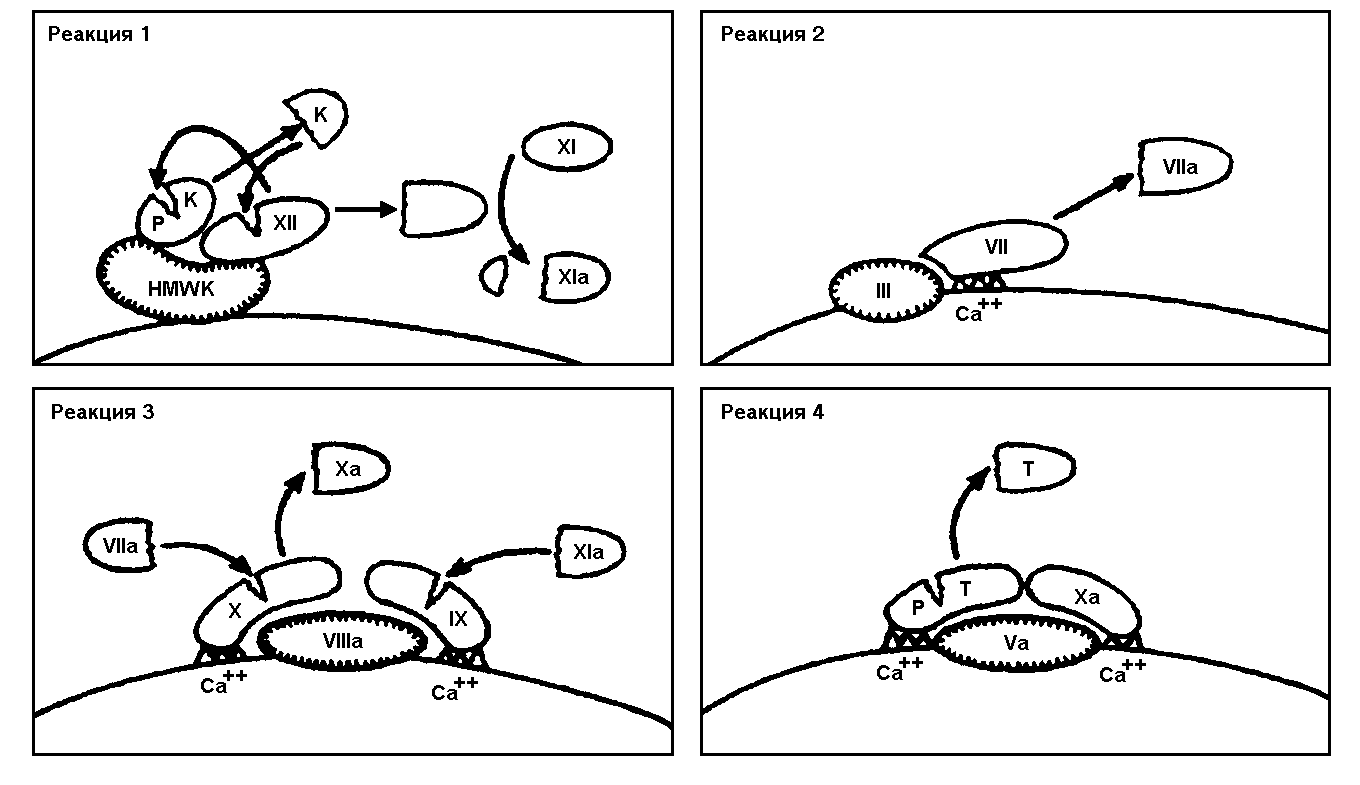
Рис.1. Механизмы формирования активных форм коагулянтов.
РК – прекалликреин, К – калликреин, HMWK – высокомолекулярный кининоген, TF – тканевой фактор, РТ – протромбин, Е – тромбин, ломаная линия Gla (ди--карбоксиглутаминовая кислота), содержащая домены факторов VII, IX, X, Xa и протромбин, которые связывают Са2+ и фосфолипиды, штриховая – белки, адгезирующие на поверхности путем гидрофобного взаимодействия.
Фаза контактной активации завершается образованием активного ф.XI (ф.XIа). В этом процессе участвуют факторы Флетчера (плазменный прекалликреин) и Фитцжеральда (высокомолекулярный кининоген), которые ускоряют активацию ф.XI и дополнительно обеспечивают активацию ф.XII, а также участвуют ионы цинка (см. рис.1, рис.2).
Фактор XIa на мембране тромбоцитов превращает ф.IX в ф.IXа. Далее образуется энзим-субстратный комплекс с включением ф.IXa, ф.Х, кофермента ф.VIII и ионов Са2+. Результатом этого процесса служит образование ф.Ха.
Фактор VIII является сложным мультимерным белком, состоящим из нескольких субъединиц. В качестве транспортной субъединицы ф.VIII служит фактор Виллебранда (ф.W), который обеспечивает стабильность в циркуляторном русле ф.VIII и необходимую концентрацию его в зоне повреждения. Поэтому, при выраженном дефиците ф.W отмечается дефицит активности ф.VIII.
внутренний
механизм
внешний
механизм
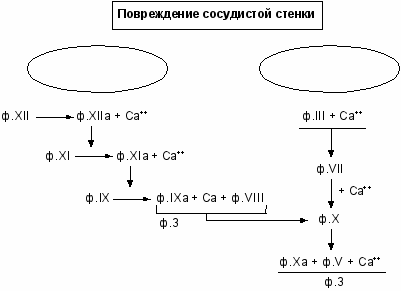
Рис.2. Работа коагулянтов во внешнем и внутреннем пути.
^ Внешний путь образования протромбиназы реализуется при повреждении сосудистой стенки и взаимодействии тканевых, тромбоцитарных и плазменных факторов гемостаза. При повреждении тканей (например, сосудистой стенки) в кровь попадает тканевой тромбопластин (ф.III), представляющий собой липопротеид, содержащий фосфолипиды и обладающий протеазной активностью. Большую роль в механизмах высвобождения тканевого фактора могут играть цитокины, которые активируют образование и выделение ф.III из эндотелиальных клеток и моноцитов. Тканевой тромбопластин образует комплекс с ф.VII и ионами Са; этот комплекс активирует ф.Х (см. рис.2). Внешний механизм обеспечивает более быстрое образование протромбиназы, однако, эффективный гемостаз возможен только при нормальном функционировании обоих механизмов образования протромбиназы.
Существует дополнительная возможность активации фф.IX и XI комплексом ф. III – ф.VII (петля Джоссо), что способствует усилению образования тромбина во внутреннем пути.
Образование тромбина
Комплекс ф.Ха, ф.V, фосфолипидов тромбоцитов (ф.3; см. стр.39), ионов кальция является протромбиназой, которая расщепляет протромбин до тромбина (см. рис. 2).
Фактор Ха, входящий в состав протромбиназы, отщепляет от молекулы протромбина большой фрагмент и при этом образуется неактивный промежуточный продукт – протромбин 2, в дальнейшем он расщепляется фактором Ха до тромбина, который расщепляет фибриноген до фибрина. Образовавшийся тромбин регулирует тромбиногенез, расщепляя молекулу протромбина до неактивного протромбина 1 и тем самым препятствуя образованию новых порций тромбина. В клинике многофакторное влияние тромбина на гемостаз имеет определяющее значение у больных с синдромом диссеминированного внутрисосудистого свертывания крови.
Основная функция тромбина – расщепление фибриногена, кроме того, он индуцирует агрегацию и реакцию высвобождения тромбоцитов, биосинтез тромбоксана А2, активирует ф.XIII и т.д.
Образование фибрина
В третьей стадии свертывания крови под влиянием тромбина происходит расщепление фибриногена и превращение его в растворимый и в нерастворимый фибрин (рис.3).
Фибриноген образуется в гепатоцитах. Молекула его представляет димер и состоит из шести полипептидных цепей – две - (А), две - (В) и две -цепи.
Превращение фибриногена в фибрин происходит в 3 стадии:
1-я стадия – протеолиз фибриногена тромбином; пептиды А и В отщепляются от аминокислотного участка - и -цепей, образуя фибрин-мономер.
2-я стадия – полимеризация фибрин-мономера и образование растворимого фибрин-полимера, чувствительного к плазмину.
3-я стадия – стабилизация растворимого фибрина под влиянием ф.XIIIа и образование нерастворимого фибрина, устойчивого к плазмину.
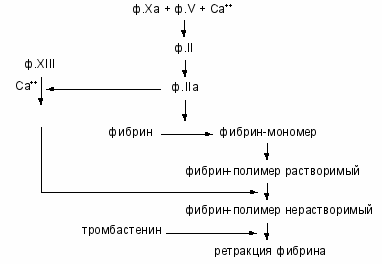
ф.XIIIа
Рис.3. Схема образования тромбина и фибрина.
Ф.XIII синтезируется в печени, циркулирует в плазме, а также имеется в тромбоцитах, эритроцитах, сосудистой стенке. В плазме ф.XIII находится в виде неактивного предшественника, который активируется тромбином в присутствии ионов Са. Ф.XIIIа стабилизирует фибрин посредством образования в молекуле фибрин-полимера ковалентных поперечных связей. После стабилизации фибрина образуется красный тромб, состоящий из нерастворимого фибрина и форменных элементов крови. Дальнейшее уплотнение тромба происходит за счет ретракции, которая осуществляется под влиянием тромбостенина тромбоцитов.
Антикоагулянтная система крови
Скорость образования тромба, его размеры, возможность спонтанного лизиса зависят не только от активности факторов свертывания, но и от содержания естественных антикоагулянтов в крови и активности фибринолитической системы.
Все антикоагулянты в зависимости от механизма действия делятся на антикоагулянты прямого и непрямого действия. Принципиальное различие между этими двумя группами состоит в том, что антикоагулянты прямого действия ингибируют процесс свертывания в результате инактивации коагулянтов уже имеющихся в крови. В связи с этим их эффект проявляется как in vivo, так и in vitro. Антикоагулянты непрямого действия оказывают эффект за счет угнетения образования в печени ряда факторов свертывания крови. Поэтому они тормозят свертывание крови только в организме (in vivo).
^ Естественные антикоагулянты
Естественные антикоагулянты подразделяются на первичные и вторичные.
Первичные антикоагулянты постоянно образуются в организме и поступают в кровь, где взаимодействуют с активной формой прокоагулянтов и ингибируют их. К первичным антикоагулянтам относят антитромбин III (АТ III), гепарин, кофактор II гепарина, протеин С, протеин S, тромбомодулин, 2-макроглобулин и др.
АТ III – это 2-глобулин с молекулярной массой 58000 Дальтон (Д), образуется в печени и эндотелиальных клетках.
Гепарин – сульфатированный мукополисахарид, синтезируется в тучных клетках и базофилах крови. Молекулярная масса гепарина колеблется от 4000 до 40000Д. В большом количестве он содержится в печени и легких.
АТ III инактивирует фф.IIа, IХа, Ха, XIIа, XIа, XIIIа, стимулируя образование энзимингибиторного комплекса с включением в них гепарина. Кинетика этого процесса зависит от последовательности включения в комплекс АТ III, гепарина и энзима – коагулянта. Одна молекула гепарина способна "катализировать" активность 150 молекул АТ III. Последовательно диссоциируя из старых (уже активированных) энзимсубстратных комплексов, гепарин вновь вступает в образование новых комплексов.
Суммарно гепарин увеличивает активность АТ III примерно в 2000-3000 раз. Гепарин, соединяясь с АТ III, делает активный центр последнего "доступнее" для тромбина. Имеются особенности действия высокомолекулярного и низкомолекулярного гепарина. Гепарин с низкой молекулярной массой значительно ускоряет связывание АТ III с Ха фактором и незначительно с тромбином, а высокомолекулярный гепарин – значительно ускоряет реакцию образования компонента АТ III-тромбин.
^ Кофактор II гепарина – глобулин, близкий по структуре к АТ III. Кофактор II гепарина осуществляет в присутствии гепарина ингибирование только тромбина, в отличие от АТ III, не ингибируя другие коагулянты. На долю АТ III-гепарин и гепарина приходится примерно 80% всей антикоагулянтной активности крови. Комплекс AT III-гепарин может фиксироваться на мембранах эндотелиальных клеток, обеспечивая тромборезистентность сосудистой стенки.
2-макроглобулин – это гликопротеин, обладающий неспецифической антипротеазной активностью. Он обратимо связывает и транспортирует фф. IIа, XIIа, XIа, калликреин, плазмин, трипсин, хемотрипсин и протеазы острой фазы воспаления. 2-макроглобулин взаимодействует с тромбином значительно медленнее, чем AТ III. Интересно отметить, что гепарин препятствует комплексообразованию 2-макроглобулина с тромбином. Максимальные концентрации этого белка отмечаются в возрасте 1-3 лет. На долю 2-макроглобулина приходится около 3% общей антикоагулянтной активности крови.
^ Протеин С (ПрС) – витамин К – зависимый белок, образующийся в печени. Антикоагулянтные свойства проявляет только активная форма протеина С (А-ПрС). Естественным активатором ПрС является тромбин, который in vitro активирует ПрС в присутствии ионов Са2+, причем процесс идет очень медленно. В организме активация ПрС осуществляется на поверхности мембран эндотелиоцитов с участием мембранного белка эндотелиальных клеток – тромбомодулина (рис.4). Протеолитическая активность комплекса тромбомодулин – ПрС значительно усиливается в присутствии другого витамин К-зависимого белка – протеина S, фосфолипидов клеточной мембраны тромбоцитов. А ПрС ингибирует неферментные факторы свертывания – Vа и VIIIа, подвергая их протеолизу.
Тромбомодулин – белок, входящий в состав клеточный мембраны эпителия. Он обнаружен в эндотелии макро- и микрососудов всех органов, за исключением микрососудов мозга. Тромбомодулин имеет большое сродство к тромбину и обратимо связывается с ним. При этом ионы Са2+ не требуются. После соединения с тромбомодулином, в молекуле тромбина происходят конформационные изменения и вновь образованный комплекс проявляет в присутствии ионов Са2+ свойства активации ПрС. Скорость этого процесса индуцируется тромбином в 20000 раз. Тромбомодулин способствует высвобождению тканевого активатора плазминогена, снижает активность ингибитора тканевого тромбопластина (антитромбопластина).
^ Протеин S (ПрS) – гликопротеин с молекулярной массой 70100 Д, образуется в печени и эндотелии, содержится в гранулах тромбоцитов. ПрS значительно усиливает антикоагулятное действие А-ПрС. Основная функция ПрS – оптимизация связывания активного ПрС с поверхностью мембран, что катализирует протеолитическую инактивацию ф.Va и ф.VIIIa. ПрS с участием А-ПрС блокируют рецепторы тромбоцитов к фактору Ха. Взаимодействие ПрС, тромбина, тромбомодулина и ПрS происходит при участии клеточной мембраны эндотелия, являющейся не только ареной, на которой разыгрываются события, приводящие к образованию А-ПрС и реализации соответствующего антикоагулянтного механизма, но и активным участником процесса, так как в ней образуются тромбомодулин и ПрS (см. рис.4 ). Помимо антикоагулянтной активности А ПрС и ПрS обладают профибринолитическим действием.
Тромбин +
Тромбомодулин +
Са2+
Протеин С
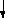
+


-
ф.Xа
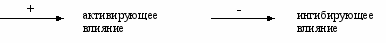
Рис 4. Активация протеина С и его антикоагулянтная активность.
В механизме фибринолитической активности крови имеет значение инактивация ингибитора активатора плазминогена, образующегося в эндотелии. Таким образом, активированная тромбином система ПрС-ПрS, с одной стороны, ингибирует гемокоагуляцию, а с другой, – повышает фибринолитическую активность крови. Активация этой системы рассматривается как первичный антикоагулянтный механизм.
Естественными антикоагулянтами внешнего пути являются липопротеинассоциированный коагуляционный ингибитор – ингибитор внешнего пути свертывания и протеазный ингибитор (антитромбопластины), уменьшающие активность ф.II и VIIIа, липидный ингибитор-конкурентный ингибитор ф.3 тромбоцитов. Механизмы их действия находятся в стадии изучения.
Вторичные антикоагулянты образуются в процессе свертывания крови и фибринолиза. К вторичным антикоагулянтам относятся:
– антитромбин I (фибрин), сорбирует на своих нитях тромбин и ф.Ха и превращает их в неактивные формы;
– антитромбин IV – (продукт расщепления протромбина тромбином), нарушает активацию протромбина протромбиназой;
– антитромбин VI – (продукты деградации фибрина – ПДФ), нарушают полимеризацию фибрин-мономера, ингибируют тромбин, агрегацию тромбоцитов, ф.Ха.
Снижение антикоагулянтной активности крови
Одной из причин тромбофилии является дефицит естественных антикоагулянтов, и прежде всего AТ III. Нарушение метаболизма AТ III может быть врожденным и приобретенным. Врожденный дефицит наследуется по аутосомно-доминантному типу и проявляется как в уменьшении выработки AТ III, так и в уменьшении его сродства к гепарину и тромбину. У гомозигот уровень AТ III может быть снижен до 5-10% от нормального. Больные дети погибают от тромбозов и тромбоэмболии легочной артерии в течение родов или первых трех лет жизни. Частота встречаемости гетерозигот 1:2000-3000. Приобретенная недостаточность AТ III развивается у больных с печеночной недостаточностью и преимущественным снижением синтетической функции гепатоцитов, в том числе обусловленной дефицитом витамина А. В третьем триместре беременности уровень AТ III снижается на 20-30%, что, видимо, связано с ростом в плазме концентрации эстрогенов и прогестерона и их ингибирующим влиянием на синтетические процессы в гепатоцитах. Прием гормональных контрацептивов влияет на эти же механизмы.
Вариантом приобретенной недостаточности AТ III является истощение его депо, у больных с хронической почечной недостаточностью, с нефротическим синдромом, острым венозным тромбозом, ДВС-синдромом, на фоне интенсивной гепаринотерапии. Возможно связывание AТ III ингибирующими антителами.
Клинически дефицит AТ III приводит к выраженной гепаринорезистентности, что имеет значение в проведении гепаринотерапии острого инфаркта миокарда.
При атеросклерозе, сахарном диабете, поздних стадиях гипертонической болезни уменьшается содержание гепарина в крови. Это связано с истощением эндогенных ресурсов гепарина в результате постоянного расхода его в качестве кофермента липопротеиновой липазы. Гиперлипидемия создает условия для поглощения гепарина агрегатами, связывания гепарина антигепариновым фактором, выделяющимся из -гранул тромбоцитов в процессе реакции высвобождения, поглощения его иммунными комплексами при выраженном воспалительном процессе.
Одной из причин гепаринорезистентности также может являться нарушение взаимодействия с AТ III. Гепарин при системной красной волчанке, синдроме Шенлейн–Геноха включается в иммунные комплексы. При воспалительных процессах гепарин обладает противоспалительным действием, модулируя активность системы комплемента. Гепарин в комплексе с AТ III взаимодействует с С1-эстеразным ингибитором, при этом активность последнего как ингибитора начинает повышаться. Врожденные дефициты ПрС и ПрS наследуются аутосомно-доминантным путем, частота встречаемости в популяции 1:3000. У гомозигот дефицит ПрС приводит к молниеностному внутрисосудистому свертыванию крови и гибели в родах и раннем периоде новорожденности.
Уменьшение образования ПрС наблюдается при хронических заболеваниях печени. Увеличивается потребление его на фоне гиперкоагуляции при ДВС, при респираторном дистресс-синдроме, обширных хирургических вмешательствах, использовании аппарата искусственного кровообращения, преэклампсии, венокклюзионной болезни.
Примерно у 1% больных с тромбозами описана тромбофилия, связанная с резистентностью ф.V к активированному ПрС. В большинстве случаев резистентность вызвана единственной точечной мутацией G 1691 А в молекуле гена ф.V, что ведет к замене (Arg) R 506 на (Gln)Q. Образуется мутантная форма ф.V, устойчивая к протеолизу активированным ПрС. Резистентность к активированному ПрС отмечается у 45% больных с венозными тромбозами и у 60% беременных женщин с тромбозами глубоких вен .
Уменьшение содержания ПрS в крови описано при нормальной беременности, приеме гормональных контрацептивных препаратов, тромбозе вен малого таза и является фактором риска тромбоза и гиперкоагуляции, так как при этом снижается антикоагулянтная активность А-ПрС.
