«Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Автореферат диссертации |
- «Челябинская государственная медицинская академия федерального агентства по здравоохранению, 333.68kb.
- «Санкт-Петербургская государственная педиатрическая медицинская академия Федерального, 682.04kb.
- «Астраханская государственная медицинская академия Федерального агентства по здравоохранению, 341.75kb.
- «Пермская государственная медицинская академия имени академии Е. А. Вагнера Федерального, 315.55kb.
- Диабетической стопы, 428.28kb.
- «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению, 431.13kb.
- «Оренбургская государственная медицинская академия федерального агентства по здравоохранению, 584.36kb.
- Основных профессий газоперерабатывающего завода, 427.41kb.
- Фомин Михаил Владимирович ТоксиколОго-гигиеническая характеристика компонентов производства, 338.79kb.
- «Уральская государственная медицинская академия Федерального агентства по здравоохранению, 743.14kb.
Научная новизна:
Впервые с позиций многоуровневой структурно-функциональной организации миокарда получены результаты о диапазоне гисто- и органотипических потенций кардиомиоцитов и немышечных клеток, реализуемых в постинфарктных условиях с точки зрения их лимитирования в зависимости от прогрессирования хронической сердечной недостаточности.
Впервые в интраоперационных условиях проведено комплексное морфофункциональное исследование структурных изменений в миокарде больных с постинфарктным кардиосклерозом и различными стадиями хронической сердечной недостаточности с позиций оценки адаптивных возможностей его клеточных элементов.
Впервые определена роль апоптоза кардиомиоцитов в развитии ремоделирования сердца у больных с ишемической болезнью сердца, перенесших инфаркт миокарда. Установлена прямая взаимосвязь между числом кардиомиоцитов, подвергшихся апоптозу, и основными гемодинамическими показателями, характеризующими систолическую и диастолическую функцию левого желудочка. Определены цитологические критерии прогнозирования развития послеоперационного ремоделирования сердца и прогрессирования хронической сердечной недостаточности.
Обоснована возможность прогнозирования послеоперационного ремоделирования левого желудочка и прогрессирования сердечной недостаточности у больных с постинфарктным ремоделированием сердца на предоперационном этапе на основе анализа гистологических, эхокардиографических и клинических данных.
^ Теоретическое и практическое значение работы.
Определение закономерностей структурной реорганизации миокарда у больных с ишемической болезнью сердца, выявление роли апоптоза кардиомиоцитов обосновывает представление о диапазоне гисто- и органотипических свойств тканевых элементов в условиях постинфарктного ремоделирования сердца и репаративного кардиомиогенеза.
Характер структурно-функциональных изменений в миокарде у больных с постинфарктным ремоделированием сердца, в том числе динамика апоптоза кардиомиоцитов, имеет прогностическое значение для оценки компенсаторных и приспособительных возможностей сердца в условиях гемодинамических и нейрогуморальных сдвигов.
Результаты сочетанного исследования больных, в том числе эхокардиографического и морфологического (интраоперационных биоптатов миокарда), могут быть использованы в качестве диагностических критериев прогнозирования развития послеоперационного ремоделирования сердца и прогрессирования хронической сердечной недостаточности, что обеспечит эффективную реализацию лечебно-профилактических мероприятий у данной категории пациентов.
^ Основные положения, выносимые на защиту:
1. Постинфарктное ремоделирование сердца сопровождается реорганизацией миокарда, являющейся следствием нарушений клеточного и тканевого гомеостаза, в основе которого лежит комплекс изменений клеточных элементов миокарда, происходящих на тканевом, клеточном, субклеточном и молекулярно-генетическом уровнях.
2. Параллелизм динамики эхокардиографических показателей постинфарктного ремоделирования сердца и структурно-функциональных изменений миокарда позволяет рассматривать данный процесс как единый клинико-морфологический синдром.
3. Ремоделирование сердца и прогрессирование хронической сердечной недостаточности связано с установлением в интраоперационных условиях ограничения компенсаторных возможностей клеточных элементов миокарда, необратимостью ультраструктурных изменений в нем, возрастанием кардиомиоцитов с признаками апоптозной доминанты.
Внедрение.
Результаты диссертационной работы внедрены в учебный процесс и практику НИР на кафедре гистологии, цитологии и эмбриологии, кафедре патологической анатомии, кафедре госпитальной терапии
им. Р.Г. Межебовского, кафедре факультетской терапии, отделении кардиологии ГУЗ «Оренбургская областная клиническая больница №2».
^ Апробация работы и публикации результатов исследования.
Материалы диссертации доложены и обсуждены на научной конференции «Фундаментальные и прикладные проблемы гистологии. Гистогенез и регенерация тканей» (Санкт-Петербург, 2004г.), на VII Всероссийской конференции по патологии клетки (Москва, 2005г.), на Международном симпозиуме «Молекулярные механизмы регуляции функции клетки» (Тюмень, 2005г.), на конгрессе кардиохирургов в НЦССХ им. А.Н.Бакулева РАМН (Москва, 2006г.), на научном совещании «Актуальные проблемы учения о тканях» (Санкт-Петербург, 2006г.), на VIII конгрессе международной ассоциации морфологов (Орел, 2006г.), на II съезде кардиологов Уральского федерального округа (Екатеринбург, 2007г.), на международной гистологической конференции (Санкт-Петербург, 2008г.), на IX конгрессе международной ассоциации морфологов (Бухара, 2008г.), на Всероссийской научной конференции «Клиническая анатомия и экспериментальная хирургия в XXI веке» (Оренбург, 2009г.), на конференции, посвященной 65-летию кафедры госпитальной терапии им. Р.Г. Межебовского (Оренбург, 2010г.).
По теме исследования опубликовано 13 печатных работ, из них 8 в изданиях, рекомендованных ВАК Мионбрнауки РФ для публикации материалов докторских и кандидатских диссертаций.
^ Объем и структура работы.
Диссертация состоит из введения, обзора литературы, описания материала и методов исследования, 3 глав результатов исследования, главы обсуждения, выводов, практических рекомендаций, литературного указателя, представлена в одном томе объемом 155 страниц.
Работа иллюстрирована 20 таблицами и 28 рисунками, которые включают микрофотографии, электронные микрофотографии, гистограммы. Список литературы содержит 277 источников, в том числе 143 иностранных. Диссертация изложена на русском языке.
^ СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Клиническая характеристика больных.
Данное исследование выполнялось на кафедре гистологии, цитологии и эмбриологии ОрГМА (зав. кафедрой з. д. н. РФ, д. б. н., профессор Стадников А.А.), на кафедре госпитальной терапии им. Р.Г. Межебовского (зав. кафедрой д.м.н., профессор Либис Р.А.), а также на базе отделения кардиохирургии ГУЗ «Оренбургская областная клиническая больница №1» (зав. отделением Рожков В.О.). Особая благодарность за оказание помощи в сборе материала д. м. н., кардиохирургу Пайвину А.А..
Было обследовано 70 мужчин с постинфарктным кардиосклерозом до и после оперативного лечения (аортокоронарного шунтирования), которые составили первую группу. Контрольную группу составили 30 мужчин с постинфарктным кардиосклерозом и аналогичными клинико-функциональными параметрами, которым проводилось только консервативное лечение.
Возраст пациентов первой группы варьировал от 39 до 76 лет, средний возраст 51,5 год. 92% обследованных переносили один инфаркт миокарда, 8% - два. В среднем с момента перенесенного инфаркта миокарда до операции прошло 5,6 лет. Это позволило наиболее полно охарактеризовать процесс постинфарктного ремоделирования.
У 90% больных основное заболевание протекало на фоне сопутствующей патологии. Среди сопутствующих заболеваний у 44,3% пациентов наблюдались артериальная гипертония I стадии, 1-й степени. У 18,6% - атеросклероз аорты, у 15,7% - пароксизмальная фибрилляция предсердий, у 15,7% хронический гастрит, холецистит, язвенная болезнь. Исключались из группы наблюдаемых больные со второй и третьей степенью артериальной гипертензии, сахарным диабетом, выраженной патологией клапанного аппарата, сложными нарушениями ритма и проводимости, аневризмой левого желудочка.
Клиническая характеристика ишемической болезни сердца, дебютировавшей у обследованных больных в среднем за 3-5 лет до поступления в стационар, чаще всего была представлена приступами стенокардии напряжения, перенесенным инфарктом миокарда и симптомами хронической сердечной недостаточности. В подавляющем большинстве случаев (96%) атеросклероз коронарных артерий манифестировал стабильной стенокардией, преимущественно 2-3 функционального класса.
Тяжесть хронической сердечной недостаточности оценивали у пациентов в соответствии с классификацией ОССН ( общества специалистов по сердечной недостаточности) (2002 г.), используя ШОКС (шкалу оценки клинического состояния) (модификация Мареева В.Ю., 2000) и тест с шестиминутной ходьбой. (таб. 1, 2).
Таблица 1. Распределение пациентов первой группы по стадиям хронической сердечной недостаточности до операции аортокоронарного шунтирования.
| Стадия хронической сердечной недостаточности (СН) | Количество (n) |
| СН I | 39 |
| СН IIА | 27 |
| СН IIБ | 4 |
| Всего (n) | 70 |
Таблица 2. Распределение пациентов первой группы по функциональным классам (ФК) хронической сердечной недостаточности до операции аортокоронарного шунтирования.
| Функциональный класс (ФК) | Количество (n) |
| ФК I | 10 |
| ФК II | 43 |
| ФК III | 17 |
| ФК IV | - |
| Всего (n) | 70 |
У 63% пациентов симптомы хронической сердечной недостаточности отмечались в течение пяти лет, у остальных - от нескольких месяцев до года. Признаки перенесенного инфаркта подтверждались ЭКГ и эхокардиографией. Всем больным перед поступлением в стационар проводилась стандартная консервативная терапия ишемической болезни сердца в соответствии с клиническими рекомендациями.
Проводимые хирургические вмешательства включали аортокоронарное и маммариокоронарное шунтирование согласно общепринятым принципам прямой реваскуляризации миокарда. У 75% пациентов осуществлено шунтирование 3 сосудов, у остальных 2.
Контрольной группе больных не выполнялась операция, а проводилось только консервативное лечение дезагрегантами, бета-блокаторами, нитратами по требованию, ингибиторами ангиотензинпревращающего фермента, мочегонными по показаниям, статинами.
^ Клинические методы обследования.
Всем больным проводилось стандартное общеклиническое обследование, а также эхокардиография в одно- и двухмерном, импульсном и постоянно-волновом допплеровском режимах на аппарате «Acuson 128X10» (Япония) с синхронной регистрацией ЭКГ (Шиллер Н., Осипов М.А., 1993). Использовались датчики 2,4 МГц и 3,5 МГц.
Определялись следующие показатели: конечные систолические и диастолические размеры (КСР, КДР, см) и объемы (КДО, КСО, мл) левого желудочка, фракция выброса (ФВ, %), толщина межжелудочковой перегородки в диастолу и систолу (МЖПд, МЖПс, мм), толщина задней стенки левого желудочка в диастолу и систолу (ЗСд, ЗСс, мм), масса миокарда левого желудочка (ММ, гр), ударный объем (УО, мл), минутный объем (МО, мл/мин). Относительную толщину стенки (ОТС) левого желудочка рассчитывали: ОТС=(МЖПд+ЗСд)/КДР. Индекс сферичности (ИС) определялся следующим образом: ИС=КДР/L. Также использовались расчетные показатели, индексированные к площади поверхности тела (ПТ). Показатель КСОИ рассчитан по формуле КСОИ (мл/м2)=КСО/ПТ. ММИ(г/м2)=ММ/ПТ. Расчет систолического миокардиального стресса (МС в дин/см2) производился по формуле МС=АДс х КСР/4 х ЗСс х (1+ЗСс/КСР), где АДс – систолическое артериальное давление, ЗСс – толщина задней стенки ЛЖ в систолу. Помимо этого рассчитывались показатели, связывающие сократительную функцию сердца и геометрию левого желудочка: МС/КСОИ и ФВ/МС (Кузнецов Г.Э., Саликова С.П., 2003).
Диастолические свойства левого желудочка изучались при помощи исследования трансмитрального диастолического потока (ТМДП) путем определения максимальной скорости трансмитрального диастолического потока в период раннего наполнения левого желудочка (Vе, м/с), максимальной скорости трансмитрального диастолического потока в период позднего наполнения левого желудочка (Vа, м/с), отношения максимальных скоростей потоков в период раннего и позднего наполнения (Е/А), времени изоволюмического расслабления левого желудочка (ВИР, мс).
Селективная коронарография проводилась на кардиографическом комплексе Integris H5000F (Philips) в условиях рентгеноперационной с одновременным мониторингом ЭКГ и артериального давления. Значимым сужением коронарных артерий считали ангиографически выявляемый стеноз для ствола 50%, для других коронарных сосудов 75% и более.
Контрольное клинико-инструментальное обследование оперированных пациентов проводилось спустя 10 дней, через 6 и 12 месяцев после операции. В контрольной группе обследование пациентов проводилось в момент взятия под наблюдение, через 6 и 12 месяцев от начала наблюдения. При анализе полученных данных учитывалось наличие и тяжесть сердечной декомпенсации.
^ Морфологические объект и методы исследования.
Материалом для исследования служили биоптаты миокарда ушка правого предсердия, полученные в процессе кардиохирургических операций до кардиоплегии у 70 больных, перенесших инфаркт миокарда различной локализации и с разной степенью выраженности атеросклеротического поражения коронарных артерий.
Весь полученный биопсийный материал был подвергнут однотипной гистологической и иммуноцитохимической обработке на световом и электронно-микроскопическом уровнях.
^ Светооптическое исследование. Материал фиксировали в 10% водном растворе нейтрального формалина. После стандартной гистологической проводки материал заливали в парафин-целлоидин. Приготовление срезов толщиной 5-6 мкм осуществляли на ротационном микротоме МПС-2. Депарафинированные срезы окрашивали гематоксилином Майера и эозином.
^ Электронномикроскопическое исследование. Материал фиксировали в охлажденном 2,5% растворе глютарового альдегида на S-коллеидиновом буфере (рН=7,3-7,4). Постфиксацию проводили в четырехокиси осмия по Millonig (1961). Материал обезвоживали при комнатной температуре в серии спиртов возрастающей концентрации и абсолютном ацетоне, после чего заключали в смолу ЭПОН-812. Полимеризацию объектов проводили при +60С в течение 2 суток.
С каждого блока на ультратоме LKB-5 (Sweden-Bromma) получали полутонкие (1мкм) и ультратонкие срезы. Полутонкие срезы окрашивали метиленовым синим и основным фуксином по прописи Sato T. и Shamoto M.A. (1973). Полутонкие срезы использовали при подготовке блоков к заточке перед изготовлением ультратонких срезов, а также для качественного и морфометрического анализов тканевой и клеточной организации на световом уровне.
Для более детального светооптического исследования с полутонких срезов получали микрофотографии при помощи микрофотонасадки МФН-12.
Морфометрические исследования осуществляли, используя винтововй окуляр-микрометр MОВ-1-15ху42 и окулярные вставки (Автандилов Г.Г., 1990).
Ультратонкие срезы подвергали двойному контрастированию в насыщенном спиртовом растворе уранилацетата при температуре +37С в течение 20 минут и цитрате свинца по Reynolds E.S. (1963). Исследование ультратонких срезов и их фотографирование производили на электронном микроскопе ЭМВ 100 АК при увеличениях от х4000 до х40000.
Вычисление площади поверхности ультраструктур осуществляли наложением на электронограмму точечной или квадратной сетки (Стропус Р.А. с соавт., 1976; Якубов А.С., Кац В.А., 1984). Снятие морфометрических параметров проводили путем подсчета точек, попавших на структурные профили. Площадь поверхности ультраструктур вычисляли по формуле:
S=2P1/LхM/1000
Где М – увеличение, Р1 – число точек, попавших на тканевую структуру, L – общее количество точек тестовой системы.
В основу определения объемной плотности тканевой структуры (V), то есть совокупного объема этой структуры в единице объема ткани, положен метод наложения точечных сеток на срезы с последующим подсчетом числа попадания точек на профили исследуемых структур.
Для определения объемной плотности (относительного объема) нами применено наложение точечной сетки (Рт= 480) на фотоотпечатки при стандартном увеличении (Стропус Р.А. с соавт., 1976). Для точек, попавших на структурные профили (Рi), характеризовала их относительный объем:
Рi
V= - , где
Рт
Рi – число точек, попавших на тканевую структуру,
Рт – общее число точек тестовой системы.
^ Иммуноцитохимическое исследование. Для идентификации клеток с признаками апоптоза применяли следующие иммуноцитохимические реакции: на определение экспрессии белка р53, bcl-2, каспазы-3, а также на выявление интернуклеосомальной фрагментации ДНК. Кусочки миокарда фиксировали в 10% нейтральном формалине, обезвоживали и заливали в парафин. Исследование проводили на серийных парафиновых срезах толщиной 5-6 мкм. Срезы инкубировали с моноклональными антителами к р53 (фирма «Дако», Дания) в рабочем разведении 1:50, bcl-2, каспазе-3 (фирма BioGеnеx, США) в рабочем разведении 1:50. Для выявления иммунного окрашивания использовали стрептавидин-биотиновый пероксидазный метод («Дако»,LSAB-kit, Дания), затем осуществляли докрашивание ядер водным гематоксилином. С целью определения внутриядерной фрагментации ДНК использовали набор реактивов «Apoptag Plus Peroxidase in Situ Apoptosis Detection Kit» (фирма «Integrin», Канада), докрашивание ядер производили 0,5% раствором метиленового зеленого на 0,1М ацетатном буфере. При постановке Apoptag-теста ядерный хроматин клеток, вступивших в апоптоз, приобретал коричневое окрашивание. Иммуноцитохимические реакции были проведены с использованием рекомендаций Новиковой Л.В. с соавт. (1981), Киясова А.П. (2001). Во всех случаях подсчитывали процент окрашенных клеток на 1000 клеток в случайно выбранных полях зрения.
Полученные результаты статистически оценивали по t-критерию Стьюдента. Вычисления производились с помощью программного пакета «Statistica 6.0». Данные представлены в виде среднего арифметического по результатам каждого раздела исследования, +/- стандартное отклонение. Достоверными считались отличия при р < 0,05(95,5%) или р < 0,01(99,7%). Анализ связи между признаками проводился путем вычисления коэффициента корреляции r (по Пирсону).
^ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Наше исследование показало, что после операции аортокоронарного шунтирования происходит достоверное улучшение клинических показателей: через 6 и 12 месяцев у 42,8% больных отмечалось улучшение течения стенокардии. После операции перехода больных в более высокий функциональный класс (ФК) стенокардии за период наблюдения не отмечалось (рис. 1).
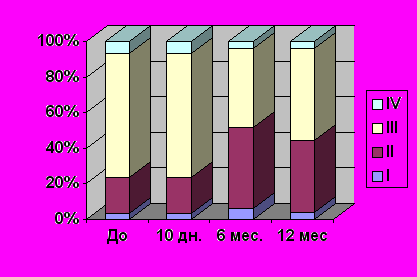
Рис. 1 Частота клинических проявлений ишемической болезни сердца у пациентов до и после операции аортокоронарного шунтирования.
I – первый функциональный класс стенокардии
II – второй функциональный класс стенокардии
III – третий функциональный класс стенокардии
IV – четвертый функциональный класс стенокардии
Восстановление коронарного кровотока с помощью операции аортокоронарного шунтирования оказывает также положительное влияние на течение хронической сердечной недостаточности, способствуя уменьшению ее тяжести. Через 6 месяцев после оперативного вмешательства число пациентов с I функциональным классом (ФК) сердечной недостаточности увеличилось на 21,4%, одновременно уменьшилось количество больных с III ФК на 18,57%. Подобная тенденция сохранялась и через год после операции аортокоронарного шунтирования (таб. 3).
Таблица 3. Динамика функционального класса (ФК) хронической сердечной недостаточности (ХСН) у больных после операции аортокоронарного шунтирования.
| ФК ХСН | До операции | Через 10 дн. | Через 6 мес. | Через 12 мес. |
| I | 37 (52,85%) | 37 (52,85%) | 52 (74,28%) | 49 (70%) |
| II | 26 (37,14%) | 26 (37,14%) | 13 (18,57%) | 16 (22,85%) |
| III | 7 (10%) | 7 (10%) | 5 (7,14%) | 5 (7,14%) |
| IV | - | - | - | - |
Было установлено, что через 10 дней после аортокоронарного шунтирования достоверных изменений линейных и объемных показателей левого желудочка не происходило, отмечалось некоторое увеличение фракции выброса (ФВ), особенно в группе больных с СН IIБ стадией, имеющих изначально более низкую ФВ.
При обследовании больных через 6 месяцев после аортокоронарного шунтирования нами было выявлено уменьшение КДО, КСО на 20,4% (р<0,01), 30,02% (р<0,01) соответственно. В этот же период у пациентов выявлялось снижение ММИ на 1,04%. Показатель ФВ, по результатам нашего исследования, увеличивался.
Также отмечалось улучшение диастолической функции левого желудочка, о чем свидетельствует снижение времени изоволюмического расслабления (ВИР) на 6,9% и уменьшение отношения Е/А на 12,4%, что согласуется с данными литературы (Долженко М.М. с соавт., 2005; Лежнев А.А., 2010).
Спустя год после аортокоронарного шунтирования у пациентов в целом сохранялась выявленная через 6 месяцев после операции тенденция положительной динамики структурно-геометрических и функциональных показателей левого желудочка: ФВ возросла на 0,61% по сравнению с дооперационными значениями. КДО и КСО уменьшились на 20,8% (p < 0,01) и 37,2% (p < 0,01) соответственно. Также у пациентов происходило снижение ВИР левого желудочка и уменьшение отношения Е/А, что указывает на улучшение диастолической функции сердца (таб. 4).
Таблица 4. Структурно-геометрические и функциональные параметры левого желудочка у больных через 12 месяцев после аортокоронарного шунтирования (АКШ).
| | до АКШ | После АКШ | Δ% |
| КДР (см) | 6,23+-0,51 | 6,03+0,22 | -3,2 |
| КСР (см) | 4,63+0,21 | 4,5+0,3 | -2,8 |
| КДО (мл) | 206,1+6,86 | 163,2+4,1* | -20,8 |
| КСО (мл) | 114,2+6,4 | 71,7+7,5* | -37,2 |
| ФВ (%) | 48,7+2,3 | 49+3,6 | +0,61 |
| Е/А | 1,69+0,13 | 1,470,13 | -13,01 |
| МС (дин/см2) | 284,2 +20,1 | 291,4+18,4 | +2,5 |
| ОТС | 0,32+0,02 | 0,31+0,05 | -3,1 |
| ММИ (гр/м2) | 188,26+15,4 | 187,3+14,3 | -0,5 |
| МС/КСОИ | 8,03+1,4 | 7,91+0,6 | -4,9 |
| ФВ/МС | 0,17+0,02 | 0,16+0,02 | -5,9 |
| ВИР,мс | 115,8+ 11,84 | 106,8+ 8,7 | -7,8 |
*- p < 0,01
С целью установления факторов прогнозирования прогрессирования хронической сердечной недостаточности после аортокоронарного шунтирования нами был проведен корреляционный анализ между клиническими и эхокардиографическими дооперационными параметрами и функциональным классом (ФК) хронической сердечной недостаточности (ХСН) после аортокоронарного шунтирования. Установлено, что прогностически неблагоприятными факторами послеоперационного течения хронической сердечной недостаточности (отсутствие положительной динамики ФК ХСН или его повышение) являются возраст пациентов старше 55 лет (r=0,54, p<0,05), фракция выброса ниже 36% (r=0,69, p<0,05), КСО>140 мл (r=0,62, p<0,05), КДО >260 мл (r=0,53, p<0,05).
При морфологическом исследовании миокарда ушка правого предсердия нами были обнаружены существенные структурно-функциональные изменения. На светооптическом уровне установлена значительная вариабельность профилей кардиомиоцитов. Часто они приобретают различные разнообразные формы. В большинстве случаев профили кардиомиоцитов соответствовали профилям поверхности капилляров. Это, на наш взгляд, свидетельствует о том, что форма сердечных мышечных клеток in situ в значительной мере обусловлена их микроокружением. Удлинение и «ветвление» кардиомиоцитов некоторыми авторами рассматривается как типовая компенсаторно-приспособительная реакция поврежденного миокарда (Пауков В.С., Гавриш А.С., 1984).
Выявлялись участки неправильного расположения мышечных волокон. В некоторых участках миокард выглядел разволокненным за счет выраженной дискомплексации миофибрилл, извитого их хода и значительного расширения межклеточных пространств за счет отека соединительной ткани. Особенно часто подобные структурные изменения обнаруживались в сердечной мышечной ткани больных с СН IIБ ст. Необходимо отметить, что вышеописанная реорганизация миокарда неспецифична. Сходные морфологические изменения были выявлены многими авторами при изучении миокарда в условиях различной патологии и в эксперименте (Пауков В.С., Фролов В.А., 1982; Саликова С.П. с соавт., 2000; Непомнящих Л.М., 2007;).
Нами отмечено, что под эндокардом и в толще миокарда отмечались обширные поля жировой ткани, являющиеся, по-видимому, результатом перерождения кардиомиоцитов. В основной массе кардиомиоциты были неравномерно гипертрофированы. В ряде случаев подобные миоциты со всех сторон были окружены соединительной тканью. Как правило, гипертрофированные кардиомиоциты имели увеличенные в размерах ядра разнообразной, причудливой формы, иногда располагающиеся субсарколеммально.
Иногда обнаруживались двуядерные кардиомиоциты, реже - сердечные миоциты с пикнотичными гиперхромными ядрами, интенсивно воспринимающими краситель. Выявлялись также кардиомиоциты с различной степенью выраженности литических изменений. В таких клетках отмечались признаки внутриклеточного отека, вакуолизации, очагового лизиса миофибрилл и «опустошения» околоядерной зоны. По полюсам ядер в некоторых клетках наблюдались скопления липофусциновых гранул.
Подобные структурные изменения обнаруживались в миокарде в экспериментах по моделированию антрациклиновой кардиомиопатии, приводящей к развитию регенераторно-пластической недостаточности сердца (Непомнящих Л.М., 2007; Саликова С.П. с соавт., 2008). Выявлялись также миоциты с признаками дистрофии, с участками пересокращения и контрактурного повреждения миофибрилл и редукцией сократительного аппарата.
Следует подчеркнуть, что в некоторых кардиомиоцитах отмечались признаки дезинтеграции мышечных волокон по вставочным дискам и картина локального повреждения межклеточных контактов. По мнению некоторых авторов, гиперконтрактуры одной клетки могут индуцировать разрыв сарколеммы и повреждение соседних кардиомиоцитов (Семенова Л.А., Целлариус Ю.Г., 1978; Непомнящих Л.М., 1991; Соколова Р.И., Жданов В.С., 2002). Вышеописанные изменения были более очевидными в миокарде ушка правого предсердия больных с СН IIБ ст.
Существенным изменениям подвергались также сосуды микроциркуляторного русла (МЦР). Интрамуральные артерии в большинстве случаев находились в состоянии спазма, мышечный слой их был утолщен. В некоторых сосудах ядра эндотелиальных клеток выдавались в просвет. Вокруг артериол обнаруживались зоны периваскулярного отека и склероза. Вены были расширенны, заполненны форменными элементами крови и нередко хлопьевидной массой. Нередко отмечались явления стаза эритроцитов в капиллярах, прекапиллярах и артериолах. Структурно-функциональные изменения в системе микроциркуляторного сосудистого русла могут быть одним из ведущих звеньев патогенеза послеоперационного ремоделирования сердца, приводя к нарушению трофики миокарда, что коррелирует с неблагоприятными отдаленными результатами хирургического лечения. В межмышечной ткани миокарда периваскулярно в некоторых случаях обнаруживались очаги геморрагического и плазморрагического пропитывания, очаговой лейкоцитарной инфильтрации. Однако выраженность лимфолейкоцитарной инфильтрации была незначительной, что не укладывается в картину миокардита, обнаруженного Казаковым В.А. с соавт., 2004, при исследовании интраоперационного миокарда больных с ишемической кардиомиопатией и ХСН. По мнению авторов, наличие воспалительной инфильтрации миокардиальной стромы, наряду с фиброзом является патоморфологическим предиктором дилатации левого желудочка у больных после аортокоронарного шунтирования, определяя неблагоприятный результат оперативного вмешательства.
При светооптическом анализе, а также исследовании полутонких срезов был установлен отек стромы миокарда. Увеличение стромального компонента миокарда происходило за счет возрастания объема микроциркуляторного русла, коллагеновых волокон и основного вещества соединительной ткани.
Ультраструктурные исследования кардиомиоцитов выявили существенные структурно-функциональные изменения миофибрилл в виде их дезориентации, фрагментации, очагового лизиса, частичной или полной дискомплексации саркомеров, деформации Z-линий. Данные процессы особенно ярко проявлялись в периферических участках цитоплазмы сердечных миоцитов, сопровождались активизацией лизосом и формированием большого числа ламеллярных телец. Изменения сократительного аппарата кардиомиоцитов при различной патологии сердца имеют важное значение для морфологической диагностики и прогноза преднекротических состояний, во многом определяя функциональные и регенераторные возможности мышечных клеток сердца. Нередко в кардиомиоцитах отмечалось неравномерное сокращение миофибрилл, появление полос пересокращения, контрактурного повреждения. В некоторых сердечных миоцитах обнаруживаются участки смещения Z-дисков соседних миофибрилл по отношению друг к другу. У больных с СН IIБ стадией иногда наблюдались размывание и исчезновение дисков Z, А, приводящие к гомогенизации миофибрилл. Подобные ультраструктурные изменения обнаруживались в миокарде при моделировании антрациклиновой кардиомиопатии (Дуднакова Т.В. с соавт., 2002; Лушникова Е.Л. с соавт., 2005).
У больных с СН I и особенно IIА стадиями в зонах локальных разрушений миофибрилл регистрировалось большое количество свободных рибосом и полисом, появлялись вновь образованные миофибриллярные пучки, что свидетельствует об осуществлении репаративного миофибриллогенеза (Серов В.В., Пауков В.С., 1975; Чечулин Ю.С., 1975). Напротив, у больных с ХСН IIБ стадией подобной картины мы не наблюдали, что, по нашему мнению, указывает на исчерпание резерва внутриклеточной регенерации сократительных структур кардиомиоцитов.
Установлено, что в сердечных миоцитах происходят также существенные изменения в митохондриях. По мере нарастания тяжести хронической сердечной недостаточности в них усиливались следующие ультраструктурные изменения: наблюдались их набухание, вакуолизация и гомогенизация матрикса, разрушение и фрагментация крист. В митохондриях также происходило уменьшение количества крист. Установлен значительный внутриклеточный гетероморфизм митохондрий. По мере нарастания хронической сердечной недостаточности митохондрии изменяли свою пространственную локализацию. У больных с СН IIA и IIБ стадиями они часто располагались около сарколеммы, контактирующей с прилежащими гемокапиллярами.
Степень выраженности деструктивных процессов в митохондриях коррелировала со стадией хронической сердечной недостаточности. Так в кардиомиоцитах больных с СН IIБ стадией отмечались необратимые изменения этих органелл в виде разрушения наружной мембраны, резкого набухания с потерей крист, вымывания или гомогенизации матрикса, на что указывается также в ряде работ (Шахламов В.А. с соавт., 1984; Непомнящих Л.М. с соавт., 2001). Необходимо также подчеркнуть, что выявленное нами нарушение отношения митохондрии/миофибриллы, (при СН I 0,31; СН IIА – 0,33; СН IIБ – 0,38) не свидетельствует о благоприятной энергетической ситуации в миокарде, так как при СН IIБ стадии увеличивается число патологически измененных и функционально несостоятельных митохондрий. При гипертрофии сердечных миоцитов данные изменения энергетических органелл может привести к фатальным ультраструктурным повреждениям их сократительного аппарата.
По мере усугубления хронической сердечной недостаточности в цитоплазме сердечных миоцитов нарастает число лизосом. Высокая лизосомальная и аутофагоцитарная активность, наблюдаемая нами в кардиомиоцитах, может свидетельствовать о наличии процесса цитоплазматической дегенерации.
Аутофагические процессы и образование липосом преимущественно нарастали у больных с СН IIБ стадией. Количество последних коррелировало со степенью гипертрофии сердечных миоцитов. Их появление обусловлено в подобных клетках переключением энергообменных процессов с углеводного на жировой.
В изученных нами кардиомиоцитах значительные изменения претерпевала саркоплазма. Наблюдались ее отек, разрыхление и снижение электронной плотности. По мере прогрессирования хронической сердечной недостаточности в саркоплазме уменьшалось число гранул гликогена, что связано, вероятно, с ослабеванием в них процессов аэробного окисления и усилением анаэробного гликолиза, происходящего без обратного ресинтеза гликогена (Чечулин Ю.С., 1975; Лушникова Е.Л. с соавт., 1999).
Наблюдалось резкое расширение канальцев эндоплазматического ретикулума, вплоть до образования крупных вакуолей и цистерн со скоплением в них осмиофильных масс или внутриклеточных органелл; реже – очаговая деструкция их мембран.
Значительным структурно-функциональным изменениям подвергались также и ядра кардиомиоцитов. По мере прогрессирования хронической сердечной недостаточности увеличивалась их площадь, как правило, за счет образования множества выпячиваний кариолеммы. Иногда обнаруживались двуядерные кардиомиоциты. Также выявлялись ядра, содержащие 2-3 электронно-плотных ядрышка. В ядрах некоторых кардиомиоцитов (при СН I и II А) отмечалось увеличение числа и размеров ядерных пор, свидетельствующее об усилении синтетических процессов и обмена веществ между ядром и цитоплазмой, приводящее к выраженному накоплению в ней рибосомального материала.
Выраженные изменения происходили также и в сарколемме. Значительно увеличивалась площадь поверхности сердечных миоцитов за счет образования множества кавеол. По мере нарастания тяжести хронической сердечной недостаточности исчезала двухконтурность сарколеммы, выявлялись места ее разрывов и локальной деструкции.
Нами установлен выраженный гетероморфизм сократительных кардиомиоцитов, проявляющийся в возрастании их ультраструктурного разнообразия, что коррелировало с прогрессированием стадии хронической сердечной недостаточности. Нами идентифицировано несколько типов реорганизованных клеток. Во-первых, кардиомиоциты с признаками выраженной гипертрофии и гиперплазии с адекватной организацией и локализацией миофибрилл и митохондрий. Данные клетки имели крупные ядра, в которых преобладали эухроматиновые районы и регистрировались 1-2 крупных ядрышка.
Во-вторых, гипертрофированные кардиомиоциты с измененным расположением миофибрилл и митохондрий. Миофибриллы в таких клетках отсутствовали как по периферии, так и в парануклеарной зоне. В этих участках отмечались крупные лизосомы, набухшие митохондрии с разрушенными кристами, иногда трансформирующиеся в липосомные структуры.
В-третьих, кардиомиоциты с выраженной дискомплексацией саркомеров, фрагментацией и изменением ориентации миофибрилл, которые располагались либо под углом, либо островками. Вышеописанные процессы имели место в двух основных вариантах: либо при фрагментации миофибрилл резко усиливалась активность лизосом, увеличивалось количество липосом, и отмечались локальные просветления цитозоля, подобные зонам секвестрации, либо в этих участках регистрировалось большое количество свободных рибосом, что свидетельствует об осуществлении репаративного миофибриллогенеза. Данный процесс в ряде случаев приводил к формированию периферических участков кардиомиоцитов de novo, что существенно изменяло рельеф клеточной поверхности.
Нами также были выделены кардиомиоциты с большим содержанием пиноцитозных пузырьков, кавеол, расширенных канальцев Т-системы. Эти клетки тесно контактировали с капиллярами, имеющими гипертрофированный эндотелий с наличием пиноцитозных пузырьков. Таким образом, гипертрофию кардиомиоцитов с гиперплазией внутриклеточных органелл можно рассматривать в качестве одного из адаптивных процессов ремоделирования сердца при хронической сердечной недостаточности (Cohn J.N..,1995; Maisch В. , 1996).
При морфометрическом анализе паренхиматозно - стромальных взаимоотношений в мышце сердца было установлено существенное возрастание квоты немышечных структур соответственно стадиям хронической сердечной недостаточности. При этом основной вклад в увеличение стромального компонента миокарда вносило возрастание объема микроциркуляторного русла, фибробластоподобных клеток, коллагеновых волокон и основного вещества соединительной ткани, что согласуется с данными литературы (Hanatani A. et al., 1998; Hojo Y. et al., 2001). Усиление дегенерации внеклеточного матрикса способствует дальнейшему прогрессированию постинфарктного ремоделирования сердца (Romanic A.M. et al., 2001).
Значительные изменения претерпевали кровеносные капилляры. Наблюдалась выраженная гетероморфность эндотелиальных клеток капилляров: одни из них имели плотный цитоплазматический матрикс, другие - просветленную цитоплазму, третьи - были вакуолизированы. Во всех случаях в эндотелиоцитах регистрировались пиноцитозные пузырьки, свободные рибосомы, расширенные канальцы эндоплазматического ретикулума, что свидетельствует об усилении транскапиллярного обмена (Katz A.M., 1990) и может расцениваться как проявление одной из компенсаторно-приспособительных реакций сердечной мышечной ткани. На апикальной поверхности таких клеток имелось множество микроворсинок. Адвентициальные клетки приобретали малодифференцированный вид (крупные светлые ядра, узкий ободок цитоплазмы со свободными рибосомами). В расширенных межклеточных пространствах располагались пучки коллагеновых волокон, фрагменты разрушенных миофибрилл, цитомембран, митохондрий, секвестрированные участки кардиомиоцитов. Данные явления наиболее четко наблюдались у больных с СН IIБ стадией.
Таким образом, результаты нашего исследования показали, что у больных с постинфарктным кардиосклерозом и хронической сердечной недостаточностью в миокарде происходят значительные структурно-функциональные изменения, отражающие реализацию гисто - и органотипических потенций его тканевых элементов, лимитированные у больных с СН IIБ стадией. Однако остается открытым вопрос насколько вышеописанные структурные изменения миокарда носят обратимый характер. По мнению большинства авторов, обратимость этих изменений находится в прямой зависимости от сохранности мембран внутриклеточных органелл, а также сарколеммы (Шахламов В.А., 2003).
При исследовании кардиомиоцитов на электронно-микроскопическом уровне нами были идентифицированы клетки, имеющие типичные изменения, характерные для апоптоза. В таких сердечных миоцитах выявлялись ядра с выраженной маргинацией и дезинтеграцией хроматина, отмечалась конденсация цитоплазмы, сопровождающаяся появлением инвагинаций ядра и клеточной поверхности, что согласуется с данными литературы (Kerr J.F.R. et al., 1972;Wyllie A.N. et al., 1980; Majno G., Joris I., 1995). Следует особо подчеркнуть, что описываемые клетки располагались в миокарде, не имеющем признаков воспаления, некробиоза и некроза.
При ультраструктурном анализе выявлялись также отдельные клетки со специфическими изменениями. Эти клетки были уменьшены в объеме. В них наблюдались конденсация цитоплазмы, везикуляция мембранных структур, образование на поверхности крупных кавеол. Количество таких клеток составило не более 1% от общего числа кардиомиоцитов. Следует отметить, что апоптозные тельца как проявление финальной стадии апоптоза при электронно-микроскопическом исследовании обнаруживались редко, что, видимо, связано с быстротечностью данного процесса и трудностью его идентификации (Pouyssegur J., 1985).
Нами также выявлены ультраструктурные изменения миокардиальных клеток, касающиеся их митохондрий и клеточной поверхности, не характерные для классической морфологической картины апоптоза. В кардиомиоцитах при этом отмечалась необычная конденсация внутриклеточных органелл, в частности митохондрий, скопления которых наблюдались либо в центральной части клеток (при этом атрофичные миофибриллы оттеснялись к краю клетки), либо по периферии между миофибриллами. Митохондрии в таких клетках были мелкими, полиморфными, с уплотненным матриксом. Нередко рядом с подобными клетками выявлялись макрофаги. Подобную реорганизацию клеток ряд исследователей относят к апоптотическому состоянию (Бокерия Л,А. c соавт., 1995; Бескровнова Н.А. с соавт., 1998; Непомнящих Л.М. с соавт., 2001).
Электронно-микроскопическое исследование показало, что апоптозоизмененные клетки миокарда встречаются довольно редко (0,08 - 0,12%). Необходимо особо подчеркнуть, что в миокарде больных с тяжелой хронической сердечной недостаточностью апоптоз протекал преимущественно по цитоплазматическому пути. В литературе имеются сведения о возрастании апоптоза кардимоиоцитов в миокарде больных с конечными стадиями ХСН до 0,7% по сравнению с 0,003% в норме (Narula N. et al., 1996; Yao M. et al., 1996; Olivetti G. et al., 1997; Shaddy R.E., 1997; Saraste A. et al., 1999). Однако на данном этапе исследования нам не представилось возможным сделать однозначные выводы о роли апоптоза кардиомиоцитов в развитии постинфарктного ремоделирования сердца и прогрессирования хронической сердечной недостаточности, что связано с ограниченными возможностями электронно-микроскопического метода.
При иммуноцитохимическом исследовании (определение экспрессии белка р53) было выявлено, что экспрессия р53 отмечалась в клеточных элементах миокарда больных с различными стадиями хронической сердечной недостаточности. Она определялась в виде окрашивания цитоплазмы клеток в розовато-коричневатый цвет разной интенсивности (от слабой - до ярко выраженной). В некоторых случаях в этих клетках обнаруживались также интенсивно окрашенные пикноморфные ядра, иногда смещенные на периферию. Количество клеток, экспрессирующих р53, варьировало от 15 до 7,4% (р 0,05) у больных в зависимости от тяжести ХСН, имея тенденцию к снижению по мере ее нарастания.
При проведении иммуноцитохимического исследования на выявление фрагментации ДНК ядерный хроматин клеток, вступивших в апоптоз, приобретал коричневое окрашивание, в то время как неизмененные ядра оставались голубыми, что подтверждает наличие в отдельных кардиомиоцитах признаков апоптотической дегенерации. Число кардиомиоцитов, подвергшихся апоптозу, в зависимости от стадии хронической сердечной недостаточности колебалось от 0,012 % (при СН I) до 0,85% (при СН IIБ). Таким образом, мы наблюдали достоверное увеличение (по критериям данного метода) апоптоза сердечных миоцитов у пациентов с тяжелой сердечной недостаточностью.
Существенное различие в числе выявленных клеток с признаками апоптоза вышеописанными иммуноцитохимическими методиками, на наш взгляд, можно объяснить тем, что они, во-первых, позволяют идентифицировать клетки, находящиеся в разных фазах апоптотического цикла (от клеток, готовых вступить в апоптоз и экспрессирующих р53, до клеток, ядра которых подверглись фрагментации и конденсации ДНК); во-вторых, видимо, не все клетки, готовые вступить на путь апоптоза, затем доходят до его финальной стадии, что подтверждает концепцию об обратимости апоптоза (Majno G., Joris I., 1995).
Данные иммуноцитохимической реакции с применением моноклональных антител к каспазе 3 – ключевого фермента протеолитического каскада, ведущего к гибели клетки посредством апоптоза, показали увеличение кардиомиоцитов с признаками апоптоза (цитоплазма таких клеток приобретала коричневое окрашивание) в миокарде больных с выраженной ХСН: 5,7% - при СН IIБ ст. против 1,2% - при СН I ст.
При иммуноцитохимическом исследовании на выявление в кардиомиоцитах экспрессии антиапоптотического протеина bcl-2 обнаруживались единичные иммунопозитивные клетки. Число сердечных миоцитов, экспрессирующих bcl-2, в миокарде больных с СН I и IIА ст. составило 0,02 % и 0,01 % соответственно. В миокарде больных с СН IIБ ст., по данным нашего исследования, экспрессия bcl-2 в кардиомиоцитах не выявлялась. (таб. 5).
Таблица 5. Уровень апоптоза кардиомиоцитов (в %) в миокарде больных с постинфарктным кардиосклерозом сердца и различными стадиями хронической сердечной недостаточности (СН) (по данным различных иммуноцитохимических методик)
| Название метода | СН I | СН IIA | СН IIБ |
| Уровень экспрессии белка р53 | 15±1,7 | 13,2±1,6* | 7,4±0,9* |
| Определение каспазы3 | 1,2±0,03 | 2,3±0,06* | 5,7±0,07* |
| Уровень экспрессии белка bcl2 | 0,023±0,003 | 0,014±0,002 | 0,0 |
| TUNEL-метод на выявление фрагментации ДНК | 0,012±0,005 | 0,63±0,01 | 0,85±0,02* |
* р0,05 – достоверность различий между группами
Сопоставление морфофункционального состояния миокарда больных, взятого во время операции аортокоронарного шунтирования, и отдаленных результатов хирургического лечения (через 12 месяцев после операции) показало, что среди пациентов выделяется группа (14,3%) без улучшения клиники хронической сердечной недостаточности и без положительной динамики структурно-геометрических и функциональных показателей левого желудочка. В миокарде больных этой группы были обнаружены кардиомиоциты с признаками апоптоза (от 0,65% до 12,8 %, по данным разных методов). В миокарде больных с положительным эффектом кардиохирургического лечения наблюдались лишь единичные клетки с признаками апоптоза. По остальным морфологическим критериям (степень воспалительной инфильтрации, фиброза миокарда, диаметр кардиомиоцитов, капилляров) достоверных различий между двумя этими группами получено не было.
Учитывая вышеизложенные данные, мы провели корреляционный анализ между основными показателями структурных изменений в миокарде и гемодинамическими параметрами у больных в отдаленном послеоперационном периоде.
Нами было установлено, что неблагоприятное изменение основных гемодинамических показателей (снижение ФВ, увеличение КСО, КДО, Е/А) в отдаленном послеоперационном периоде связано с нарушением клеточного и тканевого гомеостаза миокарда, причем достоверно (р<0,05) была определена прямая корреляционная связь между гемодинамическими показателями и числом кардиомиоцитов с признаками апоптоза (таб. 6).
Таблица 6. Взаимосвязь основных гемодинамических и морфологических показателей у больных с постинфарктным ремоделированием сердца при кардиохирургическом лечении.
| Показатель | Апоптоз кардиомиоцитов(%) | Диаметр капилляров (мкм) | Отношение мы- шечных и немы- шечных клеток |
| ФВ | r=-0,9654, p<0,05 | r=0,9462, p>0,05 | r=0,2331, p>0,05 |
| КСО | r=0,951, p<0,05 | r=-0,9343, p>0,05 | r=0,76975, p>0,05 |
| КДО | r=0,9403, p<0,05 | r=-0,9265, p>0,05 | r=0,7072, p>0,05 |
| Е/А | r=0,9858, p<0,05 | r=-0,9424, p<0,05 | r=0,7314, p>0,05 |
Резюмируя результаты нашей работы и сопоставляя их с данными литературы, можно сделать заключение, что операция аортокоронарного шунтирования способствует улучшению клинического течения стенокардии и хронической сердечной недостаточности, улучшению систолической и диастолической функции левого желудочка, а также его структурно-геометрических показателей. Апоптоз кардиомиоцитов можно считать предиктором повторного послеоперационного ремоделирования сердца и рассматривать в качестве фактора неблагоприятного отдаленного прогноза операции аортокоронарного шунтирования.
