Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина
| Вид материала | Учебно-методический комплекс |
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 2836.1kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 2979.19kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 2143.51kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 785.31kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 793.69kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 901.29kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 2591.69kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 814.76kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 2075.7kb.
- Учебно-методический комплекс дисциплины Бийск бпгу имени В. М. Шукшина, 1147.22kb.
2. ТЕОРИЯ СПЛАВОВ. ДИАГРАММЫ СОСТОЯНИЯ СПЛАВОВ
2.1. СПЛАВ. СИСТЕМА. КОМПОНЕНТ. ФАЗА
Чистые металлы находят ограниченное применение (электро- и радиотехника, электроника и т.п.), в основном используются металлические сплавы, обладающие более ценным комплексом различных свойств.
Сплав – это вещество, получаемое в результате затвердевания жидкого расплава, состоящего из двух и более элементов, или спеканием порошков методом порошковой металлургии. Металлический сплав – это вещество, обладающее металлическими свойствами, полученное путем сплавления металла с металлом или металла с неметаллом.
Система – это материальные объекты, обособленные физическими или воображаемыми границами раздела от окружающей среды и подвергнутые теоретическому и экспериментальному изучению.
Компоненты – вещества, образующие систему. Компонентами могут быть химические элементы и химические соединения, не разлагающиеся при нагреве.
Фаза – однородная часть системы, отделенная от других частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
В твердых сплавах фазами могут быть: зёрна чистого металла, зёрна твердого раствора и зёрна химического соединения. При кристаллизации чистого металла в системе 2 фазы: кристаллы металла (твёрдая фаза) и расплавленный металл (жидкая фаза).
2.2. ВИДЫ ВЗАИМОДЕЙСТВИЯ КОМПОНЕНТОВ ПРИ КРИСТАЛЛИЗАЦИИ СПЛАВОВ
Большинство металлов в жидком состоянии растворяются друг в друге в любых соотношениях. В результате образуется однородный (гомогенный) жидкий раствор с равномерным распределением атомов одного металла между атомами другого. В случае, когда металлы в жидком состоянии растворяются ограниченно или вообще не растворяются друг в друге, образуются 2 слоя несмешивающихся жидкостей.
При кристаллизации сплавов возможно различное взаимодействие их компонентов.
2.2.1. Образование твердого раствора
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решётку, а атомы других (или другого) компонентов располагаются в решётке первого компонента (растворителя), изменяя её размеры (периоды). Таким образом, твёрдый раствор, состоящий из двух или нескольких компонентов, имеет один тип решётки и представляет собой одну фазу. Различают твёрдые растворы внедрения и твёрдые растворы замещения.
а) Твёрдые растворы внедрения. При их образовании атомы растворённого компонента располагаются в междоузлиях (пустотах) кристаллической решётки растворителя. Т.к. размеры пустот невелики, то твёрдые растворы внедрения образуются только при небольшом радиусе атома растворённого компонента (элементы І и ІІ периодов). Твёрдые растворы внедрения могут быть только ограниченной концентрации ( до 1-2%).
б) Твёрдые растворы замещения. При их образовании атомы растворённого компонента замещают часть атомов растворителя в его кристаллической решётке. Большинство металлов в той или иной степени могут ограниченно растворяться друг в друге, сохраняя решётку растворителя. В тех случаях, когда компоненты могут замещать друг друга в кристаллических решётках в любых количественных соотношениях, образуется непрерывный ряд твёрдых растворов. Твёрдые растворы замещения с неограниченной растворимостью могут образоваться при соблюдении следующих условий: 1) компоненты должны иметь одинаковые по типу (изоморфные) кристаллические решётки; 2) различие в атомных радиусах ΔR компонентов должно быть незначительным и не превышать 8-15%. Но даже при соблюдении этих условий неограниченные твёрдые растворы образуются не всегда.
Т.к. и электронное строение, и размеры атомов растворителя и растворённого компонента различны, то при образовании твёрдого раствора кристаллическая решётка всегда искажается, и периоды её изменяются. При образовании твёрдого раствора замещения период решётки может увеличиться или уменьшиться в зависимости от соотношения атомных радиусов растворителя и растворённого компонента. В случае твёрдого раствора внедрения период решётки растворителя всегда возрастает.
2.2.2. Образование химического соединения
Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Характерные особенности химических соединений, образованных по закону нормальной валентности, таковы:
а) Кристаллическая решётка отличается от решёток компонентов, образующих соединение.
б) В соединении всегда сохраняется простое кратное соотношение компонентов, что позволяет выразить состав простой формулой АmBn.
в) Свойства соединения резко отличаются от свойств образующих его компонентов.
г) Температура плавления (диссоциации) постоянная.
В отличие от твёрдых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решёток.
В качестве примера типичных химических соединений с нормальной валентностью можно назвать Mg2Sn, Mg2Pb, Mg3Bi2 и др.
Соединения одних металлов с другими называются интерметаллическими соединениями или интерметаллидами.
Большинство химических соединений, образующихся в металлических сплавах, отличаются по некоторым особенностям от типичных химических соединений, т.к. не подчиняются законам валентности и не имеют постоянного состава.
2.2.3. Образование механической смеси компонент
Механическая смесь образуется тогда, когда компоненты не способны к взаимному растворению и не вступают в химическую реакцию с образованием соединения. В этом случае сплав будет состоять из смеси зёрен компонентов, т.е. не будет однофазным, как твёрдый раствор или химическое соединение.
Механическая смесь может состоять из зерен разных чистых металлов; из зёрен разных твёрдых растворов; из зёрен металла и твёрдого раствора; из зёрен металла и химического соединения; из зёрен твёрдого раствора и химического соединения; из зёрен разных химических соединений.
2.3. ДИАГРАММА СОСТОЯНИЯ. ПРАВИЛО ФАЗ
Процесс кристаллизации сплавов и связанные с ним многие закономерности строения сплавов описывают с помощью диаграмм состояния или диаграмм фазового равновесия.
Диаграмма состояния – это графическое изображение состояния любого сплава изучаемой системы в зависимости от его состава и температуры.
На практике ДС необходима при разработке технологии получения сплавов и термической обработки деталей из заданных сплавов.
Впервые теоретические основы для разработки ДС дал Дмитрий Константинович Чернов. Большой теоретический и практический вклад в изучение ДС внёс Николай Семёнович Курнаков со своими учениками.
В любой системе количество фаз, находящихся в равновесии, зависит от внутренних и внешних факторов. Закономерности всех изменений, происходящих в системе, подчинены общему закону равновесия, который называется правилом фаз или законом Гиббса.
Правило фаз выражает зависимость между числом степеней свободы С (или вариантностью), числом компонентов К и числом фаз Ф системы, находящихся в равновесии.
С = К – Ф + 2
Число 2 обозначает количество внешних факторов (температура и давление).
Для конденсированных (без учёта давления и паровой фазы) систем, какими являются почти все металлические системы, правило фаз записывается:
С = К – Ф + 1
Под числом степеней свободы системы понимают число внешних и внутренних факторов (температура, состав), которые можно изменять без изменения числа фаз в системе.
Если С = 2, то би- или дивариантная система; если С = 1 – моновариантная; если С = 0 (нонвариантная система), то данное число фаз будет находиться в равновесии только при строго определённой температуре и для строго определённого состава, и это число фаз будет максимальным для системы с данным числом компонентов. Его можно определить по формуле Ф = К + 1.
Правило фаз позволяет контролировать правильность построения ДС.
2.4. ДИАГРАММЫ СОСТОЯНИЯ ДВУХКОМПОНЕНТНЫХ (ДВОЙНЫХ) СИСТЕМ
2.4.1. ДС системы с образованием механической смеси компонентов (I тип)
tА ж tB
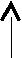



 tE А+ж Е В+ж tE`
tE А+ж Е В+ж tE`А + В
 А В
А ВЛиния tAEtB называется линией ликвидуса. Выше этой линии все сплавы находятся в жидком состоянии. Линия tAtEEtE`tB – линия солидуса. Ниже этой линии все сплавы находятся в твёрдом состоянии. Между линиями ликвидуса и солидуса в равновесии находятся жидкая и твёрдая фазы.
Сплав состава точки Е, представляющий собой механическую смесь зёрен А и В, одновременно кристаллизующихся из жидкой фазы, называется эвтектикой (с греч. легко плавящийся). Процесс кристаллизации эвтектики нонвариантный, протекающий при строго определённой температуре и у сплава строго определённого состава. В момент кристаллизации в равновесии находятся 3 фазы:
tE
жЕ А + В
ДС такого типа имеют реальные системы: Pb – Sb, Sn – Zn .
2.4.2. ДС системы с образованием неограниченных твёрдых растворов (II тип)

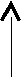
α +ж
 ж tВ
ж tВ tA
 α
αА В
ДС этого типа имеют реальные системы: Ag – Au, Cu – Ni.
2.4.3. ДС системы с образованием ограниченных твёрдых растворов (III тип)
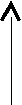
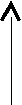

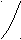 ж tB
ж tB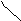
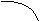 tA
tA 
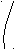
 α+ж β+ж
α+ж β+жα Е β
α + β
 А В
А ВК такому типу ДС относится система Sn – Pb.
2.4.4. ДС системы с образованием химического соединения (IV тип)
t
 ж
ж 
 tA tS
tA tS 

 tB
tB
 E1
E1A +S E2
S+B
 А S В
А S В К такому типу относится система Mg – Pb с образованием соединения Mg2Pb.
2.5. ВЗАИМОСВЯЗЬ ДИАГРАММ СОСТОЯНИЯ И СВОЙСТВ СПЛАВОВ
Между типами ДС и свойствами сплавов существует определённая взаимосвязь. Подробное исследование этой взаимосвязи было проведено Н.С.Курнаковым и его учениками.
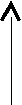
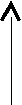
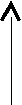
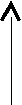
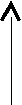
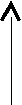
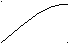

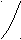 t t t t
t t t t

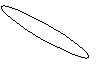
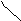
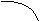



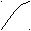
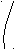

A+S S+B α A + B α α + β β



 А S B A B A B A B
А S B A B A B A B 




Н H H H





А B A B A B A B
2.6. ДИАГРАММА СОСТОЯНИЯ СИСТЕМЫ ЖЕЛЕЗО – ЦЕМЕНТИТ
Железо – серебристо-серый полиморфный, ферромагнитный ( т.Кюри 768ºС) металл с плотностью 7860 кг/м3, tпл = 1539ºС, мягкий (70-80НВ), пластичный, малопрочный (σв = 200-250 МПа).
Цементит Fe3C (карбид железа) – химическое соединение железа с углеродом имеет очень сложную ромбическую решётку с плотной упаковкой атомов. Характер связи между атомами железа – металлический, и это приводит к тому, что цементит обладает металлическими свойствами (электропроводность, металлический блеск и т.д.).
Температура плавления цементита – около 1600ºС, при низких температурах он слабо ферромагнитен (т.Кюри 217ºС). Цементит имеет высокую твёрдость (800НV), но практически нулевую пластичность. Эти свойства являются, вероятно, следствием сложного строения кристаллической решётки цементита.
Цементит способен образовывать твёрдые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: азотом, кислородом; атомы железа – металлами: Mn, Cr, W и др. Такой твёрдый раствор на базе цементита называется легированным цементитом.
Цементит – соединение неустойчивое и при определённых условиях распадается с выделением свободного углерода в виде графита.
ДС системы железо – цементит приведена на рис.
Линия ABCD – линия ликвидуса, линия AHJECFD – линия солидуса.
Феррит – твёрдый раствор углерода в α-железе и -железе.
Аустенит – твёрдый раствор углерода в γ-железе.
Ледебурит – эвтектическая смесь аустенита и цементита.
1147ºС
жС А + Ц
Перлит – эвтектоидная смесь феррита и цементита.
727ºС
АS ФР + Ц
Фазы: жидкая, феррит, аустенит, цементит.
Структурные составляющие: феррит, аустенит, перлит, ледебурит, первичный цементит, вторичный цементит.
3. ОСНОВЫ ТЕРМИЧЕСКОЙ ОБРАБОТКИ И ПОВЕРХНОСТНОГО УПРОЧНЕНИЯ СПЛАВОВ
3.1. ФОРМИРОВАНИЕ СТРУКТУРЫ И СВОЙСТВ МЕТАЛЛОВ ПРИ ДЕФОРМАЦИИ
Деформацией называется изменение формы и размеров изделия, происходящее под действием внешних и внутренних сил. Внутренние силы, приводящие к деформации, могут быть вызваны нарушением правильного расположения атомов в кристаллической решётке, обусловленным протеканием различных фазовых превращений. В общем же случае к деформации приводит приложение внешних нагрузок. Если после снятия нагрузки металл возвращается к прежней форме, то это упругая деформация. Когда при устранении внешней нагрузки металл не возвращается к своей прежней форме, деформация называется пластической.
У большинства металлов и сплавов основная часть деформации - пластическая. Пластическая деформация металлов является следствием сдвигов, происходящих внутри и по границам зёрен. Сдвиг происходит по кристаллографическим плоскостям – плоскостям скольжения. Доказано, что плоскостями наилегчайшего сдвига являются плоскости, в которых находится наибольшее количество атомов.
Пластическая деформация может осуществляться:
а) скольжением с последовательным образованием плоскости сдвига;





б) двойникованием, которое заключается в симметричном смещении одной части кристалла относительно другой под действием касательных напряжений.



 А А
А А 
АА – плоскость двойникования.
Кроме сдвига по плоскостям скольжения происходит поворот смещённых частей зерна в направлении уменьшения угла между плоскостями скольжения и действием силы. Этот поворот объясняется тем, что свободному смещению частей зерна препятствуют соседние зёрна. В результате сдвигов и поворотов зёрна вытягиваются в направлении растягивающих сил. При большой степени деформации зёрна удлиняются настолько, что напоминают волокна, и поэтому такую структуру деформированного металла называют волокнистой. Направление волокон учитывают при конструировании и разработке технологии изготовления детали, т.к. металл становится анизотропным.
С увеличением степени холодной (ниже 0,2Тпл) деформации, свойства, характеризующие сопротивление деформации (предел прочности, твёрдость и др.) повышаются, а способность к пластической деформации (пластичность) уменьшается. Это явление получило название наклёпа.
Упрочнение металла в процессе пластической деформации (наклёп) объясняется увеличением числа дефектов кристаллического строения (дислокаций, вакансий, дислоцированных атомов). Повышение плотности дефектов затрудняет движение отдельных новых дислокаций, а следовательно, повышает сопротивление деформации и уменьшает пластичность.
Наклёп возникает при обработке металлов давлением, резанием, при обкатке роликами, при специальной обработке дробью.
Металлы с ГЦК решёткой упрочняются сильнее, чем с ОЦК.
У металлов и сплавов в определённых условиях деформации может проявляться сверхпластичность.
Под сверхпластичностью понимают способность металла к значительной пластической деформации ( = 102 – 103%) в определённых условиях при одновременно малом сопротивлении деформированию. Существуют следующие разновидности сверхпластичности.
1. Структурная, которая проявляется при температурах 0,5Тпл в металлах и сплавах с величиной зерна от 0,5 до 10 мкм и небольших скоростях деформации.
2. Субкритическая (сверхплдстичность превращения), наблюдающаяся вблизи начала фазовых превращений, например, полиморфных.
Наиболее перспективен процесс структурной сверхпластичности.
Структурная сверхпластическая деформация протекает, главным образом, благодаря зёрнограничному скольжению, хотя в определённой степени существует внутризёренное дислокационное скольжение.
Явление сверхпластичности в промышленности используют при объёмной изотермической штамповке и при пневмоформовке. Сверхпластичность позволяет в процессе штамповки за одну операцию получить детали сложной формы, повысить коэффициент использования металла, уменьшить трудоёмкость и стоимость изготовления изделий. Недостатком являются необходимость нагрева штампов до температуры обработки и малая скорость деформации.
БОльшая часть работы (до 95%), затрачиваемой на деформацию металла, превращается в теплоту(металл нагревается), остальная часть энергии аккумулируется в металле в виде повышенной плотности несовершенств строения (дислокаций, вакансий и т.д.). В связи с этим состояние наклёпанного металла термодинамически неустойчиво. При нагреве такого металла в нём протекают процессы возврата и рекристаллизации, обусловливающие возвращение к свойствам металла до деформации.
Возвратом называется процесс частичного восстановления структурного совершенства и свойств деформированных металлов и сплавов при их нагреве ниже температур рекристаллизации. Возврат используется для повышения пластичности наклёпанных металлов и термической стабильности структуры и свойств. Возврат имеет две разновидности:
1. Отдых – снятие искажений решётки в процессе незначительного нагрева (для Fe 300-400ºС). В результате твёрдость и прочность несколько понижаются, а пластичность возрастает.
2. Полигонизация, заключающаяся в том, что беспорядочно расположенные внутри зерна дислокации собираются, образуя сетку и создавая ячеистую структуру, которая может быть устойчивой и затруднить процессы, развивающиеся при более высокой температуре.
При дальнейшем повышении температуры подвижность атомов возрастает, и при достижении определённой температуры (Трекр 0,4 Тпл) образуются новые равноосные зёрна.
Рекристаллизацией называется образование и рост одних зёрен за счёт соседних зёрен той же фазы.
Первичная рекристаллизация заключается в образовании новых зёрен. Это мелкие зёрна, возникающие на поверхности раздела крупных деформированных зёрен. Вновь образующиеся зёрна свободны от дефектов.
Вторичная рекристаллизация (собирательная) заключается в росте зёрен.
В результате рекристаллизации наклёп практически полностью снимается, и свойства приближаются к их исходным значения.
3.2. КЛАССИФИКАЦИЯ ВИДОВ ТЕРМИЧЕСКОЙ ОБРАБОТКИ
Процесс тепловой обработки металлических изделий с целью придания им заданной структуры и свойств называется термической обработкой (ТО).
Основные факторы воздействия при ТО – температура (t) и время (), поэтому режим любой ТО можно представить графически в координатах t -
t,ºС
 tф.п.
tф.п.


)
 ,с
,сРежим ТО характеризуют следующие основные параметры: температура нагрева tmax, т.е. максимальная температура, до которой был нагрет металл при ТО, время выдержки при tmax - в; скорость нагрева vнагр и скорость охлаждения vохл.
vнагр = t/ = tgα
Все виды ТО можно разделить на 4 основные группы (по А.А.Бочвару).
3.2.1. Отжиг I рода
Это термическая операция, состоящая в нагреве металла, имеющего неустойчивое состояние в результате предшествовавшей обработки, и приводящая в более устойчивое состояние.
Так, предшествующая обработка, например холодная пластическая деформация, создаёт наклёп – искажение кристаллической решётки. При затвердевании твёрдого раствора не успевают протекать диффузионные процессы, и возникает внутрикристаллитная ликвация, когда состав сплава даже в объёме одного зерна оказывается неоднородным. Быстрое охлаждение или неравномерное приложение напряжений делает неравномерным приложение упругой деформации. Неустойчивое состояние при комнатной температуре сохраняется долго, т.к. теплового движения атомов при этой температуре недостаточно для перехода в устойчивое состояние. Нагрев (увеличение тепловой подвижности атомов) способствует тому, что процессы, приводящие металл в устойчивое состояние (снятие напряжений, уменьшение искажений кристаллической решётки, рекристаллизация, диффузия), достигают заметных скоростей.
В зависимости от вида неустойчивого состояния различают следующие разновидности отжига I рода: диффузионный или гомогенизирующий, рекристаллизационный и для снятия внутренних напряжений.
3.2.2. Отжиг II рода
Это термическая операция, состоящая в нагреве выше температуры фазового превращения с последующим достаточно медленным охлаждением для получения структурно устойчивого состояния сплава.
Если в сплаве при нагреве происходит фазовое превращение (полиморфное превращение, растворение второй фазы, эвтектоидное превращение и т.д.), то нагрев выше некоторой критической температуры вызывает изменение в строении сплава. При последующем охлаждении произойдёт обратное превращение. Если превращение будет неполным, то сплав заново нагревают выше фазового превращения и охлаждают достаточно медленно, чтобы достичь полного превращения и равновесного фазового состава. Отжиг II рода называют ещё фазовой перекристаллизацией.
3.2.3. Закалка
Это термическая операция, состоящая в нагреве выше температуры фазового превращения с последующим достаточно быстрым охлаждением для получения структурно неустойчивого состояния сплава.
Таким образом, закалка прямо противоположна отжигу II рода. Теоретически можно представить себе такие условия охлаждения, при которых обратное превращение не произойдёт, и при комнатной температуре в результате быстрого охлаждения зафиксируется состояние сплава, характерное для высоких температур. Если такое произойдёт, то закалка будет называться истинной. Но в большинстве случаев фиксируется не состояние сплава при высокой температуре, а некоторая его стадия структурного превращения, при которой в сплаве ещё не достигнуто равновесное состояние.
3.2.4. Отпуск
Это термическая операция, состоящая в нагреве закалённого сплава ниже температуры фазового превращения для получения более устойчивого состояния.
Состояние закалённого сплава характеризуется неустойчивостью. Даже без всякого температурного воздействия в сплаве могут происходить процессы, приближающие его к равновесному состоянию. Нагрев, увеличивающий подвижность атомов, способствует этим процессам. Отпуск, если он происходит при комнатной температуре или при незначительном нагреве, называется старением.
Таким образом, отпуск – вторичная операция, осуществляемая всегда после закалки.
3.3. ОСНОВЫ ТЕОРИИ ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ
П
 ри выборе режима ТО сплавов основой является соответствующая ДС, и, очевидно, что основой для изучения ТО стали является ДС системы Fe – Fe3C, точнее её часть до 2,14% С.
ри выборе режима ТО сплавов основой является соответствующая ДС, и, очевидно, что основой для изучения ТО стали является ДС системы Fe – Fe3C, точнее её часть до 2,14% С. 

 1147˚
1147˚ 
 E
E А
9
 11º G Acm
11º G AcmAc3
А+Ф A+Ц(II)
Ф Ac1 727º

 P S K
P S KФ+П П+Ц(II)

Fe 0,8 2,14
→ %С
Критические точки, отвечающие фазовым превращениям, обозначаются буквой А. Нижние критические точки Ас1 лежат на линии PSK и соответствуют превращению А П. Верхние критические точки Ас3 для доэвтектоидных сталей лежат на линии GS и соответствуют превращению феррита в аустенит; для заэвтектоидных сталей критические точки Аcm лежат на линии ES и соответствуют концу растворения вторичного цементита в аустените.
При ТО стали наблюдаются 4 основных превращений:
I П → А Feα + Fe3C → Feγ(С)
II А → П Feγ(С) → Feα + Fe3C
III А →М Feγ(С) → Feα(С)
IV М → Ф + Ц Feα(С) → Feα + Fe3C
3.3.1. Превращение перлита в аустенит
Превращение П → А в полном соответствии с ДС системы Fe – Fe3C может совершаться лишь при очень медленном нагреве. При обычных условиях нагрева превращение запаздывает, и получается перегрев, т.е. превращение происходит при температурах несколько более высоких, чем по диаграмме.
Перегретый выше Ас1 перлит с различной скоростью в зависимости от степени перегрева превращается в аустенит. Например, при быстром нагреве и выдержке при 780ºС превращение П → А завершается за 2 мин., а при 740ºС – за 8 мин.
При перлитно-аустенитном превращении первые зёрна аустенита образуются на границе между Ф и Ц – структурными составляющими П. Т.к. эта граница весьма разветвлена, то превращение начинается с образования множества мелких зёрен. Размер таких зёрен характеризует так называемую величину начального зерна аустенита.
Дальнейший нагрев (или выдержка) по окончании превращения вызывает рост аустенитных зёрен. Рост зерна – самопроизвольно протекающий процесс, т.к. при этом уменьшается суммарная поверхность зёрен (уменьшается поверхностная энергия), высокая температура обеспечивает лишь достаточную скорость.
Различают 2 типа сталей: наследственно мелкозернистые (НМЗ) и наследственно крупнозернистые (НКЗ); первые характеризуются малой склонностью к росту зерна, вторые – повышенной склонностью.
Т.о., различают: 1) начальное зерно – размер зерна А в момент окончания перлитно-аустенитного превращения; 2) наследственное (природное) зерно – склонность аустенитных зёрен к росту; 3) действительное зерно – размер зерна А в данных конкретных условиях.
 НКЗ
НКЗ9
 00-950º НМЗ
00-950º НМЗ DА
DА 








 727º
727º DП
Аустенитные зёрна растут только при нагреве (при последующем охлаждении они не измельчаются), поэтому максимальная температура нагрева стали в аустенитном состоянии и её наследственная зернистость определяют окончательный размер зерна.
Укрупнение зерна А в стали сильно снижает ударную вязкость.
3.3.2. Превращение аустенита в перлит. (Распад аустенита.)
Feγ(С) → Feα + Fe3C
Превращение может начаться лишь при некотором переохлаждении. Чем больше переохлаждение, тем быстрее происходит превращение ГЦК решётки в ОЦК. В случае перлитного превращения образуются фазы, резко отличающиеся по составу от исходной: феррит, почти не содержащий углерода, и цементит, содержащий 6,67% С. Поэтому превращение А → П сопровождается диффузией, перераспределением углерода. Скорость диффузии резко уменьшается с понижением температуры, следовательно, с этой точки зрения увеличение переохлаждения должно замедлять превращение. Итак, при увеличении переохлаждения вступают в борьбу два фактора, прямо противоположно влияющих на скорость превращения. Суммарное действие обоих факторов приводит к тому, что вначале с увеличением переохлаждения скорость превращения возрастает, достигает при каком-то значении максимума и затем убывает.
Если нанести на диаграмму t - точки, соответствующие началу превращения (время «инкубационного периода») а и концу превращения b, плавно соединить их, то получим так называемые С – кривые превращения аустенита.
 Свойства и строение продуктов превращения аустенита зависят от температуры, при которой происходил процесс его распада. При высоких температурах, т.е. при малых степенях переохлаждения (малых скоростях охлаждения), получается достаточно грубая смесь Ф и Ц. Эта смесь называется перлитом. При более низких температурах, т.е при бОльших степенях переохлаждения, дисперсность структур возрастает, и повышаются механические свойства. Такой более тонкого строения перлит получил название сорбита. Ещё более дисперсный продукт, получающийся при температурах вблизи изгиба С-кривой, называется трооститом. Т.о., Перлит, сорбит и троостит – это структуры с одинаковым фазовым составом (Ф+Ц), отличающиеся степенью дисперсности.
Свойства и строение продуктов превращения аустенита зависят от температуры, при которой происходил процесс его распада. При высоких температурах, т.е. при малых степенях переохлаждения (малых скоростях охлаждения), получается достаточно грубая смесь Ф и Ц. Эта смесь называется перлитом. При более низких температурах, т.е при бОльших степенях переохлаждения, дисперсность структур возрастает, и повышаются механические свойства. Такой более тонкого строения перлит получил название сорбита. Ещё более дисперсный продукт, получающийся при температурах вблизи изгиба С-кривой, называется трооститом. Т.о., Перлит, сорбит и троостит – это структуры с одинаковым фазовым составом (Ф+Ц), отличающиеся степенью дисперсности.Образующаяся ниже изгиба С-кривой игольчатая структура получила название бейнит.
3.3.3. Мартенситное превращение
Если аустенит переохладить до таких температур, когда решётка Feγ, несмотря на наличие растворённого в ней углерода, неустойчива, а скорость диффузии углерода вследствие низких температур так мала, что с ней можно не считаться, то происходит перестройка решётки без выделения углерода:
Feγ(С) → Feα(С)
В аустенитно-перлитном превращении ведущую роль играет диффузия углерода, и превращение следует называть диффузионным.
При аустенитно-мартенситном превращении происходит только перестройка решётки без изменения концентрации фаз. Превращение является бездиффузионным.
Мартенсит – это пересыщенный твёрдый раствор углерода в Feα с такой же концентрацией, как и у исходного аустенита.
Для кристаллической структуры мартенсита характерна тетрагональность, т.е. то, что отношение осей с/а 1.
Мартенситное превращение в сталях необратимо. Кроме того, кристаллы мартенсита, независимо от температуры, образуются за очень короткий отрезок времени, т.е. практически мгновенно. Превращение А в М начинается при температуре Мн и заканчивается при температуре Мк. При этой температуре остаётся ещё какое-то количество остаточного аустенита. Охлаждение ниже Мк не вызывает дальнейшего превращения и не уменьшает количества остаточного аустенита. Мартенситное превращение происходит при закалке стали.
Углерод интенсивно снижает температуру начала и конца мартенситного превращения. При содержании углерода свыше 0,5% конец мартенситного превращения уходит в область отрицательных температур. Для стимулирования дополнительного образования мартенсита применяется обработка холодом (от –40 до –100ºС), которую проводят сразу же после окончания закалки, пока не произошла стабилизация остаточного аустенита. Этот метод был разработан и впервые применён в СССР Александром Павловичем Гуляевым в 1937 г.
Некоторые легирующие элементы снижают температуру начала мартенситного превращения ниже 0ºС, и закалкой можно получить только аустенитную структуру.
Бейнитное превращение переохлаждённого аустенита происходит в температурном интервале, расположенном ниже перлитного, но выше мартенситного, поэтому его часто называют промежуточным. Превращение имеет черты перлитного и мартенситного, поэтому его не относят к основным видам. Механизм бейнитного превращения более сложный, чем перлитного и мартенситного.
3.3.4. Превращения в закалённой стали при нагреве
Закалённая сталь состоит из тетрагонального мартенсита и остаточного аустенита. Мартенсит является структурой, обладающей наибольшим объёмом, а аустенит – структурой с минимальным объёмом, поэтому превращения должны совершаться с объёмными изменениями. При превращении мартенсита объём будет уменьшаться, а при превращении аустенита – увеличиваться.
Дилатометрическая кривая фиксирует превращения при отпуске. (Дилатометр – прибор, при помощи которого изучают изменения длины образца при нагреве и охлаждении).
Начиная от 80ºС и вплоть до 200ºС наблюдается сокращение длины. Это так называемое первое превращение при отпуске. Получающийся при таком низком отпуске мартенсит, у которого отношение с/а близко к 1, называется отпущенным мартенситом. Уменьшение тетрагональности можно объяснить выделением углерода из твёрдого раствора. Образуется метастабильный ε–карбид, отличающийся от цементита (ε–карбид имеет гексагональную решётку и формулу, близкую к Fе2С).
Дальнейший нагрев выше 200ºС приводит к иному превращению, вызывающему расширение стали. Это, так называемое второе превращение при отпуске, захватывает интервал температур 200-300ºС. В этом интервале остаточный аустенит превращается в гетерогенную смесь мартенсита и ε-карбида, т.е. в отпущенный мартенсит.
Наступающее при дальнейшем повышении температуры сжатие указывает на полное выделение избытка углерода из твёрдого раствора на основе Feα и снятия внутренних напряжений, возникших в результате предыдущих превращений, сопровождавшихся объёмными изменениями. Одновременно ε-карбид обособляется и превращается в цементит. Сумма этих изменений характеризует так называемое третье превращение при отпуске.
При 400ºС третье превращение заканчивается, и сталь состоит из феррита и цементита, но цементит имеет зернистую форму, тогда как при распаде аустенита – пластинчатую. Различная форма цементита в феррито-цементитной смеси предопределяет и различие в свойствах.
Дальнейший нагрев приводит лишь к укрупнению зёрен.
3.4. ТЕХНОЛОГИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ
3.4.1. Отжиг I рода
1) Гомогенизация или диффузионный отжиг (1000-1200ºС) проводится для слитков и отливок высоколегированных сталей, склонных к ликвации. (Крупное зерно устраняется последующей ТО).
2) Рекристаллизационный отжиг (600-700ºС) осуществляется для снятия наклёпа после холодной пластической деформации.
3) Отжиг для снятия внутренних напряжений (300-400ºС) проводят с целью уменьшения напряжений, образовавшихся в металле при ковке, литье, сварке, способных вызвать коробление и разрушение деталей.
3.4.2. Отжиг II рода
1) Полный отжиг: Ас3 + (30…50ºС).
Обеспечивает полную фазовую перекристаллизацию стали. Медленное охлаждение вместе с печкой приводит к распаду аустенита. Для доэвтектодных сталей проводят с целью уменьшения зерна. Повышаются пластические свойства и обрабатываемость резанием.
Разновидностью полного отжига для заэвтектоидных сталей является нормализация: Асm + (30…50ºС), при которой охлаждение проводят на спокойном воздухе, что создаёт более быстрое охлаждение, и образуется более мелкая структура. Нормализация повышает механические свойства стали (прочность, твёрдость), а также является вспомогательной операцией перед закалкой.
2) Неполный отжиг: Ас1 + (10…30ºС).
К доэвтектоидным сталям применяется лишь тогда, когда требуется не исправление структуры, а только снижение твёрдости и напряжений.
Для заэвтектоидных сталей, имеющих структуру А + Ц(II), неполный отжиг применяется для сфероидализации вторичного цементита и разрушения цементитной сетки, которая ухудшает обрабатываемость.
3) Изотермический отжиг.
Сталь, нагретая выше Ас3 или Ас1, быстро охлаждается на 50-100º ниже Ас1 и при этой температуре выдерживается столько, сколько необходимо для полного распада аустенита (выдерж. = 2…5 час.), затем охлаждается на спокойном воздухе. В результате улучшается структура.
3.4.3. Закалка
Оптимальной является закалка для доэвтектоидной стали: Ас3 + (30…50ºС), а для заэвтектоидной стали: Ас1 + (30…50ºС). Повышение температуры закалки выше этих температур вызывает рост зёрен аустенита, что ведёт к получению более грубой и крупноигольчатой структуры мартенсита. Следствием такого строения является низкая ударная вязкость.
При закалке для переохлаждения аустенита до температуры мартенситного превращения требуется быстрое охлаждение, но не во всём интервале температур, а только в пределах 650-400ºС, т.е. в том интервале, в котором аустенит менее всего устойчив, быстрее всего распадается на феррит и цементит. А в мартенситном интервале, начиная с 300-200ºС, желательно замедленное охлаждение, чтобы к значительным структурным напряжениям не прибавились термические напряжения, возникающие в результате быстрого охлаждения.
Механизм действия закалочных сред, которыми могут служить вода, водные растворы щелочей и солей, масло, следующий:
В момент погружения изделия в закалочную среду вокруг него образуется плёнка перегретого пара, охлаждение происходит через слой этой паровой рубашки, т.е. относительно медленно. Когда температура поверхности достигает некоторого значения (определяемого составом закалочной жидкости), при котором паровая рубашка разрывается, то жидкость начинает кипеть на поверхности детали, и охлаждение происходит быстро.
Первый этап относительно медленного охлаждения называется стадией плёночного кипения, второй этап быстрого охлаждения – стадией пузырькового кипения. Когда температура поверхности металла станет ниже температуры кипения жидкости (при охлаждении в воде – ниже 100˚С), жидкость кипеть уже не будет, и охлаждение замедлится. Этот третий этап называется стадией конвективного теплообмена. Закалочная жидкость охлаждает тем интенсивнее, чем шире интервал пузырькового кипения.
При закалке скорость охлаждения распределяется по сечению так, что у поверхности скорость охлаждения максимальная, а в центре – минимальная.
Под прокаливаемостью понимают глубину проникновения закалённой зоны. Этот термин не следует путать с закаливаемостью, которая характеризуется максимальным значением твёрдости, приобретаемой сталью в результате закалки. Закаливаемость зависит главным образом от содержания углерода.
Для практической оценки прокаливаемости пользуются величиной, которая называется критическим диаметром (Dк). Это максимальный диаметр цилиндрического прутка, который прокаливается насквозь в данном охладителе.
В зависимости от состава стали, формы и размеров детали, а также требуемых для термически обработанной детали свойств следует выбирать оптимальный способ закалки, наиболее просто осуществимый и одновременно обеспечивающий нужные свойства.
Основные способы закалки:
1).Закалка в одном охладителе.
Нагретую до определённой температуры деталь погружают в закалочную жидкость, где она остаётся до полного охлаждения. Это способ применяют при закалке несложных деталей из углеродистых и легированных сталей. Для уменьшения внутренних напряжений деталь иногда не сразу погружают в закалочную жидкость, а некоторое время охлаждают на воздухе, «подстуживают». Такой способ называется закалкой с подстуживанием.
2) Прерывистая закалка в двух средах.
Деталь охлаждают сначала в быстро охлаждающей среде, а затем в медленно охлаждающей. Этот способ применяют при закалке инструмента из высокоуглеродистых сталей (например, вода – масло). В мартенситном интервале сталь охлаждается медленно, что способствует уменьшению внутренних напряжений.
3) Струйчатая закалка.
Заключается в обрызгивании детали интенсивной струёй воды. Обычно её применяют тогда, когда требуется закалить часть детали. При этом способе не образуется паровая рубашка, что обеспечивает более глубокую прокаливаемость, чем простая закалка в воде.
4) Закалка с самоотпуском.
Охлаждение изделия в закалочной среде прерывают, когда в его сердцевине остаётся некоторое количество теплоты. Оставшееся тепло распространяется от центра к периферии и нагревает поверхностный слой, т.е. происходит самоотпуск. Применяется такая закалка для обработки ударного инструмента (зубил, кузнечного инструмента и др.), когда требуется постепенное понижение твёрдости от поверхности изделия к его центру.
3.4.4. Отпуск
Это вид ТО, заключающийся в нагреве закалённой стали до температуры ниже Ас1, выдержке и последующем медленном охлаждении. Является окончательной операцией ТО.
Виды отпуска:
1) Низкий отпуск (150-250˚С).
Мартенсит закалки превращается в отпущенный мартенсит, который имеет меньшие внутренние напряжения, меньшую хрупкость и ту же или более высокую твёрдость (HRC 58…63). Применяется для измерительного и режущего инструмента.
2) Средний отпуск (350-450˚С).
Даёт зернистую трооститную структуру, обладающую достаточно высокой твёрдостью(НRС 40…50), очень высокой упругостью и достаточной прочностью. Применяется для массивных пружин и рессор, штампов.
3) Высокий отпуск (500-680˚С).
Практически полностью снимает внутренние напряжения, даёт зернистую сорбитную структуру с благоприятным сочетанием пластических и прочностных свойств при твёрдости HRC 30…40. Резко повышается ударная вязкость. Такая обработка (закалка + высокий отпуск) называется улучшением.
3.5. ПОВЕРХНОСТНАЯ ЗАКАЛКА СТАЛИ
Для получения большой твёрдости в поверхностном слое детали с сохранением вязкой сердцевины, что обеспечивает износостойкость и одновременно высокую динамическую прочность детали, применяют поверхностную закалку.
Известно несколько способов быстрого нагрева поверхностного слоя (токами высокой частоты, лазером, электронно-лучевой, газо-плазменный и др.). Наибольшее применение нашёл индукционный нагрев ТВЧ.
Поверхностная закалка заключается в быстром нагреве поверхностного слоя обрабатываемой детали с последующим быстрым охлаждением. Быстрый нагрев создаёт резкий градиент температур: поверхность имеет температуру выше Ас3, а сердцевина – гораздо ниже.
После быстрого охлаждения поверхностные слои получают полную закалку, а сердцевина либо неполную, либо совсем не закаливается.
ТВЧ закалка легко поддаётся автоматизации, позволяет осуществлять нагрев со скоростями, в сотни и тысячи раз превышающими скорости нагрева в печах; поверхность не успевает окислиться и обезуглеродиться.
После поверхностной закалки и низкого отпуска поверхность изделий имеет твёрдость НRС 54…58 при высокой вязкости. Применяется для обработки коленчатых валов, шестерён, валков холодной прокатки и др.
3.6. ТЕРМОМЕХАНИЧЕСКАЯ ОБРАБОТКА СТАЛИ
Термомеханическая обработка (ТМО) заключается в совмещении двух способов упрочнения – пластической деформации и фазовых изменений.
Применительно к стали ТМО заключается в наклёпе аустенита с последующим его мартенситным превращением.

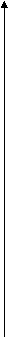 tºС
tºС

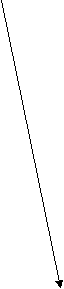
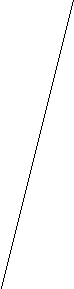
 /\/\/
/\/\/


←ВТМО

ПТМО→
 /\/\/\/\/\/\ ← НТМО
/\/\/\/\/\/\ ← НТМО  Мн
Мн
 Мк
Мк/\/\/\/\

Виды ТМО:
1) Высокотемпературная ТМО (ВТМО) состоит в деформировании аустенита выше Ас3 и быстром охлаждении.
2) Низкотемпературная ТМО (НТМО) состоит в нагреве выше Ас3, быстром охлаждении до начала мартенситного превращения, деформировании при этой температуре и более медленном охлаждении в области мартенситного превращения.
3) Предварительная ТМО (ПТМО) состоит в деформировании стали до начала ТО, но в результате быстрого нагрева до аустенита и быстрого охлаждения деформированное состояние в той или иной мере сохраняется.
Объединяет все виды ТМО то, что аустенит в результате пластической деформации претерпевает изменения, которые в какой-то степени (может даже полностью) передаются мартенситу.
3.7. ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА СТАЛИ
Химико-термическая обработка (ХТО) – это технологический процесс насыщения поверхностного слоя изделия каким-либо элементом путём диффузии его из внешней среды.
Механизм насыщения металла представляет собой: а) адсорбцию атомов, подводимых к изделию; б) растворение адсорбированных атомов в металле; в) диффузию растворённого вещества в глубь изделия.
ХТО проводят при высоких температурах, когда скорость диффузии высока. В результате происходит поверхностное упрочнение металла, повышение коррозионной стойкости.
К наиболее распространённым методам ХТО относятся: цементация, азотирование, цианирование, нитроцементация, диффузионная металлизация.
3.7.1. Цементация
Это насыщение поверхностного слоя стали углеродом.
Различают цементацию твёрдыми углеродсодержащими смесями (карбюризаторами) и газовую.
Цементацию твёрдым карбюризатором проводят при 900-950˚С в металлическом ящике, наполненном карбюризатором (древесным углем с добавлением BaCO3, Na2CO3, K2CO3). Ящик закрывают крышкой и обмазывают глиной для герметизации. Время процесса 8-14 часов.
ВаСО3 = ВаО + СО2
СО2 + С → 2СО → С + СО2
уголь атомарный
углерод
Газовая цементация осуществляется в закрытых камерных печах, заполненных газовой смесью (СО, СН4, С3Н8 и др.), при 930-950˚С в течение 6-12 часов. Процесс идёт быстрее. Механизм такой же:
2СО → СО2 + С (атомарный)
СН4 → 4Н + С (атомарный)
Цементированные изделия приобретают окончательные свойства после ТО: закалки и низкого отпуска.
Цементируют истирающиеся детали машин, от которых ещё требуется высокий предел выносливости при изгибе и кручении: зубчатые колёса, распределительные валы двигателей внутреннего сгорания.
3.7.2. Азотирование
Это процесс насыщения поверхности изделия азотом.
NH3 N + 3H
(атомарный)
Наибольший эффект получают при образовании на поверхности специальных термически стойких и твёрдых карбонитридов Fe(CN) и нитридов MoN, CrN, AlN, позволяющих одновременно повысить коррозионную стойкость, твёрдость и износостойкость стали при комнатной и повышенных температурах.
3.7.3. Цианирование и нитроцементация стали
Процесс одновременного диффузионного насыщения поверхности стали углеродом и азотом в расплаве солей цианистоводородной кислоты (NaCN, KCN) называется цианированием, а в газовой среде (СО, СН4, NH3) – нитроцементацией.
В результате обработки увеличиваются твёрдость и износостойкость поверхности изделия при сохранении вязкой сердцевины. Обычно нитроцементации подвергают детали сложной конфигурации, склонные к короблению.
3.7.4. Диффузионная металлизация
Процесс поверхностного насыщения стали различными металлами называют диффузионной металлизацией, а если насыщают и неметаллическими элементами, то поверхностным легированием.
В зависимости от насыщающего элемента различают хромирование (Cr), алитирование (Al), силицирование (Si), борирование (В) и др. Применяют также комплексное насыщение несколькими элементами сразу (например, бороалитирование).
