Тема урока: «Серная кислота и ее соли» Цель урока
| Вид материала | Урок |
- Тема урока: Алкены. Получение, химические свойства и применение алкенов. Цели и задачи, 108.44kb.
- «Серная кислота и ее отрицательное воздействие на среду», 103.82kb.
- Серная кислота справочные данные, 123.28kb.
- Тема урока: Нестандартные методы решения уравнений. Цель урока, 24.43kb.
- Урока Тема, цель, и структура урока, 23.7kb.
- Тема урока: География машиностроения. Обобщающее повторение. Цель урока, 110.96kb.
- Тема урока: Нашествие персидских войск на Элладу Цель и задачи урока, 92.33kb.
- Тема урока. Дом, семья Мелеховых. Цель урока, 42.44kb.
- Тема урока: «соли аммония», 22.5kb.
- Тема урока: Древняя история Цель урока, 57.62kb.
Тема урока: «Серная кислота и ее соли»
Цель урока: ознакомить учащихся со свойствами серной кислоты и ее солей с точки зрения электролитической диссоциации.
Ход урока.
- Организационный момент.
II. Повторение. Групповая работа с последующим обсуждением.
1. Определите, какое сырье используется для производства серной кислоты:
А) железный колчедан;
Б) мирабилит;
В) гипс;
Г) сера;
Д) вода;
Е) кислород.
Ответ: А, Г, Д, Е.
2. Укажите, какие химические процессы лежат в основе первой стадии производства серной кислоты:
А) H2S + O2;
Б) FeS2 + O2;
В) S + O2;
Г) SO2 +O2;
Д) SO3 + H2O.
Ответ: Б, В.
3. Укажите, какой химический процесс лежит в основе второй стадии производства серной кислоты:
А) H2S + O2;
Б) FeS2 + O2;
В) S + O2;
Г) SO2 +O2;
Д) SO3 + H2O.
Ответ: Г.
4. Укажите, какой процесс происходит на третьей стадии производства серной кислоты:
А) H2S + O2;
Б) FeS2 + O2;
В) S + O2;
Г) SO2 +O2;
Д) SO3 + H2O.
Ответ: Д.
5. Допишите схему:
Пирит → ? → ? → серная кислота
Ответ: FeS2 → SO2 → SO3 → H2SO4
6. По приведенному уравнению дайте характеристику реакции.
V2O5
2 SO2 +O2 ↔ 2 SO3 + 94,4 кДж
Ответ: соединения, обратимая, экзотермическая, каталитическая
III. Изучение нового материала.
(Работа в группах «Составление характеристики свойств серной кислоты и ее солей)
Сегодня мы заканчиваем изучение элементов третьего периода таблицы Д.И. Менделеева.
В «следственной камере (колба) находится промокший до нитки «шпион» (химическое вещество).
Используя различные «документы» и «следственные материалы» мы попробуем составить секретное «досье» на этого «шпиона»
«Шпион» был пойман во время дождя около химического завода. Фотоматериалы данного момента вы видите на доске. (рис. 19.8 учебника)
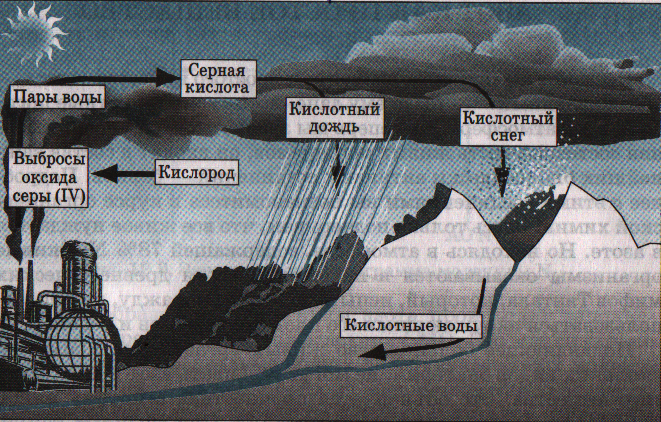
Предполагается, что место рождения «шпиона» - завод, около которого он был захвачен.
В папке 9 класс откройте файл «Досье».
Заполняя бланк «досье» вы будете вписывать данные с подчеркнутым начертанием.
Попробуем установить родителей «шпиона». Это сырье для III стадии производства серной кислоты.
1. Родители
Отец SO3
Мать H2O
Именем «шпиона» является класс химического вещества.
2. Имя «шпиона» кислота
Фамилией название кислоты
3. Фамилия «шпиона» серная
Послушаем историческую справку.
Самой первой кислотой, которую научился получать и использовать человек, была, видимо, уксусная. Упоминания о ней можно найти в древнейших рукописях. Само слово «кислота» (по латыни acid) скорее всего произошло от латинского названия уксуса acetum).
Почему уксусная кислота оказалась первой, понять не трудно. С древнейших времен люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Вначале его видимо выбрасывали, потом научились использовать как лекарство, приправу к пище, как растворитель красок.
С серной кислотой люди познакомились значительно позже, примерно в Х в. Честь ее открытия приписывается персидскому химику Абубекеру-аль-Рези. Но это установлено не совсем точно. По крайней мере, серную кислоту человек знает около 1000 лет.
Гораздо раньше люди научились использовать ее соли. В красильном производстве еще издавна применялись квасцы – вещества, состоящие из сульфата калия и сульфата алюминия. Без предварительной обработки ткани в растворе квасцов, многие красители вообще не впитывались тканью, как, например, вода не впитывается куском жира. Квасцы были дорогими, ввозились в Европу из Африки. Поэтому химики исследовали их состав, чтобы попытаться получить их искусственно. При исследовании квасцов удалось выделить квасцовый спирт – так называли тогда серную кислоту. Позднее ее выделили и из купоросов, например, из железного купороса, и, соответственно, назвали «купоросным маслом». Именно под таким названием серная кислота была известна в России.
Продолжим заполнение «досье»
Фотографией в полный рост «шпиона является его химическая формула.
4. Фотография в полный рост.
Химическая формула H2SO4
Посмотрим фрагмент. Диск «Общая и неорганическая химия»
Элементы VI группы Кислород и Сера.
Тема 6. Кислород содержащие кислоты серы.
Фрагмент 6.
Структурная формула
О
│
HO – S – OH
│
О
Уравнение диссоциации
H2SO4 = 2H+ + SO42-
Фотографией в фас является катион кислоты.
5. Фотография в фас
H+
Фотографией в профиль анион.
6. Фотография в профиль
SO42-
Профессиональные качества проявляются в силе электролита.
7. Профессиональные качества сильный электролит
Попробуем составить родословную «шпиона». Его родословной является цепочка превращений по которой можно получить вещество.
8. Родословная
FeS2 → SO2 → SO3 → H2SO4
9. «Шпион» может быть очень опасен. Степень опасности.
(правила техники безопасности при приготовлении раствора серной кислоты)
Кислоту нужно небольшими порциями вливать в воду.
В чем же проявляются преступления серной кислоты? Послушаем свидетелей.
Свидетель №1.
В 30-е годы экспедиция под руководством крупнейшего отечественного геохимика В.Е.Ферсиана обнаружила «естественный завод» Серной Кислоты. В центре пустыни Каракумы были открыты многочисленные холмы, состоящие из смеси песка и серы. Геологи набрали большое количество образцов серы. Как и положено в таких случаях, образцы завернули в бумагу, снабдили этикетками, упаковали в ящики и, окончив экспедицию, отправили в институт. Когда же по прибытии стали распаковывать образцы, многие этикетки оказались чем-то изъедены, ящики местами прожжены, а из некоторых кусков серы капала маслянистая жидкость. Разгадка пришла довольно скоро. В условиях жаркой пустыни сера довольно легко окисляется в SO2, а затем в SO3 под действием атомарного кислорода, образующегося при интенсивной солнечной радиации. Катализаторами являются оксиды металлов, содержащиеся в песке. Получившийся SO3, «жадно» поглощая ночную влвгу, быстро превращается в кислоту. Вот таким образом шпион Серная Кислота нанес ущерб экспедиции ученых.
Свидетель №2.
Несколько позднее выяснилось, что Серная Кислота – главный загрязнитель атмосферы. Значительные количества сернистого газа выбрасывают вулканы. Например, бездействующий 600 лет вулкан Эль-Чигон в Мексике, когда «проснулся», четыре дня извергался, потом взорвался. В итоге через месяц в стратосфере образовалось облако, содержащее примерно 20млн. тонн серной кислоты в виде аэрозоля. Через год облако все еще содержало около 8 млн. тонн серной кислоты и продолжало путешествовать по стратосфере.
Аналогично загрязняют атмосферу и наши камчатские вулканы. Кроме вулканов в настоящее время промышленность всего мира выбрасывает в атмосферу 130-150 млн. тонн SO2. Это, кстати, вдвое больше, чем его расходуется на промышленное производство серной кислоты.
Свидетель №3.
Шпион Серная Кислота из атмосферы тут же возвращается на землю в виде кислотных дождей. Поскольку жить под таким «душем» не очень приятно, предприниматели Англии, Франции и ФРГ стали строить на своих заводах и ТЭС дымовые трубы высотой 400м и более. На какое-то время это их спасало. Южные ветры, подхватывали выходящие из труб газы, уносили их прочь. Но… Земля не бесконечна. Тысячи тонн «английских, французких и немецких» газов обрушились на Южную Скандинавию, из-за чего на каждый квадратный километр суши там стало выпадать с осадками несколько тонн серной кислоты в год. Это привело к массовому заболеванию лесов, особенно хвойных, оголению горных склонов, эрозии почвы и смыванию плодородного слоя дождями. Кроме того, произошло почти полное уничтожение рыбы в озерах. Из 150 обследованных в Норвегии озер 145 осталось без рыбы.
«Шпион» может быть связан со следующими «агентами»: (список написан на доске) серебром, цинком, медью, оксидом углерода (IV), оксидом меди (II), гидрооксидом железа (III), карбонатом натрия.
10. Список «агентов» и возможные взаимодействия с ними.
Цинк, оксид меди, гидрооксид железа, карбонат натрия.
Zn + H2SO4 = ZnSO4 + H2↑
Zn + 2H2+ + SO42- = Zn2+ + SO42- + H2↑
Zn + 2H+ = Zn2+ + H2↑
CuO + H2SO4= CuSO4 + H2O
CuO + 2H+ + SO42- = Cu2+ + SO42- + H2O
CuO + 2H+ = Cu2+ + H2O
2Fe(OH)3 + 3H2SO4= Fe2(SO4)3 + 6H2O
2Fe + 6OH- + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O
6OH- + 6H+ = 6 H2O
Na2CO3 + H2SO4= Na2SO4 + H2O + CO2↑
2Na+ + CO32- + 2H+ + SO42- = 2Na+ + SO42- + H2O + CO2↑
CO32- + 2H+ = H2O + CO2↑
Возьмем отпечатки пальцев. Проведем реакцию между хлоридом бария и серной кислотой.
11. Отпечатки пальцев (уравнение качественной реакции)
H2SO4 + ВаCl2 = 2HCl + BaSO4↓
12. Особенности поведения (признак качественной реакции)
Выпадение белого осадка сульфата бария.
- Работа с опорными конспектами.
Все о чем мы сегодня с вами говорили относится к разбавленной серной кислоте.
Разбавленная серная кислота – это сильный электролит. Обобщив свойства серной кислоты можно составить следующую опорную схему.
Me (в ряду активности до Н2)

 MeSO4 + H2↑
MeSO4 + H2↑MeO
 MeSO4 + H2O
MeSO4 + H2OMeOH
H
 2SO4 + MeSO4 + H2O
2SO4 + MeSO4 + H2O(разб.) MeR (в случае ↑ или ↓)
 MeSO4 + HR
MeSO4 + HRBaR (качественная реакция)
Белый осадок BaSO4↓ + HR

- Свойства солей серной кислоты.
Практически все соли серной кислоты растворимы в воде. Убедимся в этом с помощью таблицы растворимости. Исключение составляют: сульфаты бария, кальция, свинца и серебра, причем они не растворимы, ни в воде, ни в большинстве кислот.
Опыты:
В трех «камерах» (пробирки) находятся сообщники нашего «шпиона»: хлорид натрия, сульфат натрия, нитрат натрия. Необходимо среди них найти родственника серной кислоты.
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2NaCl + BaCl2 = нет реакции
NaNO3 + BaCl2 = 2NaCl + Ba(NO3)2
Явных признаков реакции нет
13. Родственные связи (название солей серной кислоты)
Сульфаты
Итак, мы с вами составили досье на «шпиона» серная кислота.
- Концентрированная серная кислота.
Особенностью концентрированных растворов серной кислоты (с массовой долей 70 – 80%) является медленность ее взаимодействия со многими металлами. С некоторыми из них она вообще не реагирует без нагревания, что особенно важно по отношению к железу, т.к. позволяет использовать для транспортировки и хранения такой кислоты железные цистерны. Не действует она и на алюминий.
- Значение серной кислоты.
Примерно половина добываемой в мире серы идет на производство серной кислоты. Ее роль в химической промышленности сравнима с ролью хлеба в нашем питании. Не так уж часто приходится встречаться с этим важнейшим веществом в быту. Разве только автолюбители имеют с ней дело, да и то только если сами ухаживают за аккумуляторами. Но каждый человек, бесспорно, ежедневно встречается с вещами, в производстве которых применялась серная кислота.
Вы надели рубашку из искусственного волокна – его производство практически невозможно без серной кислоты. Снежной чистоты полотно вашего белья отбеливалось на фабрике с помощью серной кислоты. Это же вещество применялось и при дублении кожи, из которой изготовлена наша обувь, и при нанесении рисунка на ситцевом халатике. На третье блюдо вы ели кисель. В производстве крахмала, на котором он был сварен, также участвовала серная кислота. Она же помогла получить сахар. Серная кислота применяется в цветной металлургии при получении меди, цинка, никеля, серебра. Она нужна и нефтяной промышленности для очистки нефтепродуктов. Без нее не обходятся при изготовлении такого сверхпопулярного удобрения, как суперфосфат.
Перечисление это можно продолжать и дальше. Но может быть лучше сказать, что по разнообразию сфер применения серная кислота занимает первое место среди всех химических продуктов.
VIII. Домашнее задание. §19.4 вопросы 2,6
IX. Дополнительное задание §19.4 вопрос 4
Досье
1. Родители (сырье для третьей стадии производства серной кислоты)
Отец
Мать
2. Имя «шпиона» (класс химического вещеста)
3. Фамилия «шпиона» (название кислоты)
4. Фотография в полный рост.
Химическая формула
Уравнение диссоциации
5. Фотография в фас (катион)
6. Фотография в профиль (анион)
7. Профессиональные качества (сила электролита)
8. Родословная (цепочка превращений, по которой можно получить вещество)
9. «Шпион» может быть очень опасен. Степень опасности (правила техники безопасности при приготовлении раствора серной кислоты)
10. Список «агентов» и возможные взаимодействия с ними (уравнения возможных реакций в молекулярном и ионном виде)
11. Отпечатки пальцев (уравнение качественной реакции)
12. Особенности поведения (признак качественной реакции)
13. Родственные связи (название солей серной кислоты)
