Инструктивно-методическое письмо «О преподавании химии в 2010-2011 учебном году в общеобразовательных учреждениях Белгородской области» Введение
| Вид материала | Инструктивно-методическое письмо |
СодержаниеТема урока |
- Инструктивно-методическое письмо «О преподавании иностранных языков в 2010 2011 учебном, 905.21kb.
- Инструктивно-методическое письмо «О преподавании предмета «Физическая культура» в общеобразовательных, 884.2kb.
- Инструктивно-методическое письмо «О преподавании учебного предмета «Музыка» в 2010-2011, 590.63kb.
- Инструктивно-методическое письмо «О преподавании предмета «Информатика и информационно-коммуникационные, 1216.42kb.
- Инструктивно-методическое письмо «О преподавании химии в 2009-2010 учебном году в общеобразовательных, 799.2kb.
- Инструктивно-методическое письмо «О преподавании физики в общеобразовательных учреждениях, 786.97kb.
- Инструктивно-методическое письмо «О преподавании физики в общеобразовательных учреждениях, 1203.39kb.
- Инструктивно-методическое письмо «О преподавании предмета Мировая художественная культура, 527.41kb.
- Инструктивно-методическое письмо «О преподавании литературы в 2009-2010 учебном году, 729.39kb.
- Приказ № от 2010 г. Рабочая программа по геометрии 7 класс, 262.44kb.
С2. Через 32 г раствора с массовой долей сульфата меди(II) 5% пропустили избыток газообразного сероводорода до полного выпадения черного осадка. Вычислите объем (н.у.) затраченного на реакцию газа.
С2. Через 925 г известковой воды (раствора гидроксида кальция) с массовой долей растворенного вещества 1% пропустили углекислый газ до образования осадка карбоната кальция. Вычислите объем (н.у.) затраченного на реакцию газа.
С2. Через 40 г раствора с массовой долей гидроксида натрия 6% пропустили углекислый газ до образования карбоната натрия. Вычислите объем (н. у.) затраченного на реакцию газа.
С2. Избыток оксида алюминия добавили к 29,4 г раствора с массовой долей серной кислоты 10%. Вычислите массу соли, образовавшейся в результате реакции.
С2. К избытку раствора фосфата калия добавили 102 г раствора с массовой долей нитрата серебра 10%. Вычислите массу образовавшегося осадка.
Приложение 6.
Примеры заданий части С, которые оказались для обучающихся 11 классов наиболее сложными в 2007-2008 гг. и 2008-2009 гг.
С2. Даны: бромоводородная кислота, перманганат калия, гидроксид натрия и бром. Напишите уравнения четырех возможных реакций между этими веществами.
С2. Даны: сульфат марганца (II), перманганат натрия, гидроксид натрия, оксид фосфора (V). Напишите уравнения четырех возможных реакций между этими веществами.
С2. Даны: хлорид меди (II), кислород, серная кислота (конц.) и иодоводородная кислота. Напишите уравнения четырех возможных реакций между этими веществами.
С2. Даны: сульфид меди (II), кислород, хлор, азотная кислота (конц.), серная кислота (конц.). Напишите уравнения четырех возможных реакций между этими веществами.
С2. Даны вещества: сульфат меди (II), иодид калия, магний, концентрированная серная кислота. Напишите уравнения четырёх возможных реакций между этими веществами.
С3. X1
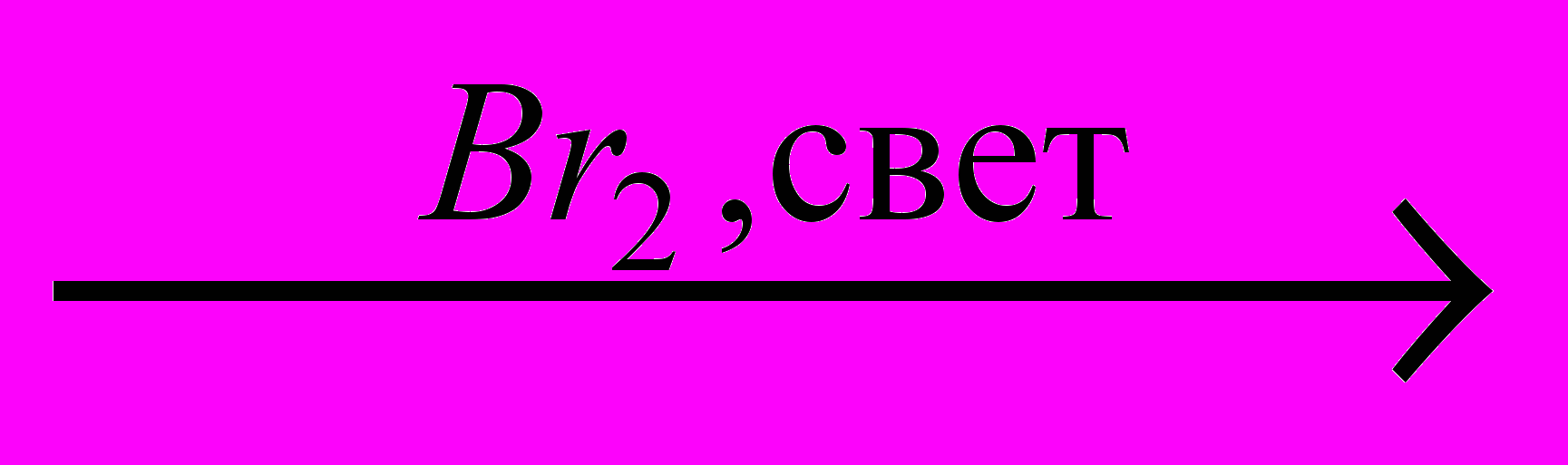 CH3Br
CH3Br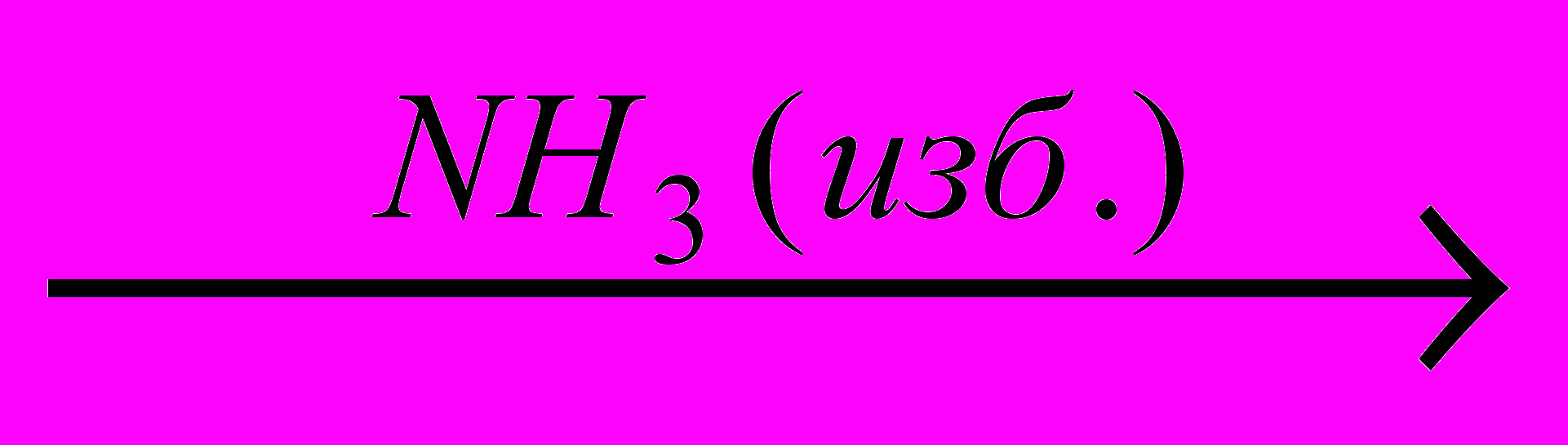 X2
X2 X3
X3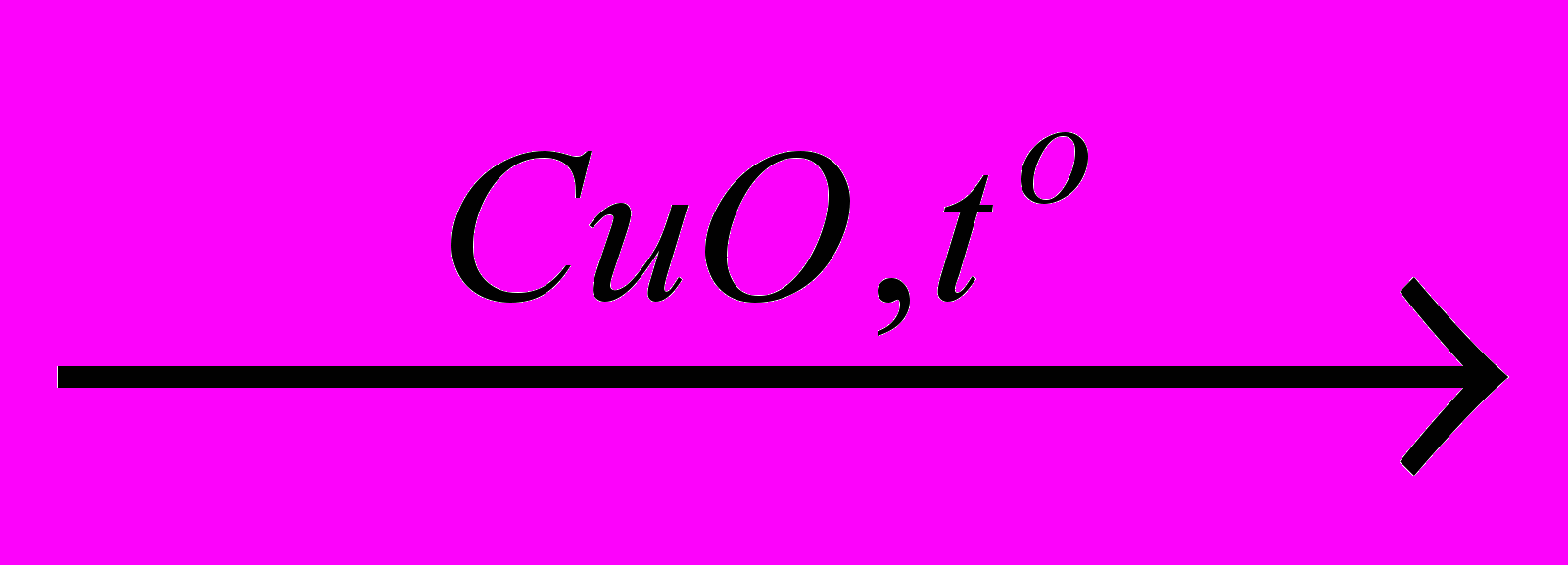
→H2CO
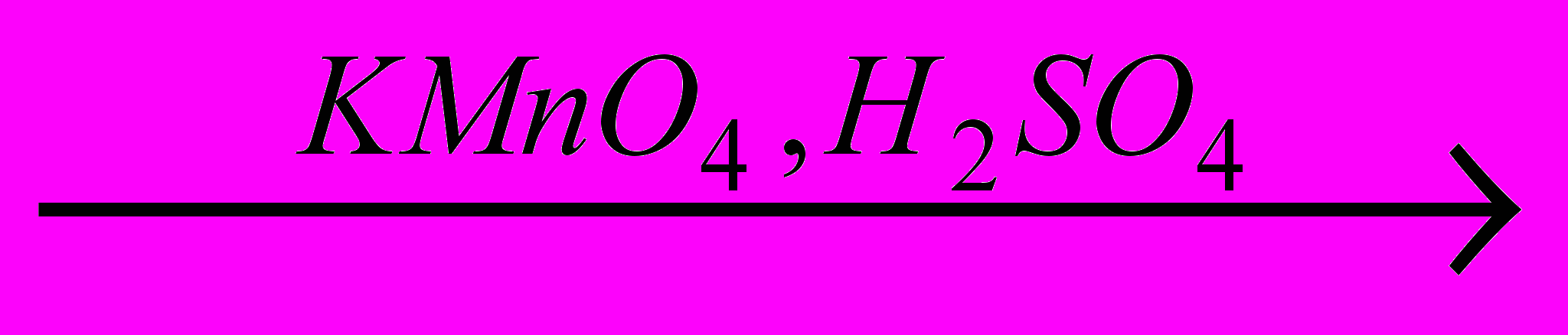 X4
X4С3. CH3CHCl2→CH3CHO
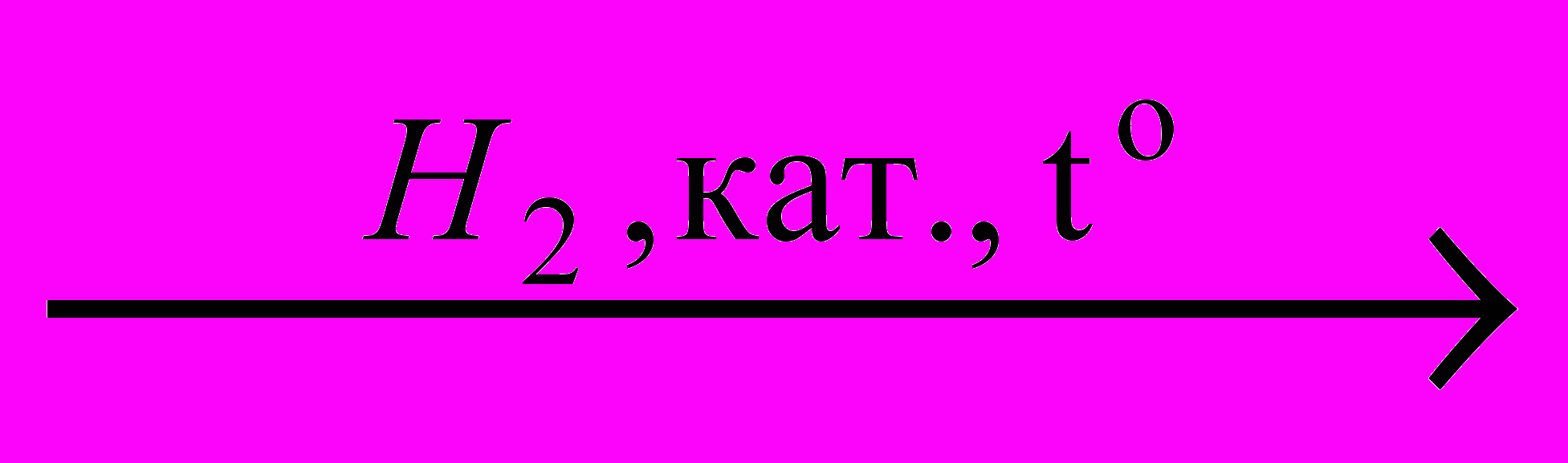 X1
X1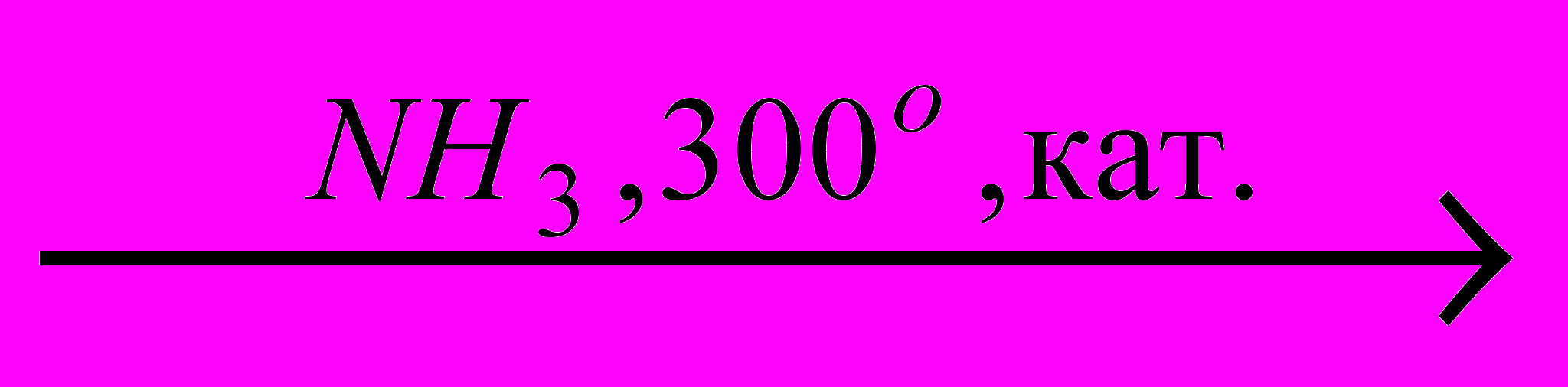 →C2H5NH2
→C2H5NH2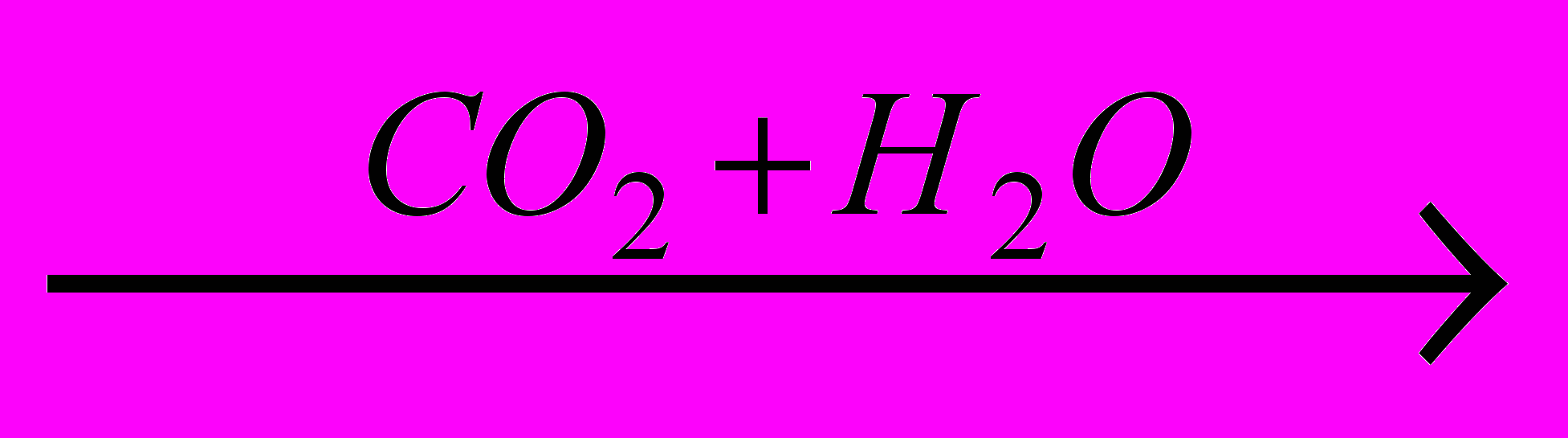 X2
X2 X3
X3С3. С2H4Br2
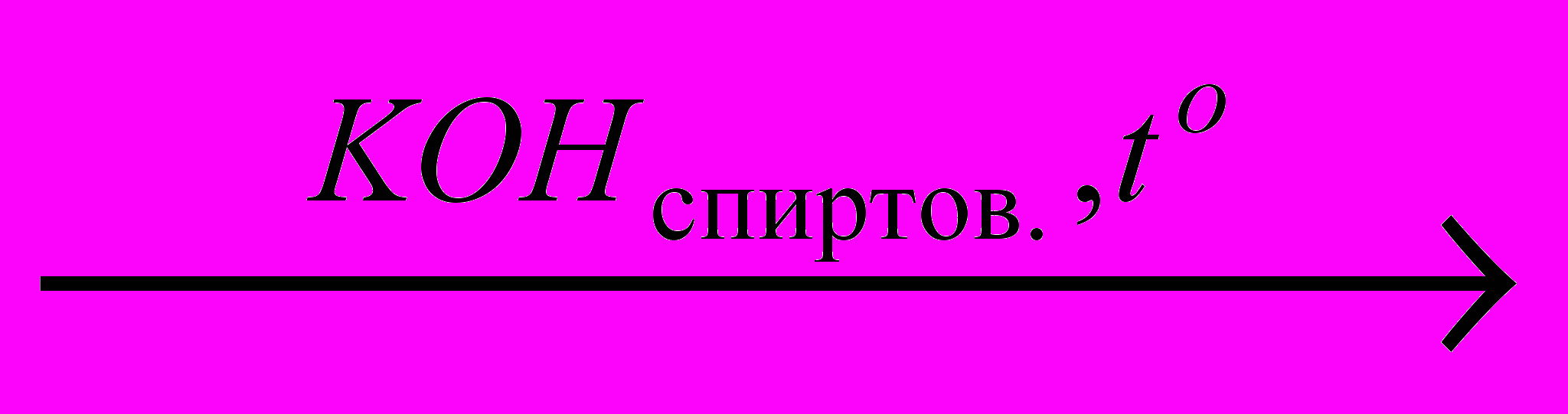 X1
X1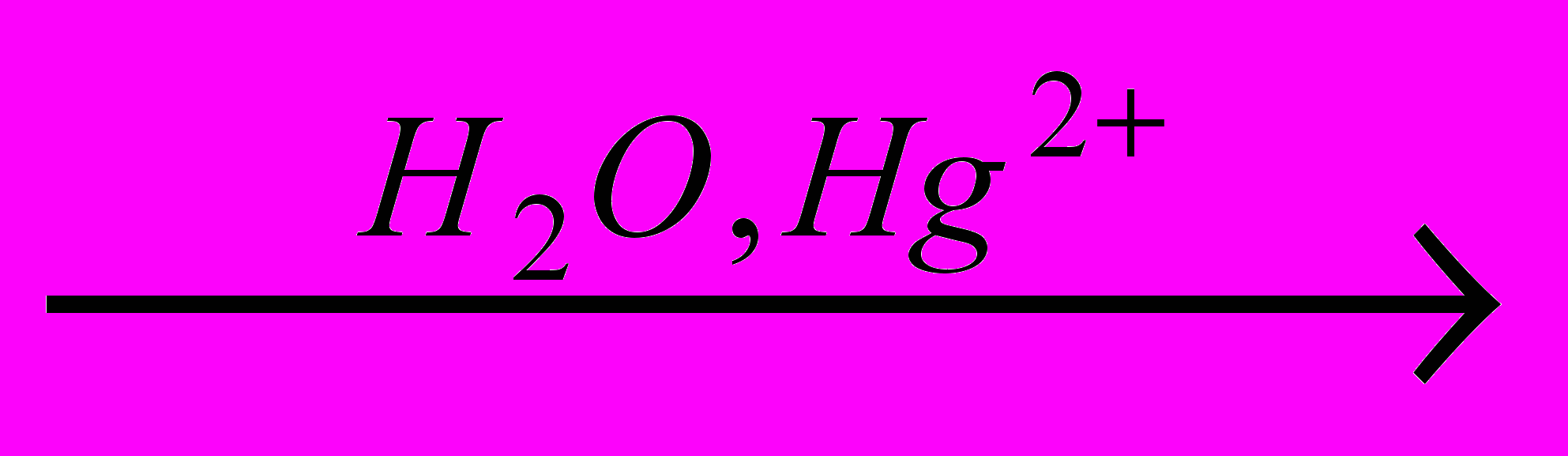 X2
X2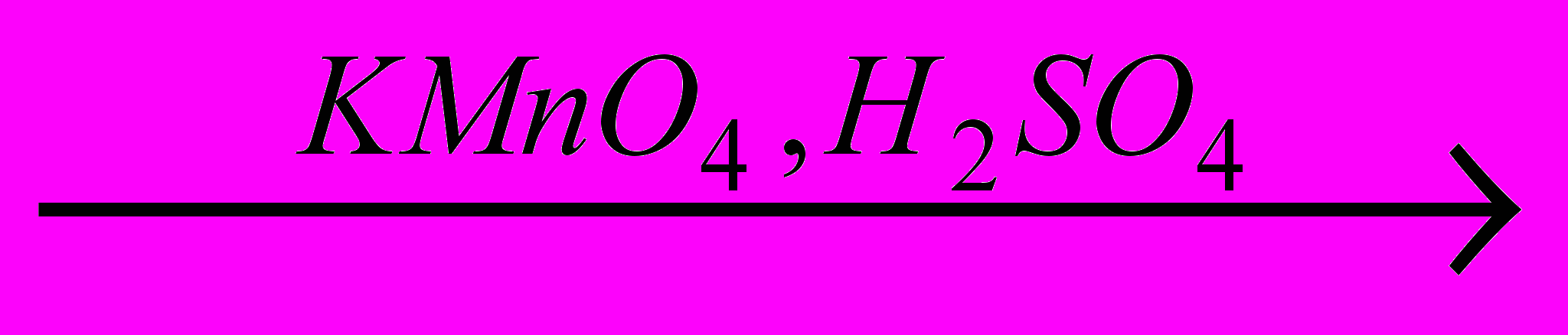
→CH3COOH
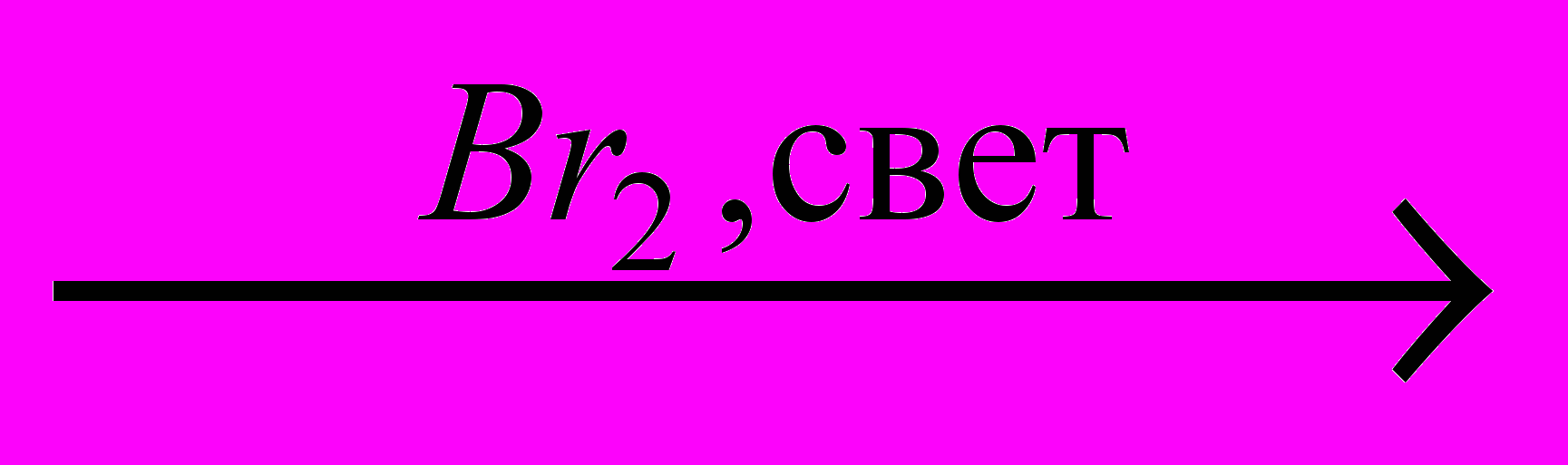 X3→ H2NCH2COOH
X3→ H2NCH2COOHС3. Пропанол-1
 X1
X1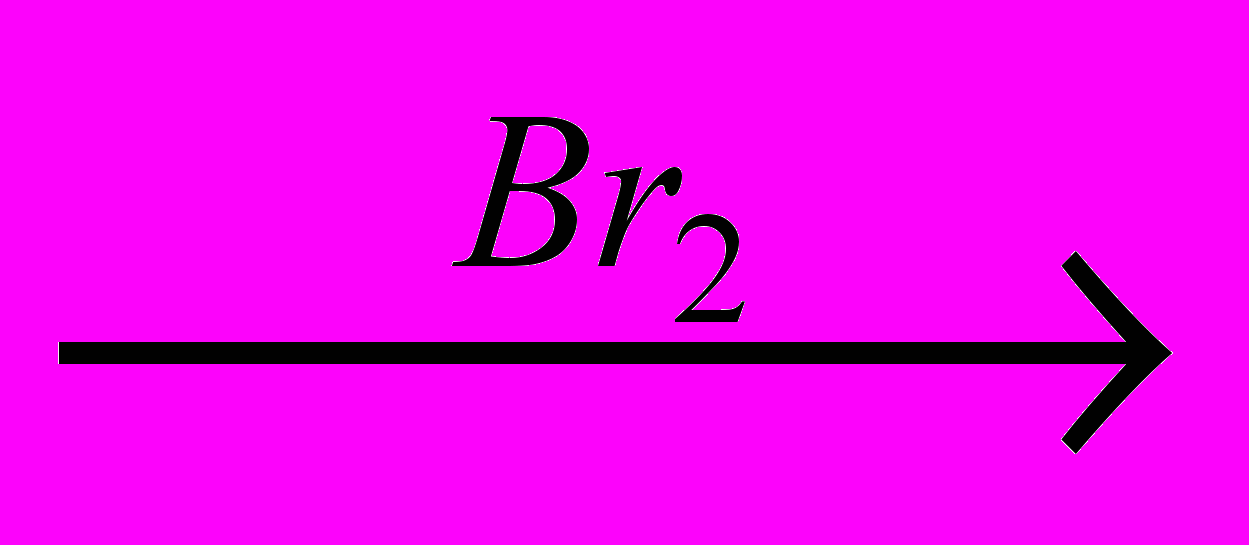 X2→пропин
X2→пропин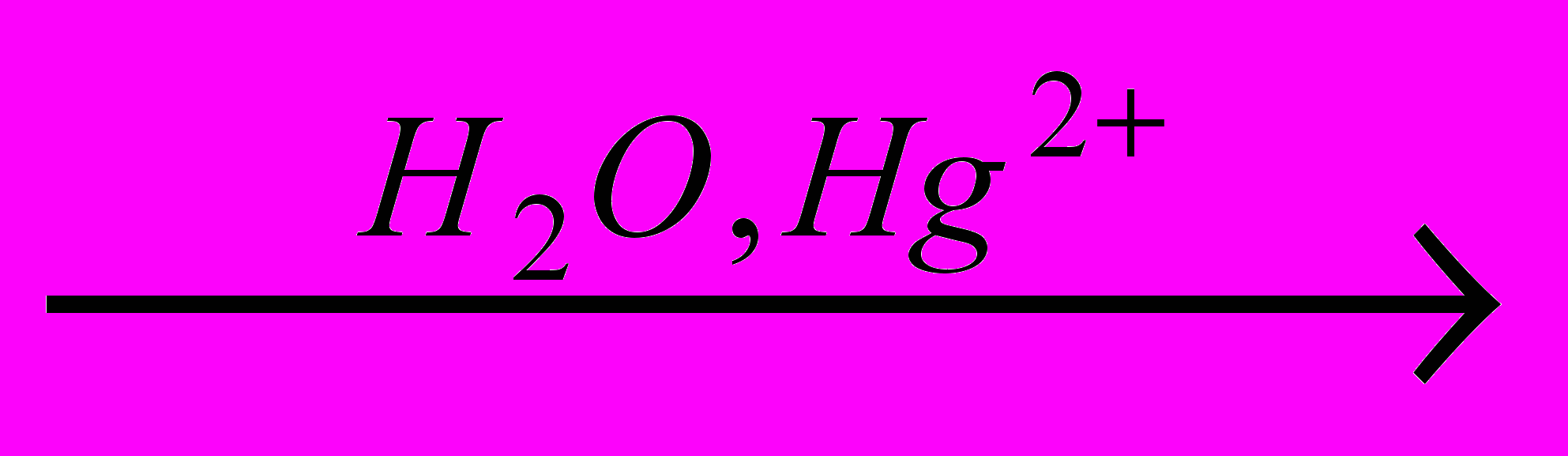
→X3
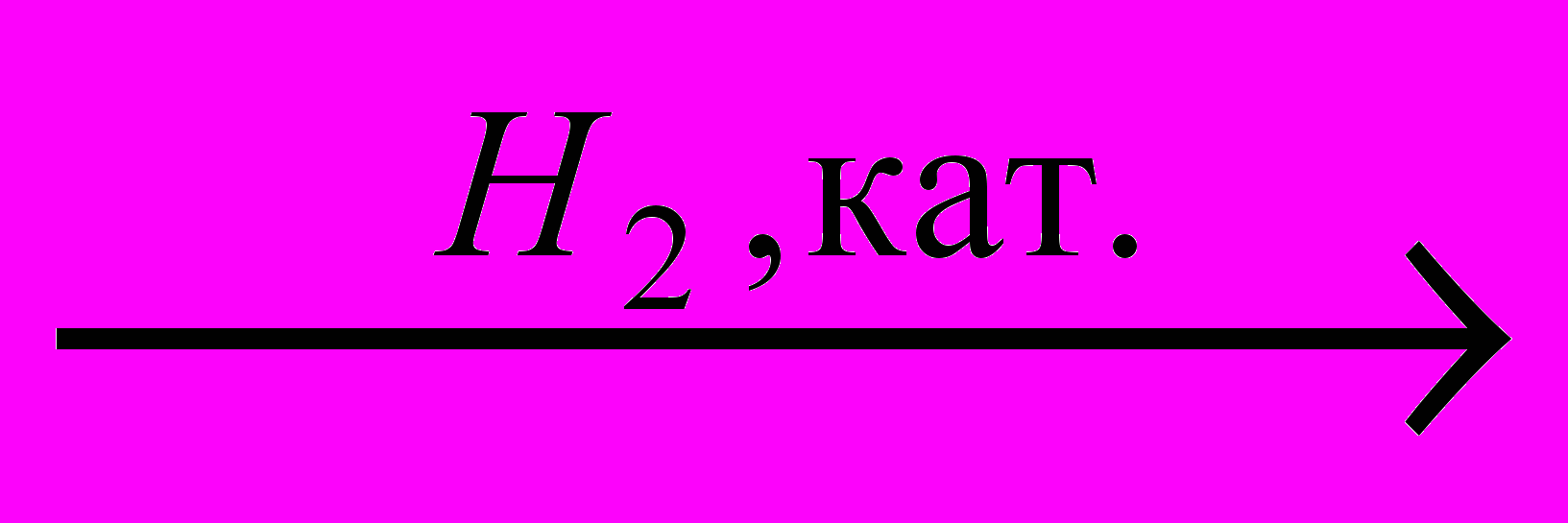 X4
X4С3.
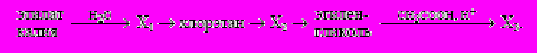
С3.
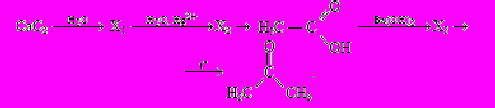
С3.
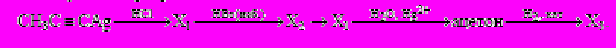
С4. Смешали 300 мл раствора серной кислоты с массовой долей 10% (плотностью 1,05 г/мл) и 200 мл раствора гидроксида калия с массовой долей 20% (плотностью 1,10 г/мл). Сколько миллилитров воды следует добавить к полученной смеси, чтобы массовая доля соли в ней составила 7%?
С4. В 120 мл раствора азотной кислоты с массовой долей 7% (плотностью 1,03 г/мл) внесли 12,8 г карбида кальция. Сколько миллилитров 20%-ной соляной кислоты (плотностью 1,10 г/мл) следует добавить к полученной смеси для её полной нейтрализации?
С4. Нитрит калия массой 8,5 г внесли при нагревании в 270 г раствора бромида аммония с массовой долей 12%. Какой объём (н.у.) азота выделится при этом и какова массовая доля бромида аммония в получившемся растворе?
С4. При взаимодействии в сернокислой среде 8,7 г диоксида марганца с 22,4 г бромида калия выделился бром, практический выход которого составил 88%. Какой объём (н.у.) этилена может прореагировать с полученным количеством брома?
С4. Карбид алюминия массой 1,44 г растворили в 150 г 21%-ного раствора азотной кислоты. Рассчитайте массовую долю кислоты в получившемся растворе.
С5. При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
С5. Установите молекулярную формулу предельной одноосновной карбоновой кислоты, бариевая соль которой содержит 60,35% бария.
С5. Установите молекулярную формулу предельной карбоновой кислоты, имеющей такую же плотность паров по кислороду, как и сложный эфир, содержащий 43,24% кислорода.
С5. Предельный одноатомный спирт сожгли. В результате реакции получили 22,4 л (н.у.) углекислого газа и 22,5 г водяных паров. Определите молекулярную формулу исходного спирта.
С5. Ацетиленовый углеводород может максимально присоединить 80 г брома с образованием продукта реакции массой 97 г. Установите молекулярную формулу этого углеводорода.
Приложение 7.
Фрагмент (примерный) календарно-тематического планирования по химии для 11 класса по УМК Габриеляна О.С. (3 часа в неделю)
| № п/п | Тема урока; практической работы; контрольной работы | Дата | Формы контроля | Литература Оборудование | Демонст. эксперимент/ Лабораторная работа | Подготовка к ЕГЭ Контролируемые элементы по кодификатору, блоки по спецификации | Д/з |
| Строение атома (11 часов) | |||||||
| 1 | Атом – сложная частица | | Вводный контроль в тестовой форме | 7.§ 1 | | Блок «Химический элемент» 1.1., 1.2. | 7.§ 1 Упр. 1,2 |
| 2 | Атом – сложная частица | | | 7.§ 1 | | Блок «Химический элемент» 1.1., 1.2., 1.3 | 7.§ 1 Упр. 4-7 |
| 3 | Состояние электронов в атоме | | | 7.§ 2 | | Блок «Химический элемент» 1.1., 1.2., 1.3 | 7.§ 2 Тест |
| 4 | Электронные конфигурации атомов химических элементов | | | 7.§ 3 | | Блок «Химический элемент» 1.1., 1.2., 1.3 | 7.§ 3 Упр. 10 |
| 5 | Электронные конфигурации атомов химических элементов | | | 7.§ 3 | | Блок «Химический элемент» 1.1., 1.2., 1.3 2.1., 2.2., 2.3. | 7.§ 3 Задачник, упр. 1-5 |
| 6 | Валентные возможности атомов химических элементов | | | 7.§ 4 | | Блок «Химический элемент» Блок «Вещество» 1.1., 1.2., 1.3 2.1., 2.2., 2.3. 2.8, 2.9, 4.1 | 7.§ 4 Тест |
| 7 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома | | | 7.§ 5 | | Блок «Химический элемент», Блок «Вещество» 2.1., 2.2., 2.3. 2.8, 2.9, 4.1 | 7.§ 5 Конспект, задания 1-5 |
| 8 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома | | | 7.§ 5 | | Блок «Химический элемент», Блок «Вещество» 2.1., 2.2., 2.3. 2.8, 2.9, 4.1 | 7.§ 5 Составить тестовые задания по теме (2 варианта) |
| 9 | Обобщение знаний по теме «Строение атома» | | | С. 7-9, 11-13, 15-18, 22-24, 27-29 | | 1.1., 1.2., 1.3 2.1., 2.2., 2.3. 2.8, 2.9, 4.1 | Повторить .§ 1- 5 |
| 10 | Обобщение знаний по теме «Строение атома» | | | С. 7-9, 11-13, 15-18, 22-24, 27-29 | | 1.1., 1.2., 1.3 2.1., 2.2., 2.3. 2.8, 2.9, 4.1 | Подготовка контрольной работе, тест |
| 11 | Контрольная работе по теме «Строение атома» | | Тестовые задания (Часть А и В) | | | | |
11. Новые лабораторные работы
22. Новые лабораторные работы
