Учреждения Российской Академии медицинских наук нии общей реаниматологии имени В. А. Неговского рамн автореферат
| Вид материала | Автореферат |
- Учреждения Российской Академии Медицинских Наук Научно-исследовательском институте, 992.11kb.
- Нии общей реаниматологии, 142.73kb.
- Основные научные вопросы: Механизмы развития ордс, 49.74kb.
- «Современные методы диагностики и лечения в реаниматологии», 25.71kb.
- Сергиев Владимир Петрович Член-корреспондент рамн, доктор медицинских наук, профессор, 829.91kb.
- Программ а VIII всероссийского конгресса, 353.79kb.
- На правах рукописи, 694.69kb.
- Структура и экспрессия mmtv-родственного провируса у больных раком молочной железы, 564.57kb.
- X всероссийский конгресс, 364.53kb.
- Автореферат диссертации на соискание ученой степени, 237.83kb.
Одним из методов генетики мультифакториальных заболеваний, к которым относится и пневмония, является исследование ассоциации полиморфных вариантов генов, продукты которых предположительно задействованы в развитии и регуляции тех или иных звеньев патогенеза заболевания [Silverman E., Palmer L., 2000, Hall I., 2002; Wright C.M....Fong K.M. 2010]. Современные представления о генетической составляющей мультифакториальных заболеваний во многом связаны с концепцией подверженности и порогового проявления многофакторного фенотипа [Dorman S.E., Holland S.M , 2000]. Согласно этой концепции подверженность заболеванию наследственно обусловлена, но реализация ее возможна только при взаимодействии с факторами среды. С позиции изучения роли «общих» генов в развитие различных болезней особую актуальность приобретает исследование системы генов метаболизма ксенобиотиков, поскольку ферментами этой системы осуществляется метаболизм не только большинства разнообразных по химической структуре экзогенных молекул, но и многочисленных эндогенных веществ, например, медиаторов воспаления.
Были сформированы выборки и создана база ДНК для 524 больных и 178 доноров. Изучена генетическая изменчивость 10 генов у больных с различной нозологией (внебольничноя пневмония, перитонит, тяжелая сочетанная травма и ранения, гнойно-воспалительные заболевания различной локализации) и здоровых доноров.
Анализ частот встречаемости однолокусных генотипов 12 полиморфных сайтов для контрольной популяции и больных ВП выявил, что риск развития внебольничной пневмонии ассоциирован с инсерционным вариантом GSTM1 Ins/Del (генотип I/*) (p=0,012, OR=1,65), мажорным аллелем 606T в гомозиготном состоянии гена CYP1A1 T606G (генотип 606T/T) (p=0,016, OR=1,61) и делеционным аллелем гена ACE Ins/Del в гомозиготном состоянии (генотип D/D) (p=0,002, OR=1,97) (табл. 5).
Таблица 5
Частоты однолокусных генотипов в исследованных группах.
| Локусы | Генотипы | Частота встречаемсти генотипа в группах, [абс.зн/%] | ||
| Контроль (N=178) | ВП (N=277) | ВП-осл (N=193) | ||
| CYP1A1 A4889G | A/A | 167 (93,8) | 218 (89,7) | 178 (92,2) |
| A/G | 11(6,2) | 25 (10,3) | 15 (7,3) | |
| CYP1A1 T3801C | C/C | 0 (0,0) | 1 (0,4) | 1 (0,5) |
| T/C | 39 (21,9) | 46 (19,0) | 30 (15,6) | |
| T/T | 139 (78,1) | 195 (80,6) | 161 (83,9) | |
| CYP1A1 T606G | T/T | 77 (43,2) | 134 (55,1) # | 115 (59,6) # |
| T/G | 74 (41,6) | 81 (33,3) | 62 (32,1) | |
| G/G | 27 (15,2) | 28 (11,5) | 16 (8,3) | |
| ACE Ins/Del | D/D | 40 (22,5) | 82 (33,7) ## | 61 (31,6) # |
| D/I | 89 (50,0) | 103 (42,4) | 79 (40,9) | |
| I/I | 49 (27,5) | 58 (23,9) | 53 (27,5) | |
| CCR5 Ins/Del | D/D | 1 (0,6) | 1 (0,4) | 1 (0,5) |
| I/D | 31 (17,4) | 40 (16,5) | 36 (18,7) | |
| I/I | 146 (82,0) | 202 (83,1) | 156 (80,8) | |
| GSTM1 Ins/Del | D/D | 92 (51,7) | 94 (38,7) | 74 (38,3) |
| I/* | 86 (48,3) | 149 (61,3) # | 119 (61,7) # | |
| GSTT1 Ins/Del | D/D | 32 (18,0) | 49 (20,2) | 42 (21,8) |
| I/* | 146 (82,0) | 194 (79,8) | 151 (78,2) | |
| GSTP1 A313G | A/A | 78 (44,1) | 45 (48,4) | 32 (54,2) |
| A/G | 87 (49,1) | 45 (48,4) | 26 (44,1) | |
| G/G | 12 (6,8) | 3 (3,2) | 1 (1,7) | |
| ABCB1 T3435G | T/T | 93 (70,99) | 128 (69,94) | 109 (68,99) |
| T/G | 35 (26,72) | 49 (26,78) | 41 (25,95) | |
| G/G | 3 (2,29) | 6 (3,28) | 8 (5,06) | |
| MTHFR C677T | C/C | 74 (41,6) | 40 (44,0) | 23 (39,0) |
| C/T | 88 (49,4) | 43 (47,2) | 32 (54,2) | |
| T/T | 16 (9,0) | 8 (8,8) | 3 (6,8) | |
| TNF-a G308A | G/G | 126 (71,6) | 207 (79,6) | 141 (77,5) |
| G/A | 50 (28,4) | 53 (20,4) | 41 (22,5) | |
| A/A | 0 (0,0) | 0 (0,0) | 0 (0,0) | |
| IL-6 G174C | G/G | 54 (30,5) | 82 (29,7) | 60 (31,1) |
| G/C | 93 (52,5) | 134 (48,6) | 88 (45,6) | |
| C/C | 30 (17,0) | 60 (21,7) | 45 (23,3) |
# р≤0,05 - относительно контрольной группы
## р≤0,01 - относительно контрольной группы
Примечание. Число лиц, генотипированных по отдельным локусам, может несколько отличаться. Светло-серым цветом выделены случаи достоверного отклонения от распределения Харди-Вайнберга (дефицит гетерозигот); темно-серым цветом отмечены генотипы, ассоциированные с риском возникновения внебольничной пневмонии. Контрольная выборка в ассоциативных исследованиях внебльничной и нозокомиальной пневмонии полностью совпадает.
Косвенным подтверждением этих наблюдений является сильное нарушение распределения Харди-Вайнберга (дефицит гетерозигот, p<10-6) в группе больных для локуса CYP1A1 T606G (и только для него). В контрольной популяции все изученные локусы находились в состоянии равновесия по Харди-Вайнбергу.
Для двух локусов зарегистрирован эффект дозы гена: в группах больных и здоровых достоверно отличаются частоты встречаемости аллелей 606T и 606G гена CYP1A1 (p=0,049, OR=1,34), а также частоты делеционных и инсерционных аллелей гена ACE (p=0,017, OR=1,39).
В ходе исследования была получена важная информация о взаимодействии ферментов системы метаболизма первой и второй фаз для оценки их вклада в подверженность к риску развития заболевания у носителей определенных сочетаний генотипов.
Проведенный анализ показал, что в ряде случаев однолокусные эффекты усиливались при рассмотрении комбинаций локусов. Относительно предрасположенности к возникновению ВП наиболее значимой оказалась комбинация локусов GSTM1 I/* - CYP1A1 606Т (p=0,006; OR=1,9) (рис.1).
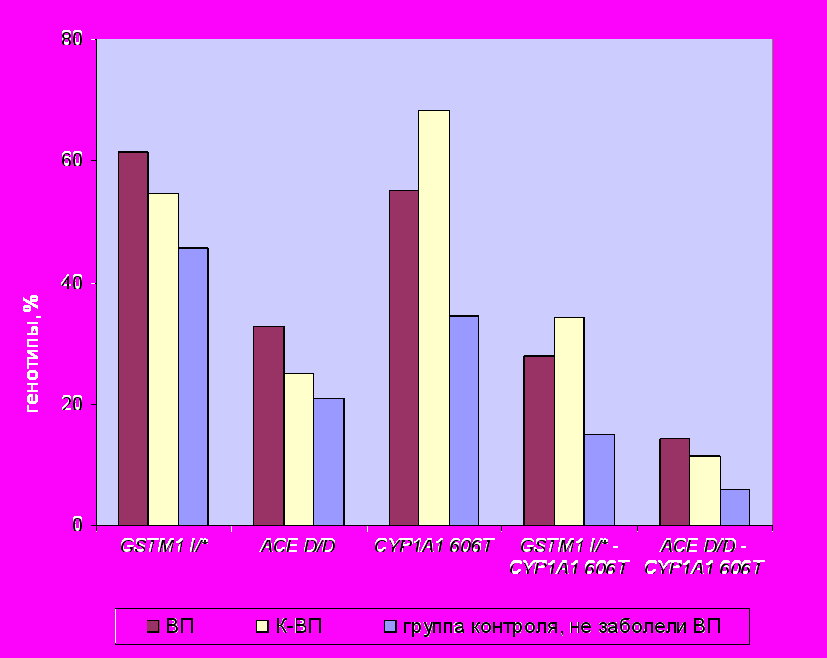 p=0,012 p=0,002 p=0,016 p=0,006 p=0,011 |
Рис.1. Частота распределения генотипов предрасположенности и их комбинаций к возникновению внебольничной пневмонии в группах больных и контрольной выборке (группа ВП и группа К-ВП).
Примечание. CYP1A1 606T – сокращенное название гена CYP1A1 T606G.
В результате сравнительного анализа частот встречаемости генотипов предрасположенности к ВП среди контрольной выборки (178 человек) была выделена группа риска, которую составили 137 человек (76,9%), имеющие один из генотипов или их комбинацию. Гомозиготы по аллелю 606Т/T гена CYP1A1 составили 75 случаев (54,74%); гомозиготы по делеции в локусе ACE D/D – 35 (25,55%), «положительные» генотипы локуса GSTM1 I/* - 84 случая (61,31%). Комбинация двух генотипов CYP1А1 606Т/T - GSTM I/* выявлена у 36 человек (26,28%), сочетание трех генотипов предрасположенности зарегистрировано у 7 человек (5,11%).
Анализ наблюдений, зарегистрированных в течение четырех лет, показал, что с диагнозом «острая внебольничная пневмония» в госпиталь поступили 47 человек из контрольной группы (К-ВП). После детального обследования диагноз пневмонии был верифицирован в 44 случаях, в двух – острый бронхит, синусит, в одном диагностирован очаговый туберкулез легких.
Среди заболевших внебольничной пневмонией из контрольной выборки - 39 человек (88,64%) из группы «риска». По частоте встречаемости среди заболевших из группы «риска» генотипы предрасположенности распределились следующим образом:
CYP1A1 606T/T – 74,36%; GSTM1 I/* - 61,54%; ACE D/D – 34,38%.
Анализ частот генотипов у заболевших из группы контроля (К-ВП) выявил высокую степень сопряженности мажорного варианта гена CYP1A1 с риском развития ВП, различия по отношению к общему контролю высоко достоверны (р=0,0013 по трендовому тесту Армитажа). Этот факт является независимым подтверждением ассоциации аллеля 606T гена CYP1A1 с риском развития внебольничной пневмонии.
Среди заболевших из контрольной группы было выявлено 15 носителей комбинации локусов GSTM1 I/* - CYP1A1 606Т, что составило 34,09% от всей группы и 65,2% среди других вариантов сочетаний генотипов.
Взаимосвязь полиморфизма генов детоксикации ксенобиотиков и ренин-ангиотензиновой системы с развитием осложнений в исследованных группах
В ходе исследования у пациентов I и II групп были зарегистрированы различные осложнения основного заболевания. Среди больных ВП - 193 (69,68%) случая осложненного течения. В группе ВП-осл (193 больных) чаще всего регистрировались инфекционно-токсический шок (ИТШ) – 61,66%, плеврит – 50,78% и токсический миокардит – 15,47%, а в 16 случаях они сочетались у одного и того же больного; деструктивные (абсцесс легкого, эмпиема плевры, пневмоторакс) составили – 4,66%, ПОН – 1,55%, сепсис – 0,5%.
Обращает на себя внимание большая частота развития ОРДС среди больных внебольничной пневмонией и некардиогенного отека легких – 7,25%. Во второй группе частота развития ОРДС, ПОН и сепсиса была значительно выше, что обусловлено основной нозологией (тяжелая сочетанная травма, минно-взрывные ранения, гнойно-воспалительные заболевания различной локализации). Сравнение частоты развития критических состояний в группах показало, что различные стадии ОРДС в подгруппе IIВ развились в 13% случаев, тогда как в группе IIA – в 36,7%; ПОН – 3,0% против 29,8%; сепсис – 1,0% против 15,8% соответственно.
Результаты сравнительного анализа по исследованным генам свидетельствует, что выявленные гены предрасположенности статистически достоверно ассоциированы с развитием осложнений при внебольничной пневмонии: GSTM1 I/* (p=0,045, OR=1,4), CYP1A1 606T (p=0,0017, OR=1,62), ACE D/D (p=0,048, OR=1,7).
Во II группе - 234 (94,75%) случаев, из них 158 (53,97%) - нозокомиальной пневмонии. Риск развития НП ассоциирован с генами: GSTP1 A313G и ABCB1 T3435C.
По гену GSTP1 (генотип G/G) результаты значимы относительно популяционного контроля (по тесту Армитажа p=0,03, имеет место аддитивный эффект). При сопоставлении частот аллельных вариантов по тесту Фишера в подгруппах IIA и IIB различия достоверны по рецессивной модели (p=0,05, OR=3,42). Зарегистрированы отличия по C-аллелю гена ABCB1 в отношении развития нозокомиальной пневмонии на уровне тенденции (р=0,08 по Фишеру). В группе IIB генотип C/C по локусу ABCB1 не выявлен (рис.2).
По аллелю 606T гена CYP1A1, ассоциированному с повышенным риском возникновения ВП, в отношении нозокомиальной пневмонии наблюдается тенденция. Частота генотипа T/T гена CYP1A1 повышена в группе IIA по сравнению с контролем (тест Армитажа, рецессивная модель, p=0,082) и относительно группы IIB (тест Армитажа, доминантная модель, p=0,075).
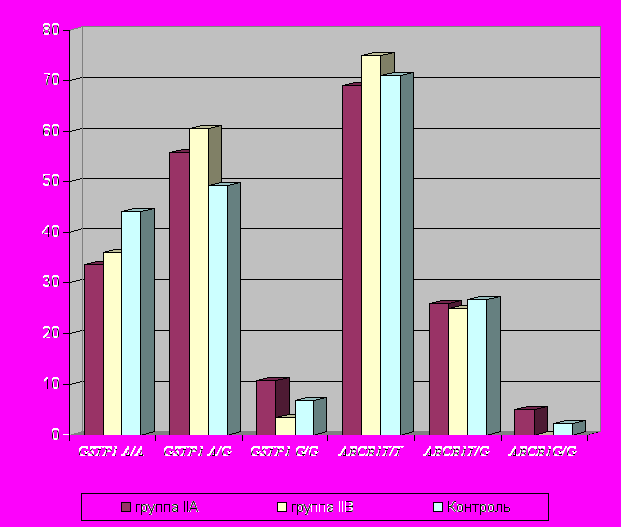
p=0,03
p=0,08
p=0,05
Рис.2. Встречаемость различных генотипов генов GSTP1 A313G и ABCB1 T3435G среди больных IIA, IIB групп и контрольной выборке.
Сравнительный анализ результатов генотипирования не выявил у больных исследованных групп статистически значимых различий в частоте встречаемости генотипов по изученным генам в зависимости от вида развившихся осложнений. Однако, было зарегистрированно, что аллельные варианты локуса ACE достоверно отличаются в группе «выживших» при развитии таких критических состояний как ОРДС, сепсис и органной недостаточности.
В группе IIA наибольшее число случаев критических состояний – 84,8% (134 из 158). Этот факт подчеркивает, что развитие нозокомиальной пневмонии всегда утяжеляет стояние больного, являясь, в ряде случаев, причиной или следствием критического состояния.
В группе ВП-осл тяжелые осложнения (ОРДС, сепсис, ПОН) развились в 19 случаях (9,84%), выжили менее половины (8 пациентов), семь из них носители аллеля I/* (87,5%).
В группе IIA благоприятный исход при критических состояниях был в 57 случаях (из 134), обладателями аллеля I/* были пятьдесят два из них (91,23%) (рис.3,4). В группе IIB достоверных различий преобладания одного из вариантов в зависимости от исхода критического состояния не получено.
В ходе проведенного исследования выявлено, что благоприятный исход в группе IIA ассоциирован с инсерционным аллелем гена ACE (генотип I/*) (p=0,01 по доминантной модели), тогда как альтернативный генотип D/D – с летальным исходом (р=0,01). В группе осложненного течения внебольничной пневмонии (ВП-осл) все случаи летального исхода при ОРДС сопряжены с D-аллелем в гомо-или гетерозиготном вариантах (p=0,047, по доминантной модели) (табл.6).
Таблица 6
Частота встречаемости различных вариантов генотипов гена ACE Ins/Del в исследованных группах больных при развитии критических состояний (ОРДС, ПОН, сепсис)
| Показатели | Значение показателей | |||||
| Группы | ВП-осл | группа IIА | группа IIB | |||
| Количество случаев осложнений | n=19 | n=134 | n=34 | |||
| в=8 | у=11 | в=57 | у=77 | в=30 | у=4 | |
| ACE I/I, [абс.зн/%] | 3 (37,5) | 2 (18,18) | 27(47,37) | 11 (14,28) ## | 24 (80,0) | 4 (100,0) |
| ACE I/D, [абс.зн/%] | 4 (50,0) | 2 (18,18) | 25 (43,86) | 25 (32,47) | 4 (13,33) | 0 (0,0) |
| ACE D/D, [абс.зн/%] | 1 (22,5) | 7 (77,78)# | 5 (8,77) | 41 (53,25)## | 2 (6,67) | 0 (0,0) |
Примечание. Использованные в таблице «в» и «у» - сокращенное обозначение исхода основного заболевания (выжившие/умершие). Достоверность значений при внутригрупповом сравнении «выжил»/«умер»: # - р< 0,05; ## - р< 0,01.
Полученные результаты ассоциативного исследования свидетельствуют в пользу того, что в этиологии и патогенезе пневмонии задействовано множество генов, каждый из которых в отдельности вносят свой вклад в общую генетическую подверженность к пневмонии, особенностям ее течения и лечения.
Генотипы протективной направленности среди изученных локусов в отношении развития внебольничной и нозокомиальной пневмонии
Сравнительный анализ распространенности аллельных вариантов генов CYP1A1 G600T и GSTM1 Ins/Del показал, что G-аллель гена CYP1A1 в гомо- или гетерозиготном варианте и гомозиготы по делеции локуса GSTM1 (генотип D/D) достоверно чаще встречаются у здоровых доноров (OR=0,66 при p=0,005), что трактовали как протективный эффект. При сочетании протективных генотипов эффект усиливается (табл.7). Наиболее значим в этом отношении вариант CYP1A1 606G/* - GSTM1 D/D, который ассоциирован с уменьшением шансов заболеваемости внебольничной пневмонией в 2 раза по сравнению с генотипом “риска” CYP1A1 606T/T – GSTM1 I/* (OR=0,50 при p=0,003). Необходимо отметить, что протективный эффект генотипа 606G/G гена CYP1A1 в гомозиготном варианте проявился лишь в случаях внебольничной пневмонии (OR=0,50 при p=0,001), тогда как гетерозиготный вариант 606T/G встречается достоверно реже как при внебольничной, так и при нозокомиальной пневмонии (OR=0,50 при p=0,003).
Таблица 7
Частота встречаемости протективных генотипов в исследованных группах
| Локус, сайт | Частота встречаемости генотипа в исследованных группах, [абс.зн/%] | ||||
| контроль, не заболели ВП, N=134 | К-ВП N=44 | ВП N=277 | группа IIA N=158 | группа IIB N=89 | |
| CYP1A1 606T/G | 63 (47,01) ## | 11 (25,0) | 81 (33,3) | 14 (8,92) | 48 (53,93) * |
| CYP1A1 606G/G | 25 (18,66) # | 3 (6,82) | 28 (11,5) | 70 (44,59) | 10 (11,24) * |
| GSTM1 D/D – CYP1A1 606G/G | 14 (10,45) | 2 (4,55) | 11 (3,97) | 4 (2,53) | 8 (8,99) * |
| GSTM1 D/D – CYP1A1 606T/G | 33 (24,63) # | 5 (11,36) | 33 (11,91) | 8 (5,06) | 19 (21,35) * |
# р< 0,05 - относительно контрольной популяции, не заболевшей пневмонией
## р< 0,01 – относительно контрольной популяции, не заболевшей пневмонией
* р< 0,01 – внутригрупповое сравнение (при сравнении IIA и IIB)
Еще более значителен этот эффект у носителей комбинации генотипов:
GSTM1 D/D – CYP1A1 606G/G (р< 0,01);
GSTM1 D/D – CYP1A1 606T/G (р< 0,01);
GSTM1 D/D – CYP1A1 606G/G - CYP1A1 606T/G (р<0,001).
Протективный эффект по локусам CYP1A1 G600T и GSTM1 Ins/Del наиболее убедителен в группе «отрицательного» контроля по отношению к возникновению НП (табл.6). В группе IIB были пострадавшие с тяжелыми сочетанными травмами, ранениями, а также больные с различными воспалительными заболеваниями, которые при поступлении имели интрапульмональные осложнения (гидроторакс, травматический пневмо- и/или гемоторакс, травматический пульмонит, различные стадии ОРДС), но в дальнейшем, нозокомиальная пневмония у них не развилась. Носителей протективных генотипов в этой группе было 65,17%, в том числе сочетаний - 30,34%.
Роль аллелей генов детоксикации ксенобиотиков в различной эффективности антибактериальной терапии при лечении больных внебольничной пневмонией.
Одна из основных тенденций современной фармакотерапии — выработка индивидуального подхода к назначению лекарственных препаратов, направленная на повышение эффективности лечения. На основании данных ранее проведенных исследований установлено, что при воспалении и инфекции происходит изменение уровня активности цитохромов Р450, авторы предполагают задействование системы метаболизма в защите организма от последствий развертывания воспалительных реакций при заболевании [Сибиряк С.В., 2003; Бикмаева А.Р. и соавт., 2004; Prandota J, 2002]. Знания об участии ферментов системы метаболизма в биотрансформации лекарственных препаратов, позволяют найти и избежать причины, определяющие нежелательные проявления терапевтического действия лекарств [Dickinson D.S. et al., 1981; Roy B. et al., 2001; Huang Y. S. et al., 2002, 2003].
Основным органом, участвующим в метаболизме лекарств, является печень, где обозначены самые высокие концентрации ферментов метаболизма по сравнению с другими органами и наибольшее разнообразие экспрессируемых форм [Райс, Гуляева, 2000]. Полиморфизм генов метаболизма ксенобиотиков в настоящее время активно изучается в отношении индивидуальной чувствительности к лекарственной терапии и, особенно в проявлении многообразных побочных реакций, связанных с лечением.
Межиндивидуальная изменчивость до 104 раз характеризует эффективность и безопасность применения большинства лекарственных препаратов [Guengerich F.P. 2003]. Одна из причин, определяющих такую вариабельность - генетически детерминированные различия в активности ферментов детоксикации ксенобиотиков, метаболизирующих лекарственные вещества. Система детоксикации ксенобиотиков состоит из двух стадий. На 1-ой стадии происходит активация соединений посредством цитохромов P-450 и ряда других ферментов, на 2-ой фазе – собственно детоксикация реактивных гидрофильных метаболитов с участием глутатион-S трансфераз и других белков. Кроме детоксикации токсичных экзо- и эндогенных соединений ферментами 1 и 2 стадий, осуществляется также активный выброс этих веществ и их реактивных метаболитов из клеток против градиента концентрации посредством работы белков – транспортеров [ссылка скрыта, ссылка скрыта., 2006]. У ферментов детоксикации ксенобиотиков чрезвычайно широкий спектр субстратов, индукторов и ингибиторов [ссылка скрыта, et al., 2007]. При ряде заболеваний вариабельность индивидуального ответа сопряжена с аллелями генов 2-ой стадии детоксикации ксенобиотиков GSTM1, GSTT1, GSTP1 и гена транспортера ABCB1 (ген P-гликопротеина, другое название – ген полилекарственной резистентности MDR-1) [ссылка скрыта., et al., 2002; Asano T, et al., 2003; ссылка скрыта., et al., 2007; ссылка скрыта, et al., 2008].
В проведенном исследовании по оценке роли фармакогенетического статуса организма были изучены гены II-й фазы детоксикации ксенобиотиков - GSTM1 I/D, GSTP1 A313G и ген ABCB1 T3435C, участвующие в регуляции метаболизма различных лекарственных препаратов и процессах утилизации метаболитов (ксенобиотиков и эндогенных субстратов).
Сопоставление генетических данных с параметрами эффективности антибиотикотерапии позволило выявить сопряженность полиморфизма гена GSTP1 A313G с результатами лечения больных внебольничной пневмонией. Статистически значимыми оказались различия в частотах генотипов гена GSTP1 в группах с альтернативными вариантами терапевтического ответа, а по локусу ABCB1 T3435C – ассоциации получены на уровне тенденции.
Как и в основной группе больных в качестве этиологического фактора в группе К-ВП превалировали пневмококки, составив 48,4%. Среди других возбудителей были выделены:
Haemophilus influenza – 22,6%, Staphylococcus aureus – 16,1%, Neisseria perflora – 6,5%, Streptococcus β-haemolyticus и Morganella morganii – по 3,2%.
Причем, в 33,3% в посевах БАЛЖ были выявлены грибы Candida tropicalis, в 13,3% - Klebsiella pneumoniae, по 6,6% - Pseudomonas spp. и Moraxella catarrhalis, что было расценено как контаминация материала микрофлорой ротовой полости.
Оценка результатов лечения больных с ВП показала, что применение амоксициллина/клавуланата (аугментин) наиболее эффективно у носителей гомозиготного варианта GSTP1 A/A (по точному критерию Фишера р=0,000[3,7Е-4]; OR=2,13; аддитивно р=0,00014).
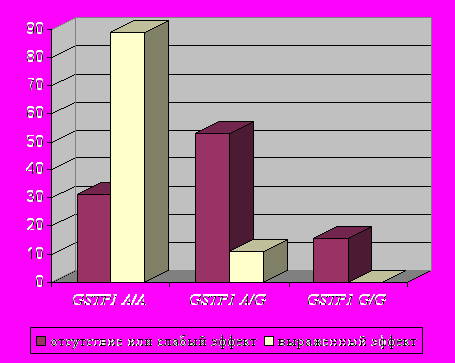
В ходе исследования выявлено, что обладатели данного аллельного варианта (А/А) хуже переносят лечение цефалоспоринами (р=0,003; OR=2,42 по точному критерию Фишера) (рис.3). Достоверно хороший эффект получен при лечении осложненных форм пневмонии левофлоксацином (таваник) в случаях наличия генотипа А/А гена GSTP1 (р=0,003; OR=1,73, зафиксирован аддитивный эффект на уровне тенденции, р=0,06). У больных с минорным аллелем G в гомо- либо гетерозиготном состоянии отмечался положительный эффект применения цефалоспоринов (р=0,00010 по критерию Фишера; OR=2,08) (рис.4).
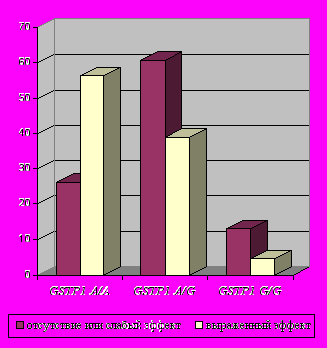  p=0,00013  | 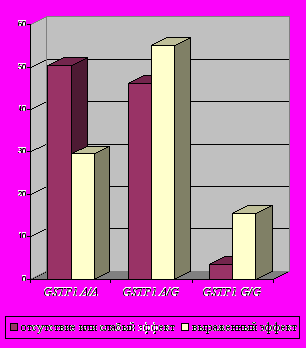  p=0,0001  |
| Рис.3. Встречаемость различных генотипов по локусу GSTP1 A313G среди больных группы ВП (277) в зависимости от эффекта применения амоксициллина/клавуланата (аугментин). | Рис.4. Встречаемость различных генотипов по локусу GSTP1 A313G среди больных группы ВП (277) в зависимости от эффекта применения цефалоспоринов. |
Относительно роли аллелей гена ABCB1 T3435C получены следующие результаты. Эффективность лечения амоксициллином/клавуланатом лучше у обладателей гомозиготного варианта гена (Т/Т), а в случаях гетерозиготного носительства (T/С) достоверно лучше эффективность при назначении цефалоспоринов (цефтриаксон, цефепим) (p=0,043; OR=0,97 по Фишеру; аддитивный эффект р=0,08 по трендовому тесту Армитаж).
При гетерозиготном носительстве также лучше эффективность при лечении карбопенемами/имипенемами (тиенам, меронем), но достоверность результатов не представлена из-за небольшого числа случаев применения препаратов у больных внебольничной пневмонией.
Выявив сопряженность генотипа с эффективностью применения лекарственными препаратами, лечение больных, позднее заболевших из контрольной выборки, осуществляли в зависимости от выявленного генотипа.
Результаты лечения группы К-ВП подтвердили ранее полученные результаты:
- достоверно лучше эффект применения амоксициллина/клавуланата у носителей мажорного варианта гена GSTP1 (генотип А/А) (p=0,000 [7,1E-7] по точному критерию Фишера; OR=2,58) (рис.5);
- лучше эффективность применения цефалоспоринов III-IV поколения по доминантной модели минорного аллеля гена GSTP1 (генотип G/G) (p=0,000 [3,5E-5] по точному критерию Фишера; OR=2,37) (рис.6);
- недостоверно лучше эффект применения таваника у носителей А-аллеля в гомо- или гетерозиготном варианте (малое число наблюдений) (рис.7).
   | 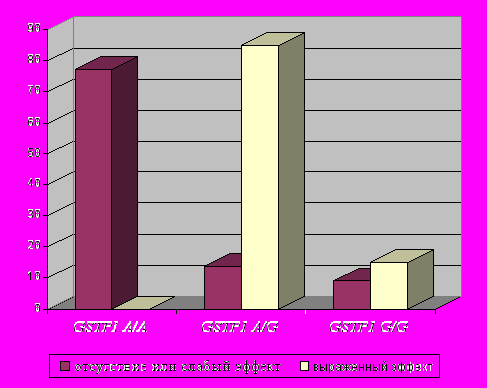   | 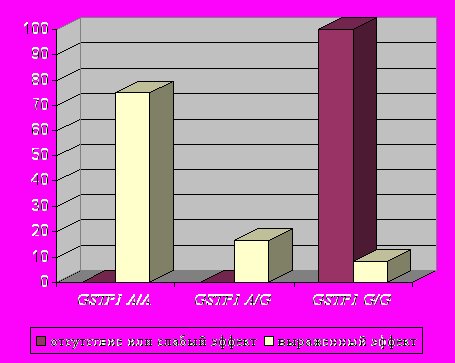   |
| Рис.5. Встречаемость различных генотипов по локусу GSTP1 A313G среди больных группы К-ВП в зависимости от эффекта применения амоксициллина/клавуланата (аугментин). | Рис.6. Встречаемость различных генотипов по локусу GSTP1 A313G среди больных группы К-ВП в зависимости от эффекта применения цефалоспоринов. | Рис.7. Встречаемость различных генотипов по локусу GSTP1 A313G среди больных группы К-ВП в зависимости от эффекта применения левофлоксацина (таваник). |
Значение полиморфизма генов TNF-α, IL-6 у больных исследованных групп
