Учреждения Российской Академии медицинских наук нии общей реаниматологии имени В. А. Неговского рамн автореферат
| Вид материала | Автореферат |
- Учреждения Российской Академии Медицинских Наук Научно-исследовательском институте, 992.11kb.
- Нии общей реаниматологии, 142.73kb.
- Основные научные вопросы: Механизмы развития ордс, 49.74kb.
- «Современные методы диагностики и лечения в реаниматологии», 25.71kb.
- Сергиев Владимир Петрович Член-корреспондент рамн, доктор медицинских наук, профессор, 829.91kb.
- Программ а VIII всероссийского конгресса, 353.79kb.
- На правах рукописи, 694.69kb.
- Структура и экспрессия mmtv-родственного провируса у больных раком молочной железы, 564.57kb.
- X всероссийский конгресс, 364.53kb.
- Автореферат диссертации на соискание ученой степени, 237.83kb.
Внедрение
Результаты выполненного исследования внедрены в практическую работу НИИ общей реаниматологии имени В.А. Неговского РАМН, МГМСУ, Главного военного клинического госпиталя внутренних войск МВД у больных внебольничной пневмонией, пострадавших с ТСТ и раненых в критических состояниях, при развитии нозокомиальной пневмонии. Основные положения исследования включены в курсы лекций сертификационных циклов усовершенствования врачей, проводимых в НИИ общей реаниматологии имени В.А. Неговского РАМН и МГМСУ.
Публикации
Материалы проведенных исследований представлены в 32 научных работах (статьи, тезисы), в том числе 16 из них опубликованы в журналах, входящих в перечень, рекомендуемый ВАК.
Структура и объем диссертации
Диссертация представляет собой том машинописного текста объемом 265 страниц, состоит из введения, обзора литературы, материала и методов исследования, результатов собственных исследований и их анализа, заключения, выводов, практических рекомендаций и списка литературы, содержащего 96 отечественных и 187 зарубежных источников, иллюстрирована 21 фотографиями, 28 рисунками и 20 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Характеристика клинических наблюдений и методов исследования
В исследование включено 712 больных, которые были распределены на следующие группы. Критерии включения: возраст от 18 до 75 лет; информированное согласие; признаки внегоспитальной и нозокомиальной пневмонии согласно принятым классификациям [Чучалин А.Г. и соавт. 2006; Чучалин А.Г., Гельфанд Б.Р., 2009].
Критерии исключения: несоответствие критериям включения; наличие хронических заболеваний органов дыхания (бронхиальная астма, хроническая обструктивная болезнь легких); терминальная стадия онкологического заболевания; заболевания сердечно-сосудистой системы в стадии декомпенсации (NYHA 4 класс); сахарный диабет в стадии декомпенсации; тяжелый неврологический дефицит, оценка по Шкале Ком Глазго (ШКГ) ≤ 8 баллов; наркомания; хронический алкоголизм; иммунодефицит;беременность.
Группу I составили 368 больных острой внебольничной пневмонией (ВП) в возрасте от 18 до 72 лет (26,0±13,9), среди которых 284 пациента – с осложненным течением.
Группа II - 344 пациента с различной нозологией в возрасте от 19 до 75 лет (39,0±15,9), среди которых в 255 случаях развилась нозокомиальная пневмония (НП), а в 89 - нет.
В зависимости от основного заболевания во второй группе были выделены четыре подгруппы:
- «перитонит» - 110 больных в возрасте 48,5±13,9 года с общим перитонитом вследствие следующих причин (панкреонекроз – 33, кишечная непроходимость - 29, несостоятельность ранее выполненного межкишечного анастомоза - 6, перфорация полого органа – 11 (язвенная болезнь желудка и 12 перстной кишки, осложненная кровотечением и перитонитом - 5; острая трофическая язва кишечника – 3, инфекционный энтероколит, осложненный перфорацией кишечника в свободную брюшную полость - 1, перфорация кишечника во время операции на органах малого таза - 1, разрыв кисты почки - 1); тотальное нагноение лапаротомной раны - 4, абсцессы брюшной полости – 10, гангренозно-перфоративный аппендицит – 5, деструктивный холецистит – 12),
- «травма» - 128 пострадавших в возрасте 35,3±15,7 лет (изолированная черепно-мозговая травма (ЧМТ) - 7; спинальная травма – 5; тяжелая сочетанная травма (ТСТ) без повреждения органов грудной полости - 87; ТСТ в сочетании с травмой груди - 29);
- «ранения» - 72 человека в возрасте 27,5±9,1 лет (минно-взрывное - 61, пулевое - 6, ножевое – 3, дробовое - 2);
- в подгруппу «другие» объединены 34 пациента в возрасте 33,4±17,8 лет, у которых НП развилась в результате манифестации инфекции из первичного гнойного очага внелегочной локализации (28 случаев) в период стационарного лечения основного заболевания. В качестве первичного локуса инфекции у данной категории больных были: обширная флегмона - 7, постинъекционные абсцессы - 2, карбункул почки, аппостемотозный пиелонефрит - 9, гангрена культи нижней конечности - 2, остеомиелит костей голени - 2, гнойно-некротический паротит - 1, аденофлегмона подчелюстной области - 2, карбункул затылочной области – 1, гнойный пансинусит – 1, гнойный эпидидимит – 1. Кроме того, в группу включены 6 случаев НП, которая развилась в раннем послеоперационном периоде после планового оперативного вмешательства (2-7-е сутки).
Группу контроля составили 178 здоровых добровольцев из числа доноров и сотрудников госпиталя в возрасте от 18 до 53 лет (21,5±5,5 лет), которые ранее не болели пневмонией.
Группы были сравнимы по полу и возрасту, но отличались по тяжести состояния в группах с нозокомиальной пневмонией при поступлении в ОРИТ (табл.1).
В группе I пневмония с односторонней локализацией – 141 (38,3%) случаев, из них 17 (12,1%) больным был выставлен диагноз крупозной ВП; в 227 (61,7%) случаев - двусторонняя с различным объемом инфильтративных изменений. Диагноз ВП выставляли на основании клинико-рентгенологических и лабораторных данных.
Таблица 1
Сравнительная характеристика больных исследованных групп, (M±σ)
| Показатели | Группа I, n = 368 | Группа II, n = 344 | |||||||
| перитонит, n=110 | травма, n=128 | ранения, n=72 | другие, n=34 | ||||||
| ВП, n=368 | с НП, n=76 | без НП, n=34 | с НП, n=97 | без НП, n=31 | с НП, n=54 | без НП, n=18 | с НП, n=28 | без НП, n=6 | |
| Число больных [абс.знач/% от общего числа в подгруппе] | 368 (100,0) | 76 (69,09) | 34 (30,91) | 97 (75,78) | 31 (24,22) | 54 (75,0) | 18 (25,0) | 28 (82,35) | 6 (17,65) |
| Пол (мужчины/женщины), абс.знач | 350/18 | 54/22 | 30/4 | 88/8 | 27/4 | 53/1 | 16/2 | 24/4 | 5/1 |
| Возраст (лет, M±σ) | 25,5±12,9 | 48,5±13,9 | 43,0±15,1 | 35,4±12,6 | 43,6±16,9 | 27,6±9,1 | 29,1±7,2 | 33,8±17,3 | 39,6±12,4 |
| Тяжесть состояния при поступлении в РАО по шкале APACHE-II (баллы, M±σ) | 12,7±3,2 | 14,6±3,7 | 13,8±3,1 | 15,6±4,3 | 14,3±4,2 | 15,3±3,1 | 13,2±1,1 | 18,6±3,7 | 13,1±3,1 |
| Вариант поступления в РАО [абс.знач/%]:
| 191 (51,9%) 168 (45,7%) 9 (2,5%) - | 15 (19,7%) 30 (39,5%) 31 (40,8%) - | 25 (73,5%) 5 (14,7%) 4 (11,8%) - | 6 (6,2%) 38 (39,2%) 13 (13,4%) 40 (41,2%) | 3 (9,7%) 9 (29,0%) 3 (9,7%) 16 (51,6%) | - 5 (9,3%) 2 (3,7%) 47 (87,0%) | - 5 (27,8%) - 13 (72,2%) | 4 (14,3%) 8 (28,6%) 6 (21,4%) 10 (35,7%) | 2 (33,3%) 3 (50,0%) 1 (16,7%) - |
| Распространенность пневмонии [абс.знач/%]
| 141 (38,3) 227 (61,7) | 33 (43,4) 43 (56,6) | - | 43 (44,3) 54 (55,7) | - | 34 (63,0) 20 (37,0) | - | 9 (32,1) 19 (67,9) | - |
| Длительность ИВЛ/ВВЛ | 4,3±1,5 | 19,3±5,5 | 5,31±1,7 | 21,3±6,5 | 6,4±1,8 | 18,12±1,3 | 6,3±2,8 | 10,2±3,7 | 3,0±1,7 |
| Длительность пребывания в стационаре/ из них в РАО | 35,5±14,2/ 4,5±3,6 | 53,2±19,9/ 26,7±14,5 | 29,3±6,5/ 7,3±1,7* | 98,7±22,1/ 26,8±17,5 | 44,8±11,3*/ 15,4±12,1 | 116,6±89,8/ 31,5±17,1 | 49,3±16,5*/ 13,8±9,2* | 55,3±15,4/ 21,3±10,0 | 31,5±7,9/ 7,8±4,21* |
| Летальность, [абс.знач/%] | 32 (8,7%) | 58 (76,3%) | 1 (2,9%) | 49 (50,5%) | 1 (3,2%) | 26 (48,2%) | - | 18 (64,3%) | - |
Примечание. Достоверность значений при внутригрупповом сравнении показателей: *р≤0,05
Тяжесть ВП оценивали по К.Г. Никулину (1975) и Niederman (1993): легкая степень - 84 (22,8%) пациента, среднетяжелая – 96 (26,01%), тяжелая – 188 (51,1%).
Диагностику нозокомиальной пневмонииику осуществляли на основании критерий, изложенных в российских национальных рекомендациях (2009г), и шкале CPIS (Clinical Pulmonary Infection Score). Во II-й группе из 255 случаев НП: односторонняя локализация зарегистрирована в 46,7% случаев, двусторонняя – в 53,3%.
Длительность стационарного лечения пациентов обеих групп колебалась в широких пределах, составив в I-й группе 31,6±13,1 суток (от 2-х до 128), в случаях госпитализации в ОАР - 5,0±3,4 (от 2-х до 31). Длительность госпитализации больных и пострадавших с НП составила от 6-ти до 323-ти суток (79,1±28,3, из них в ОАР 25,6±18,1); в группе без НП – от 24-х до 118-ти суток (44,7±13,3, из них в ОАР 11,6±5,9).
В каждой группе были выделены подгруппы с благоприятным исходом «выжившие» и с неблагоприятным - «умершие». Летальность в группе I составила – 8,7% (32 из 368), в группе II – 44,8% (153 из 344).
Оценку степени тяжести состояния больных осуществляли по оценочным шкалам APACHЕ-II. Диагностика сепсиса, инфекционно-токсического шока (ИТШ) и полиорганной недостаточности (ПОН) осуществляли в соответствии с критериями Американского Колледжа Пульмонологов и Общества Реаниматологов, Согласительной Комиссии Российского Общества Реаниматологов, Согласительной конференции ACCP/SCCM в 1992 г., дополненные в 2001 г.
Материалом для бактериологического исследования были: бронхоальвеолярный лаваж (БАЛЖ), венозная кровь, содержимое плевральной полости при ее пункции или дренировании, гнойное отделяемое из ран у пациентов группы II, а также участки ткани легкого и содержимое трахеобронхиального дерева во время патоморфологичекого исследования.
Клинический и биохимический анализы крови выполняли на автоматическом гематологическом анализаторе Advia 60 (Bayer, Германия). Для проведения мониторинга газового состава смешанной венозной и артериальной крови, кислотно-основного и электролитного баланса использовали газоанализаторы «Ciba – Corning/Diagnostics (348)», «Ciba – Corning 644 Na+/K+/Cl- Analyzer» (США), Bayer 865 Blood Gas Analyzer (Bayer, Германия) и Radiometer ABL800 Flex (Австрия).
Регистрацию острого респираторного дистресс-синдрома (ОРДС) у пациентов исследованных групп осуществляли по совокупности результатов клинических данных, лабораторных и рентгенологических исследований: степень повреждения легких по шкале J. Murray et al. (1988), критерии Американо-Европейской согласительной конференции по ОРДС (1994), критерии ОРДС, предложенные НИИ общей реаниматологии имени В.А. Неговского РАМН (2006). Стадию ОРДС определяли в соответствии с классификацией НИИ общей реаниматологии имени В.А. Неговского РАМН (2007).
Морфологическое исследование
Для выявления особенностей патоморфологических изменений в легких были проанализированы 118 протоколов патологоанатомического исследования (ПАИ). Среди изученных результатов были 25 случаев внебольничной пневмонии и 93 - нозокомиальной. Во всех наблюдениях были оценены макро- и микроскопические изменения в легких.
Определение содержания цитокинов
Определено содержание провоспалительных и противовоспалительных (IL–1α, IL-1β, IL-4, IL-6, IL-8, IL-10 и TNF-α) цитокинов у 138 больных пневмонией различного генеза на 1-3-7-14-е суткам госпитализации и у 28 человек из контрольной группы. Среди больных были: 42 пациента с ВП (из группы I) и 96 - с НП (из группы II).
Материалом исследований были: сыворотка венозной крови и бронхоальвеолярная лаважная жидкость (БАЛЖ). Забор венозной крови для определения цитокинов проводили в утренние часы, натощак, до введения антибактериальных средств. БАЛЖ получали при бронхоскопии. Содержание цитокинов определяли методом твердого иммуноферментного анализа с использованием моноклональных антител на вертикальном фотометре Stat Fax 2100 (AWARENESS TECHNOLOGY Inc., США) c использованием тест-систем BioSonroe International (Франция) для IL-4, IL-8 IL-10, BioSource International (Австрия) для TNF-α, IL-6, IL-1β согласно прилагаемой инструкции. Единица измерения пикограмм в миллилитре (пг/мл) биологической жидкости.
Генетическое исследование
Молекулярно-генетическое исследование выполнено в лаборатории экологической генетики Учреждения Российской академии наук Института общей генетики им. В.Н. Вавилова РАН.
Изучен полиморфизм десяти генов у 702 человек, среди которых:
- 277 больных внебольничной пневмонией (из группы I) – ВП, из них 193 пациента с осложненным течением заболевания – группа ВП-осл.
- 158 пациентов с нозокомиальной пневмонией (из группы II: «перитонит» – 51, «травма» - 62, «ранения» - 29, «другие» - 16) – группа IIА;
- 89 больных с анологичной нозологией, что и во второй группе, но у которых не развилась нозокомиальная пневмония («перитонит» - 34, «травма» - 31, «ранения» - 18, «другие» - 6) – группа IIВ
- 178 здоровых доноров. Группа контроля для всех исследований была идентична.
Больные и здоровые доноры были включены в исследование добровольно (либо получено согласие родственников), принадлежат к европеоидной расе, большая часть (83,4%) проживает в Центральной части России. Во всех группах превалировали мужчины молодого возраста.
Основные характеристики изученных генов
Гены, аллельные варианты которых при наличии определенных условий предрасполагают к определенным заболеваниям, получили название генов предрасположенности, то есть это измененные гены (аллели), которые совместимы с рождением и жизнью в постнатальном периоде, но при определенных неблагоприятных условиях способствуют развитию того или иного заболевания. Именно аллельные варианты генов предрасположенности составляют основу таких частых заболеваний как атеросклероз, ишемическая болезнь сердца, диабет, бронхиальная астма, опухоли и др. Сочетания аллельных вариантов различных генов, вовлеченных в развитие каждой конкретной патологии, получили название «генных сетей» [Баранов В.С. и соавт., 2008].
Многообразие функций легких обусловило выбор широкого спектра генов-кандидатов. Система биотрансформации ксенобиотиков при согласованном функционировании защитных механизмов служит эффективной защитой от различных токсикантов внешней среды, поступающих с вдыхаемым воздухом. Глутатион S-трансферазы - суперсемейство ферментов, участвующих в метаболизме большого числа электрофильных ксенобиотиков через конъюгацию с глутатионом, а также в метаболизме ряда эндогенных субстратов (гормонов, липидов, простагландинов, лейкотриенов). Поэтому, метаболизм ксенобиотиков через глутатионопосредованную детоксикацию играет важную роль в обеспечении устойчивости клеток к перекисному окислению жиров, свободным радикалам, алкилированию белков, в формировании резистентности к лекарственным препаратам и предотвращении поломок ДНК [Брагина Е.Ю., 2005].
Таблица 2
Характеристика исследованных генов
| Гены | Вид полимор-физма | Локализация в геноме/ идентификационный номер SNP | Функция фермента | Фенотип минорного варианта | Средние частоты генотипов (данные OMIM) |
| CYP1A1- ген цитохрома 1a 1 | A4889G Ile462Val | 15q22-q24 rs1048943 | 1фаза детоксикации ксенобиотиков цитохром P-450-зависимыми монооксигеназами: окисление стероидов, жирных кислот, многочисленных генотоксикантов | Активность фермента повышена для генотипа G/G | A/A-0.9 A/G-0.09 G/G-0.01 |
| T3801C | 15q22-q24 rs4646903 | Увеличенная индуцибельность фермента для генотипа T/C и C/C | T/T-0.62 T/C-0.38 C/C-0.00 | ||
| 606G>T= A606C | 15q22-q24 rs2606345 | Данный SNP находится в 1 интроне, влияние на активность неизвестно | A/A-0.2, A/C-0.7 C/C-0.1 | ||
| GSTM1- ген глутатион S-трансферазы мю1 | Инсерция (+) - делеция (0) | ссылка скрыта - | 2 фаза детоксикации ксенобиотиков: присоединение восстановленного глутатиона к широкому спектру экзогенных и эндогенных гидрофобных электрофильных соединений | Отсутствие фермента: 0/0. Наличие фермента: +/0 либо +/+ | +/+-0.12 +/0-0.38 0/0-0.50 |
| GSTT1- ген глутатион S-трансферазы тетта1 | Инсерция (+) - делеция (0) | 22q11.2 - | Отсутствие фермента: 0/0. Наличие фермента: +/0 либо +/+ | +/+-0.38 +/0-0.42 0/0-0.20 | |
| GSTP1- ген глутатион S-трансферазы пи1 | A313G Ile105Val | ссылка скрыта rs1695 | Различная активность относительно разных субстратов для фермента, продуцируемого альтернативными аллелями. Пониженная активность фермента для генотипа G/G | A/A-0.47 A/G-0.40 G/G-0.13 | |
| MTHFR- ген метилен-тетрагидрофолат-редуктазы | C677T Ala222Val | 1p36.3 rs1801133 | Катализирует единственную внутриклеточную реакцию образования 5,10-метилентетрагидрофолата в 5-метилтетрагидрофолат, который необходим для восстановления гомоцистеина до метионина | Пониженная на 70% активность и повышенная термолабильность фермента для генотипа T/T | С/С-0.49 C/T-0.45 T/T-0.06 |
| ACE- ген ангеотензин-1 конвертирующего фермента (АПФ) | Alu-элемент ins/del (287 п.о.) | 17q23.3 rs4340 | Катализирует превращение ангиотензина I в физиологически активный пептид ангиотензин II. АПФ играет ключевую роль в ренин-ангиотензиновой системе. | Делеционный полиморфизм ассоциирован с повышенным: уровнем АПФ, индексом массы тела, кардиоваскулярным риском. | I(ins)-0.7 D(del)-0.3 |
| CCR5- ген хемокинового рецептора 5 | del-32 п.о. | 3p21.31 rs333 | Рецептор для воспалительных CC-хемокинов. Передача сигнала осуществляется за счет увеличения концентрации внутриклеточного Ca. Экспрессируется T лимфоцитами и макрофагами, является ко-рецептором для макрофаг-тропных вирусов, включая HIV, необходим для проникновения вируса в клетки хозяина. Носители дефектных аллелей (делеция 32 п.о.) резистентны к HIV инфекции. | В результате делеции наступает сдвиг рамки считывания и преждевременная терминация трансляции, образуется сильно усеченный фермент, который не обнаруживается на поверхности клеток | I(ins)-0.95 D(del)-0.05 |
| TNF-α- ген фактора некроза опухолей α | G308A | ссылка скрыта rs1800629 | TNF- α – цитокин, оказывающий действие на разные типы клеток благодаря модуляции экспрессии генов ростовых факторов, цитокинов, факторов транскрипции, рецепторов клеточной поверхности и острофазовых белков; играет важную роль в иммунном ответе против инфекции и опухолевого роста; стимулирует катаболизм; является ключевым медиатором воспаления | Полиморфный вариант G308A находится в промоторе гена, аллель A ассоциирован с увеличенной продукцией белка | G/G-0.68 A/G-0.32 |
| IL-6 – ген интерлейкина 6 | G174C= G236C | ссылка скрыта rs1800795 | IL-6 - цитокин, участвует в иммунном ответе и острофазовой реакции. Может модифицировать эффекты других цитокинов и взаимодействовать с глюкокортикоидами. | Предковый аллель G ассоциирован с большей активностью транскрипции, более высокой индуцибельностью и более высокими концентрациями соответствующего белка в плазме крови | G/G-0.26 C/G-0.48 C/C-0.26 |
| ABCB1 - ген Р-гликопротеина | T3435C | 7q21.1 rs1045642 | 3-я фаза детоксикации. ссылка скрыта, ссылка скрыта из семейства ссылка скрыта. Обеспечивает перенос многих веществ (липиды, стероиды, пептиды, билирубин и др.) через мембрану клетки. | Предполагается уменьшенная активность P-гликопротеина у носителей T-аллеля | T/T-0.23 T/C-0.62 C/C-0.15 |
Наиболее полно ферменты детоксикации представлены в печени, но для большинства из них, характерна экспрессия и в других органах, в том числе, в легких и бронхах, например, глутатион-S-трансфераз (GST) и цитохромов Р-450. CYP1A1 – индуцибельный фермент 1 фазы детоксикации, который под воздействием многих вредных факторов в наиболее высоких концентрациях регистрируется в легких. Выбор генов детоксикации ксенобиотиков в качестве генов-кандидатов был обусловлен, с одной стороны, их участием в развитии воспаления, органоспецифичностью некоторых из них к легочной ткани, с другой стороны, широкой распространенностью минорных вариантов и их комбинаций, что может быть использовано в качестве прогностического критерия при определении тактики ведения пациентов с пневмонией.
Была изучена генетическая изменчивость для следующих генов-кандидатов (табл.2): гены первой фазы детоксикации ксенобиотиков (3 полиморфных сайта гена CYP1A1: A4889G, T606G и T3801C), второй фазы (GSTM1 Ins/Del, GSTT1 Ins/Del, GSTP1 A313G), ген трансмембранного P-гликопротеина - ABCB1 T3435C, гены цитокинов ( TNF-α G308A, IL-6 G174C). Учитывая мнообразие функций органов дыхания, в исследование также были включены гены, участвующие в регуляции других систем гомеостаза, и которые, по литературным данным, обуславливают риск развития острых и хронических заболеваний органов дыхания: ключевой ген ренин-ангиотензиновой системы (ACE Ins/Del), ген хемокинового рецептора 5 (CCR5 Ins/Del) и ген, ответственный за синтез и метилирование ДНК, ( MTHFR C677T).
Методической основой генотипирования явилась аллель-специфическая тетрапраймерная полимеразная цепная реакция (ПЦР). Метод позволяет в одной пробирке амплифицировать фрагменты ДНК различной длины, соответствующие альтернативным аллелям. Усложненная система подбора праймеров обеспечивает быстрое, надежное и дешевое генотипирование, которое проводится в один этап на стандартном оборудовании для ПЦР-лаборатории.
Подбор генов-кандидатов осуществлялся с учетом функционального характера полиморфизма, наличием сопряженности с изменением активности и/или количества соответствующего фермента, а также ассоциаций с различными биологическими эффектами и заболеваниями. Частота минорного варианта не менее 5%. Для исключения вероятности ингибирования ПЦР-реакции образцы проб с делеционными вариантами GSTM1 0/0 GSTT1 0/0 дополнительно проверяли отдельной ПЦР с внутренним контролем.
Для изученных генов характерны 2 вида полиморфизма:
- инсерционно-делеционный – то есть наличие (инсерция), либо отсутствие (делеция) участка гена: для GSTM1~15000 п.н., для GSTT1 ~54000 п.н., для ACE – 287 п.н., для CCR5 – 32 п.н.
- однонуклеотидный полиморфизм (Single Nucleotide Polymorphism – SNP) – для всех трех сайтов гена CYP1A1 и генов GSTP1, MTHFR, TNF-α, IL-6, ABCB1.
В случае делеционно-инсерционного полиморфизма (GSTM1, GSTT1) выявлялись два генотипа: «нулевой» - гомозигота по делеции (D/D) и «положительный», несущий функциональный аллель в гомо- или гетерозиготном состоянии (I/).
Основные компоненты лечения
Всем исследуемым больным проводили лечение в зависимости от тяжести основного заболевания и развившихся осложнений согласно современным рекомендациям.
Респираторную поддержку проводили аппаратами «Puritan Bennett 7200, 800» (Puritan-Bennett Corporation, США), Evita-XL (Draeger, Германия). Применяли вспомогательные режимы вентиляции SIMV и BIPAP в режиме с контролем по объему или по давлению. При развитии ОРДС применяли рекрутмент, в одном случае применяли эндобронхеальное введение сурфактанта BL (Санкт-Петербург, Россия) с последующим маневром «открытия легких». Параметры ИВЛ ежедневно регистрировали и корригировали в соответствии с клинической ситуацией. У больных с сепсисом, органной недостаточностью применяли экстракорпоральные методы дезинтоксикации (гемодиафильтрация, гемодиализ, дискретный плазмаферез). При выборе антибактериальной терапии основывались на Российские Рекомендации по лечению внебольничной и нозокомиальной пневмонии.
Группа I: в случаях неосложненного течения ВП назначали амоксициллин/клавулановая кислота (аугментин в/в) или цефтриаксон; при осложненном течении - в зависимости от тяжести состояния больного и вида осложнения - левофлоксацин (таваник), цефепим, тиенам, сульперазон - в/в капельно.
Группа II: применение антибактериальных препаратов начинали с момента поступления больного в зависимости от основной нозологии. Как правило, в качестве «стартовой» терапии использовали цефтриаксон, левофлоксацин (таваник) в сочетании с метронидазолом, а в случаях исходного тяжелого состояния и при развитии осложнений - тиенам или меронем. В дальнейшем, антимикробная терапия зависела от результатов микробиологического исследования и результатов антибиотикограммы.
Больным пневмонией из группы контроля антибактериальную терапию назначали с учетом выявленных генотипов.
Критерии эффективности лечения:
- Выздоровление определяли как полное исчезновение всех субъективных и объективных клинических признаков заболевания и положительная динамика по данным рентгенологических методов исследования. Применительно к пациентам с ВАП выздоровление заключалось в нормализации температуры, снижении количества лейкоцитов, повышении респираторного индекса, улучшении аускультативной картины, положительной динамике ранее выявленных рентгенологических изменений
- Отсутствие эффекта определяли на основе следующих критериев: персистировние или усиление выраженности клинико-лабораторных признаков заболевания через 3-5 дней от начала терапии; развитие новых очагов инфекции или прогрессирование рентгенологических изменений; смерть от пневмонии; необходимость дополнительной антибактериальной терапии.
- Рецидив инфекции расценивали как отсутствие эффекта.
Методы статистического анализа данных
Статистическую обработку материала проводили с использованием программных средств пакетов «STATISTICA v.6.0», «Statgraphics v.2.1». Использовали общепринятые математико-статистические методы расчета основных характеристик выборочных распределений: среднее арифметическое (M), ошибка среднего (m), стандартное отклонение (σ), t-критерий Стьюдента. Проведен корреляционный анализ с использованием коэффициентов парной линейной корреляции (r), тетрахорического показателя связи для качественных признаков и анализа уровня их статистической достоверности (р). Достоверным считалось различие при p<0,05.
Оценки частот гаплотипов и их эффектов были получены с помощью компьютерной программы SNPStats. Программа позволяет строить регрессионные модели количественных и бинарных признаков для произвольных типов детерминации (доминантный, рецессивный, аддитивный). Значимость различий частот генотипов оценивали с помощью точного критерия Фишера и трендового теста Армитажа.
Степень асоциации генотипов с заболеванием определяли с помощью показателя «odd ratio» (OR – мера коррелятивной связи), равного:
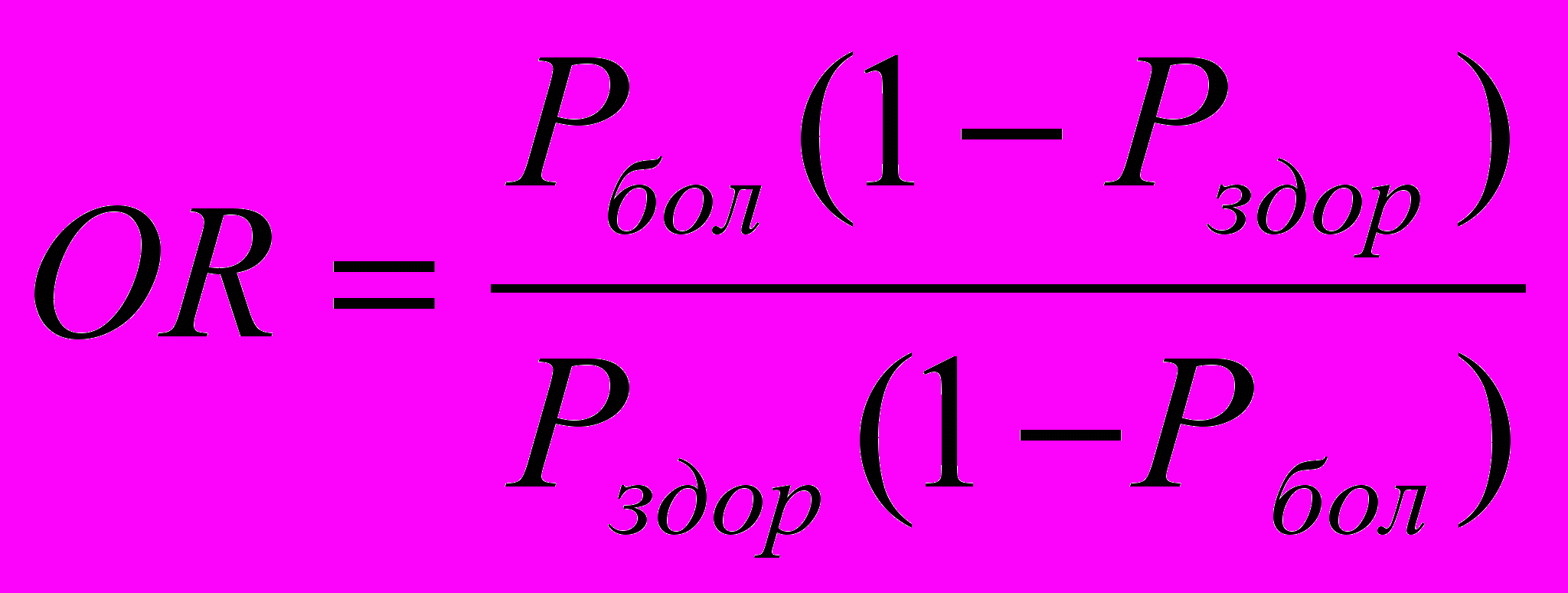 ,
,где
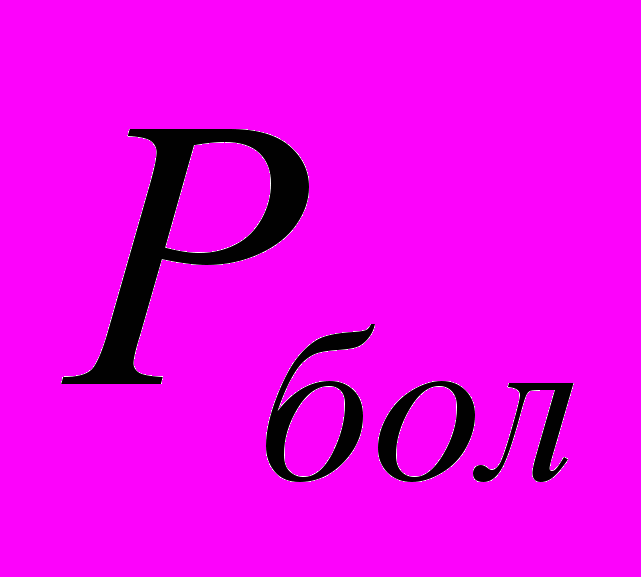 - частота генотипа среди больных,
- частота генотипа среди больных, 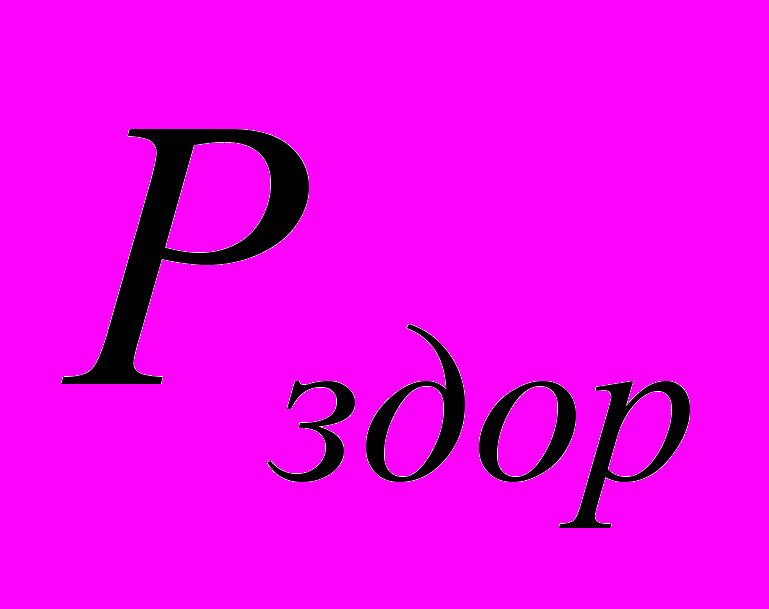 - частота генотипа среди здоровых.
- частота генотипа среди здоровых.Полученные результаты трактовали следующим образом:
- OR=1 – указывает на отсутствие корреляций между генотипом и заболеванием.
- OR>1 - означает повышенный риск заболевания при данном генотипе.
- OR<1 – указывает на протективный эффект данного генотипа относительно риска
- развития заболевания.
- развития заболевания.
При определении прогностических факторов для каждого из них были рассчитаны характеристики: чувствительность, специфичность, доля правильных прогнозов, относительный риск (relative risk).
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Патоморфоз внебольничной и нозокомиальной пневмонии
Изучение патоморфоза вносит коррективы в критерии диагностики, классификацию и описание болезней. Изменения клинических и морфологических проявлений болезни по сравнению с классическими их описаниями под влиянием различных факторов внешней среды, биологических и социальных, в том числе в результате совершенствования методов лечения называется патоморфозом [Малая медицинская энциклопедия, 1991—96 гг.]. Термин «патоморфоз» ввел немецкий психолог ссылка скрыта (Willy Hellpach) в 1929 году. Преимущественно в понятие патоморфоза вкладывают значение появившегося под воздействием внутренних и внешних факторов стойкого изменения патогенетической сущности процесса заболевания, которое находит свое отражение в изменении форм, клинической картины, течения заболеваний, вплоть до исчезновения некоторых нозологий. В связи с длительными лечебно-профилактическими мероприятиями возникает терапевтический патоморфоз. Наиболее существенна и достоверно доказана роль активных профилактических и лечебных мероприятий, особенно антибиотической терапии. Современная активная ссылка скрыта, гормонотерапия и другие методики изменяют картину болезни, лишая ее типичных черт. Это, так называемый, терапевтически обусловленный патоморфоз, резко изменивший не только картину многих болезней, но и заболеваемости. Под влиянием лекарственного патоморфоза происходят существенные изменения синдромогенеза заболевания [Никифоров А.С., 2010].
В результате проведенного исследования выявлены изменения в этиологическом спектре пневмоний и в структуре осложнений. Так, возросла роль микробных ассоциаций не только при развитии нозокомиальной пневмонии, но и при возникновении внебольничной, особенно в случаях осложненного течения и неблагоприятного исхода заболевания.
Результаты бактериологического исследования БАЛЖ и ткани легких умерших свидетельствуют о преобладании пневмококков (45,5%) среди выявленных возбудителей ВП, но в качестве монофлоры верифицирован лишь в трех случаях.
Возросла роль сочетаний различных стрептококков со стафилококками и грибами рода Candida. Следует отметить, что на долю ассоциаций микробной флоры пришлось 81,3%. В качестве этиологического фактора при деструктивной пневмонии были регистрированы St.aureus и Kl.pneumoniae в виде монофлоры или в ассоциации с другими патогенами. Обнаружение в БАЛЖ таких возбудителей, как St.aureus МRSA, Ac.baumannii, Ps.aerogenes было расценено как суперинфицирование больных с внебольничной пневмонией, длительно находившихся в стационаре.
Бактериологическое исследование БАЛЖ группы II выявило в 83,3% случаев микробные ассоциации, где 61,0% составил St.aureus, в том числе метициллинрезистентные St.aureus (MRSA), в 52,5% - Ps.aerugenosa. Грамотрицательная флора в 80,6% представлена за счет Kl.pneumoniae, Acinetobacter spp. и E.coli.
По результатам лечения больных летальность в группе I составила – 8,69% (32 из 368), в группе II – 44,48% (153 из 344). Патологоанатомическое исследование проведено в 118 случаях: 25 – внебольничной пневмонии и 93 – нозокомиальной. При бактериологическом исследовании БАЛЖ среди умерших микробные ассоциации были верифицированы в большинстве случаев (табл.3).
Таблица 3
Разновидности микробных ассоциаций, выделенных из БАЛЖ, умерших пациентов исследованных групп.
| Виды микробных ассоциаций в исследуемых группах | частота выявления |
| Группа I, n = 13:
| 5 3 2 1 2 |
| Группа II, n=59:
| 12 13 3 11 6 11 3 |
В качестве непосредственной причины смерти были:
в группе I: пневмония (68,0%) и ОРДС на фоне пневмонии (12,0%)
во II-й группе: токсемия вследствие основного заболевания (22,6%), сочетание нескольких причин (21,5%), пневмония (15,1%), сепсис (12,9%) и прогрессирование органной недостаточности (17,3%) (таб.4).
Таблица 4
Непосредственные причины смерти у больных исследованных групп
по результатам аутопсии
| Показатели | Частота встречаемости показателя, [абс.зн/%] | |
| Непосредственная причина смерти | Группа I, n=25 | Группа II, n=93 |
| Пневмония | 17 (68,0) | 14 (15,1) |
| Токсемия вследствие основного заболевания | - | 21 (22,6) |
| Сепсис | - | 12 (12,9) |
| Органная недостаточность | 1 (4,0) | 16 (17,2) |
| ОРДС | 3 (12,0) | 4 (4,3) |
| Некардиогенный отек легких | 2 (8,0) | 1 (1,1) |
| Геморрагический шок (кровопотеря) | 1 (4,0) | 2 (2,1) |
| ТЭЛА | - | 2 (2,1) |
| Отек головного мозга | - | 1 (1,1) |
| Сочетание различных осложнений | 1 (4,0) | 20 (21,5) |
Анализ клинико-лабораторных и морфологических данных показал, что ОРДС, включая острое повреждение легких, у больных пневмонией различного генеза, встречался чаще, по сравнению с традиционными представлениями.
При внебольничной пневмонии ОРДС зарегистрирован в 36,0% (13 из 25) наблюдений, в двенадцати случаях - на фоне прогрессирования воспаления в легких, в одном – после гемотрансфузии у больного с двусторонней полисегментарной пневмонией, осложненной острой перфорацией язвы желудка, внутрибрюшным кровотечением.
Разнообразие нозологических форм основного заболевания у пациентов II-й группы обусловило разнообразие причин развития острой дыхательной недостаточности (ОДН). В группе нозокомиальной пневмонии ОДН в 44,1% случаев (41 из 93) была обусловлена различными стадиями ОРДС, что самостоятельно или в сочетании с другими осложнениями послужило причиной летального исхода. В 46,3% случаев (19 из 41) ОРДС предшествовал появлению пневмонической инфильтрации, в остальных - на фоне нозокомиальной пневмонии.
При этом, независимо от причины, вызвавшей ОРДС, морфологические изменения в легких носили схожий характер. В случаях нозокомиальной пневмонии в различных участках легких можно было увидеть практически все стадии развития процесса.
При гистологическом исследовании легких умерших на ранних стадиях ОРДС, отмечали ателектазы, отек межальвеолярных перегородок, в некоторых из них – диапедезные кровоизлияния, в просветах альвеол обнаруживаются полинуклеары, макрофаги и фибрин. Во всех случаях отмечены признаки расстройства кровообращения: расширение просвета сосудов, утолщение стенок, наличие в просвете сосудов агрегированных эритроцитов.
На вторые-третьи сутки ОРДС преобладал интерстициальный отек, выявляли гиалиновые мембраны. Через пять суток превалировали воспалительные изменения, отмечался резкий альвеолярный отек (субтотальный или тотальный), многочисленные кровоизлияния, увеличивалось количество гиалиновых мембран. В таких случаях развития ОРДС на фоне внебольничной пневмонии на первый план выступали процессы воспаления, так как распространение инфильтрации приводило к углублению структурных нарушений в легких и сопровождалось характерными клиническими и лабораторными признаками (наростанием дыхательной недостаточность, гипоксемии, лейкоцитоза и т.д.).
Анализ результатов патологоанатомических исследований легких пациентов, длительно находившихся на ИВЛ (более 10 суток), показал, что в большинстве случаев при небольшой продолжительности респираторной поддержки (до 7 суток) доминируют изменения, присущие ОРДС: увеличение массы легких, интерстициальный и альвеолярный отек, стаз и сладжирование форменных элементов крови в капиллярах, лейкостазы, фибриновые тромбы, кровоизлияния, гиалиновые мембраны, ателектазы и дизтелектазы.
По мере увеличения продолжительности ИВЛ превалировали изменения воспалительного характера: наличие гнойных очагов, скопление экссудата, состоявшего из полиморфноядерных нейтрофилов, макрофагов, фибрина и слущенного эпителия в альвеолах, нейтрофильная инфильтрация межальвеолярных перегородок с их последующим формированием абсцессов, эмпиемы плевры.
Причины патоморфоза сложны и многообразны. Предполагаемая возможная причина естественной эволюции болезни (естественный патоморфоз) кроется в эволюции патогенных свойств возбудителя (мутаций бактерий и вирусов), а также сдвигов в иммунном статусе человека (генетически закрепленная иммунизация организма) [Блейхер В.М., Крук И.В., 2002].
Роль полиморфизма генов-кандидатов в предрасположенности к риску возникновения пневмонии различного генеза
