Секция 1 Аналитическая химия
| Вид материала | Доклад |
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Рабочая программа по дисциплине «Спектральные методы анализа» для специальности 020101, 175.88kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины аналитическая химия Направление подготовки, 1181.86kb.
- Неорганическая и аналитическая химия, 221.14kb.
- Программа «аналитическая химия» по направлению подготовки 020100 «Химия», 31.74kb.
- Рабочей программы учебной дисциплины аналитическая химия уровень основной образовательной, 52.53kb.
- Примерная программа наименование дисциплины «Неорганическая и аналитическая химия», 341.23kb.
- Конспект лекций по курсу «Неорганическая и аналитическая химия», 18.21kb.
ОДНОВРЕМЕННОЕ ОПРЕДЕЛЕНИЕ ПЕСТИЦИДОВ РАЗЛИЧНЫХ КЛАССОВ В ПРИРОДНЫХ ВОДАХ МЕТОДОМ МИЦЕЛЛЯРНОЙ ЭЛЕКТРОКИНЕТИЧЕСКОЙ ХРОМАТОГРАФИИ
Большаков Д.С.
Владимирский государственный университет,
Владимир, Россия.
Аспирант 2г.
bolshakov@arriah.ru
Научный руководитель: Амелин В.Г.
Пестициды представляют собой один из наиболее опасных классов загрязняющих окружающую среду веществ и оказывают негативное воздействие на здоровье человека, животных, флору и фауну. Совместное применение пестицидов (комбинированные пестициды) дает возможность снизить затраты на обработку и получить максимальный экономический эффект их применения.
Для определения единичных пестицидов или их отдельных классов используют методы газовой хроматографии и ВЭЖХ с различными детекторами, капиллярного электрофореза, но не уделяется должного внимания взаимному влиянию на разделение и определение пестицидов при их совместном применении.
В данном сообщении показана возможность одновременного определения 39 пестицидов, относящихся к различным классам химических соединений (неоникотиноиды, сим-триазины, фосфорорганические соединения, карбаматы, производные феноксикарбоновых кислот, мочевины, триазола, триазинона, имидазола/имидазолинона и бензимидазола) в природных водах методом мицеллярной электрокинетической хроматографии.
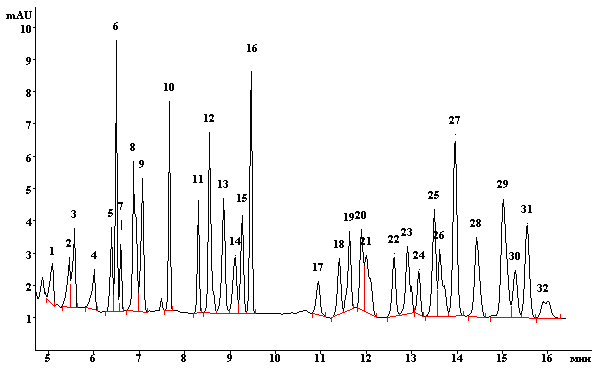
Электрофореграмма стандартного раствора пестицидов (с = 5 мг/л)
1 – метамитрон; 2 – имидаклоприд; 3 – пиразон (хлоридазон); 4 – симазин; 5 – тиабендазол + тиофанат-метил; 6 – метсульфурон-метил + трибенурон + триасульфурон; 7 – имазетапир; 8 – атразин + имазапир; 9 – десметрин; 10 – метсульфуронметил + трибенурон; 11 – дикамба; 12 – 2,4-Д; 13 – флуометурон; 14 – карбарил; 15 – флутриафол; 16 – хлортолурон + 6-хлорникотиновая кислота; 17 – малатион; 18 – тидиазурон; 19 – триадименол; 20 – триадимефон; 21 – диурон; 22 – тритиконазол; 23 – линурон; 24 – ципроконазол; 25 – хлоробромурон; 26 – диазинон + пропиконазол; 27 – имазалил + эпоксиконазол; 28 – тебуконазол + пропиконазол; 29 – пенконазол + пиримифос-метил; 30 – прохлораз; 31 – диниконазол; 32 – дифеноконазол.
Использовали систему капиллярного электрофореза «Капель-105М» (ООО «Люмэкс», Россия), оснащенную УФ-детектором. Для повышения селективности и чувствительности оптимизированы основные параметры электрофоретического процесса: разделение осуществляли в немодифицированном кварцевом капилляре (эффективная длина 50 см, внутренний диаметр 75 мкм), температура 20 °С, детектируемая длина волны 190 нм, напряжение +25 кВ. В качестве ведущего электролита использовали смесь 15 мМ тетрабората натрия, 30 мМ ДДС, 10 мМ фосфата тетрабутиламмония, содержащую 10 % ацетонитрила. На рисунке показана электрофореграмма стандартной смеси пестицидов, полученная в данных условиях.
Для извлечения и концентрирования пестицидов из природной воды использовали твердофазную экстракцию (картриджи «Oasis HLB» 3 cc 60 mg). Пределы обнаружения (S/N =3) составили 0,2 – 4,0 мкг/л при степени концентрирования равном 400 (объем анализируемой пробы 200 мл). Степень извлечения пестицидов составила 60 – 110 %. Относительное стандартное отклонение результатов анализа не превышает 0,15.
Методика успешно применена для определения пестицидов в природных водах некоторых сельскохозяйственных районов Владимирской области, по итогам которых выявлено наличие ряда пестицидов в анализируемых образцах.
ОПРЕДЕЛЕНИЕ ФЕНОТИАЗИНОВ С ПОМОЩЬЮ ГЕМСОДЕРЖАЩИХ БИОКАТАЛИЗАТОРОВ В ВОДНОЙ И ВОДНО-ОРГАНИЧЕСКОЙ СРЕДАХ
Борзенкова Н.В.
Московский государственный университет имени М.В. Ломоносова,
Москва, Россия.
Аспирант 3г.
nvborzenkova@gmail.com
Научный руководитель: Шеховцова Т.Н.
Фенотиазины широко используют в медицине в качестве нейролептических, антидепрессивных, антиаритмических и др. средств. Для них характерно проявление побочных эффектов и длительное выведение из организма, а их передозировка может приводить к отравлениям и даже летальному исходу. В связи с этим необходим строгий контроль содержания фенотиазинов в крови и моче больных, а при патологоанатомических исследованиях также и во внутренних органах (желудочно-кишечном тракте, легких, почках). Для экстракции фенотиазинов из биологических объектов, а также растворения лекарственных средств при подготовке к анализу часто применяют органические растворители, в частности диметилсульфоксид (ДМСО). Вследствие этого актуальна разработка методик определения фенотиазинов в присутствии этого растворителя. Для решения указанных задач перспективно применение биологических катализаторов.
Целью настоящего исследования явилось сравнение каталитической эффективности гемсодержащих биокатализаторов – фермента пероксидазы хрена (нативного и включенного в комплекс с полисахаридом хитозаном) и белка гемоглобина в реакциях окисления промазина и хлорпромазина и разработка методик их определения.
Оптимизированы условия проведения окисления фенотиазинов пероксидом водорода в присутствии каждого из биокатализаторов. Установлено, что оптимальная концентрация гемоглобина в 55 раз превышает концентрацию пероксидазы в реакции окисления промазина и в 25 раз выше в реакции окисления хлорпромазина, что обусловлено разной природой этих катализаторов. На примере промазина показано, что пероксидаза более эффективный, чем гемоглобин, катализатор окисления фенотиазинов в водной среде (kcat/Km 2,0·104 и 2,6·102 с-1·мкМ-1 соответственно). Разработаны методики определения промазина и хлорпромазина в диапазонах концентраций (10 – 100) мкМ и (10 – 200) мкМ с использованием гемоглобина и пероксидазы соответственно.
Основное ограничение использования ферментативных методов при определении малорастворимых в воде соединений в сложных матрицах заключается в недостаточной стабильности и активности биокатализаторов в органических и водно-органических средах. На примере промазина нами изучено влияние природы полярного органического растворителя на скорость биокаталитического окисления фенотиазинов. Найдено, что как в присутствии пероксидазы, так и гемоглобина скорость окисления промазина убывает в ряду растворителей: ДМСО > ацетонитрил > 1-пропанол. Максимально возможное содержание ДМСО в реакционной смеси составляет 20 и 30 об.% в присутствии пероксидазы и гемоглобина соответственно. Примечательно, что при этих содержаниях ДМСО скорость реакции в присутствии гемоглобина (kcat 36 с-1) в 2,5 раза выше, чем в присутствии фермента.
Стабильность пероксидазы в водно-органической смеси можно повысить включением ее в полиэлектролитный комплекс с хитозаном. Установлено, что в присутствии промазина возрастает скорость окисления о-дианизидина, катализируемого ферментом нативным и включенным в комплекс с хитозаном; при этом нативный фермент сохраняет активность при высоких содержаниях ДМСО (вплоть до 50 об.%). Описанный эффект является следствием “субстрат-субстратной” активации − ускорения окисления о-дианизидина среднеокисляемым субстратом-восстановителем пероксидазы - фенотиазином. Включение в комплекс с хитозаном повышает эффективность пероксидазы в реакции окисления о-дианизидина: значения kcat/Km в водной среде для нативного фермента и включенного в полиэлектролитный комплекс составили 1,5·102 и 2,8·102 с-1·мкМ-1 соответственно. В присутствии 30 об.% ДМСО в составе комплекса эффективность пероксидазы возрастает в 2,8 раза (kcat/Km 3,2·102 с-1·мкМ-1). Таким образом, в водной среде предпочтительно использование нативной пероксидазы, в средах с умеренным содержанием ДМСО более перспективно применение гемоглобина, а в средах с высоким содержанием этого органического растворителя – комплекса пероксидаза-хитозан.
Разработаны методики определения промазина и хлорпромазина в присутствии 30 об.% ДМСО по их активирующему действию в реакции окисления о-дианизидина в присутствии нативного фермента в диапазоне концентраций (0,1 – 0,8) мМ и (0,5 – 2) мМ соответственно. Применение полиэлектролитного комплекса пероксидаза−хитозан позволило повысить чувствительность определения фенотиазинов: диапазоны определяемых концентраций промазина и хлорпромазина составили (20 – 100) мкМ и (50 – 400) мкМ соответственно.
Работа выполнена при финансовой поддержке РФФИ (гранты №09-03-00823-а, 12-03-00249-а) и Министерства образования и науки РФ (госконтракт №П991).
СЕЛЕКТИВНОЕ ОПРЕДЕЛЕНИЕ УГЛЕВОДОВ В ЭНЕРГЕТИЧЕСКИХ НАПИТКАХ
Бычкова А.А.,1 Попова Н.Н.2
1Воронежский государственный университет инженерных технологий,
Воронеж, Россия.
Аспирант 3г.
rusalka_anna@mail.ru
2Воронежский государственный университет инженерных технологий, Воронеж, Россия. Студент II курса.
Научный руководитель: Коренман Я.И.
В последние годы заметное распространение получили алкогольные и безалкогольные энергетические напитки. В их состав входят витамины, аминокислоты, углеводы, а также кофеин, обеспечивающий тонизирующий эффект. По данным спортивных врачей и диетологов, добавление кофеина в энергетические напитки увеличивает усвоение углеводов (фруктозы, глюкозы, сахарозы) из кишечника на 26%. Кофеин и углеводы в сочетании усиливают воздействие алкоголя на мозг. При сильных физических нагрузках, когда организм функционирует на пределе возможностей, кофеин-алкогольная дегидратация может привести к летальному исходу. В связи с распространяющейся фальсификацией продуктов пищевой и фармацевтической промышленности актуальность приобретает разработка надежных и легковыполнимых способов раздельного определения отдельных компонентов и установления подлинности напитков.
Цель исследования состоит в разработке методик экстракционного извлечения углеводов (фруктозы, глюкозы, сахарозы) при анализе энергетических напитков с применением экстракции бинарными смесями гидрофильных растворителей и последующим анализом экстракта методом потенциометрического титрования.
Механизм распределения моносахаридов (фруктозы, глюкозы) и дисахарида (сахарозы) между водной и органической фазами во многом определяется природой экстрагента. Сольватация объясняется образованием водородных связей между ОН-группами углеводов и свободными электронными парами атомов кислорода эфира (алкилацетаты). Взаимодействие углеводов со спиртами отличается от сольватации эфирами. Оно осуществляется преимущественно за счет свободных электронных пар атома кислорода ОН-групп углеводов и атома водорода ОН-группы спиртов, а также взаимодействием атома кислорода альдегидной (кетонной) группы углевода в ациклической форме и ОН-групп спиртов, которое вдвое превышает силы, обусловливающие взаимодействие экстрагентов с ОН-группами углеводов.
Спирты относятся к ассоциированным растворителям, однако при введении в систему спирт – вода дополнительного растворителя, например, этилацетата происходит ослабление межмолекулярных водородных связей, образующихся при ассоциации спиртов. При этом усиливается сольватация моно- и дисахаридов. Экстракция сопровождается синергетическим эффектом, максимум отклонения коэффициентов распределения от аддитивности достигается при содержании этилацетата в смеси не более 0,4 мольных долей. Это указывает на снижение влияния эфира на самоассоциацию спирта при насыщении им органической фазы. Максимальные коэффициенты распределения углеводов установлены при экстракции смесью на основе изопропилового спирта, что объясняется его наибольшим сродством к воде из числа изученных спиртов (С3−С5).
На основе методики потенциометрического определения производного глюкозы сорбита с применением раствора борной кислоты разработана методика селективного потенциометрического титрования углеводов в неводных средах. Изучены условия анализа: выбор электродов, природа и концентрация титранта. В качестве растворителя применен входящий в состав селективного для углеводов экстрагента изопропиловый спирт. Установлено, что изученные нами углеводы титруются в порядке снижения их растворимости в спирте.
Проанализированы несколько сортов алкогольных и безалкогольных энергетических напитков, производимыхе в России. В анализируемых энергетических напитках найденное содержание кофеина и углеводов в общем соответствует заявленному содержание углеводов (фруктозы, глюкозы, сахарозы) находится на безопасном уровне и в то же время достаточно для достижения необходимого эффекта от их применения. Фальсификация в анализируемых напитках не обнаружена. В энергетических напитках в качестве подсластителя применяют сахарозу, гидролизующуюся в кислой среде, или глюкозно-фруктозный сироп. Невысокое содержание моносахаридов в проанализированных напитках указывает на применение при их производстве сахарозы в качестве подсластителя.
Нами разработана методика, включающая экстракционное разделение и последующее определение углеводов методом потенциометрического титрования. Методика легковыполнима, характеризуется точностью, низкими пределами обнаружения углеводов; продолжительность анализа 40 - 50 мин. Методика применима для выполнения серийных анализов в лабораториях пищевых предприятий.
Работа выполнена в рамках ФЦП «Научные и научно-педагогические кадры инновационной России» (г/к № П2264 от 13.11.2009).
РАЗРАБОТКА МЕТОДИКИ БИОТЕСТОВОГО АНАЛИЗА КАЧЕСТВА ВОЗДУХА ПРИ ЕГО ОЧИСТКЕ В ДИЭЛЕКТРИЧЕСКОМ БАРЬЕРНОМ РАЗРЯДЕ
Горболетова И.В.,1 Суровов А.М.2
1Ивановский государственный химико-технологический университет,
Иваново, Россия.
Студент V курса.
inuki_08@mail.ru
2Ивановский государственный химико-технологический университет, Иваново, Россия. Аспирант 3г.
Научный руководитель: Бубнов А.Г.
Загрязнение атмосферного воздуха является важнейшей глобальной проблемой 21 века. Причём одним из ведущих загрязнителей урбанизированных территорий в связи с развитием автотранспорта является формальдегид, негативное влияние которого проявляется в ухудшении состояния здоровья населения, животного и растительного мира.
Одним из наиболее перспективных методов обезвреживания подобных выбросов в атмосферу является очистка воздуха в реакторе с диэлектрическим барьерным разрядом (ДБР) и его совмещение с катализом. Известно, что при очистке воздуха от формальдегида в реакторе с дБР происходит образование побочных продуктов его окислительной деструкции, а также озона (1 класс опасности), оксидов азота и углерода, т.е. очищенный по целевому компоненту, воздух может загрязняться не менее опасными веществами (происходит его вторичное загрязнение). Таким образом становится необходим действенный и информативный контроль качества уже обработанного в ДБР воздуха [1, 2].
Одновременно с этим все более востребованной становится объективная интегральная информация о качестве окружающей среды, причём экологический мониторинг основан на сочетании методов биомониторинга и химико-аналитических исследований.
Химические методы анализа позволяют измерить количество того или иного поллютанта и проверить соответствие экологическим и гигиеническим нормативам. В свою очередь методы биотестового анализа позволяют оценить синергетическое действие и биологические эффекты даже малых концентраций загрязняющих веществ. С их помощью можно упростить анализ самых разных, в частности, природных объектов, оценивая на первой его стадии степень общего загрязнения и общей токсичности объекта для живого организма и целесообразность его дальнейшего детального анализа другими более сложными и дорогостоящими методами [3].
На сегодняшний день разработаны методики биотестирования для определения токсичности природных и сточных вод, почв, а так же класса опасности отходов (например, [4, 5]). Однако, нормативных методик экпресс-биотестирования для контроля качества воздуха (в которых бы указывались/прописывались условия проведения биотестирования) на настоящий момент не существует. В связи с этим разработка экспресс-анализа для контроля качества воздуха является актуальной.
В нашем случае, выполнение биотестового анализа было основано на установлении различия между количеством погибших особей в анализируемой пробе (опыт) и культивационной воде (контроль). В каждом опыте через определенные промежутки времени подсчитывалось количество выживших тест-организмов (ракообразные Daphnia magna, зелёная водоросль хлорелла Chlorella). Затем определялось среднее количество выживших организмов и рассчитывался процент их гибели в опыте по отношению к контролю. Случайные погрешности измерений рассчитывались по методу Стьюдента.
В работе показана возможность проведения биотестового анализа с использованием указанных выше тест-организмов для контроля качества воздуха после его очистки от формальдегида в реакторе с диэлектрическим барьерным разрядом. Нами выявлены дополнительные условия, касающиеся отбора проб для биотестирования, позволяющие осуществлять контроль в соответствии с требованиями, предъявляемым к подобного типа анализам.
Литература:
[1] Бубнов А.Г. Актуальные проблемы химии высоких энергий. IV Всероссийская конференция (с приглашением специалистов стран СНГ). Сборник материалов. – М.: РХТУ им. Д.И. Менделеева, 2009. - С. 14.
[2] Бубнов А.Г., Горболетова И.В. Пожарная и аварийная безопасность. VI Международная научно-практическая конференция, посвященная 45-летию Ивановского института ГПС МЧС России. Сборник материалов.– Иваново, ИвИ ГПС МЧС России, 2011. - Ч. 1. С. 247-252
[3] Багдасарян А.С. Экология и промышленность Росси, 44-45 (2007)
[4] ПНД Ф Т 14.1:2:3:4.10-04 Токсикологические методы анализа. Методика определения токсичности питьевых, природных и сточных вод, водных вытяжек из почв, осадков сточных вод, отходов по измерению оптической плотности тест-культуры водоросли хлорелла.
[5] ПНД Ф Т 14.1:2:4.12-06 Токсикологические методы анализа. Методика определения токсичности водных вытяжек из почв, осадков сточных вод и отходов, питьевой, сточной и природной воды по смертности тест-объекта Daphnia Magna Straus.
СИНТЕЗ И ИДЕНТИФИКАЦИЯ ВОДНЫХ РАСТВОРОВ ФУЛЛЕРЕНОЛОВ
Грузинская Е.Г.,1 Семенов К.Н.2
1Санкт-Петербургский государственный университет,
Санкт-Петербург, Россия.
Аспирант 2г.
gruzinskayae@mail.ru
2Санкт-Петербургский государственный университет, Санкт-Петербург, Россия. Молодой учёный.
Научный руководитель: Ермаков С.С.
Водорастворимые фуллерены являются многообещающими материалами для науки и техники. Это обуславливает особый интерес к доступным и простым методам синтеза и идентификации, а также изученинию физико-химических свойств растворов фуллеренолов и фазовых равновесий растворимости с участием последнего. Полигидроксилированный фуллерен, называемый фуллеренолом, обладающий простой структурой, удобной для практического применения, малой токсичностью, и возможностью дальнейшей модификации, в дополнении к выраженной способности к захвату радикалов, рассматривается как наиболее перспективный представитель водорастворимых фуллеренов. При этом, помимо собственно гидроксильных групп, в него могут входить также некоторые иные негидроксильные группы. В рамках данной работы разработаны методики синтеза фуллеренолов и индивидуальных легких фуллеренов, фуллереновой сажи, фуллереновой смеси. Проведена идентификация фуллеренолов методами электронной спектроскопии, инфракрасной спектроскопии, оптической микроскопии, высокоэффективной жидкостной хроматографии, масс-спектрометрии. Пикнометрическим методом изучена зависимость плотности от концентрации растворов фуллеренола, проведен расчет среднего молярного и парциальных молярных объемов компонентов в растворе при 250С. Методом рефрактометрии изучена зависимость показателя преломления от концентрации растворов фуллеренола, проведен расчет удельной рефракции растворов. Методом изотермического насыщения в ампулах изучена растворимость фуллеренола в дистиллированной воде в интервале температур 20
 800С, определен состав равновесных кристаллогидратов. Впервые получены данные по растворимости фуллеренола в тройной системе фуллеренол-галит-вода. Методом динамического светорассеяния определен средний размер ассоциатов и зависимость электрокинетического
800С, определен состав равновесных кристаллогидратов. Впервые получены данные по растворимости фуллеренола в тройной системе фуллеренол-галит-вода. Методом динамического светорассеяния определен средний размер ассоциатов и зависимость электрокинетического 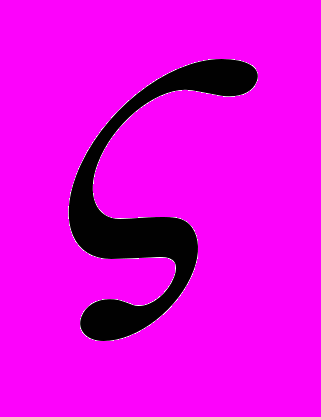 - потенциала от концетрации водных растворов фуллеренола – d.
- потенциала от концетрации водных растворов фуллеренола – d. Также в рамках проведенных исследований были изучены электрохимические свойства водных растворов фуллеренолов, синтезированных с помощью прямого гидроксилирования индивидуального С60, а именно:
-Выявлено, что сам фуллеренол является электрохимически неактивным в области потенциалов термодинамической устойчивости воды;
-на основании того, что фуллерены склонны образовывать комплексы с переходными металлами, было сделано предположение о возможности образования комплексов фуллеренола с Cu(I). С целью получения аналитического сигнала методами вольтамперометрии было изучено электрохимическое поведение меди (I) в растворах, содержащих фуллеренол. В результате было установлено, что на вольтамперограммах присутствует пик, высота которого зависит от концентрации фуллеренола.
Далее, были выбраны оптимальные условия для проведения измерений, а именно состав фонового электролита, материал рабочего электрода и т. д. Результаты, полученные из зависимости высоты пика на вольтамперограммах от скорости развертки свидетельствуют о необратимом характере электрохимического процесса образования комплекса меди с фуллеренолом. Существование комплекса фуллеренола с медью(I) было дополнительно подтверждено спектрофотометрическим методом в УФ и видимой областях, а также ИК-спектроскопией в твердом состоянии; также было изучено влияние температуры на скорость протекания реакции комплексообразования;
-также были определены (анти)коррозионные характеристики фуллеренола – d при электрохимической коррозии нержавеющих сталей;
Литература:
[1] Семенов К., Чарыков Н. Растворимость легких фуллеренов и их производных. - Germany: LAP LAMBERT Academic Publishing, 2011, 265 с.
[2] Semenov K.N., Charykov N.A., Letenko D.G., Nikitin V.A., Krokhina O.A. Vestnik SPbGU. 4, 79-86 (2010)
[3] Semenov K.N., Charykov N.A., Letenko D.G., Nikitin V.A., Matuzenko M.Yu., Keskinov V.A., Postnov V.N., Kopyrin A.A. Rus. J. Appl. Chem. 83, 1948-1952 (2010)
[4] Semenov K.N., Charykov N.A., Keskinov V.A. J. Chem. Eng. Data. 56, 230-239 (2011)
[5] Semenov K.N., Сharykov N.A., Letenko D.G., Nikitin V.A., Matuzenko M.Yu., Keskinov V.A., Postnov V.N., Kopyrin A.A. Rus. J. of Appl. Chem. 84, 44 – 49 (2011).
[6] Letenko D.G., Nikitin V.A., Semenov K.N., Matuzenko M.Yu., Keskinov V.A., Gruzinskaya E.G., Tsvetkova L.V. Rus. J. of Appl. Chem. 84, 50 – 53 (2011).
