Учебное пособие составлено в соответствии с программой по биохимии для студентов всех факультетов медицинских вузов. Оно предназначено для самостоятельной подготовки студентов и оптимизации их работы на практических занятиях
| Вид материала | Учебное пособие |
- Предлагаемое учебное пособие предназначено для студентов, аспирантов и преподавателей, 2052.38kb.
- Учебное пособие для самостоятельной работы студентов ставрополь 2007, 1394.43kb.
- Учебное пособие по дисциплине «Сестринское дело в хирургии» составлено в соответствии, 2118.11kb.
- Учебно-методическое пособие для самостоятельной работы студентов интернов по специальности, 390.76kb.
- Учебное пособие томск 2009, 1504.09kb.
- Учебное пособие Чебоксары 2007 удк 32. 001 (075. 8) Ббк ф0р30, 1513.98kb.
- Учебное пособие М.: Педагогическое общество России. 1999 442, 5623.86kb.
- Учебное пособие для самостоятельной работы студентов специальности 040600 «Сестринское, 1354.95kb.
- Новые поступления в библиотеку экономическая теория, 225.89kb.
- Учебное пособие Ставрополь 2005 удк 577. 1 (075. 8) Бкк 28. 072, 277.1kb.
ЗАНЯТИЕ 3
СТРУКТУРА И СВОЙСТВА БЕЛКОВ.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ.
БИОМЕДИЦИНСКОЕ ЗНАЧЕНИЕ:
Белки - высокомолекулярные, полимерные соединения, состоящие из аминокислот. Определение свободных аминокислот имеет клинико-диагностическое значение при изучении обмена белков в организме. Изменение содержания аминокислот в сыворотке крови и моче наблюдаются при недостаточной функции печени: усиленном распаде белков, а также при нарушении выделительной функции почек.
Обнаружить присутствие белка и отдельных аминокислот в биологических жидкостях можно с помощью качественных реакций. Хроматографический метод исследования используется для установления аминокислотного состава гидролизатов белков, первичной структуры, а также для количественного определения свободных аминокислот в крови, моче, экссудатах и других биологических жидкостях.
Работа 1 . Анализ хроматограмм гидролизатов различных белков.
ОБОРУДОВАНИЕ: ФЭК, хроматограммы различных белков, пробирки со спиртовым раствором для экстракции.
ПРИНЦИП МЕТОДА.
Аминокислотный состав гидролизатов белков исследуется с помощью распределительной хроматографии на бумаге. Распределительная хроматография основана на способности веществ по-разному адсорбироваться на адсорбентах и по-разному растворяться в полярных и неполярных растворителях. В качестве адсорбента в данном методе используется хроматографическая бумага. Разделение проводится смесью растворителей (бутанол + ледяная уксусная кислота + вода в соотношении 4:1:5). При этом вода удерживается бумагой, а органический растворитель движется по бумаге с определенной скоростью. Вещества (в данном случае аминокислоты), растворимые в органическом растворителе, будут двигаться по бумаге вместе с растворителем. Вещества, растворимые в воде, займут на хроматограмме промежуточное положение между линией старта и линией фронта растворителя. После окончания разделения и высушивания хроматограммы ее проявляют раствором нингидрина и вновь высушивают. После этого пятна разделенных аминокислот становятся видимыми и доступными для качественного и количественного анализа.
ХОД РАБОТЫ.
Студенты исследуют готовые хроматограммы различных белков.
1. Качественный анализ хроматограмм (идентификация пятен аминокислот). Производится путем расчета коэффициентов Rf для каждого пятна:
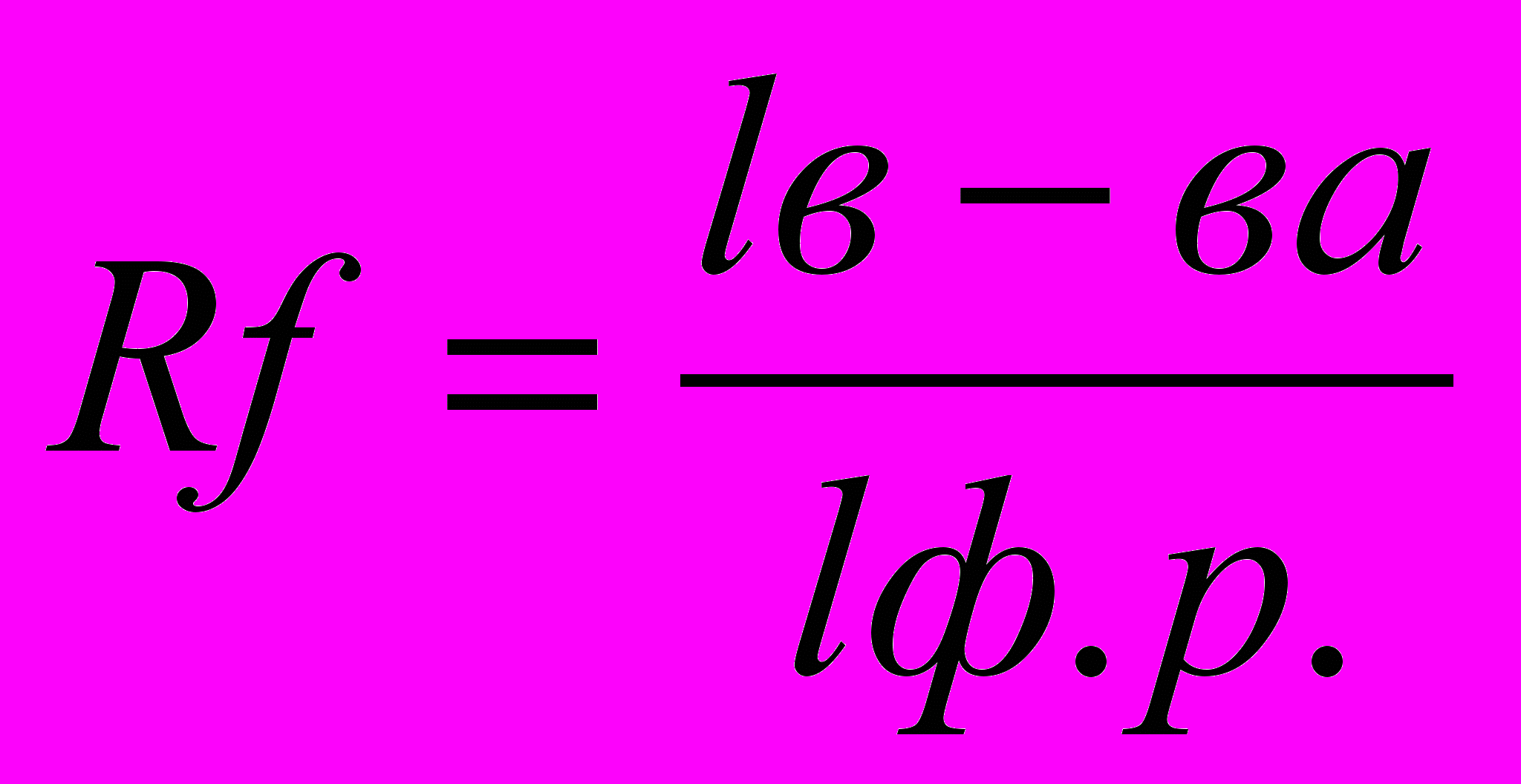
где Rf- коэффициент распределения,
lв-ва- путь, пройденный веществом от линии старта,
lф.р.- путь, пройденный фронтом растворителя от линии старта.
Пользуясь табличными значениями Rf для каждой аминокислоты, идентифицируют аминокислоты исследуемой хроматограммы. Для расчета коэффициента измеряют расстояния от линии старта до центра каждого пятна и расстояние от линии старта до линии фронта растворителя.
Рассчитанные значения коэффициентов Rf сравнивают с табличными данными и идентифицируют таким образом все пятна аминокислот на хроматограмме.
| Аминокислоты | Rf | Аминокислоты | Rf |
| Аланин | 0.45 | Треонин | 0.35 |
| Аргинин | 0.20 | Триптофан | 0.55 |
| Аспарагиновая к-та | 0.24 | Фенилаланин | 0.68 |
| Глицин | 0.25 | Метионин | 0.55 |
| Серин | 0.27 | Цистеин | 0.07 |
| Глутаминовая к-та | 0.30 | Цистин | 0.08 |
| Пролин | 0.43 | Лизин | 0.12 |
| Валин | 0.60 | Лейцин | 0.73 |
2. Количественный анализ хроматограмм Окрашенные пятна, соответствующие определенным аминокислотам, вырезать ножницами, измельчить в виде щеточек и поместить для экстракции окрашенного продукта в пробирки со спиртовым раствором. Для полноты экстракции пробирки закрыть пробками и оставить на 30 мин. в темноте, время от времени встряхивая содержимое. Затем окрашенные растворы проколориметрировать на ФЭКе с зеленым светофильтром*( длина волны 540 нм; толщина кюветы 5 мм). По полученным величинам оптической плотности (D) с помощью калибровочного графика найти концентрацию каждой аминокислоты.
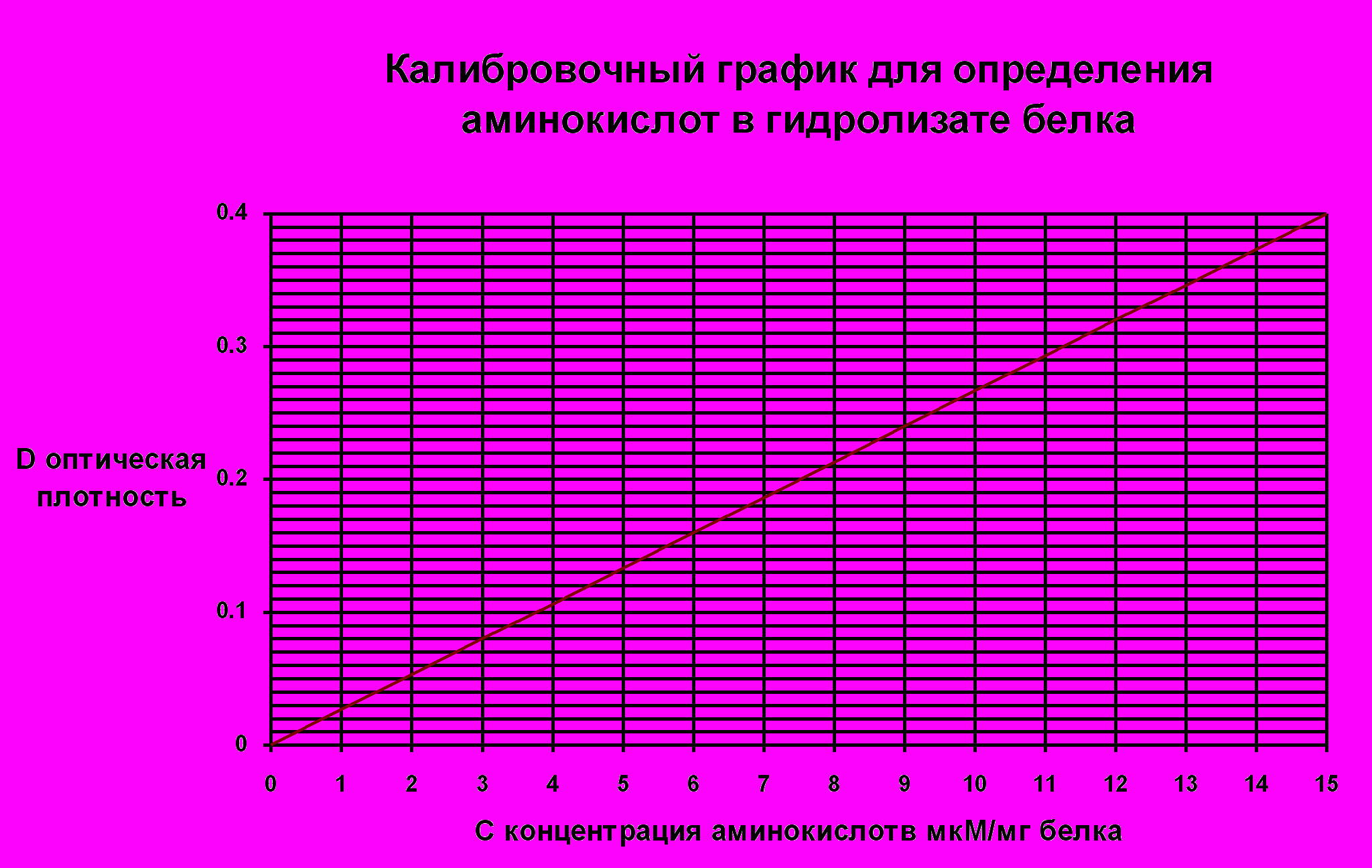
РЕЗУЛЬТАТЫ:
ВЫВОДЫ:
Работа 2. Определение концентрации белка в сыворотке крови рефрактометрическим методом.
ОБОРУДОВАНИЕ: рефрактометр.
ПРИНЦИП МЕТОДА.
При переходе луча света из среды оптически менее плотной в среду оптически более плотную и наоборот происходит изменение его направления, т.е. рефракция. Величина рефракции зависит от показателя преломления исследуемого вещества:
n = c/v, где
n – абсолютный показатель преломления данной среды, который указывает, во сколько раз скорость света в вакууме (с) больше скорости света в среде (v).
Показатель преломления является важной характеристикой исследуемого вещества, зависящей от химической природы, структуры и характера связей внутри молекулы и между молекулами, от их взаимодействия, плотности и концентрации исследуемого вещества. В связи с этим метод рефрактометрии используют для установления размера и формы частиц, структуры молекул, молекулярной массы веществ, для измерения концентрации веществ в рабочих растворах, в том числе в биологических жидкостях.
Для растворов зависимость концентрации от преломления определяется уравнением:
С = (n – n0) / K, где
n и n0 – соответственно показатели преломления раствора и растворителя, С – процентная концентрация вещества в растворе, К – удельный инкремент показателя преломления при увеличении концентрации раствора на 1%. Когда величина К неизвестна, концентрацию определяют методом калибровочных кривых. В обычной работе концентрацию вещества чаще устанавливают по известным таблицам соответствия ее показателю преломления. Их составляют по результатам стандартных измерений для данного вещества.
ХОД РАБОТЫ.
Измерения начинают с проверки нулевой точки.
- На полированную рабочую грань измерительной призмы поместить пипеткой 2-3 капли дистиллированной воды и опустить осветительную призму.
- Зеркалом направить свет в осветительную призму. Вторым зеркалом осветить шкалу рефрактометра.
- Вращением окуляров зрительной и микроскопической труб установить резкость изображения полей зрения. Найти в поле зрительной трубы границу светотени.
- Вращая ручку компенсатора дисперсии устранить ее окрашивание.
- Совместить границу светотени с визирными линиями. Отсчитать показатель преломления с точностью до десятичных долей. (При правильной настройке прибора граница светотени должна совпадать с визирными линиями и показателем преломления 1,333.)
- Осторожно высушить измерительную призму бумажным фильтром.
Измерение преломления исследуемого раствора.
-
Измерение проводится таким же образом, как и проверка нулевой точки, но вместо воды берется исследуемый раствор.
- Если раствор темный или окрашен, измерения проводят в отраженном свете, освещая снизу измерительную призму.
- По окончании измерений рабочие поверхности призм промывают дистиллированной водой и протирают насухо.
- По показателю преломления определяют концентрацию белка с использованием калибровочных графиков или таблиц. При рефрактометрическом определении содержания белка в сыворотке крови используют таблицу Рейса показателей преломления белковых растворов разной концентрации.
Норма содержания белка в сыворотке крови составляет 6,5 – 8,5 %, у детей до 3-х лет – 5,7 – 7 %.
Показатели преломления белковых растворов по Рейсу.
| Показатель преломления | Белок, % | Показатель преломления | Белок, % | Показатель преломления | Белок, % |
| 1,3412 1,3413 1,3414 1,3421 1,3422 1,3423 1,3424 1,3425 1,3426 1,3427 1,3428 1,3429 1,3430 1,3431 1,3432 1,3433 1,3434 1,3435 1,3436 1,3437 1,3438 1,3439 1,3440 1,3441 1,3442 1,3443 1,3444 1,3445 1,3446 1,3447 1,3448 1,3505 1,3506 1,3507 1,3508 1,3509 1,3510 1,3511 1,3512 1,3513 | 3,06 3,1 3,16 3,56 3,62 3,68 3,74 3,79 3,85 3,92 3,97 4,03 4,09 4,14 4,2 4,26 4,32 4,36 4,43 4,48 4,54 4,61 4,68 4,73 4,78 4,83 4,9 4,95 5,0 5,07 5,14 8,45 8,5 8,56 8,62 8,68 8,74 8,8 8,86 8,91 | 1,3415 1,3416 1,3417 1,3449 1,3450 1,3451 1,3452 1,3453 1,3454 1,3455 1,3456 1,3457 1,3458 1,3459 1,3460 1,3461 1,3462 1,3463 1,3464 1,3465 1,3466 1,3467 1,3468 1,3469 1,3470 1,3471 1,3472 1,3473 1,3474 1,3475 1,3476 1,3514 1,3515 1,3516 1,3517 1,3518 1,3519 1,3520 1,3521 1,3522 | 3,21 3,27 3,32 5,21 5,25 5,31 5,37 5,42 5,49 5,54 5,59 5,66 5,71 5,76 5,83 5,89 5,94 6,01 6,06 6,12 6,18 6,23 6,29 6,36 6,42 6,48 6,52 6,58 6,64 6,7 6,77 8,96 9,03 9,08 9,14 9,2 9,27 9,32 9,38 9,43 | 1,3418 1,3419 1,3420 1,3477 1,3478 1,3479 1,3480 1,3481 1,3482 1,3483 1,3484 1,3485 1,3486 1,3487 1,3488 1,3489 1,3490 1,3491 1,3492 1,3493 1,3494 1,3495 1,3496 1,3497 1,3498 1,3499 1,3500 1,3501 1,3502 1,3503 1,3504 1,3523 1,3524 1,3525 1,3526 1,3527 1,3528 1,3529 1,3530 1,3531 | 3,39 3,44 3,5 6,82 6,88 6,94 7,0 7,05 7,11 7,16 7,22 7,28 7,33 7,4 7,46 7,51 7,58 7,63 7,69 7,74 7,79 7,86 7,92 7,98 8,04 8,09 8,15 8,21 8,28 8,33 8,39 9,51 9,55 9,62 9,67 9,73 9,79 9,84 9,9 9,95 |
РЕЗУЛЬТАТЫ:
ВЫВОД:
Работа 3. Биуретовая реакция на пептидную связь (реакция Пиотровского).
ПРИНЦИП МЕТОДА.
Реакция обусловлена присутствием в белке пептидных связей, образующих с ионами меди в щелочной среде солеобразные комплексы. В зависимости от длины полипептидной цепи раствор окрашивается в сине-фиолетовый или розовый цвет.
ХОД РАБОТЫ.
К 10 каплям раствора белка прибавить 5 капель 10% едкого натра и 1 каплю 1% сернокислой меди и перемешать. Содержимое пробирки приобретает сине-фиолетовый цвет. То же самое проделать с растворами полипептидов и аминокислот. Затем решить задачу, определив содержимое раствора (белок, полипептид, смесь аминокислот), проделав биуретовую реакцию.
РЕЗУЛЬТАТЫ.
ВЫВОД:
ВОПРОСЫ К ЗАНЯТИЮ:
- Белки - важнейшие макромолекулы организма. Разнообразие белков и их функций. Понятие о протеомике.
- Аминокислоты – структурные мономерные молекулы белка, их строение, свойства, классификация, номенклатура. Заменимые и незаменимые аминокислоты.
- Первичная структура, строение полипептидной цепи, пептидная связь, наименование пептидов.
4. Наследственные изменения первичной структуры. Примеры изменения свойств белка при изменении первичной структуры.
Для фарм. факультета:
- Методы определения молекулярной массы и структуры белка.
- Аминокислоты, пептиды и белки как лекарственные препараты.
