Венозная система сердца при хронической сердечной недостаточности (клинико-морфологическое исследование) 14. 01. 05 Кардиология 14. 03. 01 Анатомия человека
| Вид материала | Исследование |
Содержание1-я закономерность Практические рекомендации |
- Методические указания для студентов Лечебный факультет Занятие №1 Тема: «Средства,, 863.62kb.
- Методические указания для студентов Педиатрический факультет Занятие №1 Тема: «Средства,, 940.3kb.
- Особенности течения хронической сердечной недостаточности у больных с нарушением проводящей, 367.14kb.
- Предикторы эффективности фармакотерапии хронической сердечной недостаточности у больных, 312.53kb.
- «динамика функционального состояния почек у больных ишемической болезнью сердца и хронической, 502.36kb.
- На правах рукописи, 814.77kb.
- Гирудотерапия в лечении хронической сердечной недостаточности у больных ибс с нормальным, 419.45kb.
- Адаптация недоношенных новорожденных детей при церебральной ишемии (клинико-функциональное, 394.95kb.
- Роль радионуклидных методов диагностики в оценке обратимой дисфункции миокарда при, 188.56kb.
- «Военно-медицинская академия им. С. М. Кирова», 337.36kb.
Рис. 8. Изменение большой вены сердца
при хронической сердечной недостаточности
Больной Х., стадия ХСН IIА, III ФК, пол-муж., возраст 65 лет.
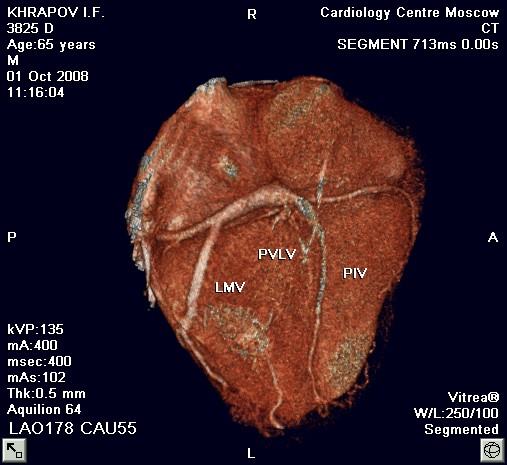
Рис. 9. Изменение крупных вен сердца
при хронической сердечной недостаточности
Больной Х., стадия ХСН IIА, III ФК, пол-муж., возраст 65 лет.
Мультиспиральная компьютерная томография сердца.
Анализируя данные клинического исследования можно утверждать, что у больных с синдромом ХСН основные параметры периферической и внутрисердечной венозной системы значительно изменяются. Данные изменения связаны с тяжестью сердечной недостаточности, параметры венозного кровотока ухудшаются по мере прогрессирования заболевания у пациента. Данное заключение подтверждается проведенным корреляционным статистическим анализом связей. А именно:
характер связи ПВД и тяжести ХСН – прямая, средняя по силе (r=0,60);
параметров правого сердца: ПП, ПЖ, Размер вын.тр., Рп.п., ∆.Рп.ж. (по данным Эхо-КГ обследования) с тяжестью синдрома ХСН – прямая, сильная (за исключением средней силы для ∆.Рп.ж.) зависимость. Коэффициент корреляции между названными параметрами и тяжестью ХСН соответственно: 0,55; 0,46; 0,50, 0,5; 0,22.
Значимая по силе отрицательная корреляционная зависимость у данной группы больных выявлена между тяжестью ХСН и ∆S правого желудочка, а также скоростью трикуспидального потока (r= - 0,69 и - 0,2 соответственно).
Проведен статистический анализ изменений параметров ВСС, которые определялись двумя методиками: Эхо-КГ и МСКТ сердца:
Размер ВС с высокой достоверностью увеличивался у больных с ХСН по сравнению с пациентами группы контроля (р<0,01 и по данным первой, и по данным второй методики). Сильная положительная корреляционная зависимость определяется между изменением диаметра просвета ВС и тяжестью ХСН у пациента (r = 0,55 при обследовании методом Эхо-КГ и 0,76 / 0,80 для методики МСКТ соответственно двум размерам ВС).
Сравнивая статистическую оценку состояния НПВ по данным Эхо-КГ и МСКТ исследований сердца, можно сказать, что второй метод, более точен и информативен, т.к. средние значения диаметра НПВ по данным Эхо-КГ исследования у больных с ХСН были ненамного отличны от средних значений группы контроля (данным методом определить диаметр вены достаточно сложно из-за фаз дыхания, при которых вена может спадаться).
При исследовании НПВ методом МСКТ сердца достоверно определяется увеличение ее диаметра в группах пациентов с синдромом ХСН в сравнении с группой контроля. Кроме того, при этом определяется сильная положительная корреляционная связь между изменением (увеличением диаметра) НПВ и тяжестью явлений (стадией и ФК) ХСН (коэффициент корреляции r =0,78).
Оценка силы связи между расширением других вен сердца и стадией ХСН по величине коэффициента корреляции показывает положительную сильную зависимость (r для БВС = 0,8 / 0,83 соответственно двум размерам; r для ЗМЖВ = 0,83; r для ЗВЛЖ = 0,56; r для ЛКВ = 0,78).
С учетом того, что на основании результатов клинического исследования можно говорить о формировании у больных с синдромом ХСН «застойного сердца в целом» проведен статистический корреляционный анализ связей между основным показателем систолической функции ЛЖ (ФВл.ж.) и ∆S правого желудочка, отражающего непосредственно сократительную способность «правого сердца», не только с тяжестью ХСН, но и состоянием внутрисердечной венозной системы, а именно диаметром просвета ВС у больных одной группы, обследованных методом Эхо-КГ и МСКТ сердца одновременно.
Характер связи между диаметром просвета ВС и показателями сократительной способности «левого» и «правого» сердца – обратная; по оценке силы связи – средняя (r = -0,45 и -0,39 соответственно ФВл.ж. и ∆Sп.ж.).
Таким образом, проведенный статистический анализ результатов клинической части исследования, дает основание для их обсуждения в сопоставлении с данными морфологической и экспериментальной частей, в ходе чего можно вывести определенные закономерности и выводы об изменении ВСС у больных с ХСН.
Говоря о проблеме ХСН, приходится говорить не столько даже о снижении смертности в данной популяции пациентов, а больше о замедлении прогрессирования данного синдрома при ССЗ. Этот факт не оспаривается. Важным в последние годы стало признание того, что ухудшение систолической функции и падение ФВл.ж. перестало быть обязательным (или обычным) условием (или критерием) сердечной недостаточности. Поиск объяснения удивительного явления: больные с ХСН с гиперкинетическим типом кровообращения с нормальной ФВл.ж., привел к появлению понятия «диастолическая дисфункция» - проблеме, которой в последнее время уделяется большое внимание. Высокий уровень развития ХСН и смертности стимулировали новый виток исследований, который привел к открытию принципиально нового понятия – ремоделирование сердца (ЛЖ). Процесс ремоделирования развивается в результате гибели значительного количества кардиомиоцитов и продолжается после прекращения повреждающего действия на миокард в виде развития ХСН. Несмотря на значительное количество работ по данной проблеме, вопрос прогрессирования ремоделирования сердца совершенно не решен. Говоря о ремоделировании сердца на сегодняшний день, подразумевается ремоделирование ЛЖ, что несомненно, не совсем верно. У больных с ХСН ремоделируется все сердце. Моделирование ХСН у крыс с использованием антрациклиновой модели позволило получить у животных симптомокомплекс, характерный для клинических проявлений ХСН у больных. Обнаруженные при вскрытии животных увеличение печени, почек, селезёнки, гидроперикард и гидроторакс, увеличение размеров и массы сердца, тургора, цвета миокарда в комплексе с клиническими проявлениями при развитии болезни у животных позволяют считать выбранную модель адекватной для изучения влияния сердечной недостаточности (а с учетом срока жизни животных рассматривать её как достаточно длительную – «хроническую») на состояние венозных сосудов сердца. Даже макроскопическое изучение субэпикардиальных вен позволило установить существенное увеличение их диаметра, полнокровие. Особенно хорошо явления венозной гипертензии были выражены в устьевых отделах вен и ВС. Эти изменения можно объяснить тем, что снижение сократительной способности миокарда приводит к венозному застою в правых отделах сердца, повышению венозного давления, затруднению венозного оттока от внутренних органов и развитию известного клинического симптомокомплекса ХСН. Но при этом затрудняется отток венозной крови и в самом сердце, что проявляется в тех изменениях, которые были нами отмечены. Нам не известны клинические или экспериментальные исследования, где бы обсуждались подобные симптомы со стороны вен сердца. В ранее проведенных исследованиях с использованием подобных моделей ХСН авторы не уделяли внимания состоянию ВСС в получаемой общей картине клинико-морфологических изменений [Непомнящих Л.М., 1987; Непомнящих Л.М., Лушникова Е.Л., Семенов Д.Е., 2001; Саликова С.П., 2004]. Получив экспериментальные доказательства влияния ХСН на вены сердца, мы решили изучить состояние ВСС у больных, умерших от ХСН. Это позволило провести оценку выявленных изменений не только в целом, но и с учетом анамнеза заболевания, установить взаимосвязь со стадиями развития процесса. По современным представлениям существуют три самостоятельных пути оттока венозной крови от сердца – по субэпикардиальным венам, впадающим в ВС, по передним венам сердца, по наименьшим венам Тебезия – Вьессена [Михайлов С.С., 1987]. Изучение наименьших вен сердца сопряжено со значительными методическими трудностями, поэтому мы остановили своё внимание на двух путях венозного оттока от сердца – венах, впадающих в ВС (БВС, СВС и МВС), самом ВС и на ПВС. В клиническом понимании основой возникновения и прогрессирования ХСН в настоящее время принято считать ремоделирование миокарда, включающего в себя увеличение массы сердца, гипертрофию и структурно-пространственную перестройку ЛЖ (его сферификацию), снижение его систолической и нарушение диастолической функций. У больных с ХСН средней и тяжелой стадий ЛЖ приобретает все более гемодинамически невыгодную геометрическую форму [Levy D., Garrison R. G., 1990; 1994; Maisch B., 1996]. Прогрессирующее ремоделирование ЛЖ приводит к значительному снижению его систолической функции. Эти данные соответствуют общепринятым представлениям о систолической недостаточности сердца [Агеев Ф.Т. и соавт., 1994; 1995; Dougherty A.H. et al., 1984; Devereux R.B., Reichek N., 1977; Brilla C.G., Maisch B., 1994; 1996; Cohn J.N., 1995].
Вместе с тем, каждый практический врач сталкивается с фактом (имеются таковые сведения в литературе), когда пациенты, у которых выявляется низкая ФВ, зачастую способны выполнять значительную физическую нагрузку и имеют низкий ФК ХСН [LeJemtel T. et al., 1994]. Это, вероятно период перехода от более благоприятного типа ремоделирования (концентрического) к неблагоприятному (эксцентрическому). Главный фактор этого этапа прогрессирования ремоделирования сердца (геометрически) и синдрома ХСН (клинически) – присоединение объемной перегрузки. Объемная перегрузка сердца приводит к внутрисердечному застою, переполнению вен сердца, затруднению оттока крови как в камеры сердца (в частности в правое предсердие), так и замедлению оттока крови из полостей сердца в связи с их дилатацией и снижением сократительной способности. Недостаточность «правого сердца» при ХСН носит вторичный характер. Практически нет работ, посвященных оценке и анализу венозного кровотока сердца, функции «правого сердца» и правожелудочковой недостаточности у больных ССЗ с синдромом ХСН. Нужно отметить, что термин «правожелудочковая недостаточность» неудачен по мнению многих авторов [Констант Дж., 2004], т.к. используется для обозначения двух патологических состояний: собственно недостаточности правого желудочка, обусловленной тяжелой обструкцией его выносящего тракта (выраженная легочная гипертензия при обструктивной болезни легких, стенозе клапана легочной артерии или массивной эмболии ветвей легочной артерии) и его вторичной дисфункции [Мухарлямов М, 1971; Замотаев И.П., 1978]. При ХСН (при левожелудочковой недостаточности) увеличение симпатической активности и высокая концентрация норадреналинах [Мареев В.Ю., 1980, 1998; Флоря В.Г., Мареев В.Ю. и соавт., 1995] приводят к вторичному повышению тонуса вен и нарастанию венозного давления, а задержка натрия ведет к увеличению объема циркулирующей жидкости, что ведет к застойным венозным явлениям. По данным литературы правое предсердие при ХСН испытывает повышенное напряжение, как вследствие избыточной симпатической стимуляции, так и в связи с высоким давлением, особенно при выраженной трикуспидальной регургитации (перегрузка объемом). Тяжелая и длительная трикуспидальная регургитация, обусловленная недостаточностью правого сердца, носит вторичный характер и становится дополнительным гемодинамически значимым фактором прогрессирования ХСН, ухудшает долгосрочный прогноз, вызывая дополнительную перегрузку и дисфункцию правого желудочка, а также системный венозный застой. Кроме того, высокое венозное давление при ХСН отражает (в том числе) сниженную сократительную способность правого желудочка, вследствие чего давление правого предсердия во время систолы желудочков снижается значительно меньше, чем должно в норме. Данные исследования геометрических и функциональных показателей правых отделов сердца, непосредственно связанных с венозным коллектором и венозной сетью сердца (как крупными венами, так и венами конечных порядков) дают основание сказать, что полная клиническая картина ХСН обусловливается не только нарушением расслабления миокарда и нарушением диастолическрй функции ЛЖ, не только снижением систолической «насосной» функции ЛЖ сердца и его дилатацией, но и в большой степени недостаточностью «правого сердца», полнокровием и застоем в венозном русле сердца, дополняющими и усугубляющими патогенез и течение синдрома ХСН у больных с ССЗ (в первую очередь на этапе перехода от концентрического ремоделирования сердца к эксцентрическому, а также и в дальнейшем течении заболевания). У больных с ХСН следует говорить не о ремоделировании ЛЖ сердца, а о ремоделировании всего сердца (предсердий и желудочков как левых отделов, так и обязательно правых отделов сердца). Результаты нашего исследования показывают, что среди клинических признаков, подтверждающих наличие у больного ХСН, более чем у половины больных были признаки нарушения венозного кровотока в той или иной степени выраженности. Об этом также свидетельствуют повышение ПВД, давления в правых отделах сердца, расширение полостей правого предсердия и правого желудочка. Увеличение размера правого желудочка происходит параллельно с увеличением размера выносящего тракта (расстояние в отделе полости правого желудочка от верхушки до клапана легочной артерии), что обусловливает увеличение длительности периода изгнания крови из правого желудочка (вновь фактор перегрузки объемом). По нашим данным у больных с ХСН увеличивается и ремоделируется не только левый и правый желудочки, но и предсердия, значительно повышается давление в правом предсердии, возникает легочная гипертензия, что свидетельствует о повышении венозного давления и застое. Изменения структуры и гемодинамики правых отделов сердца влекут за собой его функциональные нарушения, о чем свидетельствует уменьшение ∆Sп.ж. и скорости трикуспидального потока крови. Эти данные косвенно отражают прогрессирующее снижение сократительной способности правого желудочка. Данные нашего исследования больных с тяжелой ХСН дают основание ввести впервые понятие «застойное сердце» - как патогенетическое звено на определенном этапе развития сердечной недостаточности у больного с заболеванием сердца; мы можем говорить о застойном сердце (или застойной кардиомиопатии) при синдроме ХСН у больных с ССЗ. В пользу этого также свидетельствует хороший эффект у большинства больных приема мочегонных со стороны уменьшения полостей сердца. «Застойное сердце» влечет за собой функциональные изменения миокарда: снижается ФВ обоих желудочков, прогрессирует ремоделирование всего сердца. Можно полагать, что переполненные вены сердца, о чем свидетельствует увеличение ВС и диаметра просвета крупных вен сердца, вызывают венозный застой в сердечной мышце, способствуют развитию кардиосклероза и могут вызывать гибель миоцитов. При этом достоверен факт взаимосвязи тяжести синдрома ХСН с нарушением венозного кровообращения: чем «тяжелее» пациент с синдромом ХСН, тем больше у него определяется признаков нарушения венозного кровотока. Нарушение венозной внутрисердечной гемодинамики, уменьшение скорости кровотока, застой, несосмненно, приводят к необратимым морфологическим изменениям и гибели клеток миокарда. Клинические и морфологические данные нашего исследования показали, что морфологические (расширение сосудов, дряблость и истончение сосудистой стенки, увеличение размеров ВС и др.) и гемодинамические (внутрисердечный венозный застой, уменьшение скорости кровотока в сосудах миокарда) в сочетании с известным фактом нарушения реологических свойств крови [Галин П.Ю., 2002], повышением ее вязкости способствуют образованию пристеночных тромбов в венах сердца, которые часто, закрывая весь просвет сосуда, образуют новые зоны застоя, ишемии, повреждения стенки сосуда и влекут за собой прогрессирование заболевания. Несомненно, данные, установленные впервые, факты играют важную роль в патогенезе утяжеления синдрома ХСН.
Работа с больными нашего исследования также свидетельствует о том, что грамотный и профессиональный сбор клинических данных у больного не теряет своей значимости и в настоящее время. Данные исследования показывают, что результаты измерения ПВД аппаратом Вальдмана достаточно точно и достоверно дают оценку состояния периферического кровотока у больного ХСН. Оценив больного в совокупности клинических данных, данных физикального исследования и значений ПВД, уже можно сделать заключение о наличии и выраженности компонента венозного застоя в синдроме ХСН у данного пациента. Данные нашего исследования утверждают несомненную важность у больного с ХСН помимо исследования артериальной системы сердца всеми доступными методами исследовать ВСС, для чего у клиницистов есть реальные возможности: применение двух неинвазивных методов исследования - ЭхоКГ и МСКТ сердца. Первый общеизвестный метод исследования сердца обладает умеренными возможностями оценки ВСС, второй же метод обеспечивает клинициста более реальной анатомической, функциональной и качественной картиной состояния внутрисердечной венозной системы. МСКТ сердца позволяет визуализировать не только ВС, но и крупные вены сердца, впадающие в него. Результаты обследования пациентов клинической группы методом МСКТ сердца коррелируют с данными морфологического исследования, что свидетельствует о возможности использования данной методики в анатомо-клинических исследованиях. У нас не было возможности сравнить свои результаты с чьими-то, т.к. таковых исследований нами встречено не было. Данный метод на сегодняшний день реален, но находится в начальной стадии своего становления и требует дальнейшего развития, изучения и внедрения в практику врача. Подводя итог вышесказанному, можно вывести следующие клинико-морфологические закономерности изменений ВСС при ХСН.
1-я закономерность: Экспериментальное моделирование и клинико-анатомические наблюдения показывают, что синдром ХСН вызывает не только нарушения венозной гемодинамики во внутренних органах человека, но и в самом сердце. При этом явления венозного застоя и гипертензии наиболее выражены в устьевых отделах вен и в крупных венозных коллекторах (ВС, БВС, СВС); 2-я закономерность: Развитие изменений в ВСС связано со степенью выраженности (стадиями) ХСН. Первоначально происходит компенсаторное увеличение толщины венозной стенки за счет гипертрофии средней оболочки сосуда, а в последующем происходит атрофия сосудистой стенки и замещение её средней и наружной оболочек соединительной тканью; 3-я закономерность: Одним из важных звеньев нарушения венозной гемодинамики в венах сердца (особенно в устьевых отделах) является пристеночное или полное тромбообразование с последующей организацией и реканализацией тромба. 4-я закономерность: По данным МСКТ при ХСН в соответствии с её стадиями прижизненно происходит достоверное увеличение диаметра и площади поперечного сечения основных венозных сосудов сердца. 5-я закономерность: При ХСН снижение систолической функции ЛЖ и объемная перегрузка сердца приводят к внутрисердечному застою, переполнению вен и ВС сердца и нарушению венозного оттока. 6-я закономерность: Системный венозный застой при ХСН ремоделирует «правое сердце» и приводит к его функциональной несостоятельности. 7-я закономерность: Прогрессирование и финал ХСН обусловлен формированием «застойного сердца» в целом, что усугубляет необратимые морфологические изменения в мышце сердца.
Таким образом, впервые проведено прижизненное исследование вен самого сердца и получены достоверные значимые результаты у больных с синдромом ХСН. На основе полученных данных впервые сформулировано понятие «застойное сердце» (застойная кардиомиопатия) аналогично понятиям: «застойная почка», «застойные легкие», «застойная печень» и т.д. Можно утверждать, что вовлечение ВСС при ХСН позволяет расширить существующую на сегодня картину патогенеза синдрома. Генез ХСН рассматривается не только как результат систолической и диастолической дисфункции и ремоделирования ЛЖ, но и как исход «застойного и ремоделированного всего сердца», формирующегося у больных с ХСН. Учитывая данные исследования, можно определить критерии оценки состояния ВСС: повышение ПВД; ремоделирование правого сердца (увеличение правого желудочка и правого предсердия с повышением давления в полостях, удлинение размера выносящего тракта и снижение скорости трикуспидального потока крови, снижение показателей сократительной способности правого желудочка, а именно: передне-заднего укорочения); увеличение просвета ВС и диаметра крупных вен сердца и использовать их для определения степени клинической тяжести ХСН и прогноза течения заболевания. Установленные в ходе исследования факты о значимых изменениях ВСС, тесной взаимосвязи их со стадией и ФК ХСН позволяют рекомендовать поставить вопрос о применении каких-либо воздействий, кроме официально рекомендуемых препаратов, для лечения больных с ХСН, для улучшения состояния внутрисердечного кровотока. В ходе лечения необходимо добиваться уменьшения внутрисердечного венозного застоя.
ВЫВОДЫ
1. При хронической сердечной недостаточности венозная система сердца претерпевает значительные морфо-функциональные изменения. Вовлечение венозной системы сердца в патологический процесс играет важную роль в развитии и прогрессирования хронической сердечной недостаточности. Состояние и изменение венозной системы сердца зависит от стадии и функционального класса хронической сердечной недостаточности.
2. При экспериментальном моделировании синдрома хронической сердечной недостаточности происходят не только нарушения венозной гемодинамики во внутренних органах крыс, но и в венах сердца (венечном синусе и крупных венах сердца).
3. Посмертные морфологические изменения структуры оболочек субэпикардиальных вен и венечного синуса при хронической сердечной недостаточности заключаются в увеличении общей толщины стенки венечного синуса, вен сердца за счет среднего слоя и адвентиции и более значимо в устьевых отделах вен; увеличение толщины и количества соединительнотканных элементов в стенке вен сердца происходит во всем бассейне субэпикардиальных вен. При прогрессировании синдрома хронической сердечной недостаточности толщина стенок вен сердца и венечного синуса в начальных стадиях увеличивается, затем уменьшается за счет явлений склероза сосудистой стенки.
4. Прижизненные морфологические изменения венечного синуса и субэпикардиальных вен сердца при хронической сердечной недостаточности по данным мультиспиральной компьютерной томографии сердца проявляются в виде достоверного увеличения диаметра их просвета соответственно стадиям синдрома.
5. Нарушение гистоструктуры венозной стенки, реологических свойств крови, внутрисердечный венозный застой приводят к тромбозу венозных сосудов сердца, что является важным фактором в прогрессировании хронической сердечной недостаточности.
6. При хронической сердечной недостаточности формируется «застойное сердце» (или застойная кардиомиопатия), аналогично застойной печени, легких, почек; что играет важную роль в течении и исходе хронической сердечной недостаточности.
7. Повышение периферического венозного давления; увеличение правого желудочка и правого предсердия с повышением давления в полостях, удлинением размера выносящего тракта правого желудочка и снижением скорости трикуспидального потока крови; снижение показателей сократительной способности правого желудочка; увеличение просвета венечного синуса и диаметра крупных вен сердца являются комплексными критериями состояния венозной системы сердца, что может служить для определения степени клинической тяжести хронической сердечной недостаточности и прогноза течения заболевания.
8. Исследование венозной системы сердца у больных с синдромом хронической сердечной недостаточности всеми доступными неинвазивными методами диагностики (в том числе измерение периферического венозного давления) позволяет диагносцировать формирование «застойного сердца», что важно для своевременной коррекции проводимой терапии и улучшения прогноза заболевания.
9. Мультиспиральная компьютерная томография сердца является новым высокотехнологичным методом оценки состояния венозной системы сердца, более информативным по сравнению с методом эходопплеркардиографии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
1.В комплексе мероприятий по полному клиническому обследованию больных с ХСН необходимо физикальными и всеми доступными инструментальными методами исследовать периферическую и внутрисердечную венозную систему.
2.Измерение ПВД является простым и доступным способом для оценки периферического венозного застоя у пациента с ХСН.
3.При обследовании пациентов с ХСН методами Эхо-КГ и МСКТ сердца в протокол исследования необходимо внедрить оценку параметров правых отделов сердца, ВС и крупных вен сердца.
4.Состояние венозного кровотока рекомендуется рассматривать, как критерий оценки тяжести состояния пациента с синдромом ХСН и прогноза течения заболевания.
5.В учебном процессе при подготовке врачей общей практики, а также при усовершенствовании профессиональной подготовки врачей кардиологов, ревматологов и терапевтов необходимо информировать врачей о роли ВСС в патогенезе ХСН, критериях оценки состояния ВСС для возможности медикаментозной коррекции лечения больных с ХСН.
