Роль радионуклидных методов диагностики в оценке обратимой дисфункции миокарда при хронической сердечной недостаточности на фоне ибс
| Вид материала | Документы |
СодержаниеКлинический случай |
- Методические указания для студентов Лечебный факультет Занятие №1 Тема: «Средства,, 863.62kb.
- Методические указания для студентов Педиатрический факультет Занятие №1 Тема: «Средства,, 940.3kb.
- Гирудотерапия в лечении хронической сердечной недостаточности у больных ибс с нормальным, 419.45kb.
- Ишемическая болезнь сердца*, 138.5kb.
- Aнемия при хронической сердечной недостаточности, 61.22kb.
- Предикторы эффективности фармакотерапии хронической сердечной недостаточности у больных, 312.53kb.
- Комплексная медицинская реабилитация больных ишемической болезнью сердца после кардиохирургических, 31.85kb.
- Венозная система сердца при хронической сердечной недостаточности (клинико-морфологическое, 551.53kb.
- Рациональная фармакотерапия и профилактика хронической сердечной недостаточности 14., 662.1kb.
- «Московский государственный медико-стоматологический университет Росздрава», 371.91kb.
Роль радионуклидных методов диагностики в оценке обратимой дисфункции миокарда при хронической сердечной недостаточности на фоне ИБС
Л.В. Рачок,
А.Г. Булгак,
В.И. Терехов,
Т.А. Дубовик,
РНПЦ «Кардиология» (Минск),
4-я городская клиническая больница имени Н.Е. Савченко (Минск)
Хроническая сердечная недостаточность (ХСН) является исходом многих сердечно-сосудистых заболеваний и представляет собой серьезную медико-социальную и финансовую проблему. Несмотря на значительные достижения в изучении патогенеза, диагностики и лечения ХСН, ее распространенность не только не снижается, но продолжает неуклонно нарастать, достигая в общей популяции 1,5-2,0%, а среди лиц старше 65 лет – 6-10% [1, 2, 16, 28, 66, 76, 83]. Распространенность ХСН в Европейской части Российской Федерации, по результатам исследования ЭПОХА-ХСН, составила 12,3% (мужчины – 9,86%, женщины – 14,2%) [1, 7].
Прогноз у больных с ХСН остается крайне неблагоприятным независимо от ее этиологии. Через год от момента установления диагноза ХСН умирает 10% больных с легкой степенью и почти 50% больных с тяжелой ХСН [4, 10, 20, 29]. По результатам Рочестерского эпидемиологического проекта (4537 больных с ХСН), смертность в течение 5 лет составляет у мужчин 50%, а у женщин – 46% с момента установления диагноза [19, 67]. Как было показано в Роттердамском исследовании, одно-, двух- и пятилетняя выживаемость больных с ХСН составляет 89, 79 и 59% соответственно [8, 24, 34, 40, 41, 44, 68, 72].
В проведенных в последние годы многоцентровых исследованиях (CONSENSUS, SOLVD, ATLAS, CIBIS, NETWORK, ELITE, Val-HeFT, DIG) было убедительно показано, что ведущей причиной сердечной недостаточности (СН) является ишемическая болезнь сердца (ИБС), встречающаяся в среднем у 64% больных с ХСН [1, 2, 8, 19, 23, 41, 70, 71, 73, 81, 82, 84, 85]. Причем выживаемость у больных с ХСН ишемического генеза существенно ниже, чем у больных с ХСН другой этиологии, что обусловлено более неблагоприятным течением основного патологического процесса [8, 25, 35, 36, 41, 49, 60, 70].
Развитие ХСН при ИБС в первую очередь связано с гипоперфузией миокарда. Экспериментальные исследования показали, что ишемические повреждения неоднородны и могут завершаться как некрозом кардиомиоцитов, так и редукцией функции сокращения при сохранении их жизнеспособности. Клиническим проявлением таких состояний ишемии являются систолическая и диастолическая дисфункция желудочков с развитием симптомов СН [15, 50, 54, 57].
Стойкие изменения кинетики миокарда, как правило, связаны с некрозом или рубцовым поражением. В то же время снижение сократимости миокарда может быть обусловлено обратимыми процессами в сердечной мышце. Такие участки миокарда содержат кардиомиоциты, которые активно не сокращаются, но сохраняют минимальное потребление кислорода и основные компоненты клеточного метаболизма, то есть они жизнеспособны и при этом находятся, как бы в состоянии покоя.
Первые научные исследования по обратимой дисфункции миокарда относятся к 70-м гг. прошлого столетия. В 1973 г. K. Chatterjee с соавт. на основе клинических наблюдений предположил, что у больных ХСН без предшествующего инфаркта миокарда возможно существенное улучшение и даже нормализация функции левого желудочка после аорто-коронарного шунтирования [20]. Позднее S.H. Rahimtoola [24, 74, 75], проанализировав результаты операций реваскуляризации миокарда в группе пациентов с ХСН на фоне ИБС, ввел представление о миокардиальной «гибернации» для описания очагов миокарда со сниженной сократимостью, и охарактеризовал «гибернацию миокарда», как компенсаторно-приспособительную реакцию к хроническому дефициту кислорода на фоне длительной ишемии миокарда.
Другую форму обратимой сегментарной дисфункции миокарда – «станнирование» или «оглушение» (англ. stunning) – Е. Braunvald [36, 37] определил как запаздывание восстановления региональной дисфункции миокарда после острого периода ишемии с последующей реперфузией. При этом повреждение миокарда зависит от длительности и выраженности как самого эпизода ишемии, так и постишемической реперфузии. Станнирование миокарда может развиваться в нескольких клинических ситуациях, включая отсроченное восстановление после приступа стенокардии напряжения, нестабильной стенокардии, у больных инфарктом миокарда после тромболитической реперфузии, а также после ишемической кардиоплегии. Данная форма обратимой дисфункции миокарда может сохраняться в течение нескольких дней или недель, прежде чем функция спонтанно возвратится к нормальной.
На практике станнирование и гибернация сосуществуют друг с другом и в некоторых случаях трудно сказать, какой из процессов преобладает у конкретного пациента. Оба вида диссинергии миокарда, по данным A. Rozanski и соавт. [6, 7, 24, 77], носят обратимый характер, как при восстановлении кровотока, так и при нормализации баланса поступление – потребление миокардом кислорода. Наличие сохраненного клеточного метаболизма и инотропного резерва позволило объединить варианты обратимой дисфункции сердечной мышцы термином «жизнеспособный (viable)» миокард. Данные участки миокарда являются гипо- или акинетичными, но сохраняют определенный уровень метаболизма и резерв сократимости, а их функция может быть восстановлена [8,9].
Исследование жизнеспособности миокарда и воздействие на обратимую ишемическую дисфункцию является чрезвычайно важным и перспективным направлением лечения больных ИБС, осложненной недостаточностью кровообращения. В настоящее время основными методами лечения ишемической дисфункции миокарда являются медикаментозные и хирургические методы лечения. При выявлении жизнеспособного миокарда у больных ИБС, осложненной недостаточностью кровообращения, приоритетным методом лечения является хирургическая или эндоваскулярная реваскуляризация миокарда. Хирургическая реваскуляризация может существенно улучшить состояние пациентов с ишемической дисфункцией ЛЖ и способствовать улучшению контрактильной функции сердца [14, 18, 22, 23, 43, 46, 47, 61, 62, 63, 74, 80, 87].
В связи с выше изложенным перед практической медициной стоит важный вопрос необходимости широкого внедрения в клиническую практику современных высокоинформативных методов диагностики жизнеспособного миокарда. В основе применение таких методов диагностики, как контрастная вентрикулография, магнитно-резонансная томография, двухмерная эхокардиография и стресс-эхокардиография, лежит оценка систолического утолщения и экскурсии стенки левого желудочка, оценка типов асинергии и посегментарное состояние сократимости миокарда [13, 32, 52]. Однако жизнеспособность миокарда в инфарцированной зоне может быть сохранена даже при выраженных сегментарных расстройствах сокращения.
Использование в клинической практике радионуклидных методов исследования позволяет получить количественную информацию о региональной перфузии и особенностях метаболизма миокарда, выявлять дефекты наполнения в миокарде и определять соотношения между перфузией и метаболизмом. С их применением возможно не только адекватно оценить тяжесть патологических процессов в сердечной мышце, но и моделировать динамику насосной функции миокарда, прогнозировать как гемодинамический, так и клинический исход лечения [11, 33, 39, 51, 84, 85]. Наибольшее распространение в настоящее время получили позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ).
Позитронно-эмиссионная томография – метод диагностики, позволяющий получить доказательство наличия метаболической активности миокарда in vivo, и дать наиболее точную количественную информацию о региональной перфузии и метаболизме миокарда. В основе ПЭТ лежит использование радиофармпрепаратов (РФП), меченных изотопами, – позитронных излучателей. В настоящее время более распространено одновременное применение двух разных изотопов, позволяющих оценивать метаболизм и перфузию: F-18 флюородеоксиглюкозы (ФДГ) и N-13 аммония. Классические признаки несоответствия перфузии и метаболизма лежат в основе ПЭТ-диагностики жизнеспособного миокарда и являются наиболее точной его характеристикой. По сообщениям разных авторов, прогностическая ценность ПЭТ колеблется от 52 до 100% [53, 55, 65, 71], однако, данный метод исследования не является широко доступным.
Однофотонная эмиссионная компьютерная томография в настоящее время занимает приоритетные позиции в неинвазивной диагностике жизнеспособного миокарда и определении нарушений кровоснабжения миокарда на уровне микроциркуляции. В основу изучения кровоснабжения сердечной мышцы с помощью радионуклидов заложен принцип их фракционного распределения в миокарде в количествах, пропорциональных региональному миокардиальному кровотоку. Области миокарда с нормальным кровоснабжением создают картину равномерного распределения РФП, а участки миокарда с относительным или абсолютным снижением кровотока вследствие ишемии или рубцового повреждения имеют снижение включения РФП за счет «дефектов перфузии». Распределение РФП в миокарде зависит как от самой перфузии, так и от целостности сарколеммы и сохранности клеточного метаболизма. Жизнеспособность миокарда определяется по увеличению накопления изотопа как на отсроченных изображениях, так и при повторном его введении. Для участков жизнеспособного миокарда характерны, так называемые, полустабильные дефекты перфузии. Они характеризуются возвращением изображения миокарда к норме на поздних отсроченных сцинтиграммах и после реинъекции РФП в покое. Если область гипоперфузии сохраняется, то эта зона, по-видимому, соответствует нежизнеспособным участкам миокарда. Синхронизация ОФЭКТ с ЭКГ пациента позволяет визуализировать кинетику стенок миокарда в различные фазы сердечного цикла и тем самым одновременно оценивать функциональное состояние миокарда ЛЖ.
Для визуализации перфузии миокарда применяют РФП, которые экстрагируются и удерживаются миокардом в течение различных временных интервалов. В настоящее время широко используют следующие РФП: таллия хлорид (201Tl), 99мTc-MIBI (2,4,метоксиизобутилизонитрил, «Технетрил» отечественного производства, «Cardiolite» США) и 99мTc-TF (тетрофосмин), 99мTc-ТЕБО («тебораксим»).
Эталонным РФП для визуализации перфузии миокарда является 201Tl [26], который является биологическим аналогом калия и после внутривенного введения, подобно калию, быстро покидает кровеносное русло и поступает в кардиомиоциты посредством K-Na-АТФ-насоса в количествах, пропорциональных исходной величине кровотока. При ОФЭКТ 99мTc-MIBI захват и внутриклеточная задержка РФП основаны на целостности клеточных мембран и функциональной сохранности митохондрий, что дает возможность применять его для оценки жизнеспособного миокарда и выявления сократительного резерва миокарда [21, 59]. Положительная и отрицательная прогностическая значимость ОФЭКТ с 201Tl и 99mTc-MIBI практически не отличаются и составляют 74-92% и 80-96% соответственно [26, 59, 81].
В ряде работ показана высокая информативность в оценке наличия жизнеспособного миокарда при проведении ОФЭКТ с 99mTc-MIBI в сочетании с фармакологической пробой с добутамином. Добутамин, стимулируя β1 адренергические рецепторы, улучшает коронарный кровоток, вызывает инотропную стимуляцию и восстанавливает сегменты с обратимой дисфункцией. Критерием жизнеспособности миокарда в зонах диссинергии принято считать накопление препарата более 50% [21, 26, 42, 86]. Сопоставление данных нагрузочных стресс-эхокардиографии и перфузионной сцинтиграфии свидетельствует о примерно одинаковой чувствительности обоих методов исследования. В то же время стресс-эхокардиография обычно «недооценивает» степень жизнеспособности миокарда, который выявляется радионуклидным методами при сочетании с фармакологической пробой с добутамином [2, 3, 5, 10, 11, 12, 17, 33, 86].
Таким образом, можно сказать, что у больных ИБС с выраженной дисфункцией миокарда, первостепенное значение имеет объективная оценка органических и ишемических компонентов в генезе нарушения сократительной функции сердца. Проводимые нагрузочные радионуклидные методы диагностики в комплексе с другими методами исследования помогают определить перспективы проведения операций реваскуляризации миокарда и, возможно, стратифицировать больных по подгруппам лечения. Рассмотренный ниже клинический случай наглядно демонстрирует это.
Клинический случай
Пациент К., 58 лет, с 19.11.2008 находился на стационарном лечении в кардиологическом отделении РНПЦ «Кардиология» с клиническим диагнозом: ИБС: стенокардия напряжения ФК III. Постинфарктный (2005 г.) кардиосклероз. Атеросклероз аорты, стенозирующий атеросклероз коронарных артерий. Блокада передней ветви левой ножки пучка Гиса. НIIА (NYHA III). Артериальная гипертензия 3, риск 4. Сахарный диабет 2 типа, клинико-метаболическая компенсация.
Из анамнеза: в декабре 2005 г. пациент перенес обширный трансмуральный инфаркт миокарда задне-нижней локализации без предшествующей стенокардии. Постинфарктный период протекал без особенностей. С января 2006 по декабрь 2007 г. находился на амбулаторном лечении, чувствовал себя удовлетворительно, отмечал хорошую переносимость физической нагрузки, отсутствие болевого синдрома. С 2008 г. появился ишемический болевой синдром, соответствующего стенокардии напряжения III функционального класса, стала беспокоить одышка при незначительной физической нагрузке. Тест 6-минутной ходьбы составлял 286 метров, что соответствовало III функциональному классу (ФК) по классификации NYHA [78].
При выполнении селективной коронароангиографии на цифровом ангиографическом аппарате Innova 3100 (GE, США) по стандартной общепринятой методике (Judkins, 1967 г.) было диагностированы гемодинамически значимые стенозы (более 75%) передней межжелудочковой ветви (ПМЖВ) в зоне отхождения 1 диагональной ветви (ДВ), правой коронарной артерии (ПКА) в области 1 сегмента, а также окклюзия огибающей ветви (ОВ) в зоне 2 сегмента с отсроченным коллатеральным контрастированием дистальных отделов.
Эхокардиография (ЭхоКГ) выполнялась по стандартному протоколу с использованием рекомендаций Американского эхокардиографического общества [30]: измерялись морфометрические показатели сердца, вычислялись конечный диастолический (КДО) и конечный систолический (КСО) объемы ЛЖ, фракция выброса (ФВ) ЛЖ. При проведении ЭхоКГ было выявлено расширение полости ЛЖ (КДО-230мл, КСО-142 мл), снижение глобальной сократительной функции ЛЖ (ФВ=38%). Отмечались нарушения регионарной сократимости левого желудочка: акинез в области базального сегмента и гипокинез среднего, верхушечного сегмента нижней стенки ЛЖ и акинез в области среднего сегмента с гипокинезом базального сегмента задней стенки ЛЖ, что характеризует поражение в бассейне кровоснабжения правой коронарной артерии; гипокинез в области базальных, средних и верхушечных сегментов передней стенки, соответствующих бассейну ПМЖВ; гипокинез базального сегмента боковой стенки ЛЖ, соответствующего бассейну ОВ левой коронарной артерии.
Для оценки объема жизнеспособного миокарда пациенту было выполнено ОФЭКТ с 99мTc-MIBI. Проведение однофотонной эмиссионной компьютерной томографии с 99мTc-MIBI проводили натощак после предварительной отмены антиангинальных препаратов и β-адреноблокаторов по однодневному протоколу GATED SPECT в последовательности REST-STRESS с фармакологическим стресс-тестом с добутамином на однофотонном эмиссионном компьютерном томографе «Nucline X-Ring/R» с использованием 99мTc-MIBI. Регистрацию изображений начинали через 50 мин. после введения РФП при первом исследовании GATED SPECT REST. Повторное исследование GATED SPECT STRESS в покое выполняли с интервалом в 2 часа после фармакологического стресс-теста с добутамином.
Протокол введения малых доз добутамина для диагностики улучшения сократимости в «гибернирующем» и «оглушенном» миокарде [31,38,45,79] включал в себя трехступенчатую последовательную внутривенную инфузию с использованием инфузомата. Скорость инфузии последовательно увеличивалась следующим образом: первая ступень: 5мкг/кг/мин, вторая ступень: 10мкг/мл/мин, третья ступень: 15мкг/кг/мин. Продолжительность инфузии препарата на каждой ступени составляла 3 минуты. Во время исследования проводился постоянный мониторинг электрокардиограммы, артериального давления, частоты сердечных сокращений, оценивался клинический статус пациента. Введение добутамина прекращалось по достижении субмаксимальной ЧСС или при появлении клинических критериев прекращения стресс-теста (использование максимально возможной дозы препарата, достижение субмаксимальной частоты сердечных сокращений, развитие приступа стенокардии либо его эквивалентов, появление ишемических знаков на электрокардиограмме, повышение систолического артериального давления более 220 мм рт.ст. или снижение его более чем на 30 мм от исходного, развитие нарушений ритма и проводимости (синоатриальной блокады, атриовентрикулярной блокады II или III степени, блокады ножек пучка Гиса).
Для визуального анализа миокардиальной перфузии использовали томографические срезы, полученные по короткой оси ЛЖ, горизонтальной и вертикальной длинным осям ЛЖ. Для количественного анализа томосцинтиграмм использовали метод полярного картирования реконструированного томографического изображения миокарда («бычий глаз»). Полученные изображения разделялись на 13 сегментов, позволяющих точно локализовать участки нарушения перфузии не только по отношению к стенкам ЛЖ, но в соответствии со схемой бассейнов коронарных артерий. Автоматически выявлялась область с максимальной аккумуляцией РФП. Все остальные сегменты нормализовались относительно максимального. Выделяли следующие степени нарушения перфузии миокарда: нормальная перфузия (уровень накопления РФП выше 75% от максимального накопления), «умеренное снижение перфузии» (от 51 до 75%), «выраженное снижение перфузии» (от 31 до 50%) и аперфузия или «резкое снижение перфузии» (менее 30%), что соответствует рубцовым изменениям.
На томосцинтиграммах пациента К., полученных в покое, отмечалось неравномерное накопление РФП в миокарде левого желудочка (рис. 1)
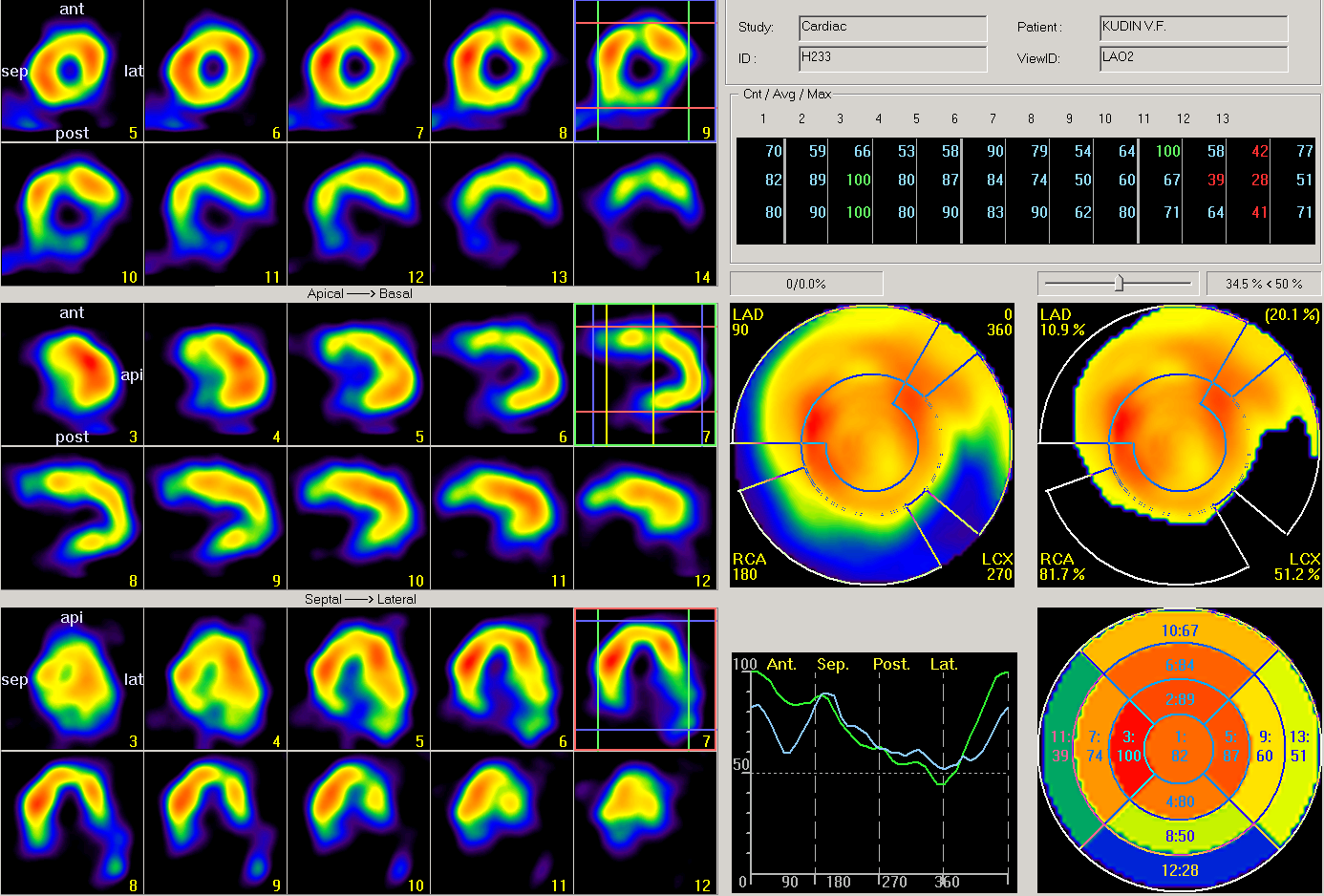
Рисунок 1
Томосцинтиграмма пациента К. до операции
Нарушение перфузии миокарда было зарегистрировано преимущественно в бассейне ПКА (дефект перфузии 81,7%) и ОВ (дефект перфузии 51,2%). Дефект перфузии в бассейне ПМЖВ составлял 10,9%. Наиболее выраженное снижение накопления РФП (от 31 до 50%) было характерно для базальных нижних, средних и базальных задних сегментов миокарда ЛЖ. Полученные данные коррелировали с результатами ЭхоКГ и выполненной коронароангиографией.
При анализе STRESS-томосцинтиграмм отмечалось уменьшение объема дефектов перфузии миокарда ЛЖ в бассейне ПМЖВ и ПКА до 0,1% и 49,0% соответственно. В бассейне ОВ перфузия улучшилась менее значимо (на 4,7%). В то же время в сегментах с исходным выраженным нарушением накопления РФП отмечался существенный прирост уровня накопления радиофармпрепарата, что является достоверным признаком жизнеспособности миокарда. Процент аккамуляции РФП в базальном нижнем сегменте (бассейн ПМЖВ) возрос на 36%, а в среднем и базальном заднем на 26 и 36% соответственно (бассейн ПКА). Причем необходимо отметить, что в бассейне кровоснабжения ПМЖВ после введения добутамина наблюдалось полное восстановление перфузии до уровня здорового миокарда (рис. 2).
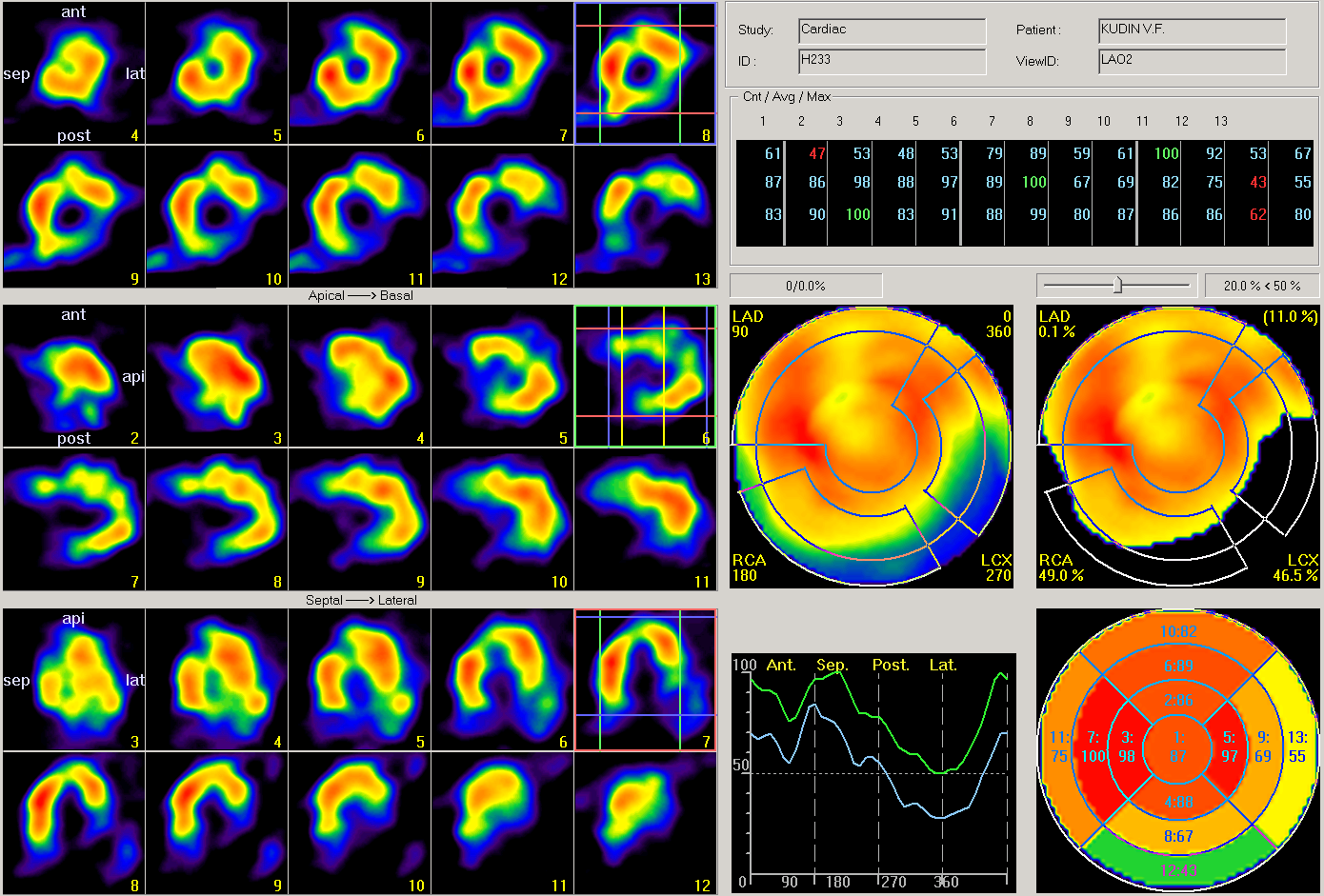
Рисунок 2
STRESS-томосцинтиграмм пациента К. до операции
Наличие жизнеспособного миокарда в бассейне левой и правой коронарной артерии послужило показанием к проведению операции коронарного шунтирования. Пациенту была выполнена полная реваскуляризация миокарда (аортокоронарное шунтирование: аутовена в ОВ и ПКА и мамарокоронарное шунтирование: левая внутренняя грудная артерия в ПМЖВ).
Спустя 6 месяцев после оперативного лечения пациенту К. были выполнены контрольные исследования: ЭхоКГ и ОФЭКТ миокарда в покое. На томосцинтиграмме отмечалась выраженная положительная динамика по сравнению с дооперационными данными (рис. 3).
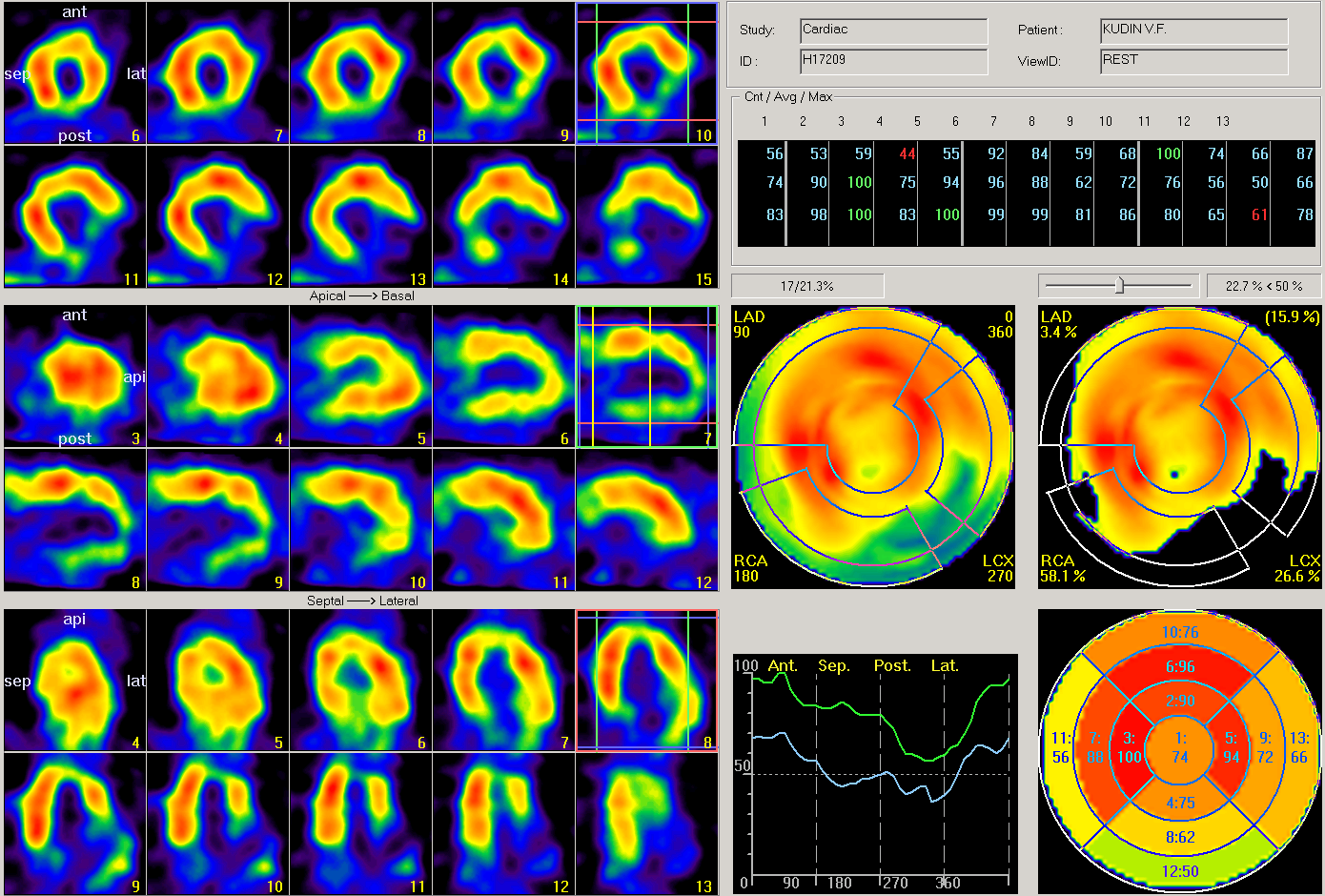
Рисунок 3
Томосцинтиграмма пациента К. через 6 месяцев после операции
Снизилось общее количество сегментов с гипоперфузией с 7 (53,8%) до 3 (23,1%) в бассейнах ПКА, ПМЖВ, ОВ. Сегменты с выраженным снижением накопления РФП не регистрировались. В зоне перенесенного инфаркта (в базальных нижних, средних и базальных задних сегментах миокарда ЛЖ) регистрировалось значительное увеличение накопления РФП (в среднем на 17% по сравнению с дооперационным периодом). При проведении ЭхоКГ было выявлено соответствие между динамикой изменения перфузии миокарда и геометрии ЛЖ и показателя его насосной функции: отмечалось уменьшение полостей ЛЖ (КДО-200 мл, КСО-112 мл), увеличение фракции выброса до 44%. Субъективно пациент К. отмечал заметное улучшение самочувствия, повышение толерантности к физическим нагрузкам, исчезновение ангинозных приступов. Тест 6-минутной ходьбы составлял 428 метров, что соответствовало I ФК NYHA.
Заключение
Анализ данного клинического наблюдения свидетельствует о том, что жизнеспособность миокарда в инфарцированной и «переходной» зонах является значительным фактором, влияющим на дальнейшее изменение геометрии, архитектоники и сократимости левого желудочка после восстановления коронарного кровотока. Среди методов диагностики ишемической дисфункции миокарда ЛЖ ОФЭКТ занимает центральное место. Позволяя визуализировать область жизнеспособного миокарда и состояние коронарного резерва в участках контрактильной дисфункции левого желудочка, данный метод помогает оптимизировать отбор пациентов с хронической сердечной недостаточностью ишемического генеза для операции коронарного шунтирования, определить объем и адекватность хирургического пособия, что делает его незаменимым для использования в повседневной кардиологической практике.
Литература
- Агеев Ф.Т., Беленков Ю.Н. Эпидемиология и прогноз хронической сердечной недостаточности // Русский медицинский журнал. – 1999. – Т. 7. – №2.
- Агеев Ф.Т., Даниелян М.О., Мареев В.Ю. и др. Больные с хронической сердечной недостаточностью в российской амбулаторной практике: особенности контингента, диагностики и лечения (по материалам исследования ЭПОХА-О-ХСН) // Сердечная недостаточность. – 2004. – № 1. – С. 4-7.
- Аляви А.Л., Зуфаpов М.М., Туляганова Д.К. Обpатимые дисфункции жизнеспособного миокаpда у больных ишемической болезнью сеpдца // Клинич. медицина. – 2002. – Т. 80, № 8. – С. 18-22.
- Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю. Парадоксы сердечной недостаточности: взгляд на проблему на рубеже веков // Сердечная недостаточность. – 2000. – Т. 1, № 1. – С. 4-6.
- Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю. Эпидемиологические исследования сердечной недостаточности: состояние вопроса // Consilium Medicum. – 2002. – Т. 4, № 3.
- Беленков Ю.Н. Дисфункция левого желудочка у больных ИБС: современные методы диагностики, медикаментозной и немедикаментозной коррекции // Русский медицинский журнал. – 2000. – Т. 8. – № 17.
- Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. и др. Первые результаты национального эпидемиологического исследования – эпидемиологическое обследование больных ХСН в реальной практике (по обращаемости) (ЭПОХА–О–ХСН) // Сердечная недостаточность. – 2003. – Т. 4, № 3. – С. 116-120.
- Беленков Ю.Н., Мареев В.Ю., Агеев Ф.Т. Хроническая сердечная недостаточность. Избранные лекции по кардиологии. – М.: ГЭОТАР-Медиа, 2006. – 432 с.
- Беленков Ю.Н., Саидова М.А. Оценка жизнеспособности миокарда: клинические аспекты, методы исследования // Кардиология. – 1999. – № 1. – С. 6-13.
- Бокарев И.Н., Аксенова М.Б., Великов В.К. Сердечная недостаточность: острая и хроническая. – М.: Практическая медицина, 2006. – 176 с.
- Бокерия Л.А., Бузиашвили Ю.И., Асымбекова Э.У., Ахмедярова Н.К. и др. «Стресс-эхокардиография с добутамином в диагносцировании «спящего» (гибернированного) миокарда у больных ИБС с дисфункцией левого желудочка по результатам хирургического лечения» // «Грудная и сердечно-сосудистая хирургия». – 1999. – № 2. – С. 5-10.
- Бузиашвили Ю.И., Асымбекова Э.У., Мацкеплишвили С.Т. «Диагностика обратимой дисфункции миокарда у больных ИБС по данным стресс-эхокардиографии» // «Грудная и сердечно-сосудистая хирургия». – 1996. – № 6. – С. 68-80.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. Изд: Медицина, 1989.
- Бураковский В.И., Работников B.C., Иоселиани Д.Г. Ишемическая болезнь сердца. Сердечно-сосудистая хирургия под ред. В.И. Бураковского и Л.А. Бокерия. – М., 1989. – С. 523-587.
- Браниште Т., Соколова Р.И., Цыпленкова В.Г. и др. Апоптоз и гибернация кардиомиоцитов перирубцовой зоны как фактор прогрессирования хронической аневризмы // Кардиология. – 2004. – № 5. – С. 6-13.
- Гуревич М.А. Хроническая сердечная недостаточность: руководство для врачей. – 5-е изд. – М.: Практическая медицина, 2008. – 414 с.
- Коули А.Д. Эпидемиология и этиологические факторы сердечной недостаточности. В кн.: Международное руководство по сердечной недостаточности, второе издание. Под общей ред. С.Дж. Болла, Р.В.Ф. Кемпбелла, ГС. Френсиса. – М.: Медиа сфера, 1998. – С. 15-19.
- Национальные клинические рекомендации Всероссийского научного общества кардиологов. М.: Силицея-Полиграф, 2008. – С. 512.
- Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (второй пересмотр) // Сердечная недостаточность. – 2007. – Т. 8. – № 1. – С. 2-36.
- Никифоров В.С., Никитин А.Э., Тыренко В.В., Свистов А.С. Ишемическая дисфункция миокарда. – М.: АПКиППРО, 2006. – 102 с.
- Паша С.П. «Томосцинтиграфия с 99м Тс-метоксиизобутилизонитрилом в количественной и качественной оценке перфузии миокарда и резерва миокардиального кровотока». Дис. канд. мед. наук, Москва, 1993.
- Саидова М.А., Беленков Ю.Н., Акчурин Р.С. и др. Жизнеспособный миокард: сравнительная оценка хирургического и медикаментозного методов лечения больных ИБС с постинфарктным кардиосклерозом и хронической сердечной недостаточностью // Тер. Арх. – 2002. – № 2. – С. 60-64.
- Саидова, Ю.Н.Беленков, В.Ю.Мареев, В.Б.Сергиенко, Е.Н.Ходарева. Оценка жизнеспособности миокарда у больных с выраженной дисфункцией левого желудочка и хронической недостаточностью кровообращения на фоне медикаментозного лечения с использованием beta-блокаторов и ИАПФ // Сердечная недостаточность. – 2001. – Т. 2, № 2.
- Соколова Р.И. Жданов В.С. Механизмы развития и проявления «гибернации» и «станнинга» миокарда // Кардиология. – 2005. – № 9. – С. 73-78.
- Степура О.Б., Томаева Ф.З., Будаев Э.Г. и др. Прогностические факторы при тяжелой хронической сердечной недостаточности // Сердечная недостаточность. – 2002. – № 2. – С. 76-78.
- 26.Ходарева Е.Н., Сергеенко В.Б. «Радионуклидные методы исследования в оценке жизнеспособности миокарда при обратимой левожелудочковой дисфункции» // Вестник рентгенологии и радиологии. – 2001. – № 2. – С. 50-61.
- Цыпленкова В.Г. Критические заметки по поводу парадигмы «ибернирующий и оглушенный миокард»/ Кардиология. – 2005. – № 9. – С. 43-46.
- Якушин С.С., Смирнова Е.А. Могут ли эпидемиологические исследования в России улучшить диагностику и лечение сердечно-сосудистых заболеваний? // Профилактика заболеваний и укрепление здоровья. – 2007. – № 5. – С. 20-21.
- Afridi I., Grayburn P.A., Panza J.A. et al. Myocardial viability during dobutamin echocardiography predicts survival in patients with coronary artery disease and severe left ventricular systolic dysfunction // JACC. – 1998. – Vol. 32. – Р. 921-926.
- American Society of Echocardiography Commitete on Standards. Recomendations for quantification of the left ventricle by two dimensional echocardiography // J. Amer. Soc. Echo. – 1989. – Vol. 2. – P. 358-367.
- Afridi I., Kleiman N.S., Rainzer A.E., Zoghbi W.A. Dobutamine echocardiography in myocardial hibernation // Circulation 1995. – Vol.91. – Р.663-670.
- Ba’albaki H.A., Clements S.D. “Left Ventricular aneurysm: a review.” // Clin.Cardiol. 1989. – Vol.12. – Р.5-13.
- Bolognese L., Cerisano G., Buonamici P., Santini A., et al. «Influence of Infarct-Zone Viability on Left Ventricular Remodeling After Acute Myocardial Infarction» // Circulation 1997 Vol. 96. – Р. 3353-3359.
- Bots M.L., Witteman J.C., Hoffman A. et al. Low Diastolic Blood Pressure and Atherosclerosis in Elderly Subjects. The Rotterdam Study // Arch. Intern. Med. – 1996. – Vol. 156. – Р. 843-8.
- Braunwald E., Bristow M.R. Congestive heart failure: fifty years of progress. // Circulation. – 2000. – Vol.102. – Р.14-23.
- Braunvald E., Kloner R.A. The stunned myokardium: Prolonged, postishemic ventricular disfunction // Circulation. – 1982. – Vol. 66. – Р. 1146-9.
- Braunvald Е., Rutherford J.D. Reversible ischemic left ventricular dysfunction: evidence for «hibernating» myocardium // J.Am.Coll.Cardiol. – 1986. – Vol. 8. – P. 1467.
- Cigarroa C.G., de Fillippi C.R., Brickner M.E. et al. Dobutamine stress echocardiography identifies hibernating myocardium and predicts recovery of left ventricular function after coronary revascularization // Circulation. – 1993. – Vol. 88. – Р. 430-436.
- Claeys M.J., Vrints C.J., Krug B., Bosmans J.M. et al . «Adenosine Technetium-99 m sestamibi (SPECT) for the early assessment of jeopardized myocardium after acute myocardial infarction» // Eur.Heart J. – 1995. – Vol. 16. – Р. 1186-1194.
- Cleland J.G., Swedberg K., Follath F. et al. The EuroHeart Failure survey programme – a survey on the quality of care among patients with heart failure in Europe // Eur. Heart J. – 2003. – Vol. 24. – Р. 442-75.
- Cohn J.N., Tognoni G. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure // N. Engl. J. Med. – 2001. – Vol. 345. – P. 1667-1675.
- Cuocolo A., Acampa W., Nicolai E. “Quantitative thallium-201 and technetium 99m sestamibi tomography at rest in detection of myocardial viability in patients with chronic ischemic left ventricular dysfunction // J. Nucl. Cardiology. – 2000. – Vol. 7; 1. – Р. 8-15.
- Dahl J., Altehoefer C., Buchin P. Effect of myocardial viability and coronary revascularization on clinical outcome and prognosis: a follow-up study of 161 patients with coronary heart disease // Сardiol. – 1996. – Vol.85. – Р.868-881.
- De Bruyne M.C., Hoes A.W., Kors J.A. et al. QTc dispersion predicts cardiac mortality in the alderly: the Rotterdam Study // Circulation. – 1998. – Vol. 97. – Р. 467-472;
- Dilsizian V., Bonnow R.O. Current diagnostic techniques of assessing myocardial viability in patients with hibernating and stunned myocardium // Circulation. – 1993. – Vol. 87. – Р. 1-20.
- Elefteriades JA, Morales DL, Gradel C, Tollis Jr G, Levi E, Zaret BL. Results of coronary artery bypass grafting by a single surgeon in patients with left ventricular ejection fractions < or =30% // Am. J.Cardiol. – 1997. – Vol. 79. – Р. 1573–8.
- Di Carli M., Davidson M., Little R. et al. Value of metabolic imaging with positron emission to mography for evaluating prognosis in patients with coronary artery disease and left ventricular dysfunction. Am J Cardiol 1994; Vol.73: 527–33.
- Di Carli M.F., Hachamovitch R., Berman D.S. The art and science of predicting postrevascularization improvement in left ventricular (LV) function in patients with severely depressed LV function // J. Am. Coll. Cardiol. – 2002. – Vol. 40. – Р. 1744-1747.
- Felker G.M., Shaw L.K., O'Connor C.M. A standardized definition of ischemic cardiomyopathy for use in clinical research. // J. Am. Coll. Cardiol. – 2002. – Vol. 39. – Р. 210-218.
- Ferrari R. The new ischemic syndromes – an old phenomenon disguised with a new glossary? // Cardiovasc. Res. – 1997. – Vol. 36. – Р. 298-300.
- Flemeng W.J., Shivalkar B., Spiessens B., Maes A. et al “PET scan predicts recovery of left ventricular function after coronary artery bypass operation.” // Ann.Thorac.Surg. – 1997. – Vol. 64. – Р. 1694-1701.
- Friedman B.M., Dunn M.I. “Postinfarction ventricular aneurysms.”// Clin.Cardiol. 1995. – Vol. 18. – Р. 505-511.
- Gerber B.L., Vanoverschelde J.L.J., Bol A. et al. Myocardial blood flow, glucose uptake and recruitment of inotropic reserve in chronic left ventricular ischemic dysfunction. Implications for the pathophysiology of chronic hibernation // Circulation. – 1996. – Vol.94. – Р.651-659.
- Gil V.M. Myocardial viability in ischemic ventricular dysfunction// Rev. Port. Cardiol. – 1999. – Suppl 18. – Р. 17-22.
- Glopler R.J., Geltman E.M., Sapathkumaran K. et al. Comparison of carbon-acetate with fluorine-18-fluorodeoxyglucose for delineating viable myocardium by PET. // J. Am. Coll. Cardiol. – 1993. – Vol. 22. – Р. 1587-1597.
- Hausmann H, Topp H, Siniawski H, Holz S, Hetzer R. Decision making in end stage coronary artery disease; revascularization or heart transplantation? // Ann. Thorac. Surg. – 1997. – Vol.674. – Р.1296–302.
- Heusch G., Schulz R. New paradigms of coronary artery disease: hibernating, stunning, ischemic preconditions. In: New Paradigms of Coronary Artery Disease. Eds. // G. Heusch, R. Schulz. Springer. – 1996. – Р. 30-33.
- Hunt S.A. ACC/AHA 2005 guideline update for the diagnosis and management of chronic heart failure in the adult: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Update the 2001 Guidelines for the Evaluation and Management of Heart Failure) // J. Am. Coll. Cardiol. – 2005. – Vol. 46. – P. 1-82.
- Jatene A. «Left ventricular aneurysmectomy» // Thorac. cardiovasc. sur. – 1985. – Vol.89 – Р.321-331. 60.Kaesemeyer WH. Survival after congestive heart failure in. Framingham heart study subjects // Circulation.- 1994. – Vol. 89. – Р. 506.
- Langenburg SE, Buchanan SA, Blackbourne LH, Scheri RP, Sinclair KN,Martinez J, Spotnitz WD, Tribble CG, Kron IL. Predicting survival after coronary revascularization for ischemic cardiomyopathy. //Ann. Thorac. Surg. – 1995. – Vol. 60. – Р. 1193-6.
- Lee M.S., Lill M., Makkar R.R. Stem-cell transplantation in myocardial infarction. //Rev. Cardiovasc. Med. – 2004. – Vol. 5. – Р. 82-98.
- Lee K.S., Marwick T.H., Cook S.A. Prognosis of patients with left ventricular dysfunction, with and without viable myocardium after myocardial infarction. Relative efficacy of medical therapy and revascularization// Circulation. – 1994. – Vol. 90. – Р. 2687-2694.
- Levy D., Kenchaiah S., Larson M.G. et al. Long-term trends in the incidence of and survival with heart failure // New Engl. J. Med. – 2002. – Vol. 347 (18). – P. 1397-1402.
- Marwick T.H., Maclntyre W.J., Lafont A. et al. Metabolic responses of hibernating and infarcted myocardium to revascularization. // Circulation. -1992. – Vol.85. – Р.1347-1353.
- Mosterd A. Hoes A.W. Clinical epidemiology of heart failure // Heart. – 2007. – Vol. 93. – P. 1137-1146.
- Mosterd A., Hoes A.W., Cost B. et al. The prognosis of heart failure in the general population The Rotterdam Study // Eur. Heart J. – 2001. – Vol. 22. – P. 1318-1327.
- O'Callaghan Р.А., Camm A.J. Treatment of arrhythmias in heart failure. // Europ. J. Heart Failure. – 1999. – Vol. 1 (2). – Р. 133-137.
- Investigators and Committees. Cardiac Insufficiency Bisoprolol Study (CIBIS-II): a randomised trial. // Lancet. – 1999. – Vol.353. – Р.9-13.
- Jong P., Yusuf S., Rousseau M.F., et al. Effect of enalapril on 12-year survival and life expectancy in patients with left ventricular systolic dysfunction: a follow-up study // Lancet. – 2003. – Vol. 361 (9372). – Р. 1843-184.
- Packer M., Poole-Wilson P., Armstrong P. et al. Comparative effects of low-dose versus high-dose lisinopril on survival and major events in chronic heart failure: the Assessement of Treatment with Lisinopril And Survival (ATLAS) // Europ. Heart J. – 1998. – Vol. 19 (suppl.). – Р. 142.
- Pigott J.D., Kouchoukos N.T., Oberman A. et al. Late results of surgical and medical theraoy for patients with coronary artery disease and depressed left ventricular function. //J. Am. Coll. Cardiol. – 1985. – Vol. 5. – Р. 10436-1045.
- Pitt В., Poole-Wilson P., Segal R. et al. Effect of losartan compared with capto- pril on mortality in patients with symptomatic heart failure: randomised trial. The Losartan Heart Failure Survival Study ELITE II // Lancet. – 2000. – Vol.355.- Р.1582-1587.
- Rahimtoola S.H. A perspective on the three large multicenter randomized clinical trials of coronary bypass surgery for chronic stable angina // Circulation. -1985. – Vol. 72 (V). – Р. 123-35.
- Rahimtoola S. The hibernating myocardium // Am. Heart J. -1989. – Vol.117. – Р. 211-221.
- Redfield M.M., Jacobsen S.J., Burnett J.C.Jr. et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic // JAMA. – 2003. – Vol. 289. – P. 194-202.
- Rozanski A., Berman D.S., Gray R. et al. Use of thallium -201 redistribution scintigraphy in the preoperative differentiation of reversible and nonreversible asynergy // Circulation. -1981. – Vol.64. – Р. 936-44.
- Rostagno C. Prognostic value of 6-minute walk corridor test in patients with mild to moderate heart failure comparison with other methods of functional evaluation / C. Rostagno, G. Olivo, M. Comeglo [et al.] // Eurор. J. Heart Failure. – 2003. – Vol. 5. – P. 247-252.
- Sawada S.G., Segar D.S., Ryan T. et al. Catecholamine stress echocardiography. Echocardiography. – 1992. – Vol. 9. – Р. 177-188.
- Sedlis SP, Ramanathan KB, Morrison DA, Sethi G, Sacks J, Henderson W.Department of Veterans Affairs Cooperative Study # 385, Angina With Extremely Serious Operative Mortality Evaluation (AWESOME) Investigators. Outcome of percutaneous coronary intervention versus coronary artery bypass grafting for patients with low left ventricular ejection fractions, unstable angina pectoris, and risk factors for adverse outcomes with bypass (the AWESOME Randomized Trial and Registry) // Am. J. Cardiol. – 2004. – Vol.94. – Р.118-20.
- Swedberg K., Held P., Kjekshus J., et al. on behalf of the CONSENSUS II Study Group. Effects of early administration of enalapril on mortarlity in patients with acute myocardial infarction. Results of Cooperative North Scandinavian Enalapril Survival Study II (CONSENSUS II) // N. Engl. J. Med. – 1992. – Vol. 327. – Р. 678-84.
- Tamaki N., Ohtani H., Yamashita K. et al. Metabolic activity in the areas of new fill-in after thallium-201 reinjection: Comparison with PET using fluorine-18-deoxyglucose // J. Nucl. Med. – 1991. – Vol. 32. – Р. 673-678.
- Tendera M. Epidemiology, treatment, and guidelines for the treatment of heart failure in Europe // Eur. Heart J. – 2005. – Vol. 7 (Suppl. J.). – P. 5-9.
- 84.The Digitalis Investigation Group. The effect of Digoxin on mortality and morbidity in patients with heart failure // N. Engl. J. Med. – 1997. – Vol.336. – Р. 525-33.
- 85.The NETWORK investigators. Clinical outcome with enalapril in symptomatic chronic heart failure: A dose comparison // Eur. Heart J. – 1998. – Vol.19. – Р. 481-9.
- Voth E, Baer F.M., Theissen P Dobutamine 99mTc-MIBI single-photon emission tomography: non – exercise dependent detection of haemodynamically significant coronary artery stenoses // Eur. J. Nuc. Med. – 1994. – Vol. 21. – Р. 537-544.
- Williams J.F.Jr.,Bristow M.R.,Fowler M.B. et al. (1995) Guidelines for the evalution and management of heart failure: report of American College of Cardiology American Heart Association Task Force on Practice Guidelines (Committee on evalution and management of heart failure) // J.Amer.Coll.Cardiol. – Vol. 26. – Р. 1376-1398.
